
克罗恩病(CD)相关的肛管直肠狭窄是发生在消化道远端的狭窄性病变,早期症状不明显,后期表现为排便困难、大便失禁和持续的肛门疼痛等,常需反复的内外科治疗,导致患者生活质量急剧下降。CD患者伴发肛管直肠狭窄通常预示着肠道炎症,尤其是直肠炎症未得到控制,显著增加转流性肠造口或直肠切除的风险。临床诊断需要综合详细的体格检查、内镜及活检、磁共振成像等。治疗以内科治疗为主,辅以内镜和器械扩肛,必要时外科手术干预,但目前缺乏标准化诊疗方案。本文对该病的发病机制、诊断及治疗方式进行阐述,以期对临床诊治有所帮助。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(Crohn′s disease,CD)相关的肛管直肠狭窄是发生在消化道远端的狭窄性病变,在肛周克罗恩病(perianal Crohn′s disease,PCD)中发病率为17% ~ 22%[1]。肛管直肠狭窄一旦出现临床症状,常预示预后不良,约57%患者最终需接受粪便转流或直肠切除手术[2,3]。抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)单克隆抗体等生物制剂给CD的治疗带来曙光,但随后的研究表明,肛管直肠狭窄的发生率及手术率并未发生显著变化[4]。与回肠或结肠狭窄不同,对肛管直肠狭窄的认识和治疗远未满足临床需求,亟需标准化的诊治方案[5]。本文根据作者的临床实践,结合国内外发表的相关研究,对CD相关肛管直肠狭窄的发病机制、临床特征及诊治策略进行论述。
CD肛管直肠纤维化狭窄发展进程的具体机制至今尚不清楚。狭窄肠管全层均显示出胶原蛋白过度沉积,但以黏膜和黏膜下层病变最为明显,通常增厚2 ~ 3倍。在黏膜肌层中,纤维化与扭曲的平滑肌混杂,相反,固有肌层受肌内隔限制,纤维化程度较小[6]。慢性炎症是肛管直肠狭窄的一个先决条件,但是除了炎症与纤维化狭窄之间的关系外,纤维化还存在与炎症无关的机制,如整合素、钙黏蛋白(cadherin)、细胞外基质(extracellular matrix,ECM)交联相关酶以及环境因素等[7,8,9]。
对肛管直肠慢性炎症、溃疡和肠道损伤,机体会反复尝试通过ECM的无序沉积来促进溃疡愈合。产生ECM的细胞主要是间质细胞分化的肌成纤维细胞(myofibroblasts)、成纤维细胞(fibroblasts)和平滑肌细胞(smooth muscle cells),还包括上皮细胞、内皮细胞、星状细胞以及骨髓干细胞[10,11,12]。纤维化发展的最主要驱动力之一是细胞转化生长因子-β1 (transforming growth factor-β1),同时包括白细胞介素(interleukin,IL)4、5、13、血小板衍生生长因子(platelet-derived growth factor)、结缔组织生长因子、成纤维细胞生长因子和胰岛素样生长因子等[13,14,15,16]。除了免疫和非免疫细胞释放的生长因子和细胞因子外,肠道微生物也是间充质细胞活化的驱动因素,共同导致纤维化进展[17,18]。
纤维化程度取决于ECM产生和降解之间的平衡。沉积的ECM通常被基质金属蛋白酶(matrix metalloproteinase,MMP)降解,MMP可被肝细胞生长因子诱导并被金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMP)抑制。在伴有纤维化的IBD肠道组织中,MMP下调而TIMP过度表达,从而导致ECM的过度沉积和纤维化[19]。
肛管直肠狭窄发病部位主要位于远端直肠及肛管,较少累及直肠中上段,并随着疾病进展表现出不同的临床特征。狭窄由慢性炎症进展而来,形成过程非常缓慢,同时由于患者多伴有不成形稀便,狭窄早期症状易被掩盖,仅大便变细或无明显临床症状,只有在内镜检查或直肠指检时才被发现。随着纤维化进程,患者后期往往出现腹胀、排便困难和肛门坠胀(直肠壶腹充溢干性粪便,不能排出),急便感或排便次数增多(溢出性腹泻),大便失禁(纤维化的肛管直肠管壁缺乏弹性控制能力)以及肛门疼痛(肛周污物导致肛周皮肤损伤)等症状。这些患者往往同时伴发其他肛周病变,如复杂性肛瘘、肛管直肠溃疡、直肠炎和皮赘,在体格检查时需要仔细辨别并详细记录。
肛管直肠纤维化狭窄后期,肛管直肠顺应性下降,易出现肛门失禁,并增加患者的焦虑抑郁心理。Kangas等[20]表明,直肠狭窄是CD患者发生完全大便失禁的危险因素,肛门直肠狭窄患者失禁风险是非狭窄患者的7.36倍(P<0.0001)。由于狭窄导致肛管压力增加,弹性减少,易导致肠壁溃疡破损加重,并发其他复杂的肛周病变,如肛瘘、直肠阴道瘘等。另一方面,由于长期持续存在的慢性炎症,慢性狭窄甚至可能与继发肛门直肠恶性肿瘤有关。文献报道肛管直肠狭窄总体癌变率为2%,且黏液腺癌多见[21]。
Hughes-Cardiff分型根据狭窄的性质和严重程度将CD肛管直肠狭窄分为S0(不存在)、S1(可逆性狭窄,具有轻度或中度临床影响)和S2(不可逆性狭窄,具有严重临床影响),见表1[22]。S1型狭窄通常与炎症有关,S2型狭窄则与组织纤维化相关。肛管狭窄多数与内括约肌痉挛有关(S1a和S1c),少数为肛管溃疡或感染导致的纤维化狭窄(S2a)。直肠狭窄则是器质性的,包括(1)膜状狭窄:直肠环周浅表溃疡、炎性水肿所致(S1b);(2)管状狭窄:直肠深溃疡反复发生并修复,或者肛门直肠深部脓肿或肛瘘蔓延所致(S2b)[23]。

克罗恩病肛管直肠狭窄的Hughes-Cardiff分型[22]
克罗恩病肛管直肠狭窄的Hughes-Cardiff分型[22]
| 狭窄(S)分型 | 描述 | 亚型 |
|---|---|---|
| S0 | 无狭窄 | |
| S1 | 可逆性狭窄(痉挛或膜状) | a.肛管痉挛b.低位直肠—膜状c.痉挛伴严重疼痛—无感染 |
| S2 | 不可逆性狭窄(严重纤维化) | a.肛管狭窄b.直肠狭窄 |
CD肛管直肠狭窄的初始评估应包括局部检查(必要时在麻醉下探查)、直肠磁共振成像、内镜检查及组织活检(狭窄段及其近端肠道),需要准确描述狭窄下缘距离肛缘的高度、狭窄长度和范围、狭窄性质、肛门直肠功能评估、是否伴发其他肛周病变(溃疡、瘘管和脓肿),以及肠道炎症特别是直肠炎的活动程度。根据这些信息进行综合评估,才能制定合适的治疗计划。麻醉下检查有助于鉴别括约肌痉挛引起的狭窄和纤维化狭窄,括约肌痉挛在麻醉状态容易松弛和张开,指诊能够通过狭窄环,而纤维化狭窄需要外力协助方可通过。
随着临床病例的增多,笔者所在临床中心按照以下方法进行评估:(1)狭窄口径:应用不同直径的硬性扩肛器(直径6 ~ 18 mm不等)评估狭窄口径(图1A);(2)狭窄长度:通过测量狭窄近端、远端与肛缘的距离进行评估(狭窄长度=狭窄近端距肛缘长度-狭窄远端距肛缘长度)。应用直肠指检或硬质扩肛器评估狭窄下缘距离肛缘的距离,16号导尿管插入直肠15cm左右,球囊注入6 ~ 8 ml生理盐水(直径2 ~ 2.5 cm),将导尿管缓慢向外牵拉至有阻力为止,此时扩张的球囊下缘即为直肠狭窄上缘;拔出导尿管后测量球囊下缘至肛缘标记线的距离,此长度即为狭窄上缘距肛缘的长度(图1B、图1C)。通常根据狭窄长度可分为:①膜状狭窄,即薄层狭窄组织;②环状狭窄,即狭窄长度<2 cm;③管状狭窄,即狭窄长度>2 cm;(3)炎性或纤维化狭窄,通常用直肠MRI评估,以炎症为主的狭窄在T2WI表现为高信号,T2WI-FS则表现为明显高信号,而炎症后期以纤维化为主的狭窄T2WI表现为低信号,T2WI-FS表现为等信号或稍高信号(图2)。患者直肠往往呈半闭合状态,为影像评估和测量直肠狭窄带来一定困难。笔者中心通常在检查前置入导尿管,球囊内注入6 ml空气,检查前将导尿管下拉至狭窄上缘,从而提高肛管直肠狭窄评估的准确率,为临床医生提供狭窄近端距肛缘的高度、肠壁增生厚度、直肠壁各层组织结构增生情况(图3),以及伴发的瘘管性病变(图4)。超声受限于肛管直肠的部位、脂肪厚度等,故较少应用于肛管直肠狭窄的评估。




药物治疗应贯穿CD肛管直肠狭窄疾病全过程,辅以内镜治疗、器械扩肛,必要时行外科手术治疗。如患者狭窄没有明显症状,可以不治疗;当患者出现排便困难时,则应给予相应的治疗。临床医生制定治疗计划需重点考虑狭窄性质,是否有排便困难、慢性梗阻或大便失禁,以及是否需要进一步排除狭窄部位和近端肠道癌变的可能性。炎性狭窄应首选药物治疗,如生物制剂和免疫抑制剂等,根据情况确定是否行器械扩肛;有症状的短段纤维性狭窄,可选择器械扩肛、内镜下球囊扩张或麻醉下扩肛;内镜无法通过或未进行充分活检的严重肛管直肠狭窄应考虑外科治疗,包括狭窄切开术和狭窄切除术;经过以上治疗效果不佳或有癌变风险时应及时行直肠切除[24]。
狭窄导致的梗阻急性发作,需要急诊处理。除禁食、补液等处理外,还需及时解除肠道梗阻,如介入下置入经肛结肠导管。若处理后梗阻仍无法解除,则需要考虑粪便转流,甚至全结肠直肠切除联合永久性回肠造口。临时性粪便转流可以解决梗阻症状,但对于肛管直肠狭窄无治疗作用。一项关于CD患者永久性造口的预测因素研究显示,结肠病变和肛管直肠狭窄是永久造口的预测因素[25]。
肛管直肠狭窄的初始治疗包括补充液体、使用大便软化剂防止粪便嵌塞,减轻因排便困难引起的疼痛,并通过排便起到自动扩肛作用,以上措施可以作为轻中度狭窄患者的有效治疗,并作为严重狭窄患者缓解症状的临时措施。
炎性狭窄或纤维化狭窄伴有严重肛周病变的患者应首选药物治疗。糖皮质激素是诱导活动期CD缓解和治疗炎性狭窄的有效药物,但研究认为激素会导致肠腔狭窄,增加术后并发症[26]。早期使用免疫抑制剂可以延后肠道纤维化的手术时间,但并未降低肠道纤维性狭窄的发生率[27]。沙利度胺可以通过调节TIMP-MMP蛋白平衡和ECM降解来改善肠道炎症,缓解TNBS诱导的小鼠结肠纤维化,但缺少相关临床报道[28]。其他免疫抑制剂如环孢素、甲氨蝶呤对IBD肠道纤维化疗效不显著[29]。
生物制剂可以抑制肠道炎症进展,但由于纤维化机制并不完全依赖于炎症通路,现有生物制剂对纤维性狭窄治疗作用不确定[30]。抗TNF-α单克隆抗体可以减少严重狭窄发生,降低永久性造口或直肠切除[21]。一项对22例使用英夫利西单克隆抗体(infliximab,IFX)治疗的肛门狭窄患者进行回顾性研究发现,狭窄完全缓解率为55%(12/22),12例中有6例同时进行扩肛治疗,表明IFX联合扩肛可能会提高肛管直肠狭窄的疗效[1]。目前缺少新型生物制剂,如维得利珠单克隆抗体(vedolizumab,VDZ)和乌司奴单克隆抗体(ustekinumab,UST)治疗CD肛管直肠狭窄的临床证据。Murate等[31]报道2例小肠狭窄型CD接受UST治疗,结果显示UST可以缓解小肠炎性狭窄。Matsumoto等[32]使用超声剪切波弹性成像(shear wave elastography,SWE)来评估应用不同生物制剂治疗肠道狭窄前后肠壁纤维化的改变程度,结果显示只有UST组的剪切波指数在治疗1年后显著下降(P = 0.028)。
器械扩肛可以降低粪便转流的可能性[25]。轻中度狭窄应首先尝试器械扩肛联合药物和(或)饮食调节治疗。扩张器直径以排便症状缓解,能通过内镜检查并活检为度,避免过度扩肛导致大便失禁。笔者中心的标准是对能够通过12 mm硬性扩肛器的患者建议扩肛治疗。首次扩肛可以在门诊或手术室进行,麻醉后用经过润滑的扩肛器或食指进行轻柔地扩张,并在扩肛后充分检查肛管和直肠。随后指导患者在家中使用相应直径的扩肛器自行扩肛,以维持治疗效果。使用的扩肛器应从能轻松插入的最大口径开始,逐渐过渡到16 mm或18 mm扩肛器。
目前肛管直肠狭窄主要的内镜治疗手段包括内镜下球囊扩张(endoscopic balloon dilation,EBD)和内镜下针刀狭窄切开(endoscopic stricturotomy with needle knife,NKSt)。内镜治疗可以判断病变部位和范围,并进行局部狭窄段的活检,是短段狭窄和内镜可通过狭窄的首选治疗方案[33,34]。
EBD是目前最广泛用于肠道狭窄的内镜治疗手段,具有简单和便捷的特点,30% ~ 40% CD患者由于狭窄复发需要多次扩张[35,36,37]。EBD适用于内镜可及范围内、狭窄长度<4 cm、无瘘管等并发症的孤立性狭窄。目前EBD球囊大小、扩张持续时间、球囊充气压力等方面标准尚未统一。相对于其他疾病,CD肛管直肠狭窄往往并发肛瘘、肛门溃疡和直肠炎等EBD禁忌证。
NKSt主要针对膜状、环状狭窄,长期疗效优于EBD,但是出血和穿孔风险增加,并发症总发生率为3.7%[38]。与EBD相比,NKSt通过精确控制切除的方向(平行于肛门括约肌)、深度(局限在固有肌层以内)和位置(侧壁或后壁),可以减少球囊扩张过程中损伤肛门括约肌或医源性直肠阴道瘘的风险[35]。一项纳入85例CD肠道狭窄(5例肛管直肠狭窄)应用NKSt治疗研究表明,NKSt治疗CD肠道狭窄是有效且相对安全的,可以成为EBD及外科手术的替代治疗[38]。
器械或内镜治疗效果不佳的肛管直肠狭窄需要手术治疗。切开或切除部分纤维化狭窄组织以维持正常排便功能,并最大限度保护肛门括约肌功能。CD肛管直肠狭窄往往伴有透壁性炎症、潜在的肛门失禁、局部缺乏可供修补的健康组织以及伤口愈合困难等不良因素,局部外科手术需要谨慎。ECCO-ESCP关于CD外科手术共识意见明确指出,伴有严重肛管直肠狭窄的患者应考虑将全结肠直肠切除术(total proctocolectomy,TPC)作为初始治疗或尽早完成直肠切除术[39]。
狭窄切开术是治疗CD肛管直肠狭窄最常用的手术方式,适用于长度<2 cm的膜状狭窄。患者取俯卧折刀位,肛门直肠牵开暴露狭窄下缘,直视下血管钳引导沿纵轴用电刀或超声刀两点(截石位3、9点)或3点(截石位3、6、9点)切开狭窄,创面开放二期愈合或横行缝合成形。根据狭窄高度决定切开的长度,深度应以肛门内括约肌为界。Lee等[40]报道15例短段型肛管直肠狭窄患者,包括7例CD患者,采用纵切横缝式成形术(Heineke-Mikulicz stricturoplasty),平均随访21个月,2例失败,其中1例为CD患者。ECCO指南不推荐应用切割挂线术治疗肛管直肠狭窄在内的肛周CD患者[39]。
受克利夫兰医学中心沈博教授内镜下环形切除肠道狭窄技术的启发,笔者中心自2017年起采用经肛门半环状狭窄切除术(transanal semicircumferential stricturotomy,TSCS)治疗CD患者重度肛管直肠纤维化狭窄(管状狭窄,管径<8 mm)。超声刀切除狭窄后壁半圈(截石位顺时针3 ~ 9点),远端切缘以狭窄下缘为标记,紧贴肛门内括约肌或直肠固有肌层表面切除增生的黏膜和黏膜下层;近端切缘至正常的直肠黏膜,切除后管径16 ~ 18 mm扩肛器可顺利通过(图5)。患者术后即正常饮食、排便,并于术后7 ~ 10 d开始教导患者自行扩肛。为维持疗效,通常建议患者每周2次扩肛,至少坚持3个月以上。
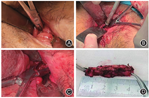

2021年底我们统计18例TSCS治疗CD肛管直肠狭窄患者的结果,平均随访(16.0 ± 11.4)个月,3例患者术后复发(不能通过14 mm硬性扩肛器),其中2例再次行TSCS手术。作者认为,在遵循医患共同决策原则下,TSCS可以用于其他局部手段无法治疗的重度狭窄,对于无法完全经肛切除的超长段狭窄,可以联合EBD或NKSt处理。然而,作为永久性造口前的挽救性手术,TSCS临床应用需要多中心、大样本临床研究。
对于上述治疗失败的患者建议行直肠切除术,如果存在癌变则需要按照肿瘤治疗的原则。严重肛管直肠狭窄的手术方式包括TPC+回肠造口术、直肠切除+结肠造口术,或对少量合适的病例行直肠切除吻合术。尽管TPC治疗CD肛管直肠狭窄的最佳手术时机仍存在争议,但TPC具有以下优势:(1)迅速改善患者整体健康状况;(2)对仅接受直肠切除术+结肠造口的患者,减少其后期因结肠病变需要再次行结肠切除术的可能;(3)随着生物制剂的广泛应用,TPC+回肠造口术后的CD肠道复发率显著降低[5,41,42,43]。会阴入路应尽可能在括约肌间切除(intersphincteric resection)以降低会阴切口不愈合的风险。
CD肛管直肠狭窄发生机制尚不明确,临床评估缺乏标准化方法,尽管内科治疗需要贯穿疾病始终,但肠道抗纤维化药物的研发滞后明显,目前尚无特异性药物治疗手段。疾病症状出现阶段需要影像、内镜、消化内科和结直肠外科多学科协作,并遵循医患共决策原则,根据狭窄性质和程度合理选择治疗策略。
所有作者均声明不存在利益冲突



























