
肝移植是目前治疗终末期肝病的唯一有效方法。超声检查具有无创、便捷、实时及可动态显示肝内血管血流动力学变化的优势,已经成为肝移植手术全程管理过程中首选的评估手段之一。为进一步规范肝移植手术前后的超声检查,中华医学会超声医学分会、中国医师协会外科医师分会、中国医师协会介入医师分会及上海市医学会超声医学分会等机构组织全国肝移植领域包括超声科、肝脏外科、介入科等多学科专家,结合目前肝移植超声诊治研究的最新实践,制定了《肝移植超声临床实践指南(2023版)》,内容涉及超声评估移植肝供体、受体,移植肝术中超声检查,术后并发症超声评估,超声在儿童肝移植中的应用以及超声引导下的移植肝穿刺活检及治疗,旨在推动中国肝移植超声检查实现规范、高质量发展的目标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝移植是目前公认治疗终末期肝病的唯一有效方法[1]。近年来肝移植术及相关技术飞速发展,移植后长期存活率不断提高。超声检查具有无创、实时、可动态显示胆管、血管及血流动力学变化等优势,已经成为肝移植手术全程管理过程中首选的评估手段之一。常规超声与超声造影、超声弹性成像、三维超声等新兴技术的联合应用又将肝移植超声评估水平显著提升到一个新的水平[2, 3, 4, 5, 6]。
近年来,美国肝病学会、美国移植学会、欧洲肝病学会等机构陆续发表或更新了活体肝移植、成人肝移植临床实践指南,其中部分涉及超声对肝移植术前、术后不同阶段的评估,但不够全面。肝移植在我国起步相对较晚,肝移植超声应用的临床研究和规范推荐也不能满足实际需要。2019年1月中华医学会器官移植学分会公布了《中国器官移植超声影像学诊疗技术规范(2019版)》。2019年4月中华医学会器官移植学分会组织全国肝移植临床专家,针对肝移植术后并发症的诊断与治疗,制订了《中国肝移植术后并发症诊疗规范(2019版)》[7](表1)。随着超声技术在肝移植手术中应用日益广泛,近年来国内、外出现了越来越多符合循证医学原则的高级别证据。为进一步规范我国肝移植超声影像学的应用,中华医学会超声医学分会、中国医师协会外科医师分会、中国医师协会介入医师分会、上海超声诊疗工程技术研究中心、复旦大学超声医学与工程研究所、中国医学装备协会超声装备技术分会及上海市医学会超声医学分会等机构组织全国肝移植领域包括超声科、肝脏外科及介入科等多学科专家,结合目前肝移植临床诊治和研究的最新实践,制定了本指南,旨在推动中国肝移植超声检查实现规范、高质量发展的目标。本指南已在国际实践指南注册平台注册(注册网址:http://www.guidelines-registry.org/)。
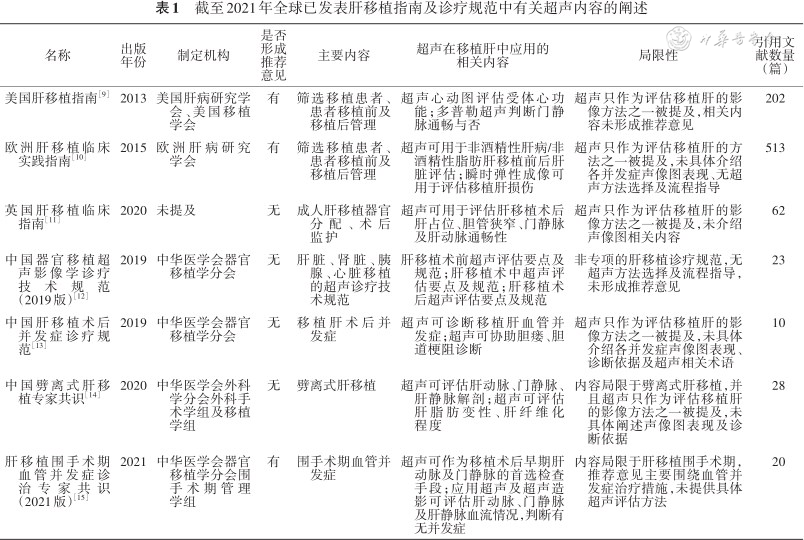
截至2021年全球已发表肝移植指南及诊疗规范中有关超声内容的阐述
截至2021年全球已发表肝移植指南及诊疗规范中有关超声内容的阐述
| 名称 | 出版年份 | 制定机构 | 是否形成推荐意见 | 主要内容 | 超声在移植肝中应用的相关内容 | 局限性 | 引用文献数量(篇) |
|---|---|---|---|---|---|---|---|
| 美国肝移植指南[9] | 2013 | 美国肝病研究学会、美国移植学会 | 有 | 筛选移植患者、患者移植前及移植后管理 | 超声心动图评估受体心功能;多普勒超声判断门静脉通畅与否 | 超声只作为评估移植肝的影像方法之一被提及,相关内容未形成推荐意见 | 202 |
| 欧洲肝移植临床实践指南[10] | 2015 | 欧洲肝病研究学会 | 有 | 筛选移植患者、患者移植前及移植后管理 | 超声可用于非酒精性肝病/非酒精性脂肪肝移植前后肝脏评估;瞬时弹性成像可用于评估移植肝损伤 | 超声只作为评估移植肝的方法之一被提及,未具体介绍各并发症声像图表现、无超声方法选择及流程指导 | 513 |
| 英国肝移植临床指南[11] | 2020 | 未提及 | 无 | 成人肝移植器官分配、术后监护 | 超声可用于评估肝移植术后肝占位、胆管狭窄、门静脉及肝动脉通畅性 | 超声只作为评估移植肝的影像方法之一被提及,未介绍声像图相关内容 | 62 |
| 中国器官移植超声影像学诊疗技术规范(2019版)[12] | 2019 | 中华医学会器官移植学分会 | 无 | 肝脏、肾脏、胰腺、心脏移植的超声诊疗技术规范 | 肝移植术前超声评估要点及规范;肝移植术中超声评估要点及规范;肝移植术后超声评估要点及规范 | 非专项的肝移植诊疗规范,无超声方法选择及流程指导,未形成推荐意见 | 23 |
| 中国肝移植术后并发症诊疗规范[13] | 2019 | 中华医学会器官移植学分会 | 无 | 移植肝术后并发症 | 超声可诊断移植肝血管并发症;超声可协助胆瘘、胆道梗阻诊断 | 超声只作为评估移植肝的影像方法之一被提及,未具体介绍各并发症声像图表现、诊断依据及超声相关术语 | 10 |
| 中国劈离式肝移植专家共识[14] | 2020 | 中华医学会外科学分会外科手术学组及移植学组 | 无 | 劈离式肝移植 | 超声可评估肝动脉、门静脉、肝静脉解剖;超声可评估肝脂肪变性、肝纤维化程度 | 内容局限于劈离式肝移植,并且超声只作为评估移植肝的影像方法之一被提及,未具体阐述声像图表现及诊断依据 | 28 |
| 肝移植围手术期血管并发症诊治专家共识(2021版)[15] | 2021 | 中华医学会器官移植学分会围手术期管理学组 | 有 | 围手术期血管并发症 | 超声可作为移植术后早期肝动脉及门静脉的首选检查手段;应用超声及超声造影可评估肝动脉、门静脉及肝静脉血流情况,判断有无并发症 | 内容局限于肝移植围手术期,推荐意见主要围绕血管并发症治疗措施,未提供具体超声评估方法 | 20 |
本指南制定采取了以下的文献检索策略:首先使用PubMed和Embase等国际医学主流医学文献数据库,以英文关键词“liver transplantation”“transplanted liver”和“ultrasound”等为检索词进行检索。同时,为了保证准确性和全面性,进一步使用中国知网、万方数据库等中文文献数据库,以“移植肝、肝移植、超声”为关键词进行检索。对于筛选出的大量相关文献,根据文献的质量、可靠性和实用性进行筛选和评估,最终选取了符合指南编写要求的、最具代表性和价值的文献进行分析。本指南是在综合文献基础上,结合编写组专家们长期的临床实践经验形成。通过专家投票方式产生推荐意见,投票过程如下:对于每条意见,专家可选择同意/不同意/弃权;计算参与专家所投同意票所占的百分比:当百分比>95%时,认为是一致同意;在75%~95%时,认为是广泛同意。指南采用《牛津循证医学中心分级2011版》来执行证据分级,结合GRADE系统的指导原则[8]对推荐意见赋予相应的推荐强度(表2、3)。

本指南证据水平分级及依据
本指南证据水平分级及依据
| 证据水平 | 依据 |
|---|---|
| 1 | 采用了公认参考标准和盲法的横断面研究的系统综述 |
| 2 | 采用了公认参考标准和盲法的单个横断面研究 |
| 3 | 非连续性研究,或未采用公认参考标准的研究 |
| 4 | 病例对照研究,或采用低质量或未采用独立参考标准的研究 |
| 5 | 基于机制的推理及假说 |

本指南推荐强度分级及依据
本指南推荐强度分级及依据
| 推荐强度 | 内容 | 依据 |
|---|---|---|
| 强推荐 | 确信干预措施利大于弊 | 有高质量的研究证据;研究结果一致性佳,几乎没有例外;和(或)专家组成员同意 |
| 中等程度推荐 | 估计干预措施利大于弊 | 有较好的研究证据支持;研究结果基本一致,有轻微和(或)少数例外;对研究质量存在轻微或少量疑虑;和(或)专家组成员同意 |
| 弱推荐 | 利弊不确定 | 研究证据有限;研究结果较一致,但有重要例外;对研究质量存在重要疑虑;和(或)专家组成员同意 |
常规腹部彩色多普勒超声诊断仪即可满足临床需要,推荐配备超声造影、弹性成像、肝脂肪定量、彩色多普勒能量图和超微血管成像等功能及软件。肝移植术前及术后超声检查常规采用凸阵探头,频率3~5 MHz。儿童,尤其是婴儿和低龄儿童,可选用频率4~9 MHz线阵或4~7 MHz凸阵探头。肝移植术中超声一般选择频率5~12 MHz的术中探头。术中超声检查前仪器应清洁消毒,术中超声探头及导线均套以医用无菌保护套或低温等离子灭菌消毒后方可使用。
1. 二维灰阶成像:选择合适的频率、增益、深度、焦点、动态范围、帧频相关等参数优化肝脏超声图像的清晰度和分辨率。肝移植超声一般使用90%~100%声输出功率,机械指数(mechanical index,MI)1.0~1.2,肥胖或脂肪肝患者可适当调低探头频率。
2. 彩色多普勒血流成像:选择合适的彩色信号阈值、增益、壁滤波、取样框、余辉等参数,以达到能敏感显示感兴趣区血流而尽量减少“彩色溢出”。彩色多普勒速度标尺通常调低至10~20 cm/s,余辉设置可适当增高。
3. 脉冲波多普勒成像:选择合适的增益、壁滤波、速度标尺、基线等参数,以达到能敏感显示感兴趣区血流信息而不出现脉冲频谱“溢出和折返”。一般取样容积2~4 mm,血流方向和声束夹角不超过±60°。
4. 超声造影:临床应用于移植肝的超声造影剂(ultrasound contrast agent,UCA)以SonoVue(声诺维,意大利Bracco公司)和Sonazoid(示卓安,美国GE药业)为主。使用SonoVue检查移植肝推荐MI为0.06~0.10,剂量为每次2.4 ml混悬液;Sonazoid选择MI为0.18~0.22,剂量为每次0.12 μl混悬液/kg。超声造影检查时,静脉内注射UCA的剂量需要考虑以下几个因素而作调整:(1)评估移植血管的通畅性时,UCA使用剂量可低于肝占位性病变检查时;(2)根据不同超声仪器和相关造影成像技术调整UCA用量;(3)选择高频率超声探头时,可使用比低频率超声探头检查时更大剂量的UCA,但一般不宜超过2倍;(4)根据儿童的年龄或体重调整UCA用量。国内SonoVue适用人群为18岁以上成人,但2016年美国FDA已批准同类造影剂Lumason(意大利Bracco公司)用于儿童肝脏检查。可以重复推注UCA[16, 17, 18],但总剂量不超过4.8 ml[19]。
5. 超声弹性成像:在肝移植方面临床应用最广泛的超声弹性成像技术为剪切波弹性成像(shear wave elastography,SWE)。检查应根据具体设备的质控参数进行适当调整,包括取样感兴趣区大小、测量区域和弹性量程等。超声弹性成像检查时患者需避免Valsalva动作。
6. 其他:当移植肝血管严重狭窄时,可进一步采用脉冲波多普勒成像评估血管狭窄的严重程度。当血流速度极低时,彩色多普勒能量图和超微血管成像技术可作为彩色多普勒血流成像(color Doppler flow imaging,CDFI)的补充,用于捕捉低速血流信号。
进行肝移植超声检查的医生需具有“医师执业证书”,具有中级及以上专业技术任职资格,熟练掌握肝脏超声检查技术以及仪器设备的操作及调节。
在独立担当肝移植超声检查工作前,应先观摩本领域专家进行的肝移植超声检查,获得相关经验,然后在该方向进行严格专业培训、考核,从而掌握肝移植超声检查的操作规范、主要评估内容及注意事项。此外,操作人员应熟悉并掌握超声造影、超声弹性成像等技术在肝移植相关检查中的应用。
肝移植超声检查无需特殊准备。小儿需安静状态下检查,必要时给予镇静剂。对肝移植患者行超声引导下介入操作前需要准备的内容包括:明确凝血功能、血常规,停用抗凝药物或减量,嘱患者练习憋气,必要时镇咳。
超声检查采用仰卧位及左侧卧位为主,必要时右侧卧位,偶尔行半卧位或坐位。常规使用消毒型耦合剂,避免接触伤口,不可避免接触伤口时需套无菌隔离套,防止伤口感染。
超声检查移植肝时主要观察断面如下:
1. 肝左叶斜断面:显示门静脉左支及矢状段的“工”字形结构。
2. 右肋缘下斜断面:显示肝膈顶区、肝右静脉、肝中静脉、门静脉左支、门静脉右支。经第二肝门斜断面显示三支肝静脉汇入第二肝门。
3. 肝右叶肋间斜断面:显示肝右叶、左内叶和尾状叶,第一肝门,第二肝门,肝右叶门静脉分支、肝右静脉及肝中静脉。其中经第一肝门斜断面为评估移植肝管道吻合的重要断面。
4. 肝-右肾矢状断面:显示膈肌上下有无胸腔积液、腹水。
1. 肝移植术前超声评估:包括(1)供体肝脏评估:①肝脏有无良、恶性肿瘤等局灶性病变和肝纤维化、脂肪肝和血吸虫肝病等弥漫性病变;②肝脏血管和胆道系统的通畅性和解剖变异。(2)受体肝脏评估:①评估肝实质有无肝纤维化及其程度;②确定肝内占位数目、部位、大小及性质。③评估是否存在肝脏血管病变,尤其关注是否存在门静脉海绵样变、门静脉栓子。
2. 肝移植术中评估:对于活体肝移植,术中超声需对供体肝中静脉进行实时定位;对于受体可直接了解移植后肝实质及肝脏血管、胆管通畅情况。
3. 肝移植术后围手术期床旁超声评估:评估移植肝血管、胆管通畅情况以及胸腹腔、心脏、肾脏等情况。对活体肝移植术后残留供肝的肝实质、血管、胆管评估,判断是否出现并发症等。
4. 肝移植围手术期后超声随访:评估移植肝血管及胆管通畅情况,移植肝局灶性病变和弥漫性病变,以及胸腹腔、心脏及肾脏等情况。
5. 超声引导下诊断治疗:可行移植肝组织穿刺活检、胆管引流、术后积液或脓肿抽液或置管引流、肿瘤消融治疗等。
肝移植超声检查无绝对禁忌证。
肝移植手术方式包括全肝移植和部分肝移植。全肝移植根据流出道重建方式不同分为经典式原位肝移植和背驮式原位肝移植;部分肝移植包括活体肝移植、劈离式肝移植及减体积肝移植。活体肝移植手术通常切取供体右半肝给受体,大多数为不带肝中静脉的右半肝移植。左半肝较小,一般供给儿童或体型较小的成人。
在经典的劈离式肝移植中,肝脏一般被分为2部分,即供给儿童的左外叶(Ⅱ段和Ⅲ段)和供给成人的扩大式右三叶(Ⅰ段和Ⅳ~Ⅷ段)。当受体为2名成人时,供肝则劈离为含Ⅰ~Ⅳ段的左半肝和含Ⅴ~Ⅷ段的右半肝,其中左半肝供给体型较小的成人[20]。
熟悉肝移植时血管、胆管常见吻合方式对移植肝超声检查十分重要。移植肝需要进行三处血管(肝动脉、门静脉和流出道)和一处胆道吻合。经典肝动脉吻合方式是供受体肝动脉端-端吻合;若受体肝动脉有解剖异常或其他原因不适合作吻合时,有时会用替代血管(常为供体髂动脉)将供体肝动脉和受体腹主动脉进行吻合。
经典门静脉吻合方式为门静脉端-端吻合;如门静脉已闭塞,会以替代血管(常用供体髂静脉)将供体门静脉与受体脾静脉或肠系膜上静脉吻合。
原位全肝移植流出道重建时,经典术式是“腔静脉双吻合”。即受体肝后下腔静脉与病肝一并切除,供体肝上及肝下下腔静脉与受体下腔静脉两断端吻合。“背驮式”是另外一种流出道常用吻合方式,即将供体肝下下腔静脉端结扎,肝上下腔静脉端和受体肝静脉的总残端吻合(图1G)[20]。右半肝移植时,因大多数活体右半供肝不带肝中静脉,若Ⅴ段和Ⅷ段有较粗大静脉回流属支,则可以建立一条桥静脉,将血液引流至受者下腔静脉以防止肝淤血的发生(图1H)。
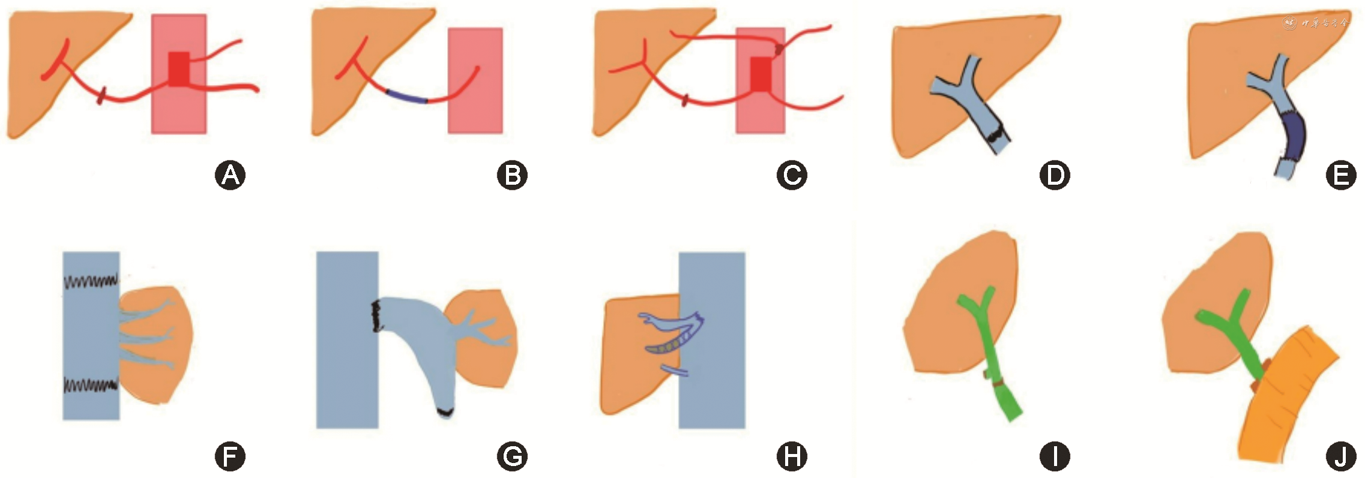

胆道吻合有2种方式,供、受体肝外胆管端-端吻合或胆管-空肠吻合,以胆总管端-端吻合首选。活体半肝移植时,通常采用胆管与空肠吻合(图1J)。
供肝术前影像学检查主要评估供肝实质情况,肝内血管系统和胆道系统的通畅性和解剖变异,可通过超声、CT、MRI和磁共振胰胆管成像(magnetic resonance cholangiopancreatography,MRCP)等进行评估,其中超声在供肝评估方面有独特的优势和应用价值。
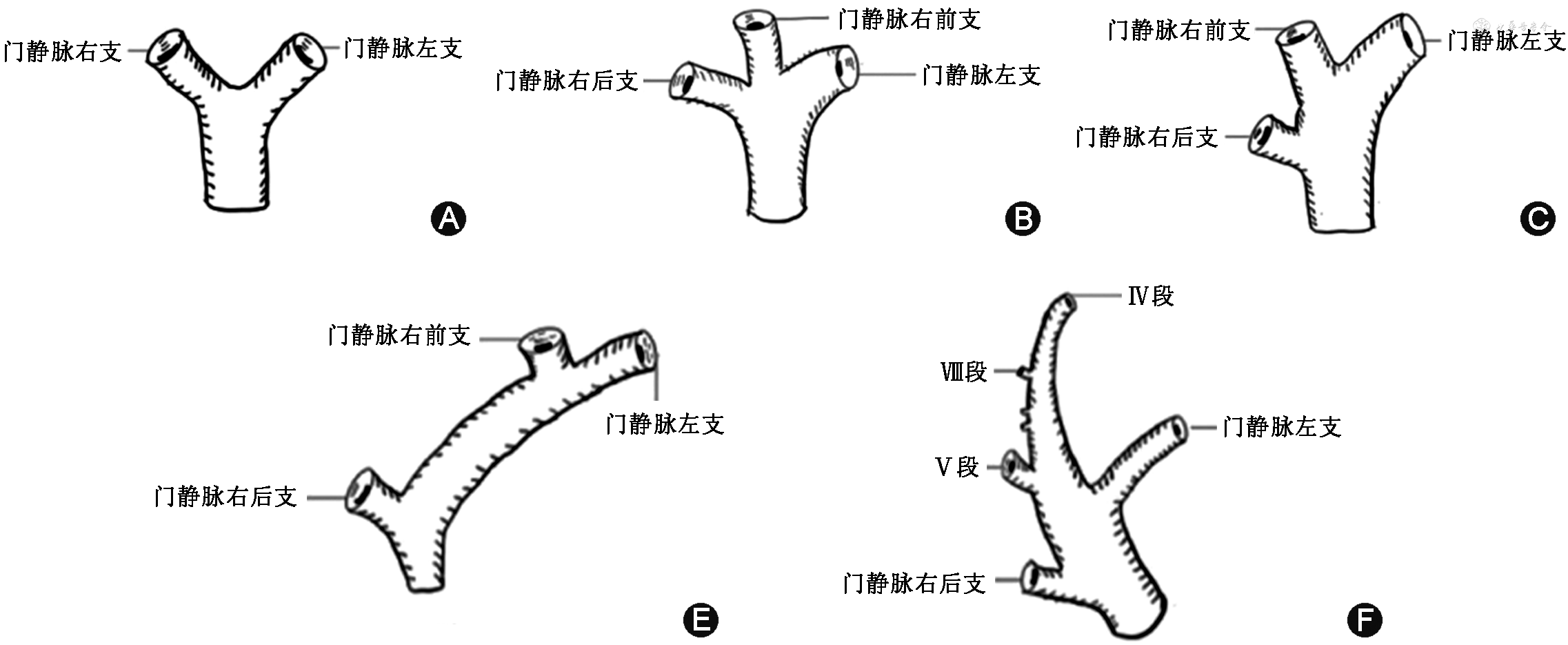
1. 供肝血管评估:(1)超声可测量肝动脉内径,正常肝总动脉内径2~5 mm,肝固有动脉内径2~3 mm。同时,超声可评估肝动脉是否存在动脉狭窄、动脉瘤。通过术前影像学检查明确肝动脉解剖情况,可为供肝劈离和肝动脉重建做好手术预案。但超声检查肝动脉变异较困难,主要依靠计算机断层扫描血管成像(computed tomography angiography,CTA)明确变异类型。(2)超声可测量门静脉内径,正常门静脉主干内径8~12 mm。同时,超声可评估门静脉主干及其分支内有无血栓、癌栓、海绵样变性、门静脉瘤(门静脉局部囊状扩张,肝外段门静脉>20 mm,肝内段>15 mm)。超声检查还可明确门静脉解剖分型,依据日本京都大学分型标准,D、E型不适宜作为活体肝移植供者(图2)[21]。(3)肝静脉:超声可测量肝静脉内径,正常肝静脉内径5~9 mm。同时,超声可观察肝静脉内有无血栓、癌栓、狭窄、闭塞等病变。超声检查需观察肝左、肝中及肝右静脉汇入下腔静脉的方式[22],对于肝左外叶(Ⅱ段+Ⅲ段)+扩大右三叶的劈离式肝移植,应注意Ⅱ、Ⅲ段肝静脉汇入肝中静脉或下腔静脉的方式及解剖变异;对于完全的左、右半肝劈离式肝移植,应注意Ⅳ、Ⅴ和Ⅷ段肝静脉的直径和汇入肝中静脉的方式。对>5 mm的肝中静脉粗大属支和副肝右静脉应重点观察[4,14]。

2. 供肝胆道评估:胆道解剖是肝移植术前影像学评估的重点,MRCP是目前显示胆道结构及变异的最主要工具,能准确显示肝内胆道第三级分支[23, 24]。常规超声在评估肝内胆道结构及变异方面价值有限。术中经胆道三维超声造影可清晰显示胆道的层次结构及管道走行,可以提供更全面的胆道解剖结构及变异等信息[25]。
3. 供肝实质评估:超声可对供肝实质进行评估,主要包括是否存在肝脂肪变性、肝纤维化及其程度。
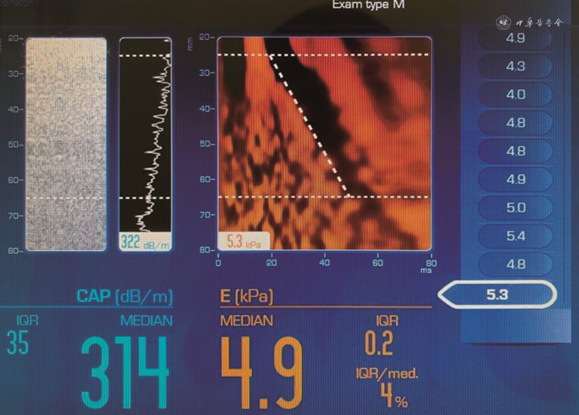
(1)供肝脂肪变性程度:不同程度肝脂肪变性对供肝质量以及移植肝受者的预后有较大影响。脂肪变性是影响劈离式肝移植早期预后的独立危险因素[14]。作为供肝的脂肪变程度上限为30%。超声对中、重度肝脂肪变性诊断有较高的灵敏度(81.2%~84.9%)和特异度(60%~100%)[26]。基于Fibroscan的受控衰减参数(controled attenuation parameters,CAP)目前已被批准作为肝脂肪变性的定量技术,以302、331和337 dB/m来诊断脂肪变性程度≥S1(10%~33%)、≥S2(34%~66%)和≥S3(66%)时,受试者操作特征曲线下面积(area under the curve,AUC)分别为0.87、0.77和0.70(图3)[27]。目前肝脏脂肪定量新技术还包括超声声衰减成像、组织背向散射成像以及新近开发的超声脂肪分数等。在评估肝脂肪变性程度方面逐步由超声定性诊断转为超声定量诊断。

(2)供肝纤维化程度:准确评估供肝纤维化程度非常重要,劈离式肝移植只能接受无纤维化的供肝[14]。超声弹性成像技术检测肝硬度以其无创、便捷、准确性较高,重复性较好的优势已逐渐应用于临床,其中基于Fibroscan的瞬时弹性成像(transient elastography,TE)已被欧洲肝病学会、亚太肝病学会(APASL)及中华医学会肝病学分会等推荐为无创评估肝纤维化的重要手段。二维剪切波弹性成像(two-dimensional shear wave elastography,2D-SWE)可于普通超声诊断系统中实现无创肝硬度检测,较TE技术具有检测成功率高、二维可视化取样等优势,更适用于肝脏等深部器官,临床应用前景广阔。利用2D-SWE获得的肝弹性模量7.1~7.6 kPa、10.1~11.7 kPa分别作为明显纤维化(≥F2)和肝硬化(F4)的诊断截断值,其AUC值为0.88~0.97和0.95~0.98[28]。
受体术前超声检查旨在选择合适的肝移植候选者,排除难以根治的肝外恶性肿瘤。超声造影被推荐用于评估肝脏局灶性病变和门静脉栓子。
1. 肝实质评估:超声可对受体肝脏实质纤维化程度进行准确评估(同供肝纤维化评估)。
2. 肝内病灶评估:米兰标准(单个肿瘤直径不超过5 cm,多发肿瘤少于3个并且最大直径不超过3 cm,无大血管侵犯及淋巴结及肝外转移)常被作为肝癌肝移植受者的选择标准[29]。超声检查可帮助确定肝内病灶数量、大小及性质。超声造影通过“动脉期均匀/不均匀高增强同时伴有门静脉期及延迟期廓清”诊断标准对肝细胞肝癌进行诊断,其结果与增强CT/MRI有很好的一致性[30]。2017版超声造影肝脏成像报告和数据系统(CEUS liver Imaging Reporting and Data System,CEUS LIRADS)可以通过对HCC高危人群中肝脏病灶LR-5类别[病灶直径≥10 mm+动脉期高增强+晚期廓清(>60 s)+轻度廓清]的确定,直接对HCC进行临床诊断,无需穿刺病理证实[31]。
3. 门静脉评估:门静脉海绵样变为肝移植相对禁忌证,超声可明确显示,表现为第一肝门部门静脉主干及肝内门静脉分支周围出现广泛或局部蜂窝状血管结构。CDFI可见蜂窝状结构内充满红蓝相间血流,脉冲波多普勒成像可检测出静脉样血流信号。肝移植术前必须要了解肝硬化HCC患者是否存在门静脉栓子(portal vein thrombosis,PVT),并确定其是否源于肿瘤,以排除移植禁忌证[32]。肿瘤性PVT在灰阶超声表现为门静脉主干或肝内分支扩张伴有腔内实性回声,CDFI可在肿瘤性PVT内测及动脉频谱(灵敏度24.0%,特异度100%)[33, 34],超声造影表现为动脉期肿瘤性栓子与肝动脉同时快速强化,门静脉期及延迟期出现造影剂廓清。移植肝供、受体术前超声评估主要内容如图4所示。
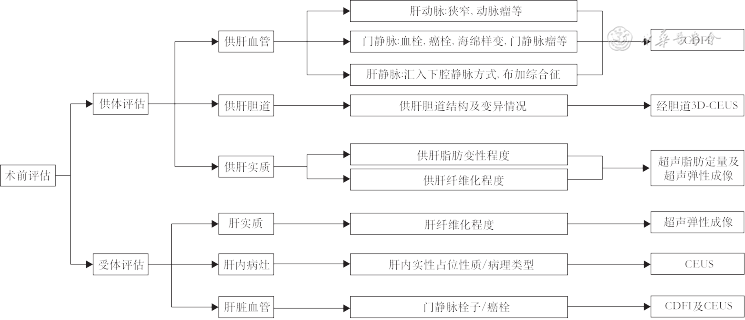

注:CDFI为彩色多普勒血流成像;CEUS为超声造影;3D-CEUS为三维超声造影
术中超声检查时探头可直接置于肝脏或血管表面,并可在血管吻合后即刻进行操作,这有利于直接了解肝实质及血管情况,及时向外科医师反馈信息并提供处理建议。术中超声在帮助提高移植成功率及减少术后并发症方面,具有其他影像学检查无法比拟的优势。
供肝切取时外科医师对肝脏血管解剖信息要求极高,超声医师需充分了解肝脏的解剖及活体肝移植手术术式,以更规范地进行术中超声检查[35, 36]。
1. 评估内容:对于活体肝移植,术中超声需对供体肝中静脉进行实时定位来明确劈肝线并避开重要血管[4]。
2. 观察要点:检查时将探头置于供肝膈面,先确认下腔静脉位置,随后沿膈面做横向或扇形扫查,确认肝中静脉全程走行,观察需离断和重建血管的管腔内径、走行及其与肝中静脉的位置关系。
在供肝植入完成血管重建后,术中超声医师应观察吻合血管的血流状态和监测移植肝血流动力学变化,及时发现异常并将信息提供给外科医生,以便及时处理。
1. 评估内容:主要评估移植肝肝动脉、门静脉、肝静脉、下腔静脉吻合口及其近、远端血流情况,判断是否存在血管痉挛、扭曲、狭窄、血栓等异常情况(图5)。
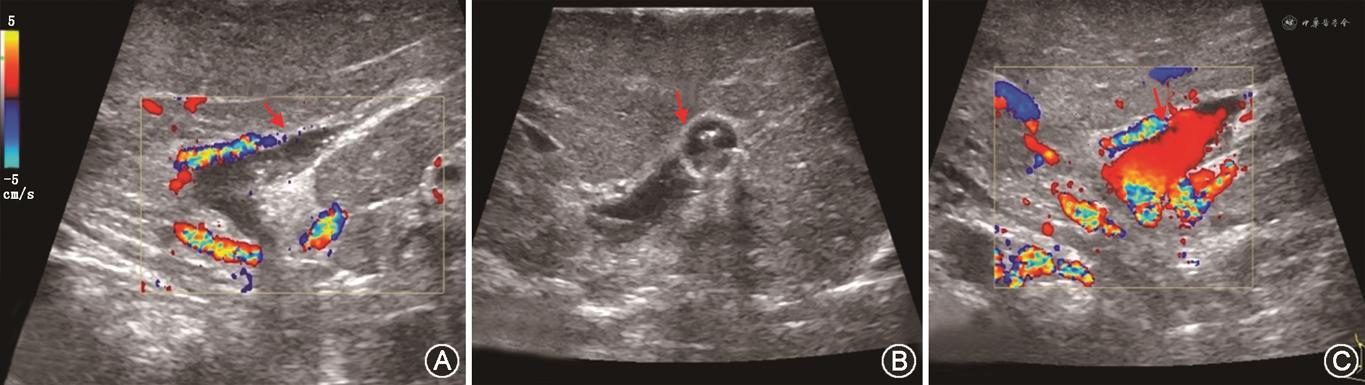

2. 观察要点:(1)术中超声检查发现门静脉周围搏动性肝动脉血流信号消失或显示不佳,吻合口远端肝内动脉峰值流速<20 cm/s时,在排除血管痉挛后,要考虑到肝动脉急性血栓形成、吻合口狭窄、扭曲或血管成角等可能;(2)术中超声需测量吻合后门静脉血流速度和血流量,流量过高(>250 ml·min-1·kg-1),术后有小肝综合征风险的可能,过低可能存在门静脉侧支分流血管。
3. 注意事项:(1)术中超声检查时动作应轻柔,如中间放置水囊则不宜过大,以免影响血管内径和血流速度的测量;(2)虽然术中超声无气体干扰,但门静脉流速高可能影响肝动脉的显示。采用瞬间夹闭门静脉或高帧频局部放大技术仍未显示肝动脉时,可应用超声造影提高对肝动脉血栓等病变的诊断准确性;(3)术中受条件限制,常规超声检查效果不理想时,可应用超声造影观察肝脏血流灌注及肝内血管情况;(4)双供体肝移植是将两个小体积供肝共同植入的特殊术式,术中超声需要分别观察2个移植肝的血管吻合情况。
1. 供体:活体肝移植供体术后24 h内行常规超声监测,观察肝实质有无缺血、淤血区域及肝内血流情况,排除门静脉内血栓及各血管吻合处狭窄等异常情况。
2. 受体:常规术后24 h内行首次超声检查。术后第1周,每日行常规移植肝超声检查,对出现异常者应增加超声随访次数,必要时随时检查以便及时发现并发症[37]。1周后根据患者恢复情况制定随访方案,怀疑出现并发症者,可增加检查次数。一般推荐的超声随访监测的时间周期见图6。
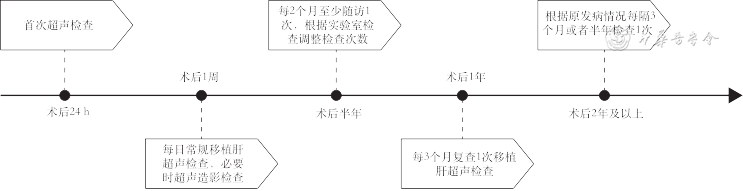

肝移植术后超声定期监测的内容[38]包括:常规超声了解肝脏的大小、形态、回声强度及有无占位等;CDFI了解肝内外血管情况及流速、阻力指数(resistance index,RI)等血流动力学指标(图7),有无肝动脉、门静脉及肝静脉等血管并发症;同时需了解肝内外胆管情况,有无胆管扩张;有无胸腔积液、腹水(表4)。
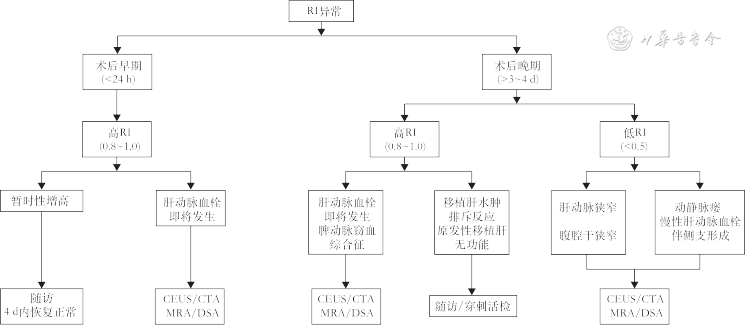

注:RI为阻力指数;CEUS为超声造影;CTA为计算机断层扫描血管成像;MRA为磁共振血管成像;DSA为数字减影血管造影

肝移植术后检查内容
肝移植术后检查内容
| 检查位置 | 检查内容 |
|---|---|
| 肝脏 | 大小及体积;肝实质回声及肝内结构;肝内占位情况 |
| 肝动脉 | 解剖形态;内径;吻合口通畅情况;频谱形态 |
| 门静脉 | 解剖形态;内径;吻合口通畅情况;频谱形态;门静脉周边水肿 |
| 胆管 | 解剖形态;内径及吻合口通畅情况;胆道积气 |
| 流出道 | 解剖形态;肝静脉及腔静脉内径;吻合口通畅情况;频谱形态 |
| 淋巴结 | 门静脉周围淋巴结;腔静脉周边淋巴结 |
| 其他 | 腹水;胸腔积液(右侧) |
常规超声发现肝内病灶或怀疑肝内血管狭窄及闭塞者可行超声造影进一步明确诊断。超声诊断困难时,可进一步行CT、MRI或数字减影血管造影(digital subtraction angiography,DSA)明确诊断。
超声监测具体内容及肝移植术后常见表现包括:
1. 胸腔及腹盆腔情况:移植肝表现及肝脏大小参考值与正常人相似,需注意观察回声强度是否均匀,是否有无回声区或梗死区,有无感染灶及占位性病变等。肝移植术后早期常有少量胸腹腔游离性积液、肝周渗液或小血肿,可随访观察,术后7~10 d可逐渐吸收。积液常见部位为右肝下间隙、右膈下、肝包膜下及左肝下间隙等。
2. 移植术后肝内血管情况:常规超声观察血管内径及管腔内有无异常回声;CDFI观察血流方向、充盈情况及血管是否扭曲;脉冲波多普勒成像观察血流频谱的形态及血流速度等。
(1)肝动脉:通常在移植肝第一肝门区检测肝动脉血流,肝右动脉可于肝内门静脉右支前方测量;肝左动脉可于门静脉左支矢状部旁测量(图8A)。移植术后肝动脉收缩期峰值流速(peak systolic velocity,PSV)变动范围较大,术后第一天PSV值可为19~133 cm/s[39, 40]。肝动脉RI正常范围为0.55~0.80,收缩期加速时间(systolic acceleration time,SAT)<0.08 s[41]。需注意的是,肝移植术后早期,肝动脉RI可较高,甚至可达到1.0,可能与术后血管痉挛、受体年龄偏高及供肝冷缺血时间过长等因素有关。对移植肝动脉RI异常患者应严密动态观察,结合患者病史、临床表现及其他影像学检查结果诊断及鉴别移植肝并发症[42]。评估流程如图7所示。
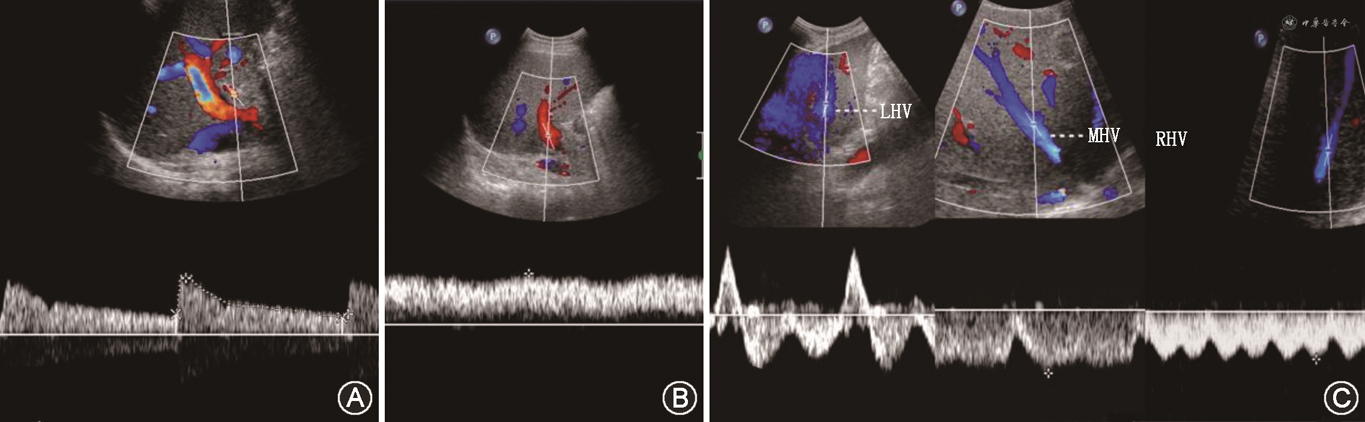

(2)门静脉:移植肝门静脉血流频谱呈向肝持续性单相波,血流流速可随呼吸轻微波动(图8B)。肝移植术后早期,门静脉流速有明显增高现象(PSV最高可达100 cm/s),甚至可以出现湍流,多数情况下会于3个月左右逐渐下降。这种移植术后早期门静脉流速增高的表现属正常现象,应注意与吻合口狭窄造成的流速增高相鉴别[43]。
(3)肝静脉及下腔静脉:正常肝静脉频谱具有期相性,反映血流随心动周期不同的生理变化(图8C)。可在距第二肝门2 cm内测量各支肝静脉流速及观察频谱形态,肝静脉流速变化范围较大(20~100 cm/s),多为三相波频谱。下腔静脉近心端流速曲线多为三相或双相波,少数呈单相波,流速变化范围大(30~100 cm/s)。
需注意的是,移植肝血管单次血流动力学参数异常,诊断移植肝血管并发症的特异度较低,强调动态多次随访的价值。
3. 移植术后胆道情况:超声检查应注意观察移植肝内外胆管有无梗阻(特别是吻合口),同时还需注意观察胆管腔内有无沉积物或结石,以及引流管位置等。正常移植肝肝内胆管可稍扩张,尤其是左叶肝内胆管。
肝移植术后可产生多种并发症,早期诊断并及时处理这些并发症对于保护移植肝功能及保证移植肝存活有重要意义。CDFI是筛查移植肝并发症的一线诊断工具,超声造影能更好地显示移植肝血管,有助于识别CDFI检查困难的移植肝动脉并区分狭窄及闭塞[44]。需更详细地评估移植肝血管解剖时,可应用增强CT或CTA检查。DSA是移植肝血管并发症的诊断“金标准”[45]。MRI对评估肝移植术后血管并发症作用有限,但在检测胆道并发症方面灵敏度很高[46]。因此,当临床上出现移植肝功能异常或怀疑移植肝并发症时,需注意合理地选择CDFI、超声造影或其他影像检查手段,流程如图9所示[3]。
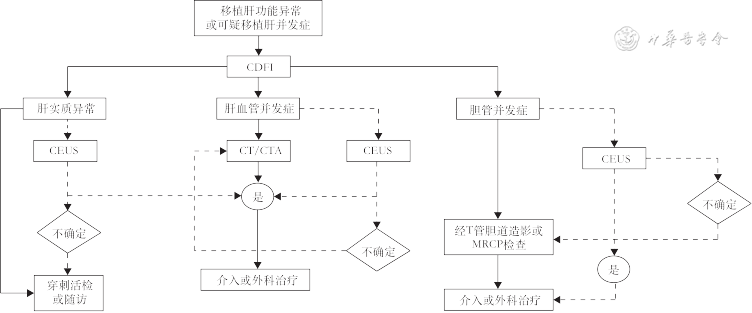

注:CEUS为超声造影;CDFI为彩色多普勒血流成像;MRCP为磁共振胰胆管成像;CTA为计算机断层扫描血管成像;虚线表示该种情况可以选择超声造影检查
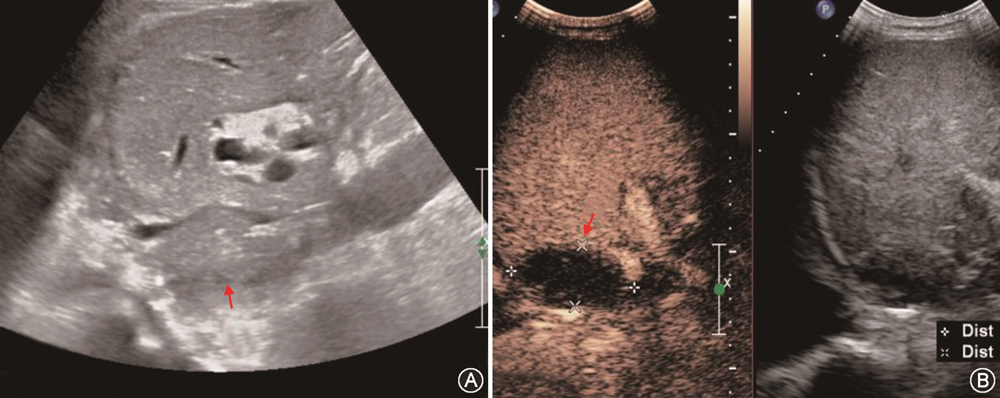
1. 肝移植术后胸腔、腹腔及肝周积液:移植后早期在双侧胸腔肋膈角、下腹部、肝裸区或肝包膜下常可探及少量透声良好无回声区,一般短期内可逐渐吸收。陈旧性或感染性积液多透声差且流动性弱,其内可见密集点状回声及粗细不等分隔,部分可呈蜂窝状或高回声的实性团块。CDFI检查内部无血流信号,超声造影检查内部始终无造影剂填充[47](图10)。超声造影检查如观察到造影剂自血管溢出,可帮助发现活动性出血[33]。当积液量较大患者症状明显或影响器官功能时,可行超声引导下置管引流术,在改善患者症状的同时有助于明确积液性质[48]。

2. 肝动脉并发症:肝动脉并发症是肝移植术后最严重的血管并发症之一,包括肝动脉血栓形成(hepatic artery thrombosis,HAT)、肝动脉狭窄(hepatic artery stenosis,HAS)及肝动脉假性动脉瘤(hepatic artery pseudoaneurysm,HAP)等。
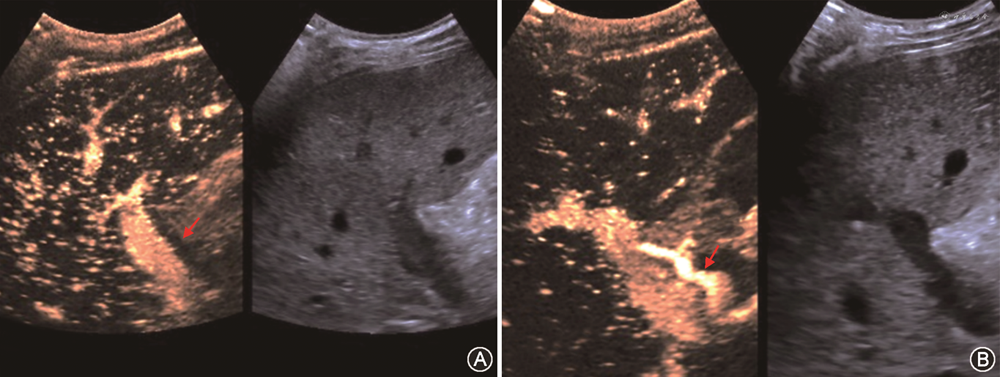
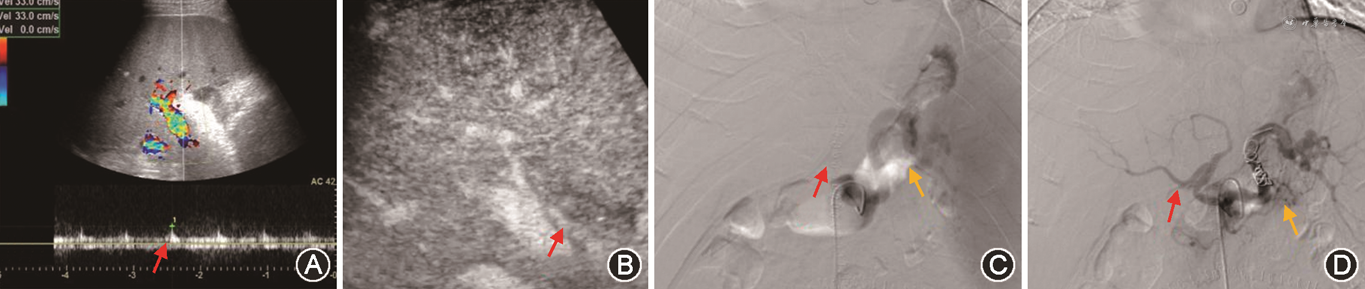
(1)HAT:HAT发生率为4%~12%,是肝移植术后最常见的肝动脉并发症,占移植后血管并发症60%。HAT的中位发生时间是移植后6.9 d[49, 50],约70%发生在吻合口。CDFI是目前筛查HAT的首选方法,在肝门、肝内外均未测及肝动脉血流,高度提示HAT[51]。CDFI诊断HAT的准确度60%~92%,移植后早期肝脏肿胀、肝动脉内径细小(1~3 mm)及术后血管痉挛均可使肝动脉显示困难,导致假阳性;而出现肝动脉—门静脉瘘或肝动脉血栓闭塞伴肝动脉侧支形成(最早于术后2周形成)时,又常因为CDFI检测到肝内动脉血流,导致假阴性发生[52, 53]。CDFI疑诊HAT时,应立即进行床旁超声造影或CTA及DSA检查。超声造影时如在门静脉显影前始终不能见到肝动脉显影可诊断HAT,有很高的阳性预测值(92.9%)及阴性预测值(100%)[54]。CDFI检测不到肝动脉血流疑诊HAT时,应用超声造影可以减少60%以上的不必要DSA检查[55, 56](图11)。同时,超声造影可明显缩短肝动脉超声检查所需时间,检查时不受患者心脏搏动、呼吸运动等造成的多普勒伪像干扰[57]。HAT可导致移植肝胆管壁缺血坏死及移植肝实质梗死。移植肝梗死灶声像图表现为近肝包膜处楔形不均匀低回声区,超声造影或增强CT表现为低灌注或无灌注区。

(2)HAS:HAS发生率为2%~11%,中位发生时间为移植后100 d[58],发生部位多见于肝动脉吻合口。与钳夹损伤、供受体肝动脉大小不匹配、肝动脉留置过长扭曲等手术技术因素有关。非吻合口部位肝动脉广泛性狭窄主要与移植肝排斥反应有关。CDFI检测到肝内动脉出现“tardus-parvus”频谱(RI<0.5及SAT>0.08 s),需考虑HAS可能[40]。此时应注意观察肝动脉吻合口处,尽可能直接显示HAS段,CDFI可见狭窄段局部呈“五彩镶嵌”花色血流,PSV>200 cm/s[59],或狭窄处PSV是其近端正常处测值的3倍以上[60](图12)。需注意,单独以肝内动脉出现“tardus-parvus”频谱诊断肝动脉吻合口狭窄假阳性率较高,达11.2%。以肝动脉“tardus-parvus”频谱与PSV降低(<48 cm/s)联合诊断HAS,假阳性率可降低为1%,特异度可从88.8%提高到99.1%[61]。超声造影可进一步改善肝动脉的显示,较CDFI更易直接观察到肝动脉吻合口狭窄段,可判断狭窄位置、程度及类型[62]。超声造影诊断HAS的灵敏度为92.3%,特异度为87.5%;与CDFI比较,超声造影可减少HAS的假阳性发现[63]。
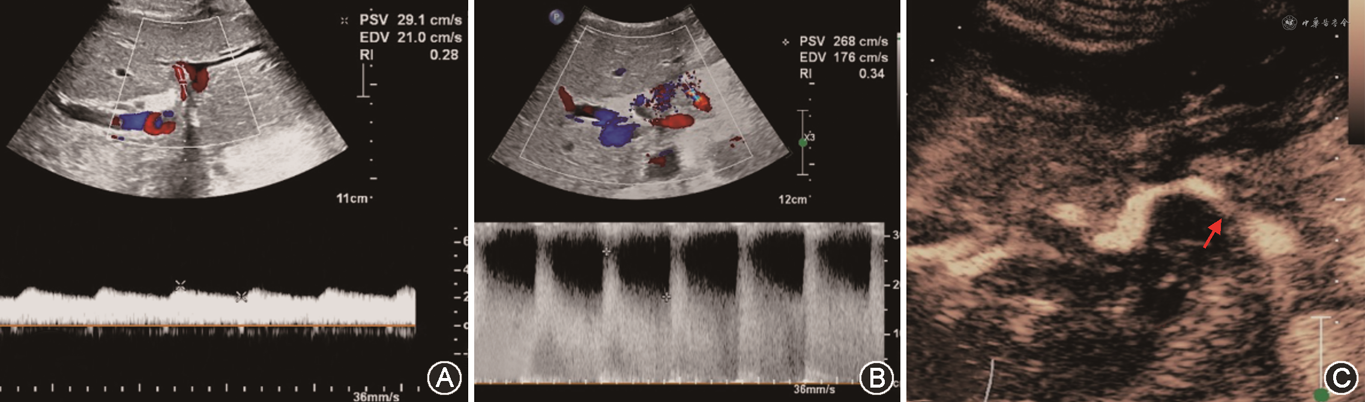

(3)HAP:HAP罕见,发生率约1%,属潜在致死并发症。HAP可发生于肝内或肝外,肝外HAP多位于动脉吻合口附近,多与感染或胆汁漏有关[64]。肝内HAP多与肝穿刺等操作有关。声像图上,HAP可表现为肝动脉吻合处或肝内肝动脉走行区域局限性无回声区,CDFI示其内杂乱或漩涡状彩色血流[65]。CDFI诊断HAP一般并不困难,当瘤体较小、位置较深时,进行超声造影检查可帮助明确诊断(图13)。需注意,移植肝动脉吻合处可呈鱼嘴状扩张,不要误诊为HAP[42](图14)。移植肝内其他易误诊为HAP的结构包括:引流管、局部扩张胆管、胃十二指肠动脉结扎处[45]。CTA有助于HAP与其他结构相鉴别。
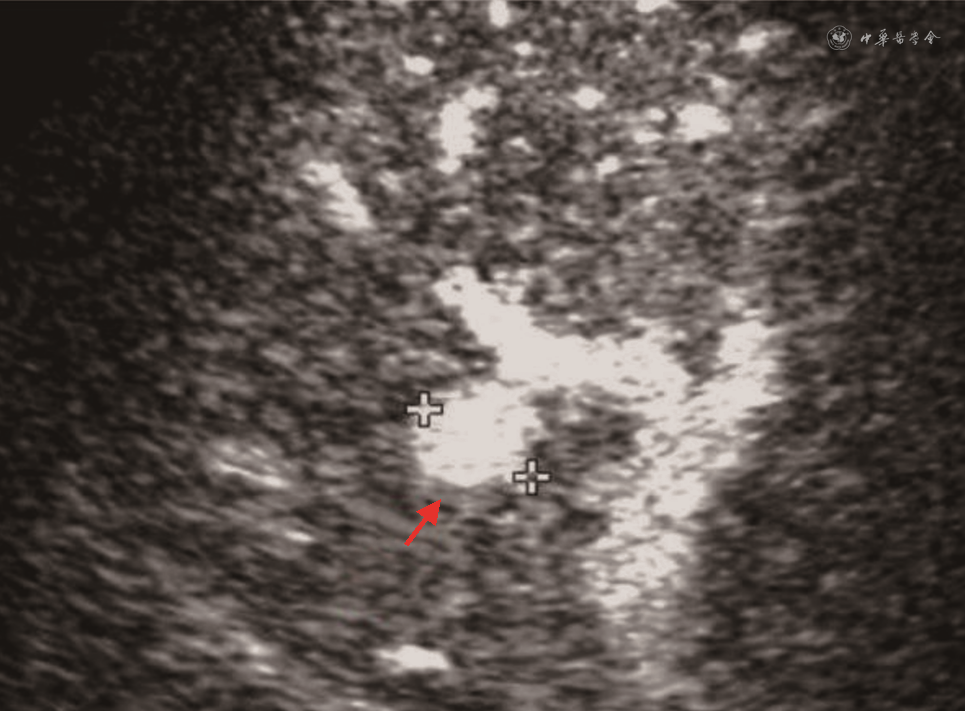

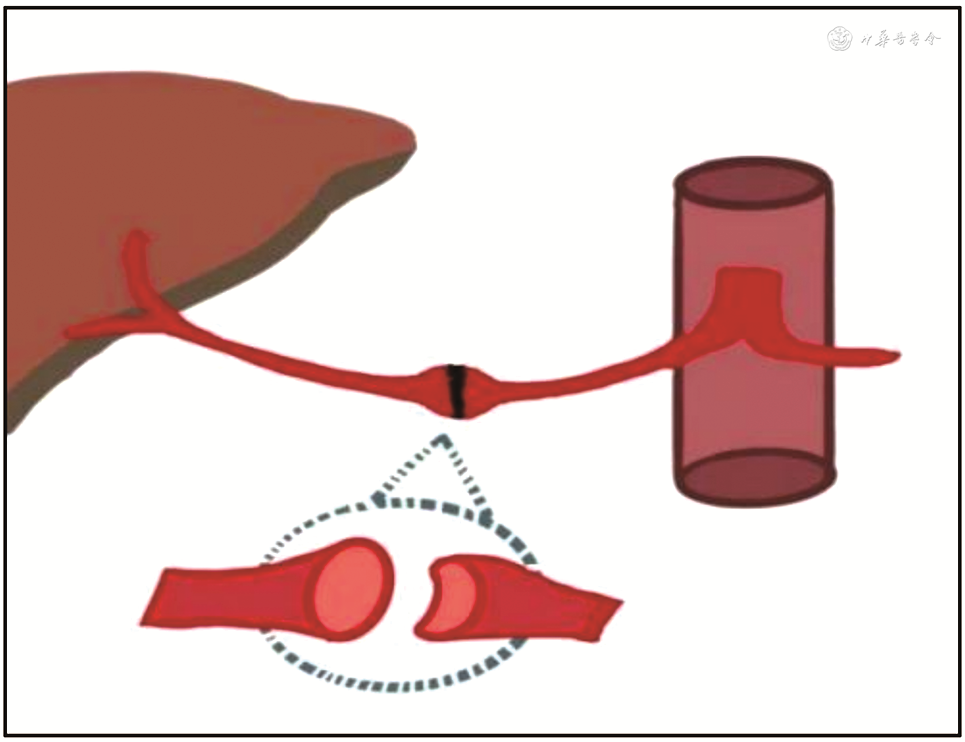

(4)脾动脉窃血综合征(splenic artery steal syndrome,SASS):SASS是指扩张的脾动脉从肝动脉处窃取或抢夺了血流,使得肝动脉向肝实质内血流灌注减少的一种现象。SASS发生率为3.1%~5.9%,主要发生在具有脾功能亢进、脾动脉相对增宽的肝硬化患者。SASS多发生在移植术后2个月内,是急性HAT重要原因之一。SASS发生时,CDFI在肝内、外动脉测及低速高阻血流(PSV<35 cm/s,RI>0.8),同时可见脾肿大、脾动脉增宽[66]。超声造影表现为肝动脉延迟出现(肝动脉与门静脉造影剂出现的时间差缩短)、显影暗淡;同时可见门静脉显影明显增强[67, 68](图15)。需注意,超声造影发现肝动脉延迟出现且显影暗淡时,还需排除其他导致移植肝动脉低灌注的原因如肝动脉血管收缩、HAS等,联合应用超声造影及CDFI检查可进行鉴别,流程如图16所示[33,69]。

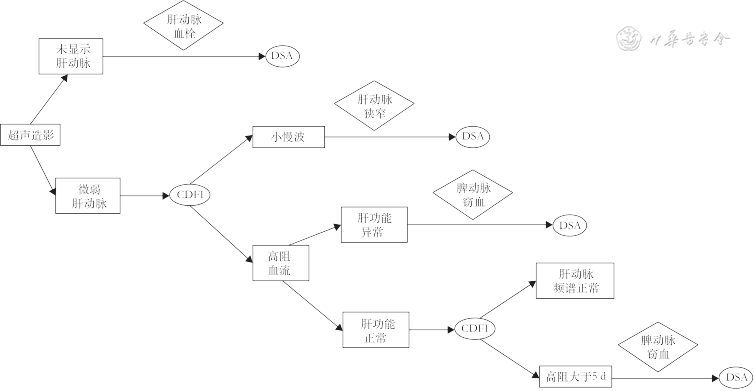

注:CEUS为超声造影;CDFI为彩色多普勒血流成像;DSA为数字减影血管造影
3. 门静脉并发症:门静脉内径相对粗大,并发症发生率不高,为1%~2%,但其可导致移植肝预后不良[70]。门静脉并发症主要包括门静脉血栓(portal vein thrombosis,PVT)和门静脉狭窄(portal vein stenosis,PVS)。
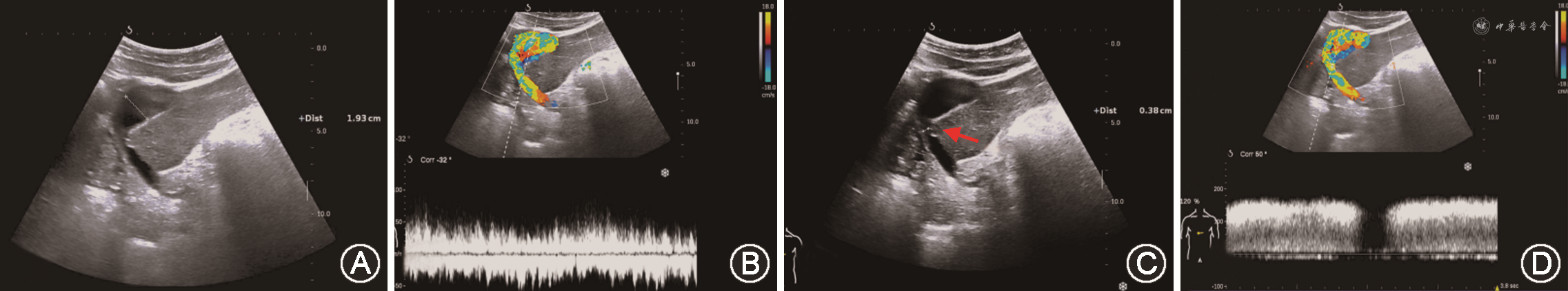
(1)PVT:PVT多发生于肝外门静脉段或门静脉吻合口。肝移植前受体有PVT病史、门静脉内径较细(<5 mm)、患者处于高凝状态及有脾切除手术病史等是好发因素[47,51,71]。移植肝PVT声像图表现为门静脉管腔内见实质回声,CDFI显示血流充盈缺损或不能测及彩色血流。急性PVT灰阶超声上有时可呈无回声表现,需结合CDFI检查进行鉴别。当CDFI检查门静脉血流显示不清时,应用超声造影可以改善门静脉的显示,明确门静脉是否闭塞(图17)[33,72]。
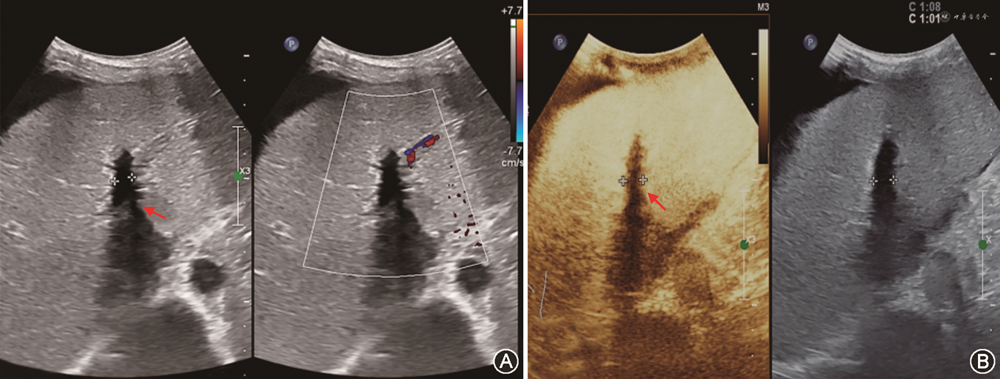

(2)PVS:移植肝PVS多发生在门静脉吻合口附近[73]。超声诊断PVS形态学依据是门静脉内径减少大于50%[74]。血流动力学依据包括:①门静脉吻合口处流速>125 cm/s[44];②门静脉吻合口处与之前正常段流速比值>3[74, 75]。以跨门静脉吻合口的两端流速差值>60 cm/s诊断门静脉显著狭窄,灵敏度可达100%,特异度为84%[76]。移植肝供受体门静脉内径不匹配时,CDFI检查门静脉有时可见湍流,应注意与PVS鉴别(图18)[77]。当门静脉吻合口处内径小于5 mm时,为防止移植肝预后不良,需及时进行介入手术或外科治疗[74]。
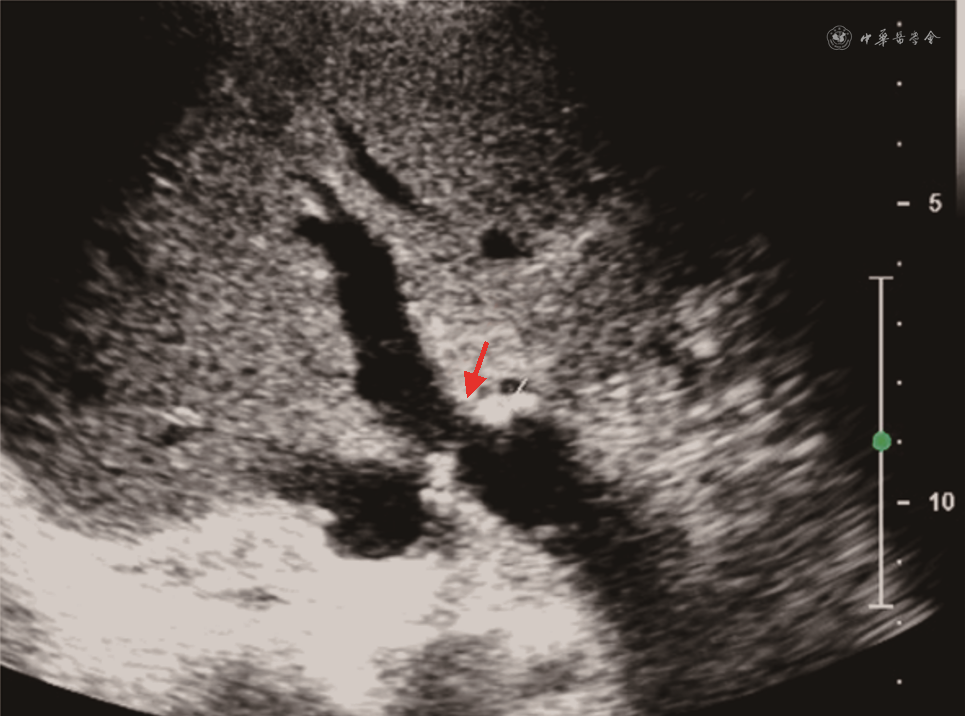

4. 肝脏流出道梗阻(hepatic outflow obstruction,HOO):移植肝流出道包括肝静脉及下腔静脉。HOO是较少见的血管并发症,发生率低于1%,多见于接受“背驮式”肝移植术式或活体半肝移植患者(可高达5%),一般发生在移植1年后[78]。常见类型为流出道狭窄、血栓或移植肝扭转。
(1)肝静脉或下腔静脉狭窄:肝静脉或下腔静脉狭窄多发生在吻合口,常见原因与外科吻合技术有关。声像图表现为:灰阶超声显示静脉吻合处细窄,CDFI局部可见彩色混叠及流速增高,当狭窄处与狭窄前正常段流速比值>3~4时,提示显著狭窄。有研究指出,当观察到移植肝静脉持续为单相波且峰值流速<15.5 cm/s时,应高度警惕肝静脉狭窄可能;而肝静脉持续为双相或三相波时则基本可排除肝静脉显著狭窄[79, 80]。需注意,以肝静脉内持续单相波频谱诊断HOO灵敏度高,但特异度低。移植术后早期移植肝肿大,肝外积液(血)压迫,移植肝静脉内也可出现类似频谱[1]。
(2)肝静脉或下腔静脉血栓:肝静脉或下腔静脉血栓与外科吻合技术及患者处于高凝状态均有关。声像图表现为肝静脉或下腔静脉附壁见实质回声,CDFI示局部血流充盈缺损。增强CT或增强MRI可观察到静脉相应引流肝段的血流灌注改变。肝中静脉属支血栓闭塞时,静脉相应引流肝段血流灌注改变,超声造影检查可见受影响区域肝实质动脉期呈片状高增强,门静脉期消退为片状低回声。超声造影诊断肝中静脉属支血栓闭塞,假阳性率从CDFI诊断时的14%下降为3%[81]。需注意,术式如果为“背驮式”肝移植,其静脉吻合的盲端处常可见血栓形成,该血栓通常无不良临床后果。
(3)移植肝扭转:移植肝扭转也是导致HOO原因之一。移植肝扭转的好发因素包括供肝较小但受体腹腔容积大或移植肝未充分固定。移植肝扭转导致HOO时,表现为肝静脉或下腔静脉急性闭塞声像图,CDFI在肝静脉内不能测及血流。移植肝吻合口狭窄或扭转引起HOO时,肝动脉及门静脉血流动力学也可出现改变,如门静脉流速降低甚至出现反向血流,肝动脉RI值增高,超声应同时注意观察[12]。
5. 胆道并发症:胆道并发症是除移植肝排斥反应外,导致移植肝功能异常的第二大原因。胆道并发症常见类型有胆漏、胆道狭窄、胆管铸型及胆道结石等[82]。
(1)胆漏:胆漏多发生于胆管吻合口,原因与T管拔除、胆管壁缺血或胆道重建技术不当有关。活体肝移植、劈离式肝移植或减体积肝移植术后可出现移植肝断面胆漏[83, 84]。胆漏的声像图表现与胆汁漏出的量及是否合并感染等有关。超声可表现为肝门部或肝内出现大小不等、边界较清的局限性无回声或低回声区,合并感染时其内可见漂浮的点状或者絮状回声[85]。经胆道超声造影检查发现造影剂自胆管向周围外溢,可明确诊断胆漏[3]。介入超声对胆漏具有诊断及治疗作用,超声引导下穿刺抽出胆汁样液体即可明确胆漏诊断。
(2)胆道狭窄:胆道狭窄包括吻合口狭窄和非吻合口狭窄。吻合口狭窄较常见,多表现为手术吻合口附近5 mm内的孤立狭窄,与吻合技术不当有关,其中位发生时间是移植术后5~8个月。非吻合口狭窄指距离手术吻合口>5 mm的不规则狭窄,可在肝门部或肝内胆管多处发生,多与胆管缺血有关,故又被称为缺血性胆道病变[82,86],发生时间多在移植术后3~6个月。吻合口狭窄声像图主要表现为胆管吻合口处狭窄伴肝内胆管规则连续扩张;超声还可显示因狭窄导致胆汁引流缓慢而出现的胆泥或结石;经胆道超声造影对显示肝外胆道狭窄的部位及程度有一定价值[3]。缺血性胆道病变时,CDFI检查示肝内胆管为跳跃性、节段性不规则扩张,可合并胆管铸型、胆汁瘤及胆漏(图19);超声造影检查可观察到肝门部胆管壁动脉期无增强或低增强,以该特征诊断缺血性胆道病变的灵敏度、特异度及准确性分别为66.7%、88.9%及76.2%[86, 87]。需注意,超声检查发现移植肝胆道狭窄时,应同时检查肝动脉通畅情况,排除肝动脉并发症可能[88, 89]。MRCP能清楚显示包括胆道狭窄段的胆管全程,诊断胆道狭窄阴性预测值高。因此,评估移植肝胆道狭窄,超声与MRCP联合应用更有诊断价值[90, 91]。
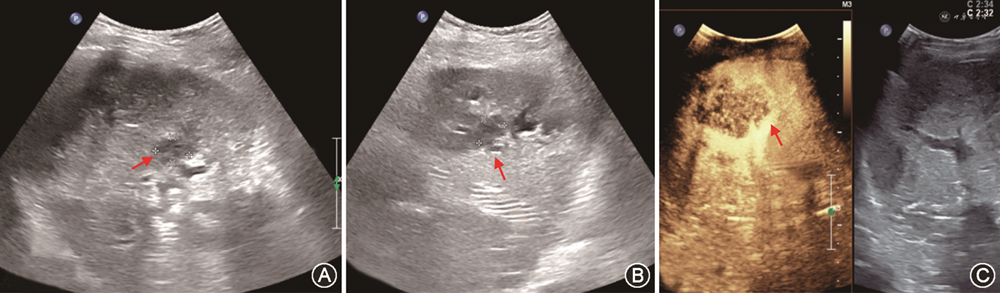

(3)胆管铸型:胆道铸型是指胆道上皮细胞明显坏死、脱落,胆管腔内脱落的黏膜碎片堆积。肝移植后胆管铸型发病率2%~4%,常发生在移植术后1年,与胆管壁缺血有关。胆管铸型典型声像图表现为肝内、外胆管扩张,内见黏膜碎片附着胆管壁或在胆管腔内漂浮。胆管铸型常与缺血型胆道病变合并存在,有时伴胆汁瘤形成。MRCP、ERCP及胆道造影时肝内外胆管可表现为多节段造影剂充盈缺损[42]。
6. 移植肝排斥反应:移植肝排斥反应以急性排斥反应常见,多发生在肝移植术后30 d内。移植肝急性排斥反应时,部分患者超声检查可表现为移植肝实质回声不均匀,但无特异度[92]。排斥反应严重时,CDFI及脉冲波多普勒可观察到肝动脉舒张期血流反向,门静脉流速降低甚至血流反向[93, 94, 95]。超声随访过程中发现肝静脉频谱由三相波形变为单相波形要注意排除移植肝急性排斥反应可能,但特异度低;如果肝静脉持续为三相波形基本可排除移植肝急性排斥反应,阴性预测值达92%[96]。超声弹性成像可作为补充方法对移植肝急性排斥反应进行评估及监测[4,97]。移植4周后,以肝脏超声弹性测值(SWE技术)>10.82 kPa诊断移植肝急性排斥反应或肝炎复发,特异度大于80%,显著高于肝功能检查[98]。另有研究以肝脏超声弹性测值(TE技术)>8.5 kPa为界限值区分移植肝轻度及中重度急性排斥反应,阳性预测值可达100%[99]。需注意,移植肝排斥反应时并无特征声像图表现,诊断“金标准”仍为肝穿刺活检病理检查。
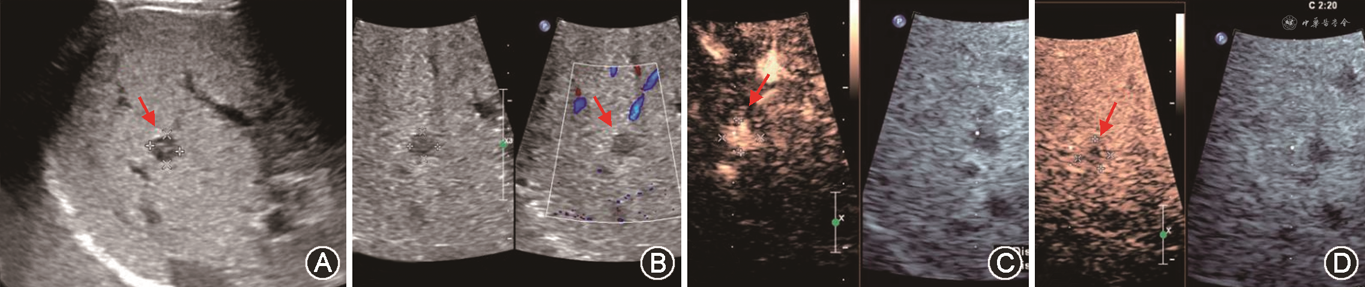
7. 移植肝原恶性肿瘤复发:移植术后肿瘤复发是影响肝恶性肿瘤移植患者生存期的首要原因,多见于移植术后2~3年,常见复发部位依次为肺、移植肝、腹腔和骨。由于肝移植患者免疫功能抑制,肝内肿瘤常表现为多灶性,且常伴有肝外转移病灶。移植术后肝内复发肿瘤声像图表现与原发肿瘤类似,超声检查应仔细扫查全肝,以明确病灶位置、数目、大小及与周围重要组织结构的解剖位置关系(图20)。肝癌肝移植术后肿瘤复发监测的合理计划为移植术后3年内每6个月进行1次胸腹部影像学检查。

8. 肝移植相关新发肿瘤性病变:因长期应用免疫抑制剂,肝移植患者的恶性肿瘤发生率为普通人群2~4倍[100, 101]。常见的移植相关新发肿瘤性病变为皮肤癌(最常见,约占30%)及移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disease,PTLD)。
(1)皮肤癌:肝移植相关皮肤癌以鳞状细胞癌、基底细胞癌及黑色素瘤常见,该类病灶需借助高频或超高频超声进行检查,以评估病灶范围、表面及基底特征、侵犯层次以及淋巴结转移情况[102]。
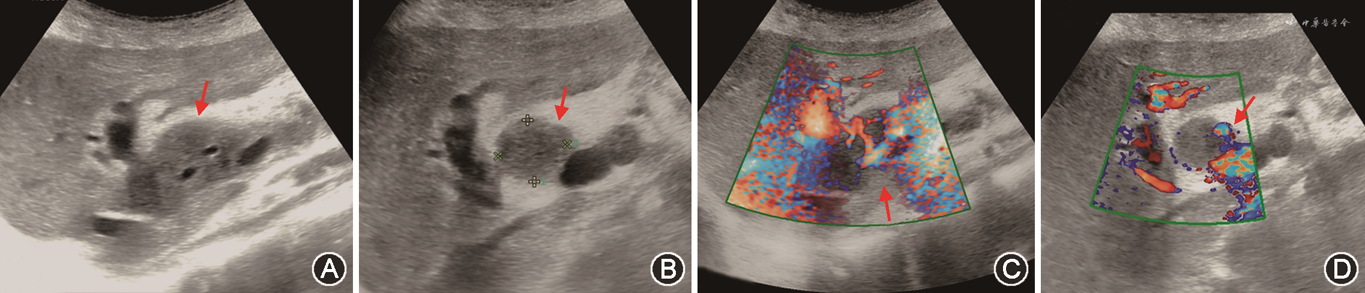
(2)PTLD:PTLD与EB病毒感染有关,可发生于术后任何时间[103, 104]。病灶可累及全身多部位淋巴结及结外组织,以腹部(肝门区)为主,且可在短时间内出现或消退。PTLD超声检查显示肝门部多发淋巴结肿大,呈均匀低回声,边界清晰,可包绕并压迫胆道及血管。病灶多呈乏血供表现,CDFI检查内部可见点状或线状血流信号(图21),超声造影检查病灶动脉期多呈均匀等或低增强,部分可呈高增强,肿块内造影剂消退速度可快于肝实质或与肝实质同步[105]。当减少或停用免疫抑制剂时,50%患者可见病灶不同程度缩小。PTLD的声像图表现缺乏特异度,需借助组织病理学检查明确肿块性质。

(1)感染:肝移植患者细菌性感染与复杂的手术过程相关,多发生于术后1个月内[106, 107],病毒感染以术后1~6个月多见,而侵袭性真菌感染多发生于移植更长时间后,后二者均与长期应用免疫抑制剂有关。超声可显示感染部位渗出性积液等非特异性表现,当伴发肝脓肿时,可见肝实质内单发或多发异常回声区,以低回声为主,其范围、形态及回声随疾病病程呈动态变化,借助超声监测肝脓肿动态变化过程可较好地判断脓肿成熟度及穿刺引流的可行性。需注意,感染性疾病的诊断需要结合患者临床表现及实验室检查,肝外感染则需借助其他影像学检查方法综合分析。
(2)急慢性肾功能损伤:肝移植术后急性肾损伤(acute kidney injury,AKI)发生率高达50%以上[108]。大部分AKI经早期临床干预后可逆转,但其中仍有15%~25%最终发展为慢性肾功能衰竭[109]。肾功能损伤声像图表现与疾病病程密切相关。AKI声像图表现为肾脏体积增大且回声弥漫性增高;随着病程延长及病情加重,AKI演变为慢性肾功能不全,声像图表现为肾实质体积逐渐缩小、皮质变薄且回声增高、皮髓质分界不清,血流稀疏且肾动脉RI逐渐增高[110, 111, 112],超声造影显示双肾血流灌注减少[113]。然而,肝移植术后AKI及慢性肾功能衰竭的超声表现无特异性,其诊断仍以实验室检查为标准。
(3)动静脉瘘:肝移植后动静脉瘘较少见,常因肝脏活检损伤所致,部分可自行恢复。超声检查时灰阶超声可无任何异常或可见肝实质内局部扭曲的管状无回声区,两端分别与肝动脉及门静脉分支/肝静脉属支相延续。肝动脉-门静脉瘘时,CDFI显示其内充满“五彩镶嵌”花色血流,局部门静脉内血流呈双向或反向,脉冲波多普勒显示静脉血流动脉化,呈“高速低阻”型频谱。肝动脉-肝静脉瘘罕见,CDFI显示肝静脉管腔内血流速度加快,出现鲜亮血流束,其内血流方向多正常,肝动脉RI及搏动指数减低,调节彩色多普勒条件设置显示高速血流时,部分可以显示供血动脉和瘘口处[114]。
(4)心血管系统并发症:由于肝移植术中需要阻断下腔静脉、门静脉及肝动脉的血流,手术创伤大,因此对全身血流动力学的影响较大,肝移植术后心血管系统并发症的发生率为25%~70%,是术后常见的并发症和死亡原因之一[10, 11]。常见的心血管系统并发症有高血压、心律失常、心肌缺血或心肌梗死、心功能不全、肺动脉高压等[115, 116]。高血压和心律失常需要根据患者临床表现、血压及心电图检查进行诊断。心肌缺血或心肌梗死、心功能不全、肺动脉高压的诊断需要结合患者临床症状、实验室检查和心脏超声进行综合分析。心肌缺血或心肌梗死时,超声能够显示狭窄或闭塞冠状动脉供应的室壁节段运动减弱至消失;心功能不全时,超声可以定量心腔大小和心功能参数,包括左心室射血分数、三尖瓣环收缩期位移及总体长轴应变等;超声估测的肺动脉收缩压是诊断肺动脉高压的重要指标。
近年来我国儿童肝移植发展迅速,已经成为全球完成儿童肝移植数量最多的国家[117]。由于供体的稀缺性以及为了移植物和受体之间大小更好地匹配,除了全肝移植,目前儿童肝移植逐渐发展出基于肝脏分段解剖的供肝劈离式肝移植、活体供肝移植和减体积肝移植等部分肝移植技术,特殊疾病可以选择多米诺肝移植与辅助性肝移植[118]。
儿童终末期肝病的主要病因为胆汁淤积性肝病,如胆道闭锁(biliary atresia,BA)、Alagille综合征、进行性家族性肝内胆汁淤积症等,其余病因包括遗传代谢性疾病(如遗传性高酪氨酸血症、糖原累积症和原发性高草酸盐尿症等)、暴发性肝衰竭、肝脏肿瘤如肝母细胞瘤、肝细胞肝癌、婴儿型肝脏血管内皮瘤等和其他(如病毒性肝炎肝硬化、自身免疫性肝炎和布-加综合征等)[119]。
超声检查有助于儿童肝移植术前适应证的评估。胆囊缺失或萎缩,并出现三角索征(门静脉分叉附近的门静脉右支前壁厚度≥3 mm),诊断BA具有很高的灵敏度、特异度和准确性(分别为92%、94%和94%)[120]。2D-SWE可提供一种无创、无辐射、低成本且耐受性良好的方法来量化肝脏硬度,为等待肝移植的BA患儿进行术前评估,作为需要优先手术的选择标准之一[121]。
超声是筛查儿童胆道闭锁和肝细胞肝癌的首选检查手段。增强CT和增强MRI可以进一步确诊肿瘤,并进行治疗的风险分层评估。
由于儿童肝移植大多为部分肝移植,且儿童血管及胆道系统尺寸较小,手术技术难度高,术后并发症发生率高于成人[49,122](图22、23)。儿童肝移植术后超声监测需注意以下几点:
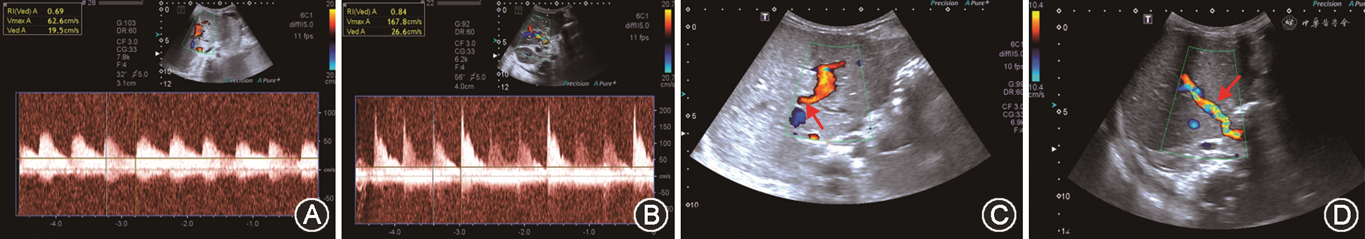


1. 儿童肝移植术后诊断PVS时,需注意门静脉直径会随年龄而变化:新生儿门静脉直径约3 mm,1岁健康患者门静脉直径为4~8 mm,12岁患者门静脉直径可达11 mm[123]。
2. 肝静脉流出道梗阻(hepatic venous outflow obstruction,HVOO):在儿童劈离式肝移植或减体积肝移植中,因受体下腔静脉需要修整、供体肝静脉有一部分需要重建,HVOO发生率略高于全肝移植。脉冲波多普勒显示肝静脉吻合口流速≥100 cm/s且超出供体侧肝静脉流速2~4倍以上,和(或)肝静脉为单相波频谱时,需怀疑HVOO并进一步行增强CT评估肝静脉情况。对增强CT可疑HVOO者,可行经颈内静脉血管造影检查确诊[124, 125]。
3. 儿童移植肝术后肝纤维化:儿童肝移植受者术后其原发疾病往往能够治愈,因此原发疾病复发所致的肝纤维化较少,但肝纤维化的比例随着时间的延长有增高的趋势[126]。超声弹性成像技术可用于临床定期动态评估儿童移植肝术后肝纤维化程度[127]。
超声引导肝穿刺活检、经皮热消融治疗以及置管引流等在肝癌患者接受肝移植术诊治过程中具有重要的临床价值。
超声引导移植肝穿刺活检安全、并发症少,可以方便快捷地获取组织标本,明确病理结果。肝移植术后,出现不明原因的肝功能异常(转氨酶升高,胆红素升高),无法用血管或胆道并发症解释者,以及怀疑肝移植术后排斥反应者建议行超声引导下移植肝穿刺活检[11]。
移植肝穿刺活检通常选择肝右叶实质,穿刺活检针规格为18 G或16 G,穿刺组织标本至少2条长度1.5 cm以上,含10个完整的门管区以上能满足病理要求,病理标本应当日送检[128, 129],穿刺活检术后建议患者卧床休息2~24 h,并腹部加压包扎。
超声引导经皮热消融治疗(射频或微波)创伤小,并可重复多次,可作为肝癌患者等待肝移植时的桥接治疗,以达到阻止肿瘤进展、减少因肿瘤进展被排除至肝移植候选名单之外的情况。以射频消融治疗作为等待肝移植时独立桥接治疗手段,12个月后退出肝移植的比例可低至5.8%[130]。该类患者在移植术后5年和10年的总生存率分别可达75.8%和42.2%[131]。
对于肝细胞癌肝移植术后肝内肿瘤复发患者,只要符合消融治疗适应证[132],超声引导下局部热消融治疗对提高肝癌患者移植术后的生存率具有重要临床价值。
肝移植术后出现胆管吻合口狭窄、闭塞及胆漏是较严重的并发症,首选内镜下胆汁内引流术(endoscopic retrograde biliary drainage,ERBD)和内镜下支架置入术。
超声引导经皮肝穿刺胆管引流术(percutaneous transhepatic cholangiography drainage,PTCD)对患者的要求较低,尤其是术后早期,症状危重不宜行ERBD或手术的患者更具优势。PTCD可为后续胆道狭窄处扩张和支架置入创造机会,也可同步进行联合球囊扩张或支架植入。PTCD治疗胆道狭窄合并胆漏患者,可以使得胆管扩张程度减轻,胆漏减少甚至消失。对于胆汁瘤也可以通过PTCD置管引流的方法使其缩小。PTCD还可以作为肝移植术后胆道并发症的一种长期治疗手段[133, 134]。
此外,对于肝移植术后的胸腹腔积液,如积液量多或合并感染,超声引导穿刺置管引流是有效的治疗手段。
超声检查具有安全、实时及便捷等优势,可为肝移植全过程提供丰富、准确的信息,减少有创性检查的应用。肝移植术前超声检查可评估供体肝脏情况及帮助选择合适的肝移植候选者;术中超声检查可帮助明确供肝劈离线,评估移植肝吻合后各管道即刻通畅情况;术后超声定期随访可及时发现移植肝各种并发症。需要注意的是,超声评估肝移植术后并发症要密切结合手术方式及实验室检查信息,充分了解肝内动、静脉血流动力学变化及其相关性。
随着影像技术的发展及对肝移植相关认识的提高,超声在移植肝评估领域的应用仍在不断拓展:超声弹性成像及超声造影已被用于术前评估供肝质量,预测肝移植术后早期和晚期并发症发生风险[135];还有研究在探索通过彩色多普勒超声成像及三维超声等技术评估活体肝移植或劈离式肝移植时肝脏各部分体积,而肝体积的评估对于保证供者安全及预防受体的小肝综合征有十分重要的临床价值[136, 137]。
其他相关内容,包括各种移植肝并发症好发时间段(附录1)、肝移植超声相关评估内容(附录2)和移植肝报告模版(附录3)请扫描本文二维码阅读。
近年来,国内外在肝移植超声评估方面的循证医学证据在不断增加,这为本指南及推荐意见(表5)的诞生奠定了良好基础。但同时也应看到,目前在移植肝超声评估方面仅限于单中心、小样本的病例研究,尚缺乏多中心、大样本的临床研究,对临床的诊治决策还缺乏更翔实、可靠的循证医学证据。这有待于今后大样本、更高循证医学证据的研究成果进一步验证和充实。

专家投票形成推荐意见一览表
专家投票形成推荐意见一览表
| 序号 | 推荐意见 | 证据等级 | 推荐强度 | 专家投票a |
|---|---|---|---|---|
| 1 | 肝移植术前可应用超声评估供肝的脂肪变性及纤维化程度,排除移植手术禁忌证 | 3 | 中等 | 58/1/0(98) |
| 2 | 肝移植术中可应用超声对肝中静脉实时定位来明确劈肝线并避开重要血管 | 3 | 强 | 57/0/2(100) |
| 3 | 肝移植术中供肝血管重建后,可应用超声观察吻合血管的血流状态,及时发现异常 | 3 | 强 | 59/0/0(100) |
| 4 | 超声是肝移植术后首选的监测方法,用于筛查肝占位及肝内血管及胆管并发症 | 3 | 强 | 58/1/0(98) |
| 5 | 超声是肝移植术后肝动脉血栓的首选筛查手段,超声造影对肝动脉血栓有很高的诊断价值 | 2 | 强 | 59/0/0(100) |
| 6 | 超声是移植术后肝动脉狭窄的首选筛查手段,联合检查肝内动脉及肝动脉吻合处,可提高超声诊断肝动脉狭窄的准确性 | 3 | 中等 | 56/1/2(98) |
| 7 | 超声对诊断肝移植术后脾动脉窃血综合征有价值,结合超声造影及彩色多普勒超声表现,可与其他导致肝动脉低灌注的原因相鉴别 | 3 | 中等 | 55/0/4(100) |
| 8 | 超声可测量门静脉内径及流速变化,对肝移植术后门静脉狭窄诊断价值高 | 3 | 强 | 59/0/0(100) |
| 9 | 超声对评估移植肝胆道狭窄有价值,还可一并发现胆管内胆泥、结石及肝内胆汁瘤形成 | 3 | 中等 | 57/0/2(100) |
| 10 | 超声弹性成像可用于评估移植肝急性排斥反应,表现为肝脏弹性测值增高 | 4 | 中等 | 45/6/8(88) |
| 11 | 超声可作为儿童肝移植术前评估的首选筛查手段 | 3 | 强 | 57/1/1(98) |
| 12 | 超声是儿童肝移植术后监测的首选筛查手段,诊断移植肝血管并发症时需要结合儿童年龄和手术方式综合判断 | 3 | 强 | 58/0/1(100) |
| 13 | 肝移植术后肝功能异常患者可通过超声引导肝穿刺活检明确病理诊断,为临床治疗提供依据 | 3 | 强 | 56/2/1(97) |
| 14 | 超声引导经皮肝肿瘤热消融治疗可作为肝癌患者等待肝移植的桥接治疗,以阻止肿瘤进展、降低等待移植者的退出率 | 3 | 强 | 58/0/1(100) |
注:a表示同意/不同意/弃权的例数比[同意率(%)]
执笔专家:韩红(复旦大学附属中山医院超声科);任杰(中山大学附属第三医院超声科);舒先红(复旦大学附属中山医院心脏超声诊断科);丁红(复旦大学附属华山医院超声医学科)
指南制定工作秘书:李翠仙(复旦大学附属中山医院超声科);朱宇莉(复旦大学附属中山医院超声科);王希(复旦大学附属中山医院超声科)
指南编写指导专家:梁萍(解放军总医院介入超声科);王文平(复旦大学附属中山医院超声科);樊嘉(复旦大学附属中山医院肝脏外科);滕皋军(东南大学附属中大医院介入与血管外科)
指南编写组长:徐辉雄(复旦大学附属中山医院超声科);周俭(复旦大学附属中山医院肝脏外科)
指南编写副组长:杜联芳(上海交通大学附属第一人民医院超声医学科);蒋天安(浙江大学医学院附属第一医院超声医学科);罗燕(四川大学华西医院超声医学科);黄备建(复旦大学附属中山医院超声科);于杰(解放军总医院介入超声科)
指南专家组成员(按姓氏笔画排序):王希(复旦大学附属中山医院超声科);叶新华(江苏省人民医院超声诊断科);卢强(四川大学华西医院超声医学科);孙丽萍(同济大学附属第十人民医院超声医学科);孙晓峰(吉林大学第一医院超声诊断中心);李凡(上海交通大学附属第一人民医院超声医学科);李杰(山东大学齐鲁医院超声科);李嘉(东南大学附属中大医院超声医学科);李开艳(华中科技大学同济医学院附属同济医院超声影像科);李翠仙(复旦大学附属中山医院超声科);吕柯(北京协和医院超声医学科);任秀昀(解放军总医院第三医学中心 超声科);朱宇莉(复旦大学附属中山医院超声科);刘嵘(复旦大学附属中山医院介入科);刘广健(中山大学附属第六医院超声科);许世豪(温州医科大学附属第一医院超声科);杨红(广西医科大学附属第一医院超声医学科);何年安(中国科技大学附属第一医院超声科);季正标(复旦大学附属中山医院超声科);张一峰(同济大学附属第十人民医院超声医学科);张连仲(河南省人民医院超声科);张德智(吉林大学附属第一医院超声诊断中心);陆清(复旦大学附属中山医院超声科);陈莉(南昌大学附属第一医院超声医学科);陈云超(复旦大学附属中山医院厦门医院超声医学科);陈立斌(宁波大学附属第一医院超声医学科);陈宝定(江苏大学附属医院超声科);林宁(福建省立医院超声科);范培丽(复旦大学附属中山医院超声科);罗鸿昌(华中科技大学同济医学院附属同济医院超声科);周平(中南大学湘雅三院超声科);周显礼(哈尔滨医科大学附属第二医院超声科);周建华(中山大学肿瘤防治中心超声科);郑加贺(中国医科大学盛京医院放射科);经翔(天津第三中心医院超声医学科);柳建华(华南理工大学附属第二医院超声诊断科);姜立新(上海交通大学医学院附属仁济医院超声医学科);贺轶锋(复旦大学附属中山医院肝脏外科);聂芳(兰州大学附属第二医院超声医学中心);顾莉红(上海交通大学医学院附属仁济医院超声医学科);徐栋(浙江省肿瘤医院超声医学科);徐金锋(深圳市人民医院超声科);徐晓红(广东医科大学附属医院超声科);郭乐杭(同济大学附属第十人民医院超声医学科);唐缨(天津市第一中心医院超声科);黄瑛(中国医科大学盛京医院超声科);黄斌(浙江大学附属浙江医院超声医学中心);黄晓武(复旦大学附属中山医院肝脏外科);崔立刚(北京大学第三医院超声医学科);谢晓燕(中山大学第一附属医院超声医学科);程文(哈尔滨医科大学附属肿瘤医院超声科)
中华医学会超声医学分会, 中国医师协会外科医师分会, 中国医师协会介入医师分会, 等. 肝移植超声临床实践指南(2023版)[J]. 中华医学杂志, 2023, 103(31): 2365-2388. DOI: 10.3760/cma.j.cn112137-20230510-00768.
所有作者声明不存在利益冲突




























