
作为抗骨质疏松的基础用药,活性维生素D主要通过促进肠道对钙和磷的吸收,抑制甲状旁腺激素释放,维持血钙和血磷水平正常,进而保证骨骼健康。艾地骨化醇(eldecalcitol, ED-71)是活性维生素D的新型类似物,于2011年正式用于日本骨质疏松患病人群的临床治疗。艾地骨化醇不仅能够促进肠道钙吸收、抑制破骨细胞数量和活性,还可有效促进不依存于破骨细胞骨吸收的局灶性骨形成—"mini-modeling"骨形成,提升骨小梁连续性和增加骨小梁厚度,从而修复骨组织微损伤。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨质疏松症是以骨量减少、骨微结构破坏为特征,导致骨脆性增加、易发生骨折的全身性代谢性骨病[1]。随着人口老龄化进程的加速,我国骨质疏松症发病的绝对人数呈明显上升趋势。2018年10月19日,国家卫生健康委员会发布了首个我国骨质疏松症流行病学调查结果:骨质疏松症已成为我国中老年人群的重要健康问题,50岁以上人群骨质疏松症患病率为19.2%,中老年女性骨质疏松问题尤甚,50岁以上女性患病率达32.1%,65岁以上女性骨质疏松症患病率高达51.6%。骨质疏松症最直接的并发症就是骨折,对健康危害巨大,严重影响患者本人的生存质量和增加患病人群家庭的照料负担和生活压力,已经成为严重的医疗问题和社会问题而亟待解决[1]。目前我国骨质疏松症诊疗率在地区间、城乡间还存在显著差异,整体诊治率较低。因此,对于骨质疏松的治疗应遵循早预防、早诊断、早治疗的原则,加强国民整体对骨质疏松这一静默流行病的防治意识。
目前,抗骨质疏松症药物按作用机制可分为骨吸收抑制剂[如双膦酸盐(BPs)]、骨形成促进剂[如甲状旁腺激素(PTH)]、双重作用机制(如硬骨抑素单克隆抗体)、其他机制类药物(如活性维生素D)及传统中药[2]。20世纪70年代,具有广谱生物学功能的活性维生素D类药物走向骨质疏松症临床医疗市场,其主要生理功能是促进肠道对钙和磷的吸收,抑制甲状旁腺激的释放,进而维持血钙和血磷水平正常,保证骨骼健康和神经肌肉功能正常[3,4]。此外,活性维生素D还作用于成骨细胞、破骨细胞以及骨细胞,对骨转换及骨骼矿化过程发挥重要调控作用[3,4]。1978年骨化三醇[1α,25-(OH)2D3]上市。阿法骨化醇是第二代活性维生素D代表药物,其由肠道吸收后无需经肾脏活化,所以在肾功能不全的患者体内更容易发挥作用,但也需注意其安全性[6]。中华医学会骨质疏松和骨矿盐疾病分会发布的《原发性骨质疏松症诊疗指南》建议,当使用活性维生素D制剂时,不宜同时补充较大剂量的钙剂,并建议定期监测患者血钙和尿钙水平。
艾地骨化醇(eldecalcitol,ED-71)是活性维生素D[1,25-(OH)2D3]的一种新型衍生物。2011年,艾地骨化醇软胶囊获得日本厚生劳动省批准,正式用于日本骨质疏松症患病人群的临床治疗。在既往临床应用和研究中,艾地骨化醇被证明对更广泛的骨质疏松症患者有效,并且不良反应较少[7,8,9,10,11]。2020年,艾地骨化醇获得国家药品监督管理局颁发的进口药品注册证,将被用于我国绝经后女性骨质疏松症患者。
1985年,新一代活性维生素D类似物艾地骨化醇被发现,命名为"ED-71"。出于合成简便和结构多样性的考虑,活性维生素D的结构修饰主要集中于侧链[12]。最初A环的结构修饰集中于1位和3位,但生物活性均无明显改善[13]。在阿法骨化醇工业合成路线中有一关键环氧中间体[14,15],当其被亲核试剂进攻时可构型选择性生成2β类衍生物。利用该性质,通过在2β位引入不同长度的羟基烷氧基侧链,合成得到了阿法骨化醇系列衍生物。初步活性评估数据显示,在骨钙动员方面,所有化合物均优于或与阿法骨化醇相当。其中含3-羟基丙氧基的化合物活性最强,进一步在25位引入羟基得到了艾地骨化醇(图1)[16]。
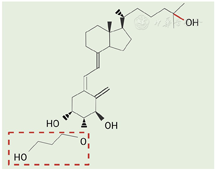

艾地骨化醇是在骨化三醇的基础上,于2β位添加羟基丙氧基,成为1α,25-(OH)2-2β-(3-羟基丙氧基)维生素D3。与骨化三醇相比,艾地骨化醇与维生素D受体(vitamin D receptor, VDR)亲和力较弱,但与血清中的维生素D结合蛋白(vitamin D binding protein, DBP)结合较强。虽然它对VDR的亲和力较低,但3-羟基丙氧基通过H键和CH-π相互作用稳定了艾地骨化醇-VDR复合物,使其能够与VDR紧密结合[17]。此外,由于具有庞大的羟基丙氧基取代基,艾地骨化醇阻止了相邻基团的差向异构化,这可能是临床研究中观察到的抑制甲状旁腺激素效力较弱的原因[18]。同时,由于肾脏CYP24A1中没有3-羟基丙氧基的空间,故艾地骨化醇不能结合CYP24A1,这种CYP24A1抗性赋予艾地骨化醇许多优点:其一,艾地骨化醇不会被局部细胞产生的CYP24A1降解而稳定性增强;其二,代谢由肾脏依赖性转变为肝脏依赖性,因肝脏比肾脏具有更高的代谢潜力,因而大大减少了骨质疏松患者的代谢负担[17]。
2004年,艾地骨化醇在日本的Ⅲ期临床试验启动,研究纳入1 087例46~92岁骨质疏松症患者,随机给予艾地骨化醇0.75 μg/d(n=543)或阿法骨化醇1 μg/d(n=544)治疗36个月,主要终点为椎体骨折发生率,次要终点包括非椎体骨折等。研究表明:相比阿法骨化醇,艾地骨化醇的新椎体骨折发生风险降低26%;艾地骨化醇在早期具有腕部骨折抑制效果,36个月的骨折发生风险降低71%[19]。同年,日本厚生劳动省批准艾地骨化醇软胶囊用于防治骨质疏松症,正式打开了艾地骨化醇相关临床研究的大门。临床数据表明,艾地骨化醇在原发性骨质疏松症(如绝经后骨质疏松症)和继发性骨质疏松症(如糖皮质激素性骨质疏松症、糖尿病骨质疏松症)等方面均展现出良好的治疗效果[7,10,11],且其效果优于骨化三醇与阿法骨化醇[8]。在安全性方面,相关研究提示艾地骨化醇与DBP具有更高的亲和力,从而拥有较长的半衰期;同时因其能够减少对甲状旁腺激素的抑制而弥补了原有活性维生素D引起钙磷失衡的缺陷[9]。
2005年,日本德岛大学Matsumoto等[20]对219例骨质疏松患者(49~87岁)进行了随机、双盲、安慰剂对照临床试验,受试者被随机分配接受安慰剂或0.5、0.75或1.0 μg/d ED-71,持续12个月。所有受试者接受200或400 IU/d维生素D3。结果发现:ED-71治疗12个月后腰椎骨密度(bone mineral density,BMD)增加(与安慰剂组相比,接受0.5、0.75和1.0 μg ED-71的受试者分别比基线增加2.2%、2.6%和3.1%,分别为2.9%、3.4%和3.8%)。当ED-71剂量分别为0.75和1.0 μg时,髋关节骨密度也有所增加。在0.75和1.0 μg ED-71治疗12个月后,骨形成和再吸收标志物被抑制了约20%。而在0.5、0.75和1.0 μg ED-71组中,分别有7%、5%和23%的受试者出现超过2.6 mmol/L的短暂性高钙血症,但没有人出现持续的高钙血症。这些结果提示在补充维生素D情况下,每天给予0.75 μg艾地骨化醇能够安全有效地增加腰椎和髋骨的骨密度。2007年,为了阐明艾地骨化醇是否可以在受试者的血清25-(OH)D水平低于最佳数值时发挥作用,Matsumoto科研团队对相关临床数据进行了事后分析,比较了血清25-(OH)D高(>29 ng/mL)和低(<25 ng/mL)的受试者ED-71对腰椎和髋关节骨密度的影响。发现在使用0.5、0.75和1.0 μg/d ED-71治疗12个月后,血清25-(OH)D水平较低和较高的两组腰椎骨密度均有相似的增加。此外,髋关节骨密度也有增加的趋势,尽管增加无统计学意义。这些研究数据提示ED-71对骨的作用不依赖于对维生素D不足的补充作用,其可以作为一种独特的VDR配体发挥作用。与1,25-(OH)2D3相比,其对骨的作用更强[21]。2010年,Matsumoto课题组通过纳入59名日本绝经后妇女进行了一项随机临床试验,比较了艾地骨化醇和阿法骨化醇对骨转换标志物和钙代谢的调控作用。受试者被随机分配接受1.0 μg阿法骨化醇,0.5或1.0 μg艾地骨化醇,每天1次,持续12周。结果发现:整个研究期间血清钙几乎没有增加。从0.5 μg到1.0 μg的艾地骨化醇以剂量依赖的方式增加每日尿钙排泄,1.0 μg的艾地骨化醇增加尿钙的程度与1.0 μg的阿法骨化醇相似。0.5和1.0 μg艾地骨化醇对尿NTX的抑制作用均强于1.0 μg阿法骨化醇(在12周时,1.0 μg阿法骨化醇、0.5和1.0 μg艾地骨化醇处理组分别为-6%、-30%和-35%)。相比之下,3组之间的血清BALP变化相似(在12周时,1.0 μg阿法骨化醇组、0.5和1.0 μg艾地骨化醇组分别为-22%,-22%和-29%)。这些结果表明,0.5~1.0 μg艾地骨化醇可有效抑制骨吸收,其抑制骨形成的作用和对尿钙排泄的作用与阿法骨化醇相当,表明艾地骨化醇可能具有更好的骨保护作用[22]。2016年,日本庆应大学和北海道大学合作,对接受脊柱手术的绝经后女性骨质疏松患者的椎体标本进行了抗骨质疏松制剂临床疗效的骨形态测量分析。根据骨质疏松症用药情况患者被分为3组(n=5或6):未治疗组、艾地骨化醇治疗组和双膦酸盐治疗组。与未治疗的患者相比,艾地骨化醇治疗患者的mini-modeling骨形成有增强的趋势,双膦酸盐治疗患者的mini-modeling骨形成出现被抑制的趋势。两组促进mini-modeling骨形成能力具有统计学差异。这些研究数据表明,艾地骨化醇和双膦酸盐对mini-modeling骨形成有相反的影响,而且mini-modeling骨形成如在髂骨和股骨头所描述的那样,也可以发生在椎骨[23]。
2015年,艾地骨化醇在中国的Ⅲ期临床试验启动:纳入265例48~83岁骨质疏松症患者,随机接受艾地骨化醇0.75 μg/d(n=137)或者阿法骨化醇1 μg/d(n=128),持续治疗12个月。两组的基线钙摄入量均低于550 mg/d,平均血清25-(OH)D低于43 nmol/L。钙摄入量和血清25-(OH)D较低的患者基线骨密度较低。整个研究过程中,患者未补充维生素D或钙剂。研究结果发现:与阿法骨化醇组相比,艾地骨化醇组的腰椎、全髋和股骨颈BMD分别增加了2.05%、1.33%和1.78%。提示艾地骨化醇对骨密度的提升作用没有受到患者血清维生素D水平和钙剂摄入量的影响[24]。2020年,艾地骨化醇获得国家药品监督管理局颁发的进口药品注册证,被批准用于我国绝经后女性骨质疏松症患者,其临床应用人群得到进一步拓展。
肠道钙吸收是钙摄入的重要途径,包括主动运输和被动运输,同时受到活性维生素D等多种激素的调节。随着年龄的增长,肠道钙吸收率(FCA)下降,增加了骨质疏松和骨折风险,严重影响骨骼健康。传统活性维生素D一方面促进钙转运相关蛋白(TRPV6、钙结合蛋白、PMCA1b等)的生物合成,并增加钙的通透性促进钙离子主动向血液转运,还进一步上调紧密连接蛋白-2/12/15的表达,从而促进钙的被动运输[25]。与此不同的是,艾地骨化醇因其独特分子结构而能够有效提高肠道钙吸收效率(图2)。首先,艾地骨化醇的2β-3-羟基丙氧基可与DBP形成氢键和范德瓦耳斯力[17],导致艾地骨化醇与DBP的亲和力更强,具有更长的血浆半衰期;其次,2β-3-羟基丙氧基阻碍了艾地骨化醇与24-羟化酶(CYP24A1)的结合,使其不易被代谢失活,可以更持久地在靶细胞内发挥活性[26,27]。同时,2β-3-羟基丙氧基侧链可与VDR形成氢键和CH-π相互作用。由于侧链位阻较大占据平伏键,使A环倾向于β椅式构型,稳定了艾地骨化醇与VDR的结合模式,使两者结合时间变久,进而提高生物活性[17,26];此外,艾地骨化醇能够增加TRPV6和钙结合蛋白Calbindin-D9k的十二指肠mRNA表达,更有效促进钙的主动运输,使FCA增高[28]。中国和日本的Ⅲ期临床研究均表明,对于骨质疏松症患者,无需补充钙剂,艾地骨化醇单药治疗显著增加骨密度,降低椎体和腕部骨折风险[19,24]。
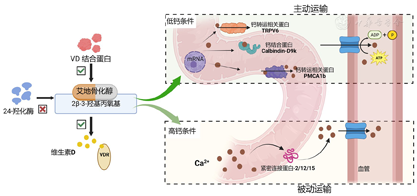

注:VDR:维生素D受体
血液富含的脂质介质鞘氨醇1磷酸(sphingosin-1-phosphate, S1P)可以调控破骨细胞前体细胞的迁移和定植,S1P通过与破骨细胞前体上的化学吸引受体S1PR1或化学排斥受体S1PR2结合,分别促进或抑制其向血液的迁移。2013年,日本大阪大学Ishii课题组通过相关实验设计阐明了艾地骨化醇通过下调破骨细胞前体上的化学排斥受体S1PR2的表达,从而显著增加破骨细胞前体靶向血管的迁移率,这种作用有助于限制体内破骨细胞的分化和骨吸收功能[29]。翌年,日本德岛大学Matsumoto课题组发表综述论文肯定了该观点[30]。2011年,我们课题组前期工作发现,艾地骨化醇能够促进卵巢切除(ovariectomy, OVX)大鼠的前成骨细胞分化为成熟成骨细胞,但其没有同步促进其增殖率,而导致来自成骨细胞系的RANKL有所减少,在一定程度上对化学吸收受体S1PR1的抑制作用有所降低。结合艾地骨化醇对化学排斥受体S1PR2的抑制作用,最终促进破骨细胞前体离开骨基质进入血液循环系统。同时,由于前成骨细胞数量的减少,在某种程度上降低了前成骨细胞和破骨细胞前体之间的接触概率,导致RANKL/OPG比率降低而抑制了破骨细胞前体的分化[31](图3)。此外,在成骨细胞和破骨细胞之间存在Eph/Ephrin双向信号通路:即破骨细胞表达的EphrinB2激活成骨细胞表面EphB4的"正向信号"促进成骨;以及成骨细胞表达的EphB4激活破骨细胞EphrinB2的"反向信号"抑制破骨细胞的分化和功能[32]。2022年,我们课题组通过建立成骨细胞与破骨细胞直接接触的共培养体系以及OVX大鼠模型,阐明了艾地骨化醇可以通过调控EphB4/EphrinB2之间的反向信号抑制破骨细胞分化,从而预防雌激素缺失导致的骨量减少[33](图4)。
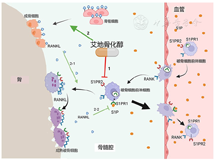

注:S1P:鞘氨醇1磷酸;S1PR1:S1P化学吸引受体;S1PR2:S1P化学排斥受体;RANKL:NF-κB受体激活因子配体
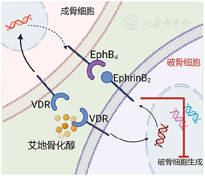

注:VDR:维生素D受体;EphB4:促红细胞生成素肝细胞激酶受体B4; EphrinB2:促红细胞生成素肝细胞激酶受体配体B2
生理状态下的骨形成是通过破骨细胞和成骨细胞相互偶联的过程来完成的,即破骨细胞吸收骨基质后产生和分泌多种偶联因子如胰岛素样生长因子-1(IGF-1)和转化生长因子β(TGF-β),进而启动与骨吸收水平相匹配的新骨形成过程[34]。众多的研究已经表明破骨细胞及其衍生偶联因子的缺乏均会导致成骨细胞活性的降低。2009年,我们课题组探究了破骨细胞在甲状旁腺激素驱动的骨合成代谢中的作用,实验数据显示破骨细胞的缺失阻碍了甲状旁腺激素驱动的骨合成代谢,提示破骨细胞的存在可能是甲状旁腺激素间歇给药后促进成骨细胞分化和增强骨形成所必需的[35]。既然如此,那么艾地骨化醇为何能够在抑制破骨细胞骨吸收的前提下增加骨量改善骨质疏松呢?2011年,课题组首次发现了艾地骨化醇诱导的"mini-modeling"骨形成现象,即在艾地骨化醇治疗的OVX大鼠骨小梁表面有大量以小山丘样的"骨芽"形态存在的"mini-modeling"骨形成(图5),其表面聚集了大量形态丰满的成熟成骨细胞[31]。与传统骨改建骨形成不同,"mini-modeling"骨形成过程中,覆盖在骨基质表面的静止的、扁平的前成骨细胞转化为活跃的成骨细胞,将新形成的骨基质直接沉积在既存骨组织表面,而不需要经过骨重建过程的破骨细胞骨吸收过程,因此,"Mini-modeling"骨形成具有连续形成、形态微小、水泥线较为平滑等特点[36,37]。
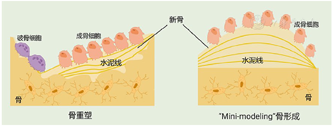

在骨质疏松病理状态下,骨髓间充质干细胞(bone marrow mesenchyml stem cell, BMSCs)功能常常会受到影响,而后者亦是驱动骨改建失衡的内在因素[38]。为了深入阐明艾地骨化醇诱导"Mini-modeling"骨形成改善骨质疏松的作用机制,课题组通过构建糖尿病骨质疏松小鼠模型及体外BMSCs培养体系,明确了艾地骨化醇能够通过增强碱性磷酸酶(alkaline phosphatase, ALP)活性及活化P13K/AKT信号通路,促进BMSCs成骨向分化[39]。同时发现艾地骨化醇能够显著抑制OVX大鼠BMSCs的细胞衰老并增强其成骨分化能力,而且这一作用可能是通过调控氧化应激来实现,从BMSCs衰老角度解释了艾地骨化醇治疗骨质疏松症的部分作用机制[40]。
作为成骨细胞系的末端细胞,骨细胞(osteocyte)约占骨组织细胞总数的95%,其通过骨陷窝-骨小管系统(osteocyte lacunar canalicular system, OLCS)进行着物质交换、内部应力感知以及调节其他骨组织细胞活性等生物活动,在调控和维持骨组织新陈代谢方面发挥着重要作用。课题组前期工作曾多次使用白喉毒素受体转基因小鼠模型探究了骨细胞被有目的消除而引发成骨细胞、破骨细胞以及骨基质矿化状态等的相应改变[41,42]。艾地骨化醇是否通过影响控骨细胞调控"mini-modeling"骨形成过程是我们课题组一直在思考的问题。鉴于骨细胞表达VDR, 且活性维生素D能够通过调控骨细胞功能而影响骨改建的理论逐渐成熟[43,44],以及课题组前期工作发现艾地骨化醇诱导的"mini-modeling"新生骨基质中骨细胞分泌的硬骨抑素(sclerostin, SOST)明显减少,我们认为骨细胞可能在艾地骨化醇诱导的"mini-modeling"骨形成过程中发挥重要调控作用。
此外,免疫细胞和骨组织细胞共同起源于骨髓,从细胞的起始、成熟到活化,存在着密切的相互影响关系。免疫细胞通过细胞因子及和骨组织细胞间相互作用,调节骨改建平衡,参与代谢性骨病的发生与发展[45]。课题组利用糖尿病性骨质疏松症小鼠模型发现巨噬细胞在艾地骨化醇促进BMSCs的成骨分化过程发挥重要调控作用[39]。同时,课题组的近期研究也明确了艾地骨化醇能够调控适应性免疫中CD4+辅助T细胞(CD4+ T细胞)亚群平衡,进而创造有利于骨形成的微环境。因此,骨免疫学相关研究也可能为阐明艾地骨化醇诱导"mini-modeling"骨形成提供新的思路。
艾地骨化醇作为一种新型活性维生素D类药物,其改善骨松、预防骨折并发症疗效显著持久,其抗骨质疏松症的作用机制主要表现在:(1)通过S1P机制及EphrinB2/EphB4信号通路调控破骨细胞分化而有效抑制骨吸收;(2)通过诱导独特的"mini-modeling"骨形成机制,有效促进骨形成和骨基质矿化,增加骨小梁的连接性、提升骨密度和改善骨结构;(3)通过有效促进钙的主动运输,显著提高肠道钙吸收率(图6)。但是,除了在临床应用过程中需要密切关注不良反应的发生外,对于其发挥改善骨质疏松的具体分子和细胞机制尚有待进一步探究。
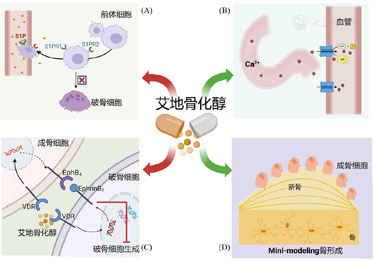

注:(A)抑制破骨细胞分化(S1P机制、EphB4/EphrinB2反向信号);(B)通过特有的2β-3-羟基丙氧基分子结构促进肠道钙吸收;(C)、(D)促进不依赖于破骨细胞骨吸收的"mini-modeling"骨形成
作者声明不存在利益冲突
感谢日健中外制药有限公司医学部提供相关材料
1.艾地骨化醇(eldecalcitol, ED-71)是活性维生素D[1α,25-(OH)2D3]的一种新型衍生物,是在骨化三醇的2β位添加了( )。
A.羟基 B.丙氧基 C.羟丙基 D.羟基丙氧基
2.艾地骨化醇能够有效提高肠道钙吸收效率,以下( )与艾地骨化醇促进肠道钙吸收关系不大。
A.与DBP亲和力 B.抑制骨吸收 C.与24-羟化酶结合力 D.与VDR结合稳定性
3.艾地骨化醇具有抑制破骨细胞的骨吸收功能,以下( )与艾地骨化醇抑制破骨细胞分化关系不大。
A.促进成骨细胞分化 B.减少前成骨细胞来源RANKL
C.调控EphrinB2/EphB4信号通路 D.抑制破骨细胞前体S1PR2表达
4.艾地骨化醇主要通过( )促进新骨形成,增加骨密度。
A.抑制骨吸收 B.骨改建 C.Mini-modeling D.促进肠道钙吸收
5.( )艾地骨化醇获得我国国家药品监督管理局颁发的进口药品注册证。
A.2019年 B.2020年 C.2021年 D.2022年



























