基于时变频谱相干研究工作记忆过程中海马(HPC)和前额叶皮层(PFC)局部场电位的同步特征模式,为研究工作记忆的信息处理机制提供支持。
采集6只SD大鼠在执行Y迷宫空间工作记忆任务过程中的腹侧海马(vHPC)和内侧前额叶皮层(mPFC)的局部场电位(LFPs)信号,应用短时傅里叶变换(STFT)计算vHPC和mPFC LFPs的时频分布,确定工作记忆的特征频段,进而基于时变频谱相干研究vHPC和mPFC LFPs特征频段的同步特征模式,最后应用支持向量机探索应用频谱相干值预测工作记忆的可行性。
大鼠正确执行工作记忆时,HPC和PFC的theta频段(4~12 Hz)能量均增加(均P<0.01),且HPC-PFC theta频段的频谱相干值增加(P<0.05)。以正确和错误执行工作记忆时的平均频谱相干峰值和峰值与起始点的差值作为特征,进行支持向量机的训练和预测,准确率达89%,精确率达90%,召回率为88%,F1分数为88%,与随机打乱标签数据重排结果相比差异均有统计学意义(均P<0.05)。
HPC-PFC theta频段的同步协同是正确执行工作记忆时信息处理的潜在机制之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
工作记忆是指在进行认知任务过程中短时间内对信息进行处理和存储的容量有限的系统[1,2,3],它在推理、理解和学习等高级认知任务中起着重要的作用。研究表明,海马(hippocampus,HPC)和前额叶皮层(prefrontal cortex,PFC)是工作记忆的责任脑区。药物失活或损毁HPC和PFC均会导致工作记忆障碍[4,5,6,7]。具体地说,PFC在工作记忆的编码和执行中发挥重要作用[8,9]。Baeg等[10]研究大鼠在八臂迷宫中的工作记忆行为学,发现大鼠PFC的神经元电活动编码了工作记忆信息。Jo等[11]研究发现大鼠PFC的神经元活动会将工作记忆相关的神经信息编码存储起来,并用来指导相应认知行为的完成。Li等[12]研究大鼠Y迷宫工作记忆过程中内侧前额叶皮层(medial prefrontal cortex,mPFC)局部场电位(local field potentials,LFPs)不同频段之间的耦合,发现LFPs的theta和gamma分量协同编码了工作记忆。Brady等[13]探索了大鼠HPC缺损影响工作记忆功能的原因,发现腹侧海马(ventral hippocampus,vHPC)缺损会导致PFC神经元树突棘密度的减少和神经元发放活动的异常,从而引起工作记忆障碍。HPC-PFC回路在工作记忆中的作用不可或缺[14,15,16]。研究发现,小鼠在T迷宫中执行工作记忆任务时mPFC中theta振荡与vHPC中神经元放电同步[17]。大鼠记忆任务中PFC神经元发放相位锁定于HPC的theta节律[18]。HPC-PFC的theta-gamma频段耦合被证明在空间工作记忆中发挥了重要作用[19]。
频谱相干分析是一种研究大脑不同区域神经电信号同步性的经典方法,它可以用于描述在特定频率时,2个电极或脑区之间的线性相关关系,它可以通过计算2个信号的交叉功率谱和它们各自的功率谱来得到。应用频域相干分析多通道神经生物电信号的同步性是十分有效的[20]。Benchenane等应用相干性分析方法发现大鼠HPC-PFC的theta频段相干性增加,能够预测大鼠的工作记忆行为[21]。Bygrave等[22]研究进一步揭示了HPC-PFC不同频段相干性在介导工作记忆中的作用。但是,频谱相干分析存在一定的局限性:在固定窗口进行频域相干分析不能反映出多通道信号相干性随时间的变化,在一个较长时间窗口内研究时变信号平均的频域相干会丢失大量动态信息。随着信号时-频分析技术的发展,研究人员开始使用时变频谱相干分布来阐述不同信号随时间变化的相干关系。时变频域相干分析克服了传统相干分析的局限性,能够反映在大脑认知活动中神经电信号在时间、频率及空间的三维关系[23]。时变频谱相干同步分析能够用于分析vHPC和mPFC脑区LFPs之间的协同作用。因此,本文应用时变频谱相干方法研究工作记忆过程中大鼠HPC-PFC LFPs的同步特征模式,期望为研究工作记忆的信息处理机制提供支持。
雄性Sprague-Dawley(SD)大鼠,8~12周龄,体质量300~350 g,动物使用许可证号SCXK(京)2016-0011,购于北京维通利华实验动物技术有限公司,饲养于天津医科大学实验动物科学部的标准温度和光线控制动物饲养室饲养。本实验符合实验动物的伦理学要求,并通过天津医科大学动物伦理委员会批准(批件号TMUaMEC2015011);RD-1102YM-Y型Y迷宫,共有3条臂,两两夹角均为120°,每条臂的长度为80 cm,宽度为16 cm,高度为21 cm,购于上海移数信息科技有限公司。
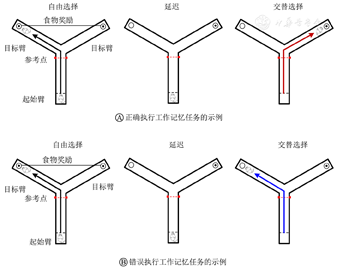
Y迷宫中延迟-交替工作记忆任务是啮齿类动物一个典型的空间工作记忆范式[24]。定义竖直臂为起始臂,其余两条臂为目标臂,末端分别装有食槽,用于大鼠在执行任务时获取食物奖励。在起始臂接近3条臂交点处,安装一个红外线检测装置(图1的红色虚线位置),大鼠通过此位置时会遮挡红外检测装置接收信号,该时刻设为工作记忆任务的行为学参考点。本研究范式包括自由选择、延迟和交替选择3个阶段。自由选择阶段:大鼠自由选择进入其中一个目标臂,获得食物奖励后回到起始点;延迟阶段:大鼠在起始臂等待5 s;交替选择阶段:大鼠再次选择一个目标臂进入。如图1A所示,当选择的目标臂与上一次不同时,得到食物奖励,视为正确执行工作记忆任务;如图1B所示,当选择的目标臂与上一次相同时,则不能得到食物奖励,视为错误执行工作记忆任务。
本研究以行为学参考点为分界线,截取行为学参考点前4 s和后2 s,共6 s([0~6])的实验数据进行研究分析。共选取6只大鼠80次正确执行工作记忆任务和20次错误执行工作记忆任务的mPFC和vHPC各16通道LFPs数据。数据采样率为2 000 Hz,进行去基线漂移和去工频干扰的预处理。
使用短时傅里叶变换(short-time Fourier transform,STFT)计算大鼠工作记忆过程中vHPC和mPFC脑区LFPs的时频分布,确定工作记忆LFPs的特征频段。
设单通道LFP为x(t),计算公式如下:
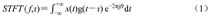
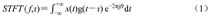
式中,g为窗函数,τ为窗函数中心,j为虚部符号,f表示频率。文中窗函数为汉明窗,窗口宽度为1 000 ms,窗口移动步长为100 ms。
频谱相干分析是一种用于测量2个平稳信号在不同频率上的相似程度或相关程度的方法,应用频谱相干分析啮齿类动物脑区间LFPs的同步性是有效的[26]。因此本文使用此方法分析工作记忆mPFC和vHPC之间的频谱相干特征模式。设vHPC单通道LFP为时间序列X=x(t),mPFC单通道LFP为时间序列Y=y(t),其中t为时间。时间序列X与Y的频谱相干函数值Cxy(f)计算公式如下:
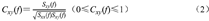
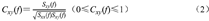
式中,Sxy(f)是X和Y在频率f的互功率谱,Sxx(f)是X在频率f的自功率谱,Syy(f)是Y在频率f的自功率谱。
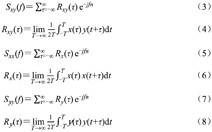
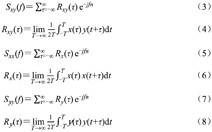
计算频谱相干值的公式如下:
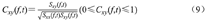
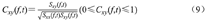
式中,Sxy(f,t)表示X和Y的互功率谱,Sxx(f)和Syy(f)分别是X和Y的自功率谱;Cxy(f,t)是X和Y的频谱相干值。相干值Cxy(f,t)的范围是0~1:为1时,表示2个信号完全同步;为0时,表示2个信号完全不同步;在0~1内时,表示2个信号不完全同步。
应用支持向量机,根据vHPC和mPFC 2个脑区LFPs特征频段的频谱相干值以及工作记忆行为学的结果,研究频谱相干值预测工作记忆行为学,具体过程如下:
(1)设计带通滤波器,提取工作记忆的特征频段,计算2脑区间多通道LFPs特征频段的时变频谱相干值;(2)对多通道的频谱相干值叠加求平均,获得平均频谱相干值。选用平均频谱相干峰值和平均频谱相干差值这2个数值作为分类特征,其中平均频谱相干差值是通过平均频谱相干峰值减去起始值得到的;(3)应用支持向量机学习算法进行分类和预测,共讨论80次行为学正确和20次行为学错误共100次实验的数据,按5∶3∶2的比例随机划分为训练集、测试集和验证集。根据已知行为学结果,定义行为学正确的标签为1,行为学错误的标签为0;(4)使用训练集和验证集对分类模型进行训练和验证,保存训练好的分类模型。最后使用训练好的分类模型预测测试集的标签。应用准确率、精确率、召回率、F1分数、受试者工作特征曲线(receiver operating characteristic curve,ROC)和ROC曲线下的面积(area under curve,AUC)6种模型评估指标,对模型进行评估。
为排除分类实验的有效性及排除数据选取对分类结果的影响,设置数据集1(工作记忆频谱相干值与行为学标签对应),以及数据集2(工作记忆频谱相干值与行为学标签随机打乱重排),从数据集中分别进行500次随机划分选取训练集、测试集和验证集。
应用Graphpad Prism 8.0软件对工作记忆过程中2个脑区LFPs的能量密度和平均频谱相干值随时间变化进行One-way ANOVA进行分析;对能量密度峰值,平均频谱相干峰值和模型评估指标等进行t检验分析。计量资料采用均数±标准差( ±s)表示。以P<0.05为差异有统计学意义。
±s)表示。以P<0.05为差异有统计学意义。
从图2A中可见,大鼠正确执行工作记忆任务时,2个脑区LFPs的能量密度明显集中在行为学参考点(品红色直线)前,并集中在4~12 Hz(theta频段)。从图2B中看出,工作记忆行为学错误时能量密度值较小,且没有集中分布趋势。
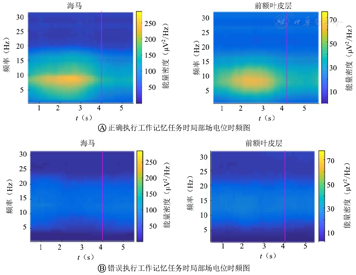

从图3中可以看出,在行为学正确时,2个脑区平均能量密度值从起始点开始增大,峰值出现在行为学参考点(品红色直线)之前,然后下降。对2个脑区LFPs的平均能量密度进行统计学分析,发现时间变量对能量密度值均有影响(均P<0.01)。而在错误的行为学状态下,差异均没有统计学意义(均P>0.05)。

**P<0.01
同时可以看出,在行为学正确时,vHPC脑区LFPs的theta频段能量密度峰值高于行为学错误时的能量密度值(P<0.01);mPFC脑区LFPs的theta频段能量密度峰值高于行为学错误时的能量密度值(P<0.01)。
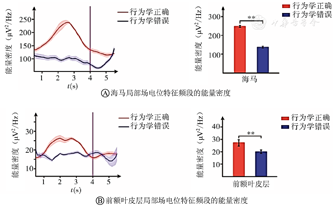
从图4A中可见,2个脑区LFPs在theta频段的频谱相干峰值出现在行为学参考点(品红色直线)前。从图4B中可见,在行为学正确时,平均频谱相干值从初始点开始增大,峰值出现在行为学参考点前,然后下降。对频谱相干值进行统计学分析,结果显示:时间变量对频谱相干值变化的影响有统计学意义(P<0.01)。在行为学错误时,平均频谱相干值的变化没有规律,并且时间变量对频谱相干值变化的影响没有统计学意义(P>0.05)。

*P<0.05
在行为学正确和错误情况下,对平均频谱相干峰值进行统计学分析:行为学正确的频谱相干峰值高于行为学错误的频谱相干峰值(均P<0.05)。
图5A表示工作记忆和随机重排2个数据集支持向量机模型的平均ROC曲线分布情况,工作记忆数据集的假阳率明显低于随机重排数据集。进一步,从图5B中看出,在工作记忆任务时,模型评估指标数值均达到80%以上,并且与数据重排情况下比较差异有统计学意义(准确率:P<0.001,精确率:P<0.001,召回率:P<0.05,F1分数:P<0.001,AUC:P<0.001),表明基于平均频谱相干峰值和平均频谱差值这2个特征,运用支持向量机可以较准确预测正确和错误工作记忆行为。
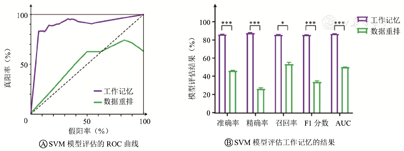

ROC—受试者工作特征曲线;AUC—ROC曲线下面积;SVM—支持向量机。*P<0.05,***P<0.001
本研究基于时频分析和时变频谱相干分析对6只大鼠正确和错误执行工作记忆任务,发现在行为学参考点PFC和HPC的能量密度,以及时变频谱相干值均出现了峰值;应用支持向量机对时变频谱相峰值特征可较为准确预测工作记忆行为学结果,从信息学进一步支持了PFC和HPC之间的相互作用是工作记忆的重要机制的观点。
认知功能的实现与神经振荡密切相关。本研究结果显示了工作记忆中PFC和HPC theta能量增加,这一结果与前人研究是一致的[27,28,29]。Theta振荡被认为在工作记忆中发挥了重要作用。工作记忆任务会持续诱导额内侧theta频段功率的增加[27],且额内侧theta频段振荡与工作记忆的任务表现和工作记忆的容量有关[28,29]。实施theta频段范围内的经颅磁刺激能够改善工作记忆功能[30]。另一方面,在工作记忆任务中存在额顶之间的theta振荡耦合[31,32],且通过经颅交流电刺激实验诱导额顶theta耦合能够提高工作记忆的性能[33]。综上,额区theta振荡能够协调其他大脑区域并维持刺激的表征,以此来支持工作记忆任务的完成。
学习和记忆过程不仅与大脑的单个脑区密切相关,而且是在大脑多个脑区的协同合作下完成。本课题组先前研究了大鼠在工作记忆过程中PFC和HPC的神经元活动,发现HPC和PFC都参与了工作记忆[34,35]。进一步的问题在于工作记忆中HPC和PFC 2个脑区之间的信息交互如何?为了回答这个问题,科研人员开展了大量的实验和计算研究。解剖学上,HPC通过各种直接或间接途径与PFC相互作用[36]。啮齿类动物的HPC-PFC直接连接主要是来自腹侧HPCCA1区的单向单突触投射,这种投射支配mPFC,而背侧HPC则接收来自mPFC前扣带回亚区的单突触投射[37]。HPC对PFC的直接输入对工作记忆编码空间信息至关重要,这些信息的编码依赖于HPC输入导致的前额叶神经元活动,成功的编码由HPC与PFC之间的跨频耦合介导。通过光遗传技术抑制vHPC到mPFC的神经通路,导致空间工作记忆受损[38]。O'Neill等[17]研究发现vHPC和mPFC的theta振荡受到空间工作记忆任务的调制。Tamura等[19]提出工作记忆任务的执行需要PFC和HPC的跨频耦合。Liu等[34]揭示大鼠在正确执行工作记忆任务时,vHPC脑区LFPs theta频段的瞬时幅度领先于mPFC。Xia等[35]通过记录mPFC和vHPC的神经元放电,构建mPFC-vHPC脑网络,揭示工作记忆中信息流主要是vHPC到mPFC。本研究结果也揭示了工作记忆中HPC和PFC之间的theta同步性增加。综上,PFC和HPC之间的信息交互会导致同步振荡活动的产生以及细胞放电,对空间工作记忆是必需的[39]。
工作记忆的信息处理可划分为编码、保持和提取3个阶段[5,40]。编码是将信息载入到工作记忆系统中,而保持则是在短时间内对信息进行存储,提取是指对信息进行回忆以及应用这些信息实现目标任务。研究表明,工作记忆与信息编码、储存和提取的3个神经回路的信息传递密切相关[17,41,42]:工作记忆的编码神经回路的信息从HPC(腹侧)传递到PFC(内侧),储存神经回路的信息从丘脑(背内侧)传递到PFC(内侧),提取神经回路的信息从PFC(内侧)传递到丘脑(背内侧)。从神经回路的信息传递角度研究工作记忆及其障碍的机制是神经科学工作记忆机制研究的前沿方向。本研究揭示了HPC-PFC在工作记忆中的信息交互,对于空间工作记忆神经环路的信息交互还需深入研究,为后续研究工作记忆的跨脑区信息处理机制提供了支持。
所有作者均声明不存在利益冲突