
模拟目标试验是一种观察性研究方法,该方法在无法进行随机对照试验(RCT)的情况下,可以利用真实世界数据(如观察性数据及历史性数据)按照RCT的设计原则进行研究设计,模拟随机分组形成干预组和对照组,最终得到近似RCT的高可信度结论。本研究以他汀类药物对糖尿病患者心肌梗死预后的影响为例,对模拟目标试验的基本概念和应用流程进行介绍,为其在真实世界中的应用提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随机对照试验(RCT)被认为是验证因果关系的高等级证据之一,但因样本选择要求高、随访难度大、伦理道德限制等因素,使RCT无法得到全面应用。因此,探索使用现有的真实世界数据(如观察性数据及历史性数据)进行高水平分析成为更多人的选择。近年来,得益于更好的可行性和较好的可信度,类RCT在流行病学中得到越来越多的应用。模拟目标试验由Hernán和Robins在2016年提出[1]。该方法是一种基于反事实推理的因果推理方法,在观察性研究和RCT间建立联系。目标试验即在进行因果推断时设计的RCT。模拟目标试验即在设计观察性研究时,通过假想一个解决研究问题的目标临床试验,参照目标临床试验进行观察性研究的关键因素设计,在因果推断方法学的合理运用下也可以达到RCT试验的效果[1, 2]。因此,该方法能够更好地利用观察数据中的时间因素,对因果关系作出更准确的推断。
本研究以他汀类药物对糖尿病患者心肌梗死预后的影响为例,概述模拟目标试验的框架以及具体步骤[3],对其原理和应用进行阐述。由于现有临床指南推荐糖尿病患者使用他汀类药物,基于伦理学考虑无法进行随机分组,故使用模拟目标试验进行研究。同时,本研究使用回顾性队列研究对同一人群进行分析,并对比两种方法的结果。
模拟目标试验的实质是利用观察数据模拟RCT,从而达到近似于RCT的研究效能。在RCT中,研究对象符合纳入排除标准入组、分配干预、开始随访应同时开始。在传统的观察性研究中,有2种常见偏倚:一种是恒定时间偏倚,也称永恒时间偏倚。恒定时间即研究对象符合纳入排除标准到分配干预之间的时间,在研究对象符合纳入排除标准入组、分配干预、开始随访3个时间点不相同时就会出现该偏倚[4]。一般有2种情况:研究对象在接受干预前已开始接受随访,恒定时间被归于干预时间;研究对象在接受随访前已符合纳入排除标准,恒定时间被删除。恒定时间偏倚会使研究对象的接受干预状态被错误判断,从而导致错误分组,造成干预措施的效应被高估或低估[5]。另一种是现使用者偏倚,即在研究对象既往接受过研究感兴趣的干预后,再次接受干预会对结局产生影响(如现使用者的依从性更好、某些药物的长期效应等)。除此之外,使用基线后信息作为纳入排除标准(如要求一定的随访时间)也会导致选择偏差。见图1。
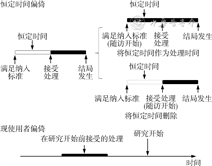

模拟目标试验的关键即确保研究对象符合纳入排除标准入组、干预分配和随访开始三者同时进行[6]。具体来说,进行一项模拟目标试验需要进行以下步骤。
1. 确定纳入排除标准:模拟目标试验的纳入排除标准与RCT的标准基本相同,但使用时需要注意不要使用基线后信息作为纳入排除标准,以免造成选择偏倚。在本研究示例中,纳入标准:年龄>18岁、已确诊1型或2型糖尿病、没有陈旧性心肌梗死、首次入院。纳入的研究对象必须接受某一项感兴趣的干预措施(干预组)或者未进行任何干预(对照组),对于接受了其他干预的研究对象不应纳入研究中。例如本研究纳入了接受他汀类药物治疗的患者,对于接受了介入治疗的对象不纳入研究中。另外,为了避免现使用者偏倚,在选择研究对象时挑选第一次接受干预的对象,这种设计被称为新用户设计[7]。本研究中通过纳入首次入院的患者以满足该条件。
2. 确定干预措施:干预措施的确定与进行RCT所用的干预措施相同,根据研究目的确定相应的干预措施。
3. 干预措施的分配:在模拟目标试验中,由于使用观察性数据,无法进行盲法分配。因此,为了模拟随机化,需要尽可能调整所有的混杂因素以确保各组间的可比性。常用的方法包括匹配、分层或回归、标准化或逆概率加权、g估计和双重稳健方法[8]。本研究示例采用的是逆概率加权。
4. 零时刻的确定:零时刻即研究对象满足纳入排除标准入组、接受干预分配并开始随访的时间。需要特别注意的是,在零时刻之后才符合纳入排除标准的个体不应纳入研究中。因此,确定零时刻的最佳方法是将其定义为符合条件个体启动治疗策略的时间。但是在一个长时间的研究中,同一个研究对象可能在多个时间符合纳入排除标准。因此零时刻的确定可以根据实际情况考虑2种策略。
(1)研究对象在一个时刻纳入研究:在这种情况下,研究对象仅在某一个时刻符合纳入排除标准并进入研究。本研究示例即属于该类,所有研究对象在入院时纳入研究并且不考虑第二次入院。
(2)研究对象在多个时刻多次纳入研究:在长期研究中,研究对象可能有多次机会符合纳入排除标准。例如,在一项模拟目标试验中比较过去2年内没有慢性病史且未使用激素治疗的绝经后妇女中开始与未开始激素治疗的结局差异,在一段时间内(如50~55岁),从未接受过治疗的女性,50岁时未接受过治疗可以纳入对照组,51岁时同样符合纳入排除标准可以纳入对照组,换言之,这位女性有多个时间符合零时刻定义。对于这种情况有2种处理方法:第一种,选取某个时间为零时刻开始试验,即零时刻确定的第一种策略,例如在50岁时开始;第二种,嵌套多个试验,在固定的周期或在每次符合纳入排除标准时均开始一个新的试验。从统计学角度分析,第二种策略比第一种的效能更高[9]。但是,由于同一个体包含在多个试验中,因此需要对方差估计量进行适当调整。
5. 确定主要/次要结局:结局的确定与RCT相同,在本研究示例中主要结局为医院内死亡。
6. 随访:随访的过程与RCT大致相同,但考虑到在实际的观察性数据中符合纳入排除标准后立即开始分配干预措施的情况较少,在随访开始前会设置一定时间的宽限期。宽限期即允许研究对象在符合纳入排除标准后一段时间再进行干预措施的分配并进行分组。宽限期的设置一方面可以增加观察数据库中可用于模拟目标试验的人数,另一方面某些特殊的干预措施(如手术)可能需要一定的准备时间,不能立即进行,宽限期使模拟更贴近RCT。宽限期的设置与零时刻并不冲突,前提是其长短不会对最终结局产生影响,长短主要取决于具体的研究问题及数据的结构(如研究某因素对慢性疾病的影响时宽限期可设置为数月,而在本研究示例急性心肌梗死的预后时宽限期仅为2 d)。如不能确定宽限期的长短,可以进行敏感性分析来考察设置不同宽限期的影响。本研究示例中设置了2 d的宽限期,即在入院2 d内进行他汀类药物治疗的个体均被按干预组对待。在随访过程中对关键信息丢失的研究对象做删失处理(如干预状态),少部分变量的丢失可采用多种方式进行填补以保证有足够的样本量进行分析。
7. 统计学分析:根据是否考虑随访过程中干预状态的改变,提出2种分析方案供选择。
(1)干预状态不随时间改变:在此分析方案中实际比较的是干预的分配对结局的影响,由于不考虑在随访过程中的干预状态变化,可采用边际结构的Cox比例风险回归模型计算生存率或嵌套结构的加速失效模型计算生存时间[10, 11],这2种方法都可以对时变混杂因素进行适当调整[12]。边际结构模型通过逆概率加权调整,嵌套结构模型通过g估计进行调整[13]。g估计可利用暴露和潜在结果间的条件独立性实现对混杂变量的控制[14]。g估计和逆概率加权均属于g方法,专用于处理随时间变化的混杂因素。在比例风险假定不满足时可采用时间依赖性Cox比例风险回归模型进行调整。另外,因失访导致的偏倚需要额外进行逆概率加权。
(2)干预状态随时间改变:对于时依性暴露的处理,模型不仅必须包括时变暴露,还必须包括用于在制度中分配处理的时变协变量,此时,嵌套结构模型可以包含这些交互项,但边际结构模型不再适用[13]。另一种更方便的方法是在零时刻时将所有研究对象的信息进行克隆,将每份克隆信息分配至不同的干预措施中。在随访过程中,当其停止遵循所在干预策略时对其进行审查[15]。由于研究对象的干预变量是非时变的,因此不存在时变混杂,也不需要对其进行调整。但是审查本身会造成偏倚,需要使用逆概率加权进行调整[16]。
8. 敏感性分析:敏感性分析中应包括不同宽限期的设置,以排除不恰当的宽限期对结果的影响。在考虑时变混杂的分析中,可添加或减少某些时变混杂观察其对结果的影响,确保关键变量被纳入。
9. 模拟目标试验的特点:为更直观阐述模拟目标试验的特点,本研究以他汀类药物对糖尿病患者患心肌梗死预后的影响为例,比较RCT、模拟目标试验、队列研究在研究设计阶段存在的差异。见表1。

随机对照试验(RCT)、模拟目标试验、队列研究的特点比较
随机对照试验(RCT)、模拟目标试验、队列研究的特点比较
| 项目 | RCT | 队列研究 | 模拟目标试验 |
|---|---|---|---|
| 目标 | 估计他汀类药物对糖尿病患者患急性心肌梗死的预后的影响 | 同RCT | 同RCT |
| 纳入标准 | 入院诊断为糖尿病和心肌梗死的患者 | 同RCT并要求一定的随访时间(以及其他要求) | 同RCT |
| 排除标准 | 患陈旧性心肌梗死 | 同RCT | 同RCT |
| 干预措施 | 采用任一种他汀类药物治疗 | 同RCT | 同RCT |
| 分组的确定 | 人为将研究对象随机分至干预组(他汀类药物)和对照组 | 根据用药记录或其他记录将参与者分至不同组 | 采用真实世界数据模拟随机分组 |
| 干预的实施 | 按随机分组结果实施干预 | 无 | 一定的宽限期 |
| 结局指标 | 入院后的全因死亡率、生存时间 | 同RCT | 同RCT |
| 协变量 | 随机化会平衡两组间的协变量,因此,仅在有证据表明协变量是结局的预测因子时,才建议在RCT中进行协变量调整 | 尽可能调整所有已知的协变量以确保组间的可比性 | 同队列研究 |
| 随访 | 随访从确诊开始,随访至出院或死亡 | 从研究对象接受治疗开始随访 | 宽限期过后开始随访 |
| 统计分析 | 意向治疗分析; 符合方案分析:检查参与者是否以及何时偏离其指定的治疗策略,并调整依从性相关的基线前和基线后预后因素 | 对两组间的差异进行分析 | 同RCT,同时需要对基线协变量做额外调整 |
心血管疾病是糖尿病患者死亡的主要原因[17],44%的1型糖尿病患者和52%的2型糖尿病患者死于心血管疾病[18]。而高血压、糖尿病、肥胖、高脂血症、吸烟等已被确定为心血管疾病的常见危险因素[19]。研究发现,糖尿病患者的降脂治疗是降低心血管疾病风险的有效措施之一,目前已有研究建议>40岁的糖尿病患者使用他汀类药物以控制血脂水平[20]。但是,也有研究表明他汀类药物会导致新发糖尿病和血糖升高[21, 22],这两者都是急性心肌梗死的重要危险因素。在现有的研究中,他汀类药物对急性心肌梗死患者的治疗效果并不一致[23],他汀类药物对糖尿病患者患心肌梗死的治疗效果需要进一步研究。
1. 模拟目标试验过程:本研究数据来自MIMIC-Ⅳ 2.0数据库。纳入标准为糖尿病确诊、首次入院、急性心肌梗死确诊、无陈旧性心肌梗死。见图2。将入选研究对象的入院时间作为零时刻,每个研究对象均为一次模拟,试验时长为30 d,最后将所有结果进行整合。干预措施为在入院2 d内接受他汀类药物治疗(宽限期为2 d)。采用逆概率加权平衡基线信息,纳入变量:性别、年龄、血脂异常、高血压、充血性心力衰竭、外周血管病、脑血管疾病、慢性肺疾病、肾脏疾病、恶性肿瘤、严重肝病、艾滋病。确定最终的结局为院内死亡。对研究对象随访至治愈出院或死亡。使用边际结构模型估计他汀类药物对生存率的影响,本研究中计算了研究对象接受他汀类药物治疗的时变稳定逆概率权重,定义为在某时刻接受治疗的概率的倒数,拟合logistic回归模型用于计算该概率,将接受他汀类药物治疗作为结果,将包含基线信息变量和时变变量纳入模型。最终权重为基线权重×时变权重。最后绘制加权后的K-M生存曲线。使用R 4.1.3软件进行统计学分析。双侧检验,检验水准α=0.05。
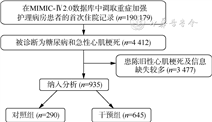

2. 模拟目标试验结果:最终纳入935人。在2 d的宽限期内,290人未接受他汀类药物治疗,645人接受他汀治疗。K-M曲线显示两组生存概率有交叉,差异无统计学意义(χ2=0.52,P=0.472)。见图3。对所有协变量是否满足比例风险假定进行检验,结果显示性别不满足比例风险假定(χ2=3.37,P=0.066)。时间依赖性Cox比例风险回归模型结果显示,他汀类药物对糖尿病患者30 d死亡率的影响无统计学意义(HR=2.144,95%CI:0.667~6.894,P=0.142)。进一步对性别进行分层分析,男、女性Cox比例风险回归模型结果均无统计学意义(HR=0.985,95%CI:0.666~1.455,P=0.937;HR=0.830,95%CI:0.497~1.388,P=0.478)。
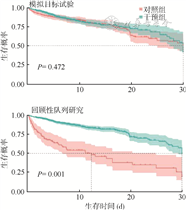

3. 回顾性队列研究结果:为更好展示模拟目标试验的特点和优势,本研究使用同一数据库和相同人群进行回顾性队列研究作为对比。实际上由于模拟目标试验对观察性数据的要求更严格,其纳入的研究对象数量相比于回顾性研究更少。本研究干预组为接受过他汀类药物治疗的患者(n=836),对照组为未接受过他汀类药物治疗的患者(n=99)。根据入院、出院或死亡时间计算每个人的生存时间,使用Cox比例风险回归模型和K-M生存曲线分析他汀类药物对患者死亡率的影响,结果显示,两组生存曲线间的差异有统计学意义(P<0.001);他汀类药物对死亡的影响有统计学意义(HR=0.255,95%CI:0.179~0.364,P<0.001)。见图3。
在临床试验设计中,严格的标准和准确的实施会减少研究的偏倚和混杂,但这种经过高度选择过的研究对象和地点虽然提高了内部有效性,却忽略了普遍性,这会高估干预因素的益处从而使试验结果与真实情况不符[24]。2种解决方案可以拟合试验数据和真实情况间的差异:第一种是放宽限制,将RCT设计得更加务实,以研究干预措施在日常临床环境中的效应。例如在新型冠状病毒感染流行期间,利用机器学习自动筛查电子病历记录并随机化,加快和简化受试者筛选、随机化和治疗分配流程,快速得到高质量的临床证据[25]。第二种是按照RCT原则设计观察性研究,即模拟目标试验[6]。作为一种类RCT方法,其本质是使用观察数据对RCT进行模拟。与传统的观察性研究相比,模拟目标试验对使用的观察性数据要求相对较高,以获得更多信息用于调整基线和时变混杂。同时,得益于使用了高质量的观察数据,在统计分析中可以使用更有效的统计方法针对混杂变量尤其是时变混杂做出调整,使结果更加贴近真实世界。另外,零时刻的确定方式和宽限期的加入使模拟目标试验可以较好地解决恒定时间偏倚,获得的结果具有更高的可信度。最后,模拟目标试验的分组与回顾性研究不同,不单纯依据干预记录的存在与否,而是模拟RCT的随访过程,适时对不符合要求的研究对象进行审查或加权。传统的观察性研究由于其本身限制不能较好反映出观察数据与真实情况间的联系,模拟目标试验填补了观察性研究和RCT间的空缺。在有条件获得高质量的观察数据时,正确使用模拟目标试验而不是使用传统观察性研究会增加估计结果的有效性[16]。
本研究利用模拟目标试验对他汀类药物应用与糖尿病患者急性心肌梗死预后的关系进行研究。结果表明,他汀类药物对提升糖尿病患者心肌梗死的生存率的影响无统计学意义。与既往临床试验结论一致[26, 27]。而既往观察性研究显示,在糖尿病人群中使用他汀类药物治疗急性心肌梗死的全因死亡率低于非他汀类药物使用者(HR=2.346,95%CI:1.791~3.072,P<0.001)[28],在全人群中他汀类药物的使用可以降低急性心肌梗死后并发症的发生率(1年生存率或1年无心血管事件发生率的统计学显著增加与他汀类药物使用率增加相关)[29],观察性研究的结论与本研究不一致。从本研究回顾性队列结果可以看出,在使用同一人群的前提下,模拟目标试验的结论与传统回顾性研究结论也不尽相同。其主要原因是模拟目标试验可以更好地利用观察性数据中的时间因素,不单纯以是否接受过干预将研究对象分组,使其更贴近于RCT。这一优势在时间跨度较长的研究中更为明显。且模拟目标试验使用的数据更为详尽,使研究可以利用更有效的统计方法估计干预的效应。除本研究中使用的边际结构模型外,还有加速失效模型和克隆+审查等多种统计方式可供选择。
在无法进行RCT时,模拟目标试验为合理使用观察性研究数据提供了一个更好的思路。需要注意的是,在模拟过程中应严格保证研究对象满足纳入排除标准入组、接受干预分配、开始随访的时间三者同步,否则将会导致的模拟失败。本研究示例中的零时刻的确定并不复杂(研究对象入院时间即为零时刻),但是当研究时间跨度长的慢性疾病时,零时刻的确定相对复杂且困难。因此需要合理使用嵌套实验、宽限期、克隆等方法确定正确的零时刻。模拟目标试验在信息收集全面的大型数据库中尤其适用。因此,该方法在临床研究领域有广泛的应用前景,可以很好地利用临床数据得到可靠结论。除此以外,该方法也适用于慢性疾病的病因探究,利用队列数据进行模拟。另外,由于观察性研究受伦理约束较少,可以在更广的范围内进行模拟目标试验。模拟目标试验存在局限性。一是模拟目标试验本质上仍属于观察性研究,在RCT中可以做到完全随机化分组,而在模拟目标试验中只能尽可能全面地平衡干预组和对照组间的混杂因素,相当于事后随机化。因此其对观察数据有较高的要求,需要数据内容全面,包含所研究的内容及相关混杂因素。所平衡的混杂因素越全面,研究结局与真实世界结局越接近。二是对数据量有一定的要求,由于纳入标准严格、数据缺失、失访等因素,最终纳入研究的人数相对于数据库总人数可能较少,因此不一定适用于小型数据库。
综上所述,在标准RCT不适用时,模拟目标试验可以作为替代方案利用观察性数据获得可信度较高的结果。为设计观察性研究和真实世界的数据挖掘提供了新思路。
王睿哲, 奚丽婧, 杨雪珂, 等. 模拟目标试验在真实世界中的应用:他汀类药物对糖尿病患者死亡率的影响[J]. 中华流行病学杂志, 2023, 44(9): 1480-1485. DOI: 10.3760/cma.j.cn112338-20230301-00115.
Wang RZ, Xi LJ, Yang XK, et al. Application of target trail emulation in real world:a case study of effect of statins on mortality in diabetes patients[J]. Chin J Epidemiol, 2023, 44(9):1480-1485. DOI: 10.3760/cma.j.cn112338- 20230301-00115.
感谢贝斯以色列女执事医疗中心为MIMIC项目提供的数据
所有作者声明无利益冲突



























