
探讨CT测量第1腰椎(L1)与第3腰椎(L3)层面透析患者骨骼肌质量的一致性及L1层面骨骼肌密度(SMD)与预后的相关性。
回顾性收集2014年1月至2019年12月在东南大学附属中大医院、苏州大学附属第三医院、南京医科大学附属泰州人民医院及扬州大学附属医院4家中心初始透析且同时有CT检查结果的1 020例患者资料,筛选出同时具有L1和L3层面CT图像的患者,测量计算骨骼肌指数(SMI)和SMD。分析L1和L3层面SMI、SMD的一致性,探讨L1层面SMI和SMD预测全因死亡的最佳临界值及与透析患者预后的相关性。应用Cox回归模型研究透析患者全因死亡和心源性死亡的危险因素。
共纳入同时具有L1和L3层面CT图像的透析患者383例,男233例,女150例。有16例样本(4.2%)SMD平均值超出了95%的一致性界限范围(-8.71~7.75 HU),15例样本(3.9%)SMI平均值超出了95%的一致性界限范围(-20.45~9.53 cm2/m2)。L1层面SMD预测全因死亡的受试者工作特征(ROC)曲线下面积为0.658(95%CI:0.596~0.721,P<0.001),最佳临界值为36.46 HU,灵敏度83.8%,特异度57.5%;L1层面SMI与全因死亡无明显相关性(P=0.299)。多因素Cox回归分析结果显示,L1层面低SMD是全因死亡(HR=2.861,95%CI:1.576~5.193,P=0.001)和心源性死亡(HR=3.771,95%CI:1.462~9.724,P=0.006)的危险因素。
CT测量L1与L3层面透析患者SMD具有良好一致性,可通过L1层面SMD评估肌肉质量,且低SMD是透析患者死亡的危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肌少症是一种进行性、全身性的骨骼肌疾病,其特征是骨骼肌力量、肌量、质量的丧失[1, 2],并易导致患者跌倒、骨折、机体功能下降、住院和死亡率增加[3]。目前认为,肌少症与多种疾病的不良预后相关,包括肿瘤[4, 5, 6]及非肿瘤性相关疾病(慢性肝病[7]、风湿免疫疾病[8]、心力衰竭[9]、慢性阻塞性肺疾病[10]等)。
终末期肾病(end-stage kidney disease,ESKD)行维持性透析治疗的人群容易并发肌少症,合并肌肉质量下降的透析患者心血管事件的发病率和死亡率显著升高[11]。可能与患者体内的尿毒症毒素蓄积、蛋白质摄入不足以及分解代谢增加有关[12]。骨骼肌质量的评价是肌少症诊断的关键,但传统肌肉质量检测方法如双能X线吸收测定法(dualenergy X-ray absorptiometry,DXA)、生物电阻抗分析(bioelectric impedance analysis,BIA)均受人体水合状态影响[13, 14]。ESKD患者多无尿,水合状态不稳定,因此需要一种稳定、便捷的方法评估患者骨骼肌质量。
CT可以通过测量腹壁总肌肉组织和大腿总肌肉组织,计算骨骼肌指数(skeletal muscle index,SMI)和骨骼肌密度(skeletal muscle density,SMD)来评估骨骼肌量和质量[15]。在血液透析患者中,腹部骨骼肌面积(skeletal muscle area,SMA)减少与全因死亡相关[16]。目前最常用的标记是第3腰椎(3rd lumbar vertebrae,L3)层面[16, 17, 18],而CT评估第1腰椎(1st lumbar vertebrae,L1)层面的骨骼肌量和质量能否替代L3层面,是否与透析患者的远期死亡相关尚不清楚。因此,本研究通过多中心回顾性分析,探讨CT在L1与L3层面评估透析患者骨骼肌质量的一致性及其与预后的相关性。
本研究为多中心回顾性队列研究,以2014年1月至2019年12月在东南大学附属中大医院、苏州大学附属第三医院、南京医科大学附属泰州人民医院及扬州大学附属医院4家中心初始透析(血液透析或腹膜透析,时间≥3个月)的患者为研究对象。纳入标准:(1)年龄18~75岁;(2)具有透析后1个月内的胸部和(或)腹部CT图像,需包含L1层面。排除标准:(1)恶性肿瘤或预计生存期<3个月;(2)肝硬化;(3)炎症性肠病;(4)肾移植术后脱离透析;(5)格林-巴利综合征、阿尔茨海默病;(6)截肢;(7)急性感染性疾病。本研究通过东南大学附属中大医院临床研究伦理委员会批准(伦理号:2022ZDSYLL003-P01)。作为观察性研究,研究过程中未对患者采取干预措施,不损害患者利益,对受试者的风险不大于最小风险,已申请免除知情同意并通过。
选择每例患者L1和L3椎体横突水平的单层横断面CT图像,层厚为1.25 mm或5.00 mm。由各中心统一进行培训的人员采用专业软件Image J 1.46测量CT图像上不同衰减值范围的组织面积(cm2)和密度,不同组织的密度取同一CT值范围内该组织的平均衰减值,计算总SMA及平均SMD(包括竖脊肌、腰方肌、腹横肌、内斜肌、外斜肌和腹直肌)。骨骼肌组织CT值范围为-29~150 HU。应用面积除以身高的平方从而校正身高的影响,得到SMI(cm2/m2)。对40张患者图像利用组内相关系数(inter-class correlation coefficient,ICC)进行一致性评价,SMA的ICC为0.998,SMD的ICC为0.995。
根据医院电子病历信息系统收集患者临床资料及实验室检查结果,包括年龄、性别、吸烟史、透析方式(血液透析/腹膜透析)、既往史(糖尿病、高血压和冠心病)、用药史(铁剂、红细胞生成素和复方α-酮酸)、身高、体重等,计算体质指数(body mass index,BMI)。血液透析患者留取长透析间期透析前空腹静脉血标本。采用UniCel AU5800全自动生化分析仪(美国Beckman Coulter公司)检测透析前血红蛋白、血小板计数、血清白蛋白、血清肌酐(serum creatinine,Scr)、胱抑素C(cystatin C,Cys C)[19]。
所有患者从CT扫描之日起每3个月通过临床住院病历系统和住院部电话完成随访,并进行患者健康状况随访,至患者死亡或3年随访结束,终点事件包括全因死亡及心源性死亡。
所有数据使用SPSS 26.0和GraphPad Prism 9软件进行统计学分析。连续型变量符合正态分布采用表示,两组间比较采用独立样本t检验;非正态分布采用M(Q1,Q3)表示,两组间比较采用Mann-Whitney U检验;分类变量采用例数和百分比(%)表示,组间比较采用χ2检验。通过Bland-Altman检验分析L1和L3之间SMI和SMD的一致性,<5%的样本超出一致性界限范围即可认为一致性较好。通过受试者工作特征(receiver operating characteristic,ROC)曲线分析SMI和SMD预测全因死亡的最佳临界值。采用Kaplan-Meier曲线结合log-rank检验评估L1层面不同SMD值患者全因死亡率和心源性死亡率的差异。采用单因素Cox回归分析(向后法)筛选出P≤0.1的变量,随后代入多因素Cox回归模型(向后法)筛选出与透析患者死亡相关的变量。均为双侧检验,检验水准α=0.05。
本研究纳入同时具有L1和L3层面CT图像的透析患者383例,男233例(60.8%),女150例(39.2%),患者年龄主要分布在18~65岁(298例,77.8%),BMI 23.4(20.8,26.3)kg/m2,透析方式以血液透析为主(314例,82.0%)。在3年随访期间,87例(22.7%)患者死亡,其中46例(12.0%)为心源性死亡(表1)。
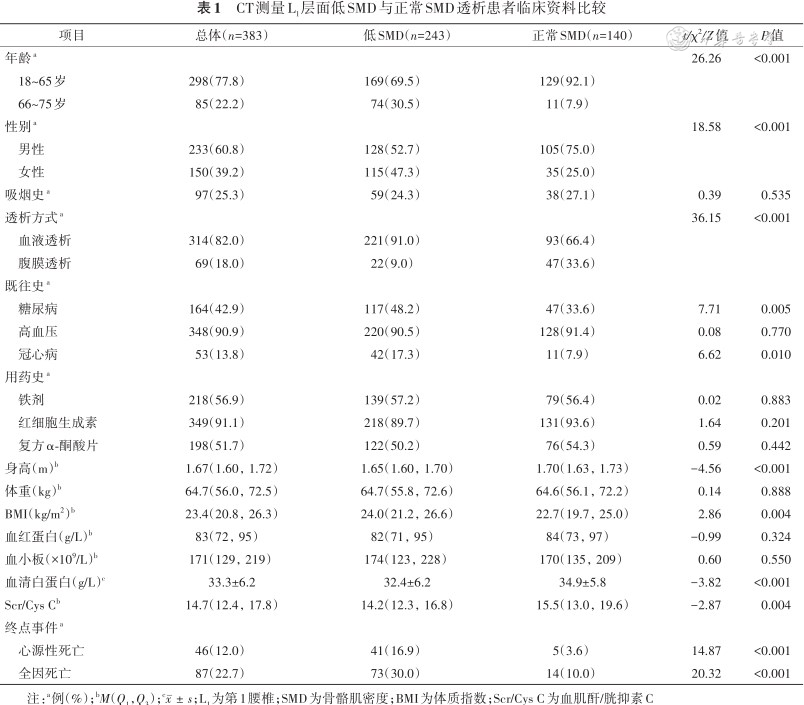
CT测量L1层面低SMD与正常SMD透析患者临床资料比较
CT测量L1层面低SMD与正常SMD透析患者临床资料比较
| 项目 | 总体(n=383) | 低SMD(n=243) | 正常SMD(n=140) | t/χ2/Z值 | P值 |
|---|---|---|---|---|---|
| 年龄a | 26.26 | <0.001 | |||
| 18~65岁 | 298(77.8) | 169(69.5) | 129(92.1) | ||
| 66~75岁 | 85(22.2) | 74(30.5) | 11(7.9) | ||
| 性别a | 18.58 | <0.001 | |||
| 男性 | 233(60.8) | 128(52.7) | 105(75.0) | ||
| 女性 | 150(39.2) | 115(47.3) | 35(25.0) | ||
| 吸烟史a | 97(25.3) | 59(24.3) | 38(27.1) | 0.39 | 0.535 |
| 透析方式a | 36.15 | <0.001 | |||
| 血液透析 | 314(82.0) | 221(91.0) | 93(66.4) | ||
| 腹膜透析 | 69(18.0) | 22(9.0) | 47(33.6) | ||
| 既往史a | |||||
| 糖尿病 | 164(42.9) | 117(48.2) | 47(33.6) | 7.71 | 0.005 |
| 高血压 | 348(90.9) | 220(90.5) | 128(91.4) | 0.08 | 0.770 |
| 冠心病 | 53(13.8) | 42(17.3) | 11(7.9) | 6.62 | 0.010 |
| 用药史a | |||||
| 铁剂 | 218(56.9) | 139(57.2) | 79(56.4) | 0.02 | 0.883 |
| 红细胞生成素 | 349(91.1) | 218(89.7) | 131(93.6) | 1.64 | 0.201 |
| 复方α-酮酸片 | 198(51.7) | 122(50.2) | 76(54.3) | 0.59 | 0.442 |
| 身高(m)b | 1.67(1.60,1.72) | 1.65(1.60,1.70) | 1.70(1.63,1.73) | -4.56 | <0.001 |
| 体重(kg)b | 64.7(56.0,72.5) | 64.7(55.8,72.6) | 64.6(56.1,72.2) | 0.14 | 0.888 |
| BMI(kg/m2)b | 23.4(20.8,26.3) | 24.0(21.2,26.6) | 22.7(19.7,25.0) | 2.86 | 0.004 |
| 血红蛋白(g/L)b | 83(72,95) | 82(71,95) | 84(73,97) | -0.99 | 0.324 |
| 血小板(×109/L)b | 171(129,219) | 174(123,228) | 170(135,209) | 0.60 | 0.550 |
| 血清白蛋白(g/L)c | 33.3±6.2 | 32.4±6.2 | 34.9±5.8 | -3.82 | <0.001 |
| Scr/Cys Cb | 14.7(12.4,17.8) | 14.2(12.3,16.8) | 15.5(13.0,19.6) | -2.87 | 0.004 |
| 终点事件a | |||||
| 心源性死亡 | 46(12.0) | 41(16.9) | 5(3.6) | 14.87 | <0.001 |
| 全因死亡 | 87(22.7) | 73(30.0) | 14(10.0) | 20.32 | <0.001 |
注:a例(%);bM(Q1,Q3);c;L1为第1腰椎;SMD为骨骼肌密度;BMI为体质指数;Scr/Cys C为血肌酐/胱抑素C
分别构建L1层面SMD和SMI预测透析患者全因死亡的ROC曲线,L1层面SMD预测全因死亡的ROC曲线下面积为0.658(95%CI:0.596~0.721,P<0.001),根据约登指数最大获得最佳临界值为36.46 HU,灵敏度83.8%,特异度57.5%;L1层面SMI预测全因死亡的ROC曲线下面积为0.537(95%CI:0.471~0.603,P=0.299),根据约登指数最大获得最佳临界值为35.32 HU,灵敏度79.3%,特异度67.9%(图1)。根据SMD最佳临界值将患者分为低SMD组(SMD<36.46 HU)和正常SMD组(SMD≥36.46 HU)。低SMD组243例(63.4%),128例(52.7%)为男性。与正常SMD组比较,低SMD组患者年龄较大,BMI较高,血清白蛋白、Scr/Cys C较低,高龄、女性、透析方式为血液透析、合并糖尿病或冠心病比例更高(均P<0.05)。此外,低SMD组全因死亡率及心源性死亡率均较高(均P<0.001)。吸烟史、合并高血压、贫血、血小板计数及铁剂、复方α-酮酸片、红细胞生成素使用情况两组间比较差异均无统计学意义(均P>0.05)(表1)。
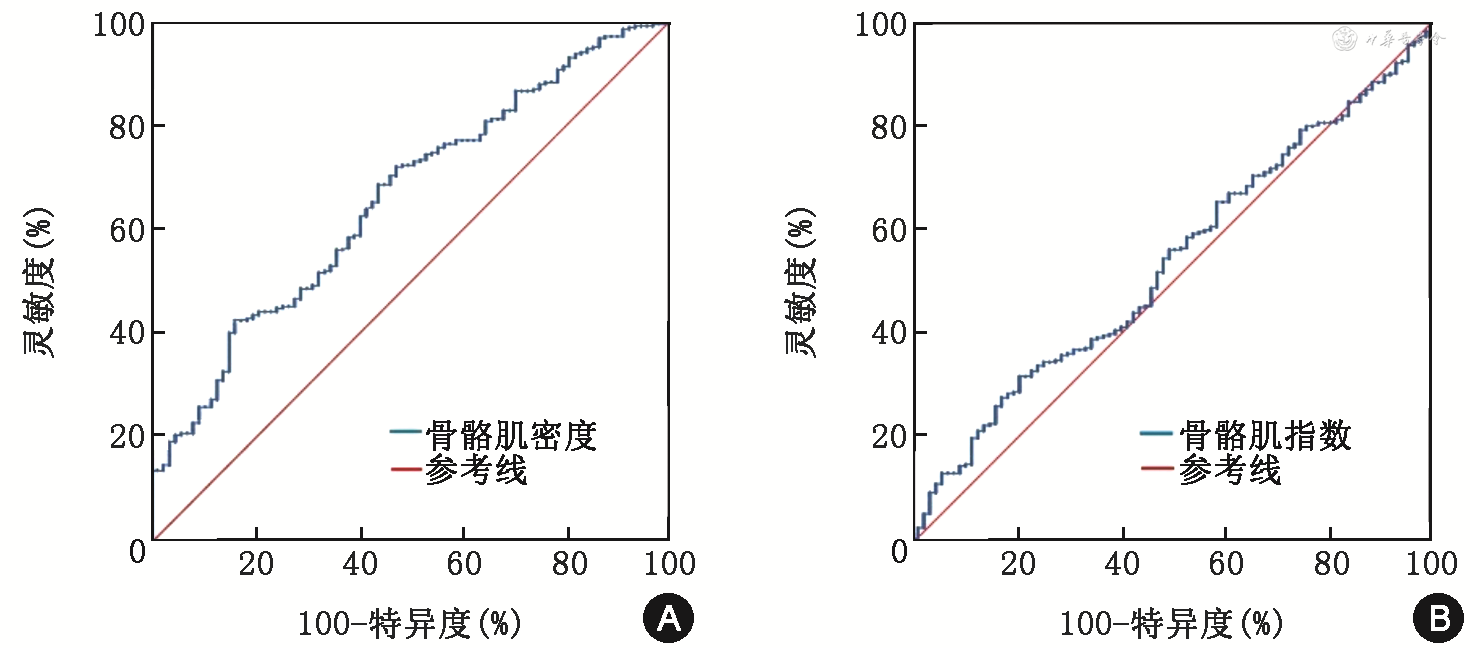

注:L1为第1腰椎;ROC曲线为受试者工作特征曲线;SMD为骨骼肌密度;SMI为骨骼肌指数
使用Bland-Altman检验分析383例同时具有L1和L3层面CT图像的患者数据,有16例样本(4.2%)SMD平均值超出了95%的一致性界限范围(-8.71~7.75 HU)(图2),15例样本(3.9%)SMI平均值超出了95%的一致性界限范围(-20.45~9.53 cm2/m2)(图3),L1和L3层面测量的SMD和SMI具有较好的一致性。
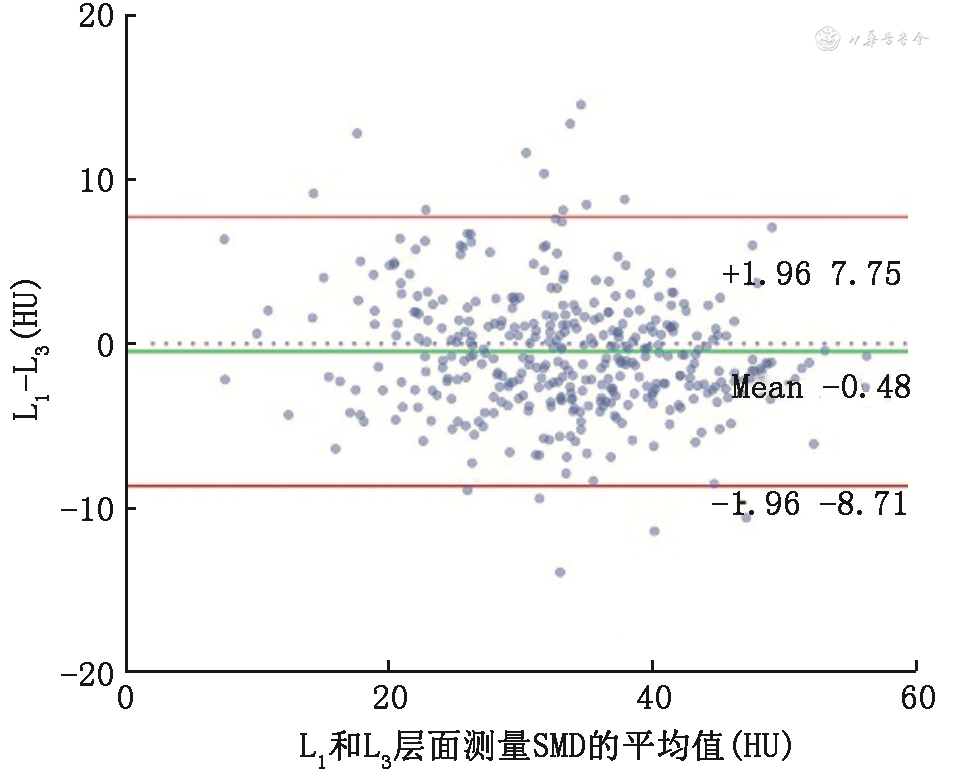

注:L1为第1腰椎;L3为第3腰椎;SMD为骨骼肌密度;HU为CT图像中测定组织密度大小的计量单位;Mean为平均值;红色水平线表示95%一致性界限的上限与下限,即±1.96倍的标准差;绿色水平线表示差值的均值,为-0.48 HU;无色虚线表示差值平均值为0的位置
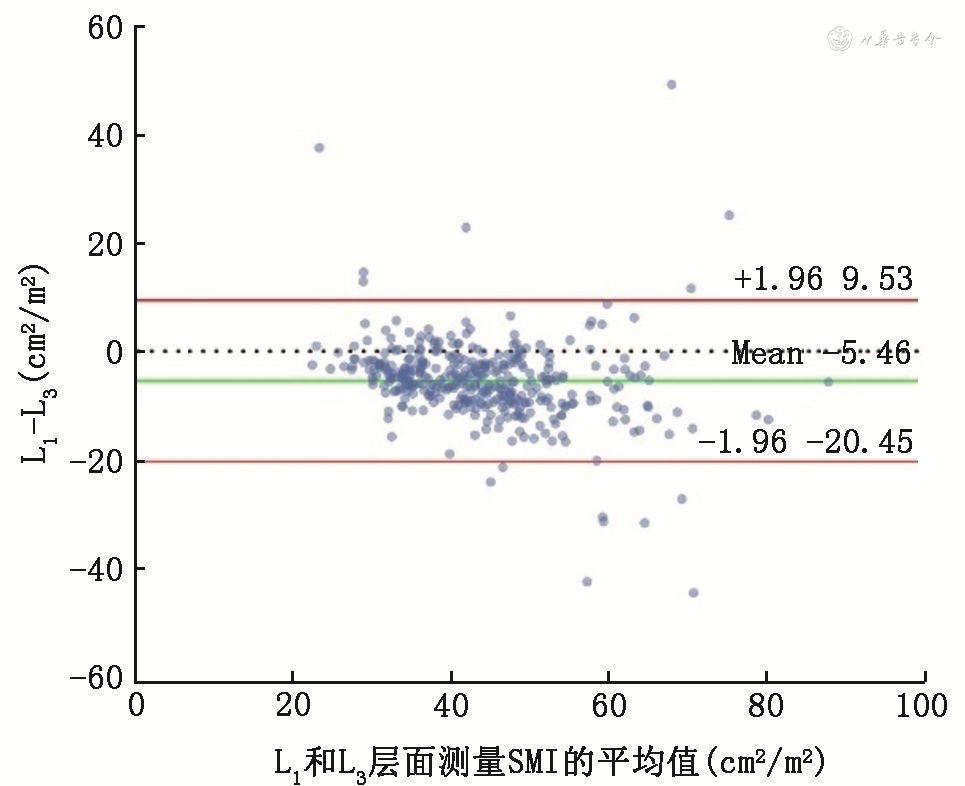

注:L1为第1腰椎;L3为第3腰椎;SMI为骨骼肌指数;Mean为平均值;红色水平线表示95%一致性界限的上限与下限,即±1.96倍的标准差;绿色水平线表示差值的均值,为-5.46 cm2/m2;无色虚线表示差值平均值为0的位置
低SMD组的全因死亡率(73例,30.0%)和心源性死亡率(41例,16.9%)高于正常SMD组(全因死亡14例,10.0%;心源性死亡5例,3.6%)(均P<0.001)(表1)。
单因素Cox回归分析结果显示,低SMD、高龄、血液透析、吸烟史、糖尿病、冠心病、低血小板计数、低血清白蛋白是全因死亡的危险因素(均P<0.05)。在多因素Cox回归分析中,低SMD(HR=2.861,95%CI:1.576~5.193,P=0.001)、高龄(HR=1.756,95%CI:1.124~2.744,P=0.013)、糖尿病(HR=3.360,95%CI:2.096~5.387,P<0.001)仍然为全因死亡的危险因素(表2)。
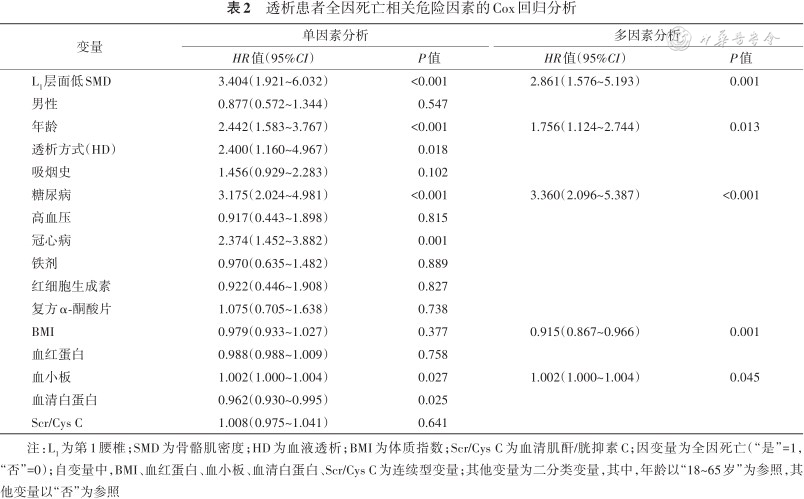
透析患者全因死亡相关危险因素的Cox回归分析
透析患者全因死亡相关危险因素的Cox回归分析
| 变量 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| L1层面低SMD | 3.404(1.921~6.032) | <0.001 | 2.861(1.576~5.193) | 0.001 |
| 男性 | 0.877(0.572~1.344) | 0.547 | ||
| 年龄 | 2.442(1.583~3.767) | <0.001 | 1.756(1.124~2.744) | 0.013 |
| 透析方式(HD) | 2.400(1.160~4.967) | 0.018 | ||
| 吸烟史 | 1.456(0.929~2.283) | 0.102 | ||
| 糖尿病 | 3.175(2.024~4.981) | <0.001 | 3.360(2.096~5.387) | <0.001 |
| 高血压 | 0.917(0.443~1.898) | 0.815 | ||
| 冠心病 | 2.374(1.452~3.882) | 0.001 | ||
| 铁剂 | 0.970(0.635~1.482) | 0.889 | ||
| 红细胞生成素 | 0.922(0.446~1.908) | 0.827 | ||
| 复方α-酮酸片 | 1.075(0.705~1.638) | 0.738 | ||
| BMI | 0.979(0.933~1.027) | 0.377 | 0.915(0.867~0.966) | 0.001 |
| 血红蛋白 | 0.988(0.988~1.009) | 0.758 | ||
| 血小板 | 1.002(1.000~1.004) | 0.027 | 1.002(1.000~1.004) | 0.045 |
| 血清白蛋白 | 0.962(0.930~0.995) | 0.025 | ||
| Scr/Cys C | 1.008(0.975~1.041) | 0.641 | ||
注:L1为第1腰椎;SMD为骨骼肌密度;HD为血液透析;BMI为体质指数;Scr/Cys C为血清肌酐/胱抑素C;因变量为全因死亡(“是”=1,“否”=0);自变量中,BMI、血红蛋白、血小板、血清白蛋白、Scr/Cys C为连续型变量;其他变量为二分类变量,其中,年龄以“18~65岁”为参照,其他变量以“否”为参照
单因素Cox回归分析结果显示,低SMD、高龄、血液透析、吸烟史、糖尿病、冠心病是心源性死亡的危险因素(均P<0.05)。在多因素Cox回归分析中,低SMD(HR=3.771,95%CI:1.462~9.724,P=0.006)、糖尿病(HR=3.173,95%CI:1.621~6.211,P=0.001)、冠心病(HR=2.165,95%CI:1.147~4.087,P=0.017)仍然为心源性死亡的危险因素(表3)。
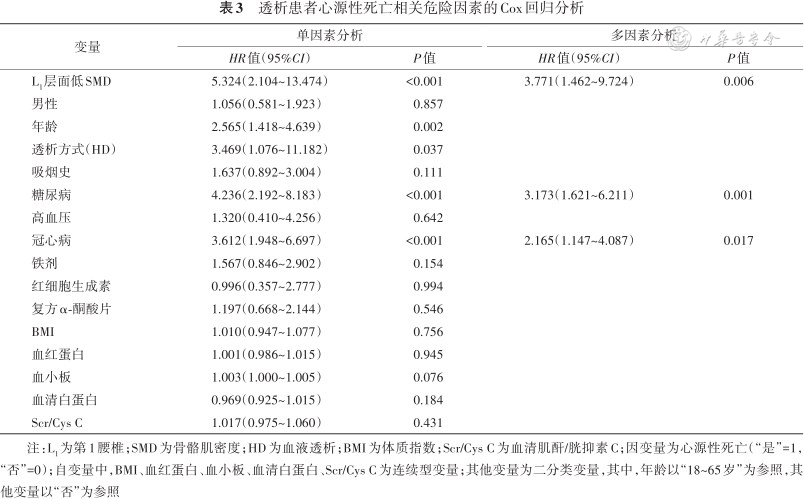
透析患者心源性死亡相关危险因素的Cox回归分析
透析患者心源性死亡相关危险因素的Cox回归分析
| 变量 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| L1层面低SMD | 5.324(2.104~13.474) | <0.001 | 3.771(1.462~9.724) | 0.006 |
| 男性 | 1.056(0.581~1.923) | 0.857 | ||
| 年龄 | 2.565(1.418~4.639) | 0.002 | ||
| 透析方式(HD) | 3.469(1.076~11.182) | 0.037 | ||
| 吸烟史 | 1.637(0.892~3.004) | 0.111 | ||
| 糖尿病 | 4.236(2.192~8.183) | <0.001 | 3.173(1.621~6.211) | 0.001 |
| 高血压 | 1.320(0.410~4.256) | 0.642 | ||
| 冠心病 | 3.612(1.948~6.697) | <0.001 | 2.165(1.147~4.087) | 0.017 |
| 铁剂 | 1.567(0.846~2.902) | 0.154 | ||
| 红细胞生成素 | 0.996(0.357~2.777) | 0.994 | ||
| 复方α-酮酸片 | 1.197(0.668~2.144) | 0.546 | ||
| BMI | 1.010(0.947~1.077) | 0.756 | ||
| 血红蛋白 | 1.001(0.986~1.015) | 0.945 | ||
| 血小板 | 1.003(1.000~1.005) | 0.076 | ||
| 血清白蛋白 | 0.969(0.925~1.015) | 0.184 | ||
| Scr/Cys C | 1.017(0.975~1.060) | 0.431 | ||
注:L1为第1腰椎;SMD为骨骼肌密度;HD为血液透析;BMI为体质指数;Scr/Cys C为血清肌酐/胱抑素C;因变量为心源性死亡(“是”=1,“否”=0);自变量中,BMI、血红蛋白、血小板、血清白蛋白、Scr/Cys C为连续型变量;其他变量为二分类变量,其中,年龄以“18~65岁”为参照,其他变量以“否”为参照
此外,本研究分析了CT测量L1层面SMD对全因死亡和心源性死亡的影响。L1层面SMD与3年累积死亡风险之间的关系见表4。在校正了BMI、年龄、性别、透析方式、吸烟史、既往史(糖尿病、高血压、冠心病)、用药史(铁剂、红细胞生成素、复合α酮酸片)、实验室数据(血红蛋白、血小板、血清白蛋白、SCr/Cys C)后,低SMD仍与全因死亡(HR=2.861,95%CI:1.576~5.193,P=0.001)和心源性死亡(HR=3.771,95%CI:1.462~9.724,P=0.006)相关。
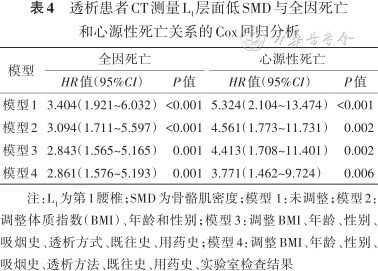
透析患者CT测量L1层面低SMD与全因死亡和心源性死亡关系的Cox回归分析
透析患者CT测量L1层面低SMD与全因死亡和心源性死亡关系的Cox回归分析
| 模型 | 全因死亡 | 心源性死亡 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 模型1 | 3.404(1.921~6.032) | <0.001 | 5.324(2.104~13.474) | <0.001 |
| 模型2 | 3.094(1.711~5.597) | <0.001 | 4.561(1.773~11.731) | 0.002 |
| 模型3 | 2.843(1.565~5.165) | 0.001 | 4.413(1.708~11.401) | 0.002 |
| 模型4 | 2.861(1.576~5.193) | 0.001 | 3.771(1.462~9.724) | 0.006 |
注:L1为第1腰椎;SMD为骨骼肌密度;模型 1:未调整;模型2:调整体质指数(BMI)、年龄和性别;模型3:调整BMI、年龄、性别、吸烟史、透析方式、既往史、用药史;模型4:调整BMI、年龄、性别、吸烟史、透析方法、既往史、用药史、实验室检查结果
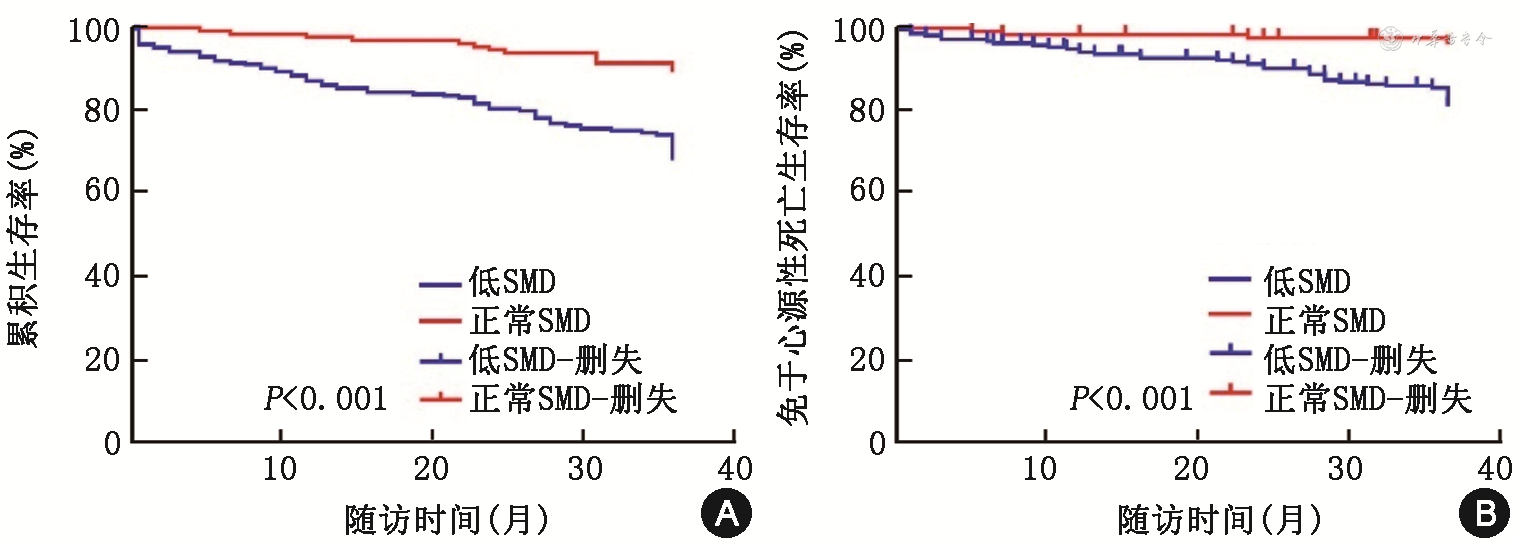
分别以全因死亡和心源性死亡为终点事件时,各时间段的低SMD组患者全因死亡率(log-rank χ2=19.74,P<0.001)和心源性死亡率(log-rank χ2=15.25,P<0.001)均高于正常SMD组(图4)。

注:SMD为骨骼肌密度
肌少症是ESKD患者的常见并发症,尤其是血液透析患者,其肌少症的发生率高于非透析患者、腹膜透析患者及肾移植患者[11, 12]。本研究通过CT图像评估透析患者骨骼肌肌量和质量,分析其与死亡风险的关系,结果发现L1和L3层面SMI和SMD一致性较好。此外,本研究结果显示L1层面低SMD是全因死亡和心源性死亡的危险因素。
包括DXA、BIA、超声、CT、MRI在内的多种影像技术可用于测量骨骼肌成分[20, 21]。与CT相比,超声主观性强、可重复性差[22],MRI成本较高,临床应用受限[23]。2018年欧洲老年人肌少症工作组指出,CT是诊断肌肉质量的金标准[2]。通过CT评估肌肉质量是衡量慢性肾脏病患者肌肉异常的理想指标[24]。骨骼肌测量一般采用胸部(T1~L1)、腹部(T10~L4)、骨盆(L4~L5)3种方法,L3是最常用来诊断肌少症的层面。Derstine等[25]通过评估美国健康人群中T10~L5水平的肌肉指标在肌少症中的诊断价值,证明L1层面可以很好地代替L3层面。此外,Pickhardt等[26]的研究发现,通过评估L1层面的肌肉质量和密度比L3层面能更有效地预测预后。本研究结果显示,L1与L3层面测量的SMI和SMD具有较好的一致性,说明在实际工作中,可以用L1层面代替L3层面评估骨骼肌。由于透析患者容易并发肺部感染、心力衰竭及其他心肺疾病[27],胸部CT检查在临床中应用更为普遍,通过分析L1层面的CT肌肉质量参数,可替代L3层面用于评价ESKD患者的肌肉质量,且具有易于获取、无需额外接受辐射暴露的优点。
常用的CT评价肌肉质量指标包括SMI和SMD。Marcus等[28]发现与非血液透析患者相比,维持性血液透析患者身体机能更差,而这种差异并不能用肌肉面积解释。同样,在老年人群中也发现与肌肉面积无关的身体机能下降[29]。本研究结果也显示,基于肌肉面积的指标SMI与预后不良相关性较低。这提示基于肌肉面积的参数并不能用来评价ESKD患者的骨骼肌质量。此外,基于肌肉质量的指标SMD与全因死亡和心源性死亡均相关,是患者死亡的独立风险因素。SMD基于肌肉密度计算所得,一定程度上反映了肌肉脂肪化和脂肪浸润程度,是肌肉衰老的重要特征。
衰老可能会导致肌肉蛋白质合成分解失衡,导致肌纤维细胞体积和数量的减少,伴随着肌肉内和肌肉间脂肪组织浸润(肌肉脂肪化)[1]。多项研究表明,肌肉脂肪化与肝病、脓毒症休克、肺癌、结肠癌等多种疾病的不良预后相关[30, 31, 32, 33, 34]。在慢性肾脏病患者中,肌肉脂肪化与代谢紊乱、心血管疾病及全因死亡有关[35]。CT测量SMD可反映肌肉量的变化和脂肪化程度[36]。Wilkinson等[37]认为肌肉质量应该被视为可能导致慢性肾脏病患者活动和功能缺陷的重要因素。本研究结果显示,低SMD与透析患者死亡风险相关。在使用基线数据校正后,低SMD仍是透析患者全因死亡和心源性死亡的危险因素。通过测量透析患者L1及L3层面SMD值,可评估患者肌肉脂肪化并采取有效措施,有助于提高患者肌肉质量,从而改善患者长期预后。
本研究存在一定局限性:仅选取了江苏省内4家代表性三甲医院的透析患者作为研究对象,研究结果可能存在偏倚;此外,本研究未能从发病机制的角度说明透析患者人群中肌肉质量下降的原因。
综上所述,本研究结果提示,在开始透析的患者中,低SMD是透析后3年内全因死亡及心源性死亡有效预测因子,L1与L3层面SMD的一致性良好,通过对初次透析慢性肾脏病患者CT检查结果二次分析计算L1与L3层面SMD值,可有效评估患者肌肉质量以及判断预后。
杨敏, 侯师梅, 袁莉, 等. CT测量L1和L3层面透析患者骨骼肌质量的一致性及L1层面骨骼肌密度与预后的相关性[J]. 中华医学杂志, 2023, 103(36): 2850-2858. DOI: 10.3760/cma.j.cn112137-20230608-00970.
所有作者声明不存在利益冲突



























