
探讨初诊CD5阳性弥漫大B细胞淋巴瘤(DLBCL)患者的临床特征及预后。
回顾性分析2015年1月至2018年12月同济大学附属第十人民医院和上海交通大学医学院附属第九人民医院收治的19例初诊CD5阳性DLBCL患者的临床资料,分析患者临床特征及实验室指标等,并采用Kaplan-Meier法进行生存分析,采用Cox比例风险模型对预后影响因素进行多因素分析。
19例初诊CD5阳性DLBCL患者中位年龄63岁(34~76岁),其中Ann Arbor分期Ⅲ~Ⅳ期13例,乳酸脱氢酶高于正常值上限12例,国际预后指数评分≥4分9例,存在B症状13例,Ki-67阳性指数≥80% 10例,存在≥1处淋巴结外器官受累15例,存在大包块(肿块长径≥7 cm)8例。患者2年无进展生存率为47.4%,2年总生存率为63.2%。单因素分析显示,Ann Arbor分期、大包块、淋巴结外受累及≥4个周期鞘内注射与总生存均相关(均P<0.05);多因素分析显示,Ann Arbor分期(Ⅰ~Ⅱ期比Ⅲ~Ⅳ期:HR=0.158,95% CI 0.031~0.803,P=0.026)、大包块(肿瘤长径<7 cm比≥7 cm:HR=0.076,95% CI 0.009~0.637,P=0.018)及≥4个周期鞘内注射(是比否:HR=9.130,95% CI 1.062~78.157,P=0.044)均为总生存的独立影响因素。
初诊CD5阳性DLBCL侵袭性强,易发生结外浸润。Ann Arbor分期Ⅲ~Ⅳ期、存在大包块及未接受≥4个周期鞘内注射是初诊CD5阳性DLBCL患者预后的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是一组具有高度异质性的侵袭性B细胞肿瘤。5%~10%的新诊断DLBCL表达CD5,CD5阳性DLBCL具有独特的生物学特征和较差的预后,2008年版世界卫生组织(WHO)淋巴造血系统肿瘤分类已将其归为一个独立类型[1]。本研究对初诊CD5阳性DLBCL患者的临床特征、预后等进行分析,以期为该类淋巴瘤的治疗提供思路。
回顾性分析2015年1月至2018年12月同济大学附属第十人民医院和上海交通大学医学院附属第九人民医院收治的19例初诊CD5阳性DLBCL患者的临床资料。所有病例均经活组织病理形态学检查和(或)免疫组织化学染色确诊,符合2008年版WHO淋巴瘤分类诊断标准。本研究符合2013年修订的《赫尔辛基宣言》的相关要求。
应用医院电子病历管理系统收集患者临床资料,包括患者的年龄、性别、淋巴瘤发病部位、临床分期、国际预后指数(IPI)评分、治疗方案、疗效、实验室检查结果(血液、骨髓)及影像学指标等。
患者均采用一线R-CHOP或R-EPOCH、二线R-ICE或R-GDP为基础的方案化疗,根据患者年龄、脏器条件调整药物剂量;鞘内注射:甲氨蝶呤10 mg,阿糖胞苷50 mg,地塞米松5 mg。完成3~6个周期化疗后,通过检测血液学相关指标、增强CT、增强磁共振成像(MRI)或PET-CT评估疗效,按照国际工作组淋巴瘤疗效评价标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD);总反应率(ORR)以CR+PR计算。中期评估达到PR及以上者继续原方案巩固治疗,共治疗6个周期后再进行疗效评估;中期评估为SD及以下者更换二线化疗方案挽救治疗,共治疗4个周期后进行疗效评估。
随访主要通过门诊、住院、电话等方式,随访截至2020年12月。7例因随访时间不足未纳入生存分析。无进展生存(PFS)时间定义为患者诊断起至首次出现PD、死亡或随访截止的时间;总生存(OS)时间定义为患者诊断起至任何原因死亡或随访截止的时间。
应用SPSS 16.0统计学软件对数据进行分析。采用Kaplan-Meier法进行生存分析,并行log-rank检验;总生存的多因素分析采用Cox比例风险模型。以P<0.05为差异有统计学意义。
19例患者中位年龄为63岁(34~76岁);生发中心B细胞型7例,非生发中心B细胞型12例;Ann Arbor分期Ⅲ~Ⅳ期13例;LDH高于正常值上限12例;IPI评分≥4分9例;存在B症状13例;Ki-67阳性指数≥80% 10例;存在大包块(肿块长径≥7 cm)8例;存在≥1处淋巴结外器官受累15例,其中骨髓受累7例、骨骼(扁骨为主)受累2例、上颌受累2例、睾丸受累2例、鼻窦受累1例、眼眶腔受累1例、舌受累1例、消化道受累1例、胰腺受累1例、肾上腺受累1例。
所有患者均至少完成3个周期化疗,中期疗效评估CR 9例,ORR为57.9 %(11/19);15例患者完成6个周期化疗,可进行终期评估,CR 8例,ORR为73.3 %(11/15)。所有患者中位随访时间为24个月(4~51个月),至随访结束,4例死亡,3例失访,其余患者中,CR 4例,PR 6例(其中4例复发),SD 1例,PD 1例;2年PFS率为47.4%,2年OS率为63.2 %。
单因素分析显示,患者OS与Ann Arbor分期、大包块、IPI评分、淋巴结外受累及≥4个周期鞘内注射均相关(均P<0.05);患者PFS与Ann Arbor分期、大包块、淋巴结外受累及≥4个周期鞘内注射均相关(均P<0.05)(表1)。多因素Cox回归分析显示,Ann Arbor分期、大包块及≥4个周期鞘内注射为患者OS的独立影响因素(均P<0.05)(表2)。
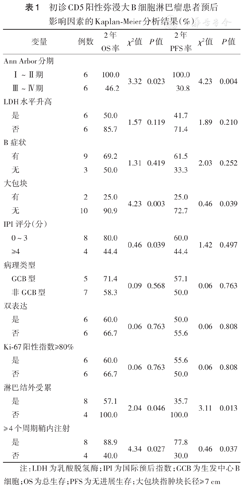
初诊CD5阳性弥漫大B细胞淋巴瘤患者预后影响因素的Kaplan-Meier分析结果(%)
初诊CD5阳性弥漫大B细胞淋巴瘤患者预后影响因素的Kaplan-Meier分析结果(%)
| 变量 | 例数 | 2年OS率 | χ2值 | P值 | 2年PFS率 | χ2值 | P值 |
|---|---|---|---|---|---|---|---|
| Ann Arbor分期 | |||||||
| Ⅰ~Ⅱ期 | 6 | 100.0 | 3.32 | 0.023 | 100.0 | 4.23 | 0.004 |
| Ⅲ~Ⅳ期 | 6 | 46.2 | 30.8 | ||||
| LDH水平升高 | |||||||
| 是 | 6 | 50.0 | 1.57 | 0.119 | 41.7 | 1.89 | 0.210 |
| 否 | 6 | 85.7 | 71.4 | ||||
| B症状 | |||||||
| 有 | 9 | 69.2 | 1.31 | 0.419 | 61.5 | 2.03 | 0.252 |
| 无 | 3 | 50.0 | 33.3 | ||||
| 大包块 | |||||||
| 有 | 2 | 25.0 | 4.23 | 0.003 | 25.0 | 0.46 | 0.039 |
| 无 | 10 | 90.9 | 72.7 | ||||
| IPI评分(分) | |||||||
| 0~3 | 8 | 80.0 | 0.46 | 0.039 | 60.0 | 1.42 | 0.497 |
| ≥4 | 4 | 44.4 | 44.4 | ||||
| 病理类型 | |||||||
| GCB型 | 5 | 71.4 | 0.09 | 0.568 | 57.1 | 0.06 | 0.763 |
| 非GCB型 | 7 | 58.3 | 50.0 | ||||
| 双表达 | |||||||
| 是 | 6 | 60.0 | 0.06 | 0.763 | 50.0 | 0.06 | 0.808 |
| 否 | 6 | 66.7 | 55.6 | ||||
| Ki-67阳性指数≥80% | |||||||
| 是 | 6 | 60.0 | 0.06 | 0.763 | 55.6 | 0.06 | 0.808 |
| 否 | 6 | 66.7 | 50.0 | ||||
| 淋巴结外受累 | |||||||
| 是 | 8 | 57.1 | 2.04 | 0.046 | 35.7 | 3.11 | 0.013 |
| 否 | 4 | 100.0 | 100.0 | ||||
| ≥ 4个周期鞘内注射 | |||||||
| 是 | 8 | 88.9 | 4.34 | 0.027 | 77.8 | 0.46 | 0.037 |
| 否 | 4 | 40.0 | 30.0 |
注:LDH为乳酸脱氢酶;IPI为国际预后指数;GCB为生发中心B细胞;OS为总生存;PFS为无进展生存;大包块指肿块长径≥7 cm
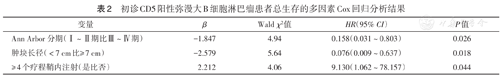
初诊CD5阳性弥漫大B细胞淋巴瘤患者总生存的多因素Cox回归分析结果
初诊CD5阳性弥漫大B细胞淋巴瘤患者总生存的多因素Cox回归分析结果
| 变量 | β | Wald χ2值 | HR(95% CI) | P值 |
|---|---|---|---|---|
| Ann Arbor分期(Ⅰ~Ⅱ期比Ⅲ~Ⅳ期) | -1.847 | 4.94 | 0.158(0.031~0.803) | 0.026 |
| 肿块长径(<7 cm比≥ 7 cm) | -2.579 | 5.64 | 0.076(0.009~0.637) | 0.018 |
| ≥ 4个疗程鞘内注射(是比否) | 2.212 | 4.06 | 9.130(1.062~78.157) | 0.044 |
近年来,对CD5阳性DLBCL的研究越来越多。早期Yamaguchi等[2]研究发现,该类淋巴瘤主要见于老年女性,常伴有多发结外病变,呈现侵袭性高、预后差等特点;该团队后续进一步研究显示,109例CD5阳性DLBCL患者中,IPI评分中高危及高危占52%,年龄>60岁占69%,69%的患者LDH升高,62%的患者为Ⅲ~Ⅳ期;35%的患者结外受累超过1处,其中最常见的结外受累部位是骨髓[3]。本研究中,19例CD5阳性DLBCL患者中位年龄63岁,Ann Arbor分期Ⅲ~Ⅳ期13例,LDH高于正常上限12例,IPI评分≥4分9例,存在B症状13例,15例患者存在≥1个淋巴结外器官受累,结果与既往研究相似,我们还发现8例患者存在大包块,提示该类淋巴瘤侵袭性高,治疗存在挑战。在预后因素的分析中,一项对29例CD5阳性DLBCL患者的研究发现,患者2年无事件生存(EFS)率为42.5%,中位EFS时间为10个月;2年OS率为44.9%,中位OS时间为19个月;OS的独立影响因素为Ann Arbor分期和病理分型[4]。另一项对104例CD5阳性DLBCL患者的研究发现,患者大多数初诊时处于疾病晚期、IPI评分较高且为非生发中心B细胞型,80%有结外病变;在单变量分析中,较短的PFS和OS与晚期、超过1处结外受累、高IPI评分和B症状相关;在多变量分析中,IPI评分较高是与OS较短相关的唯一因素[5]。而我们的研究提示,患者的2年PFS率和2年OS率分别为47.4%和63.2%,与上述研究结果相似,但单因素分析却发现OS与Ann Arbor分期、大包块及淋巴结外受累相关(均P<0.05),而与LDH水平、IPI评分、B症状及病理分型均无关(均P>0.05);多因素分析提示Ann Arbor分期(P=0.026)及大包块(P=0.018)为OS的独立影响因素。
无论初治还是复发阶段均易累及中枢神经系统(CNS)亦是CD5阳性DLBCL侵袭性强的一种表现。在对337例CD5阳性DLBCL患者的研究中观察到,3.26%的患者在初次诊断时即有CNS累及,且无论是否使用利妥昔单抗,仍有约12%的患者在治疗后出现CNS复发,从而导致OS明显缩短[6]。还有研究观察到CNS复发率高达23%[5]。虽然本研究19例CD5阳性DLBCL在初次诊断时并未发现CNS浸润,但我们结合既往文献报道,在诱导缓解的同时即对部分患者采用鞘内注射甲氨蝶呤、阿糖胞苷及地塞米松预防CNS受累。结果发现,所有患者在治疗过程中均未出现CNS受累,即使有4例患者复发,亦同样无CNS累及。单因素分析提示≥4个周期鞘内注射与OS及PFS均相关;多因素分析提示≥4个周期鞘内注射是OS的独立危险因素;由于病例数少,我们的结果在一定程度上存在偏倚,≥4个周期鞘内注射是否可作为CD5阳性DLBCL患者CNS受累的有效预防策略需要进一步证实。
虽然CD5表达造成DLBCL预后差的机制尚不明确,但CD5介导的肿瘤免疫逃逸、肿瘤微环境改变等理论逐渐被接受。有研究发现CD5阳性DLBCL患者的肿瘤组织有明显的血管增生现象,且同时高表达缺氧诱导因子1α(HIF-1α)。在B细胞活化过程中,通过STAT3和NF-κB途径可上调HIF-1α表达,在促进CD5阳性B细胞扩增的同时,与此类细胞上的白细胞介素(IL)-10启动子缺氧反应元件结合,诱导CD5阳性B细胞分泌IL-10,达到抑制效应T细胞的抗肿瘤作用[7]。IL-6作为CD5分子的配体,两者结合后通过gp130和JAK2途径促使CD5阳性B细胞内STAT3磷酸化,上调IL-10、血管内皮生长因子水平,通过抑制效应T细胞功能和促血管生成,导致肿瘤发生、发展,同时STAT3活化还可正反馈促进B细胞表达CD5[8]。另有研究发现,CD5与CD19共表达的B细胞程序性死亡受体1(PD-1)过表达[9],慢性淋巴细胞白血病(CLL)就是以CD5、CD19共表达为特征的恶性B细胞肿瘤,越来越多的证据表明PD-1通路参与CLL的肿瘤逃避[10]。在DLBCL中,PD-1表达见于活化B细胞型-DLBCL和EB病毒阳性DLBCL,提示PD-1表达可能是CD5阳性DLBCL未来关注的领域[11]。一项包括46例CD5阳性DLBCL患者的研究显示,通过二代测序发现肿瘤细胞突变频率最高的基因是MYD88 L265P,且该突变与OS显著相关[12]。我们虽然只对部分患者进行了二代测序,但也观察到MYD88突变最常见。该研究同时发现肿瘤细胞存在bcl-6、c-myc和IRF4重排,但无bcl-2重排,且与预后无显著相关性[12]。本研究19例CD5阳性DLBCL患者中6例为双表达,其中3例存在bcl-2重排,同样与预后无相关性。
综上,CD5表达在DLBCL诊治过程中值得关注,传统的化疗方法对CD5阳性DLBCL患者尚不能取得令人满意的疗效,需要积极开展更多的前瞻性临床试验(如布鲁顿酪氨酸激酶抑制剂和免疫检查点抑制剂、放化疗结合[14])、开发更多的新型疗法(如嵌合抗原受体T细胞免疫治疗),以进一步提高疗效,改善患者预后。
所有作者均声明不存在利益冲突



























