
评估稳定期慢性阻塞性肺疾病(慢阻肺)患者胸部定量CT测量指标与呼吸道症状之间的关联。
前瞻性纳入2021年3月至2022年2月就诊于北京医院门诊的稳定期慢阻肺患者186例,收集患者人口学资料、呼吸道症状及肺功能,使用FACT医学影像信息系统处理高分辨CT(HRCT)原始DICOM数据,并自动测量肺气肿指标像素指数-950(PI-950)与代表段及亚段支气管的4~6代支气管管壁厚度(4~6 T)、管壁面积百分比(4~6WA%)。根据改良英国医学研究委员会呼吸困难量表(mMRC)评分(0~1分为低分组,2~4分为高分组)、慢阻肺评估测试评分(CAT)(分数<10分为低分组,≥10分为高分组)、咳嗽、咳痰与喘鸣(无症状组与症状组)分别进行二分组作为因变量,采用logistic回归模型评估影像学参数与以上症状的关系。
186例患者中,男162例,女24例;年龄(68.9±9.3)岁;mMRC高分组83例,CAT高分组120例,咳嗽组146例,咳痰组154例,喘鸣组65例。mMRC高分组年龄及肺气肿参数PI-950均高于低分组,而用药后第一秒用力呼气容积(FEV1)占预计值百分比(FEV1%预计值)、一氧化碳弥散量(DLCO)占预计值百分比(DLCO%预计值)及用药后最大中期呼气流速(MMEF)占预计值百分比(MMEF%预计值)低于低分组(均P<0.05)。CAT高分组年龄高于低分组,而用药后FEV1%预计值及用药后MMEF%预计值低于低分组(均P<0.05)。咳嗽组男性比例、有吸烟史比例及吸烟指数均高于无咳嗽组,而4WA%低于无咳嗽组(均P<0.05)。咳痰组男性比例、有吸烟史比例、吸烟指数及PI-950高于无咳痰组,而用药后FEV1%预计值、4WA%低于无咳痰组(均P<0.05)。喘鸣组5WA%及6WA%高于无喘鸣组,而用药后MMEF%预计值低于无喘鸣组(均P<0.05)。多因素logistic回归模型分析显示,调整了人口学特征、吸烟、合并疾病及肺功能混杂因素后,PI-950每增加10%,mMRC高分组风险增加67.3%(OR=1.673,95%CI:1.052~2.658);6 WA%每增加10%,出现喘鸣的风险增加3.189倍(OR=4.189,95%CI:1.070~16.395)。未发现各影像学指标与咳嗽、咳痰、CAT评分的关联(均P>0.05)。
稳定期慢阻肺患者定量CT测量可解释呼吸道症状的存在及严重程度,肺气肿指标与呼吸困难相关,近端气道的管壁面积百分比与喘鸣相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性阻塞性肺疾病(慢阻肺)是一种以慢性呼吸道症状和持续气流受限为特征的慢性气道疾病,具有高患病率和高致残率[1]。其主要呼吸道症状为呼吸困难、咳嗽、咳痰及喘鸣等,对慢阻肺患者生活质量造成明显影响,是慢阻肺疾病评估的重要组成部分[1, 2]。高分辨CT(high-resolution computed tomography,HRCT)定量测量慢阻肺患者肺气肿及气道参数,常用于评估慢阻肺相关的肺部结构病理改变,与肺功能指标相关[3, 4],并作为依据归纳慢阻肺的各种亚型[5, 6, 7, 8, 9, 10]。国外有研究结果显示,在年轻成年人、重度吸烟者、慢阻肺患者中,影像学指标与呼吸道症状有关联,而且慢阻肺患者的影像学指标可预测呼吸道症状[11, 12, 13]。我国此类研究较少。本研究纳入呼吸科门诊就诊的稳定期慢阻肺患者,收集人口学资料、呼吸道症状、肺功能及HRCT,定量测量影像学指标,并分析影像学指标与呼吸道症状之间的关联。
前瞻性纳入2021年3月至2022年2月就诊于北京医院门诊的186例稳定期慢阻肺患者。记录患者的年龄、性别、身高、体重、吸烟情况等人口学资料,收集合并疾病、呼吸道症状、肺功能及HRCT。所有入选患者均符合慢阻肺全球倡议(Global Initiative for Chronic Obstructive Pulmonary Disease,GOLD)2021[1]的诊断标准,即吸入支气管扩张剂后,第一秒用力呼气容积(forced expiratory volume in one second,FEV1)与用力肺活量比值(forced expiratory volume in one second to forced vital capacity,FEV1/FVC),即一秒率<70%[2]。稳定期定义为近6周内咳嗽、咳痰及呼吸困难等呼吸道症状无明显加重。排除标准:(1)合并其他影响呼吸道症状与肺部结构的肺部疾病,如支气管扩张症、弥漫性泛细支气管炎、肺炎、活动性肺结核、肺癌、肺不张、肺切除术后、肺栓塞、间质性肺病等;(2)合并胸膜及胸廓疾病,如大量胸腔积液、气胸、胸膜明显占位及胸廓畸形等;(3)合并影响呼吸道症状的肺外疾病,如心源性肺水肿、严重贫血、恶液质等;(4)肺功能及HRCT资料不完整。本研究获得北京医院伦理委员会批准(2016-科-183-1),所有患者知情同意。
使用改良英国医学研究委员会呼吸困难量表(Modified British Medical Research Council Dyspnea Scale,mMRC)进行量化评估患者呼吸困难症状,根据分数0~1与2~4分为低分组(103例)与高分组(83例)[2]。同时收集综合评分慢阻肺评估测试评分(chronic obstructive pulmonary disease assessment test,CAT),根据CAT分数<10与≥10分为低分组(66例)与高分组(120例)[2]。若CAT中关于咳嗽的评分≥1分,则定义为有咳嗽症状(146例)。若CAT中关于咳痰的评分≥1分,则定义为有咳痰症状(154例)。喘鸣是一种呼气相干啰音,不用听诊器亦可听及[14],为呼吸系统常见体征之一。由于喘鸣也可以被患者本身感受到并作为主诉,所以亦是广义的呼吸道症状[14]。喘鸣按无或有症状分为无喘鸣组(121例)与喘鸣组(65例)。
1.CT扫描:HRCT为美国通用电气公司产品,采用Lung算法重建肺窗,Detail算法重建纵隔窗,重建图像层距及层厚均为5 mm;采用Bone重建薄层图像,重建图像层厚为1.25 mm,层距为1 mm。
2.肺气肿参数:使用陕西渭南神州德信医学成像技术有限公司自主研发的FACT医学影像信息系统(陕械注准20232210007)处理HRCT原始DICOM数据并自动测量[15]。使用-950 HU作为阈值,低于该阈值区域标记为肺气肿区域。通过FACT智能几何技术计算出肺气肿区域占全肺容积的百分比,得出肺气肿指标像素指数-950(pixel index-950,PI-950)(图1)。
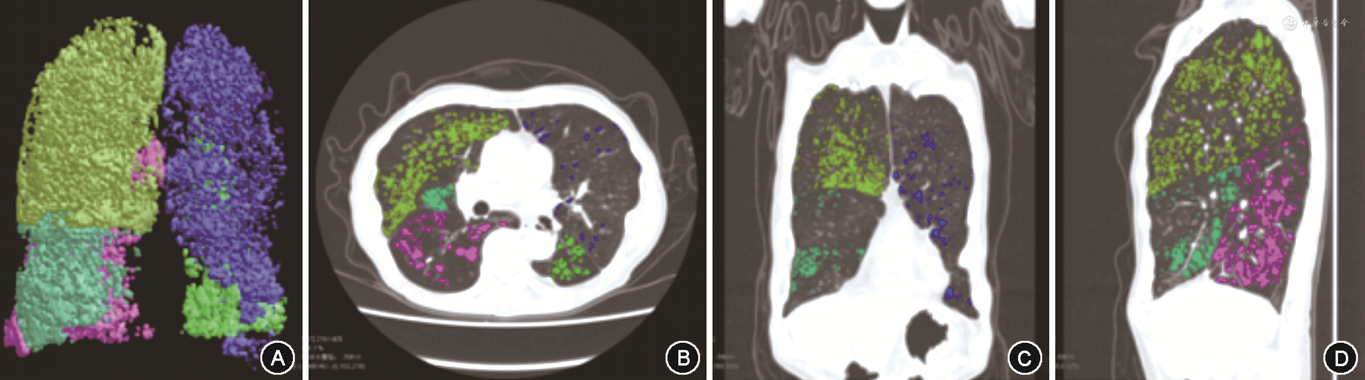

注:CT值<-950 Hu标记为肺气肿区域,各肺叶使用不同颜色,不同角度呈现;通过FACT智能几何技术计算出肺气肿区域占全肺容积的百分比,即得出PI-950
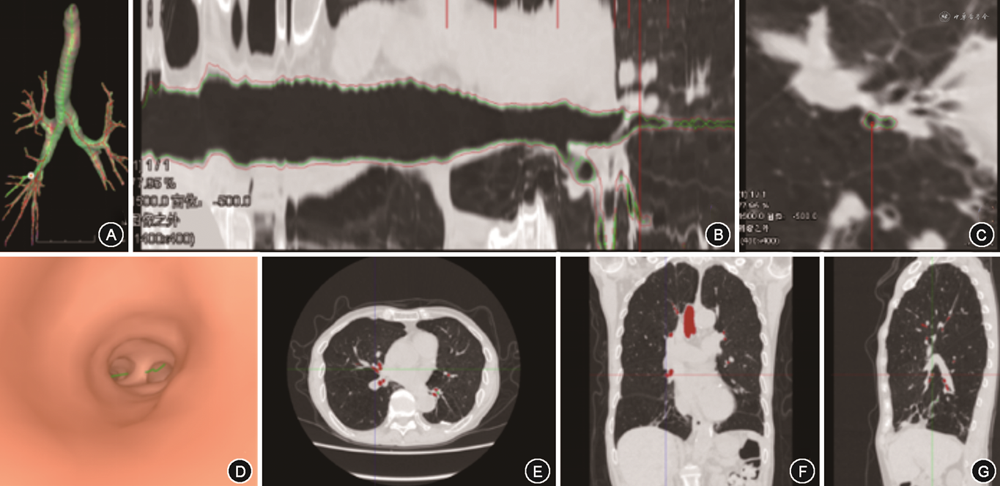
3.支气管参数:通过FACT智能几何技术自动分割支气管结构,得到支气管内外壁3D模型,并根据支气管3D模型处理得到支气管骨架,即支气管中线。支气管骨架为二叉树结构,分叉位置处由上级支气管分为两根下级支气管。气管标记为第0代,到分叉位置处分为第1代支气管,即左主支气管和右主支气管,依次类推,第3代为肺叶支气管,第4~6代为段及亚段支气管。两个分叉位置之间或分叉到远端端点之间的支气管为一个支气管分支。该软件对每个支气管分支自动进行全程测量,同一代的所有支气管分支参数取平均值得到该代的支气管参数。支气管内骨架点位置处,根据骨架方向,获得垂直于骨架方向的截面。利用已获得的内外壁结构和截面位置,计算得到4~6代支气管管壁厚度(4~6 thickness,4~6 T)、管壁面积百分比(4~6 wall area percent,4~6 WA%),同一支气管截面上管壁面积占支气管总面积的百分比截面参数(图2)。

所有患者在入组后1个月内接受肺功能检查和支气管舒张试验(德国耶格公司MasterScreen SeS肺功能仪),采用的支气管舒张剂均为400 μg沙丁胺醇吸入气雾剂。为了避免吸入支气管扩张剂对气道的定量测量造成影响,所有入选患者的肺功能检查(包括支气管舒张试验)均在CT扫描之后或非同日进行。根据患者吸入支气管扩张剂后FEV1占预计值百分比(FEV1%预计值)进行气流受限程度分级(GOLD分级):GOLD1级(轻度)为FEV1%预计值≥80%;GOLD2级(中度)为50%≤FEV1%预计值<80%;GOLD3级(重度)为30%≤FEV1%预计值<50%;GOLD4级(极重度)为FEV1%预计值<30%。
采用SPSS 27.0软件进行数据分析。符合正态分布的计量资料用表示,组间比较采用独立样本的t检验;非正态分布的计量资料用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验;分类资料以例(%)表示,组间比较采用χ²检验。分别以mMRC、CAT、咳嗽、咳痰、喘鸣二分类作为因变量,以PI-950、4~6 T、4~6WA%作为自变量,以人口学特征、吸烟、合并疾病、肺功能作为协变量进行多因素logistic回归模型分析,双侧检验,检验水准α=0.05。
186例患者中,男162例,女24例,年龄(68.9±9.3)岁,从不吸烟者34例,曾经吸烟者87例,目前仍吸烟者65例。mMRC高分组83例,占44.6%;CAT高分组120例,占64.5%;咳嗽组146例,占78.5%;咳痰组154例,占82.8%;喘鸣组65例,占34.9%。按GOLD分级,GOLD2级占比最多,达57.0%,GOLD4级最少,只有4.8%。合并疾病中,以心血管疾病为主,尤其合并高血压最多,占52.7%。男性吸烟史、目前吸烟者、吸烟指数、咳嗽、咳痰比例均高于女性,而用药后FEV1%预计值、合并高血压的比例低于女性(均P<0.05);其余指标差异均无统计学意义(均P>0.05)。详见表1。
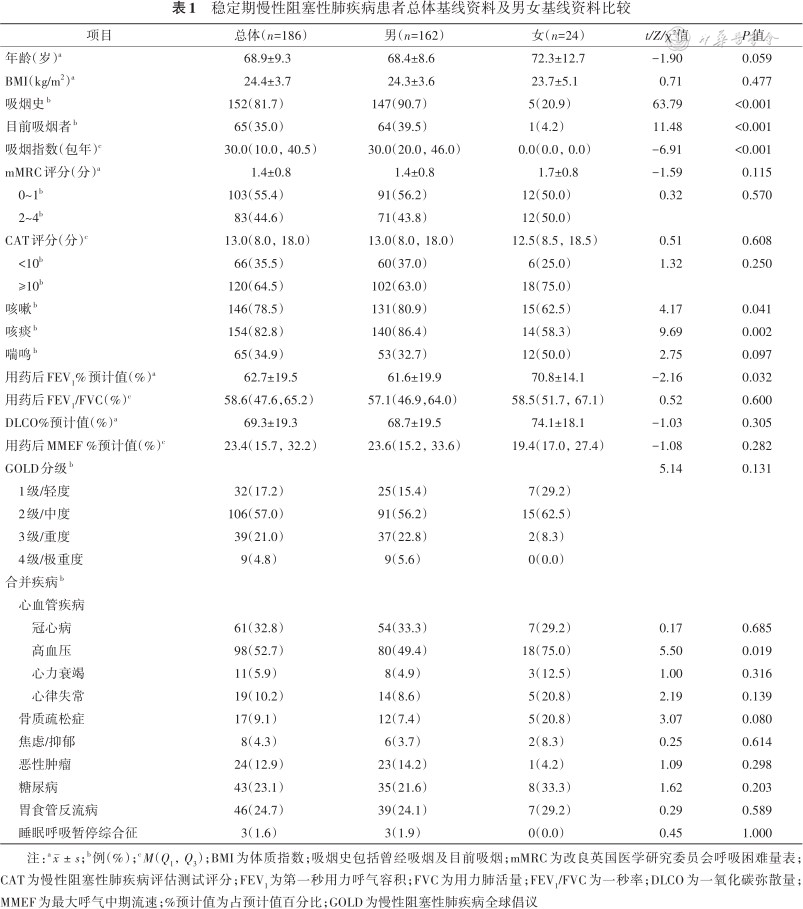
稳定期慢性阻塞性肺疾病患者总体基线资料及男女基线资料比较
稳定期慢性阻塞性肺疾病患者总体基线资料及男女基线资料比较
| 项目 | 总体(n=186) | 男(n=162) | 女(n=24) | t/Z/χ²值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁)a | 68.9±9.3 | 68.4±8.6 | 72.3±12.7 | -1.90 | 0.059 |
| BMI(kg/m2)a | 24.4±3.7 | 24.3±3.6 | 23.7±5.1 | 0.71 | 0.477 |
| 吸烟史b | 152(81.7) | 147(90.7) | 5(20.9) | 63.79 | <0.001 |
| 目前吸烟者b | 65(35.0) | 64(39.5) | 1(4.2) | 11.48 | <0.001 |
| 吸烟指数(包年)c | 30.0(10.0,40.5) | 30.0(20.0,46.0) | 0.0(0.0,0.0) | -6.91 | <0.001 |
| mMRC评分(分)a | 1.4±0.8 | 1.4±0.8 | 1.7±0.8 | -1.59 | 0.115 |
| 0~1b | 103(55.4) | 91(56.2) | 12(50.0) | 0.32 | 0.570 |
| 2~4b | 83(44.6) | 71(43.8) | 12(50.0) | ||
| CAT评分(分)c | 13.0(8.0,18.0) | 13.0(8.0,18.0) | 12.5(8.5,18.5) | 0.51 | 0.608 |
| <10b | 66(35.5) | 60(37.0) | 6(25.0) | 1.32 | 0.250 |
| ≥10b | 120(64.5) | 102(63.0) | 18(75.0) | ||
| 咳嗽b | 146(78.5) | 131(80.9) | 15(62.5) | 4.17 | 0.041 |
| 咳痰b | 154(82.8) | 140(86.4) | 14(58.3) | 9.69 | 0.002 |
| 喘鸣b | 65(34.9) | 53(32.7) | 12(50.0) | 2.75 | 0.097 |
| 用药后FEV1%预计值(%)a | 62.7±19.5 | 61.6±19.9 | 70.8±14.1 | -2.16 | 0.032 |
| 用药后FEV1/FVC(%)c | 58.6(47.6,65.2) | 57.1(46.9,64.0) | 58.5(51.7,67.1) | 0.52 | 0.600 |
| DLCO%预计值(%)a | 69.3±19.3 | 68.7±19.5 | 74.1±18.1 | -1.03 | 0.305 |
| 用药后MMEF %预计值(%)c | 23.4(15.7,32.2) | 23.6(15.2,33.6) | 19.4(17.0,27.4) | -1.08 | 0.282 |
| GOLD分级b | 5.14 | 0.131 | |||
| 1级/轻度 | 32(17.2) | 25(15.4) | 7(29.2) | ||
| 2级/中度 | 106(57.0) | 91(56.2) | 15(62.5) | ||
| 3级/重度 | 39(21.0) | 37(22.8) | 2(8.3) | ||
| 4级/极重度 | 9(4.8) | 9(5.6) | 0(0.0) | ||
| 合并疾病b | |||||
| 心血管疾病 | |||||
| 冠心病 | 61(32.8) | 54(33.3) | 7(29.2) | 0.17 | 0.685 |
| 高血压 | 98(52.7) | 80(49.4) | 18(75.0) | 5.50 | 0.019 |
| 心力衰竭 | 11(5.9) | 8(4.9) | 3(12.5) | 1.00 | 0.316 |
| 心律失常 | 19(10.2) | 14(8.6) | 5(20.8) | 2.19 | 0.139 |
| 骨质疏松症 | 17(9.1) | 12(7.4) | 5(20.8) | 3.07 | 0.080 |
| 焦虑/抑郁 | 8(4.3) | 6(3.7) | 2(8.3) | 0.25 | 0.614 |
| 恶性肿瘤 | 24(12.9) | 23(14.2) | 1(4.2) | 1.09 | 0.298 |
| 糖尿病 | 43(23.1) | 35(21.6) | 8(33.3) | 1.62 | 0.203 |
| 胃食管反流病 | 46(24.7) | 39(24.1) | 7(29.2) | 0.29 | 0.589 |
| 睡眠呼吸暂停综合征 | 3(1.6) | 3(1.9) | 0(0.0) | 0.45 | 1.000 |
注:a;b例(%);cM(Q1,Q3);BMI为体质指数;吸烟史包括曾经吸烟及目前吸烟;mMRC为改良英国医学研究委员会呼吸困难量表;CAT为慢性阻塞性肺疾病评估测试评分;FEV1为第一秒用力呼气容积;FVC为用力肺活量;FEV1/FVC为一秒率;DLCO为一氧化碳弥散量;MMEF为最大呼气中期流速;%预计值为占预计值百分比;GOLD为慢性阻塞性肺疾病全球倡议
mMRC高分组年龄及肺气肿参数PI-950均高于低分组,而用药后FEV1%预计值、一氧化碳弥散量(diffusing capacity of the lungs for carbon monoxide,DLCO)占预计值百分比(DLCO%预计值)及用药后最大中期呼气流速(maximal midexpiratory flow,MMEF)占预计值百分比(MMEF%预计值)均低于低分组(均P<0.05)。CAT高分组年龄高于低分组,而用药后FEV1%预计值及用药后MMEF %预计值均低于低分组(均P<0.05)。咳嗽组男性比例、有吸烟史比例及吸烟指数均高于无咳嗽组,而4WA%低于无咳嗽组(均P<0.05)。咳痰组男性比例、有吸烟史比例、吸烟指数及PI-950高于无咳痰组,而用药后FEV1%预计值及4WA%均低于无咳痰组(均P<0.05)。喘鸣组5WA%及6WA%均高于无喘鸣组,而用药后MMEF%预计值低于无喘鸣组(均P<0.05)。其余指标组间差异均无统计学意义(均P>0.05)。详见表2、3。
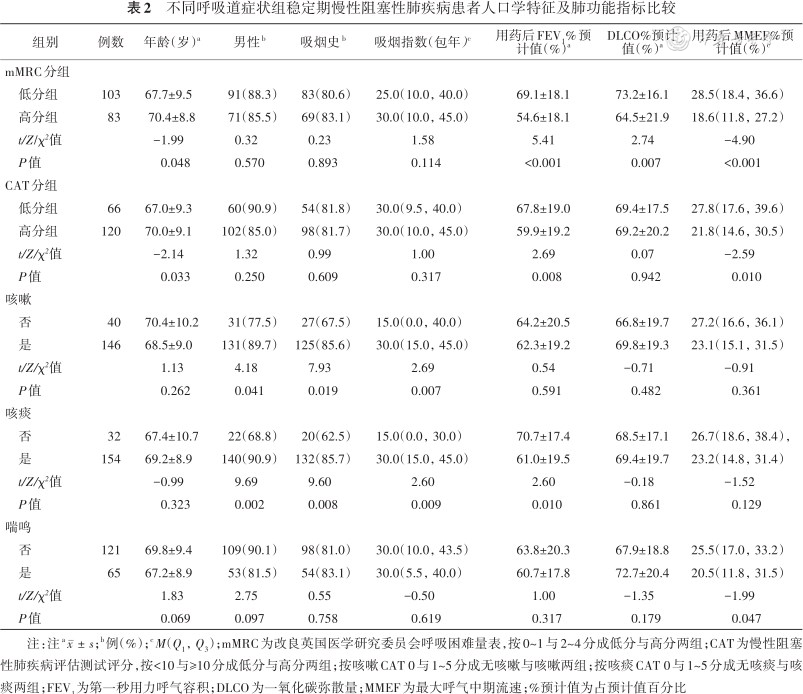
不同呼吸道症状组稳定期慢性阻塞性肺疾病患者人口学特征及肺功能指标比较
不同呼吸道症状组稳定期慢性阻塞性肺疾病患者人口学特征及肺功能指标比较
| 组别 | 例数 | 年龄(岁)a | 男性b | 吸烟史b | 吸烟指数(包年)c | 用药后FEV1%预计值(%)a | DLCO%预计值(%)a | 用药后MMEF%预计值(%)c |
|---|---|---|---|---|---|---|---|---|
| mMRC分组 | ||||||||
| 低分组 | 103 | 67.7±9.5 | 91(88.3) | 83(80.6) | 25.0(10.0,40.0) | 69.1±18.1 | 73.2±16.1 | 28.5(18.4,36.6) |
| 高分组 | 83 | 70.4±8.8 | 71(85.5) | 69(83.1) | 30.0(10.0,45.0) | 54.6±18.1 | 64.5±21.9 | 18.6(11.8,27.2) |
| t/Z/χ²值 | -1.99 | 0.32 | 0.23 | 1.58 | 5.41 | 2.74 | -4.90 | |
| P值 | 0.048 | 0.570 | 0.893 | 0.114 | <0.001 | 0.007 | <0.001 | |
| CAT分组 | ||||||||
| 低分组 | 66 | 67.0±9.3 | 60(90.9) | 54(81.8) | 30.0(9.5,40.0) | 67.8±19.0 | 69.4±17.5 | 27.8(17.6,39.6) |
| 高分组 | 120 | 70.0±9.1 | 102(85.0) | 98(81.7) | 30.0(10.0,45.0) | 59.9±19.2 | 69.2±20.2 | 21.8(14.6,30.5) |
| t/Z/χ²值 | -2.14 | 1.32 | 0.99 | 1.00 | 2.69 | 0.07 | -2.59 | |
| P值 | 0.033 | 0.250 | 0.609 | 0.317 | 0.008 | 0.942 | 0.010 | |
| 咳嗽 | ||||||||
| 否 | 40 | 70.4±10.2 | 31(77.5) | 27(67.5) | 15.0(0.0,40.0) | 64.2±20.5 | 66.8±19.7 | 27.2(16.6,36.1) |
| 是 | 146 | 68.5±9.0 | 131(89.7) | 125(85.6) | 30.0(15.0,45.0) | 62.3±19.2 | 69.8±19.3 | 23.1(15.1,31.5) |
| t/Z/χ²值 | 1.13 | 4.18 | 7.93 | 2.69 | 0.54 | -0.71 | -0.91 | |
| P值 | 0.262 | 0.041 | 0.019 | 0.007 | 0.591 | 0.482 | 0.361 | |
| 咳痰 | ||||||||
| 否 | 32 | 67.4±10.7 | 22(68.8) | 20(62.5) | 15.0(0.0,30.0) | 70.7±17.4 | 68.5±17.1 | 26.7(18.6,38.4), |
| 是 | 154 | 69.2±8.9 | 140(90.9) | 132(85.7) | 30.0(15.0,45.0) | 61.0±19.5 | 69.4±19.7 | 23.2(14.8,31.4) |
| t/Z/χ²值 | -0.99 | 9.69 | 9.60 | 2.60 | 2.60 | -0.18 | -1.52 | |
| P值 | 0.323 | 0.002 | 0.008 | 0.009 | 0.010 | 0.861 | 0.129 | |
| 喘鸣 | ||||||||
| 否 | 121 | 69.8±9.4 | 109(90.1) | 98(81.0) | 30.0(10.0,43.5) | 63.8±20.3 | 67.9±18.8 | 25.5(17.0,33.2) |
| 是 | 65 | 67.2±8.9 | 53(81.5) | 54(83.1) | 30.0(5.5,40.0) | 60.7±17.8 | 72.7±20.4 | 20.5(11.8,31.5) |
| t/Z/χ²值 | 1.83 | 2.75 | 0.55 | -0.50 | 1.00 | -1.35 | -1.99 | |
| P值 | 0.069 | 0.097 | 0.758 | 0.619 | 0.317 | 0.179 | 0.047 |
注:注a;b例(%);cM(Q1,Q3);mMRC为改良英国医学研究委员会呼吸困难量表,按0~1与2~4分成低分与高分两组;CAT为慢性阻塞性肺疾病评估测试评分,按<10与≥10分成低分与高分两组;按咳嗽CAT 0与1~5分成无咳嗽与咳嗽两组;按咳痰CAT 0与1~5分成无咳痰与咳痰两组;FEV1为第一秒用力呼气容积;DLCO为一氧化碳弥散量;MMEF为最大呼气中期流速;%预计值为占预计值百分比
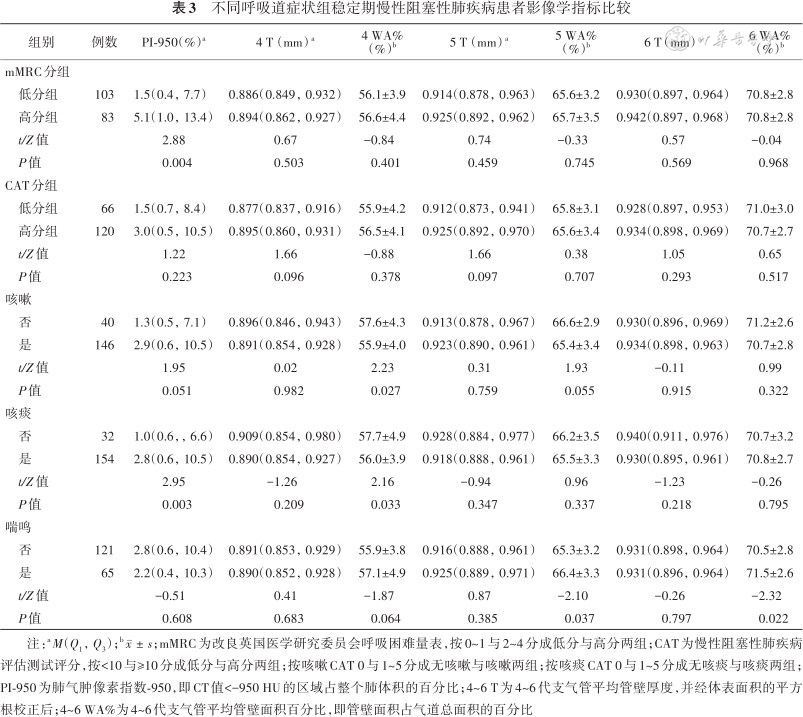
不同呼吸道症状组稳定期慢性阻塞性肺疾病患者影像学指标比较
不同呼吸道症状组稳定期慢性阻塞性肺疾病患者影像学指标比较
| 组别 | 例数 | PI-950(%)a | 4 T(mm) a | 4 WA%(%)b | 5 T(mm) a | 5 WA%(%)b | 6 T(mm) a | 6 WA%(%)b |
|---|---|---|---|---|---|---|---|---|
| mMRC分组 | ||||||||
| 低分组 | 103 | 1.5(0.4,7.7) | 0.886(0.849,0.932) | 56.1±3.9 | 0.914(0.878,0.963) | 65.6±3.2 | 0.930(0.897,0.964) | 70.8±2.8 |
| 高分组 | 83 | 5.1(1.0,13.4) | 0.894(0.862,0.927) | 56.6±4.4 | 0.925(0.892,0.962) | 65.7±3.5 | 0.942(0.897,0.968) | 70.8±2.8 |
| t/Z值 | 2.88 | 0.67 | -0.84 | 0.74 | -0.33 | 0.57 | -0.04 | |
| P值 | 0.004 | 0.503 | 0.401 | 0.459 | 0.745 | 0.569 | 0.968 | |
| CAT分组 | ||||||||
| 低分组 | 66 | 1.5(0.7,8.4) | 0.877(0.837,0.916) | 55.9±4.2 | 0.912(0.873,0.941) | 65.8±3.1 | 0.928(0.897,0.953) | 71.0±3.0 |
| 高分组 | 120 | 3.0(0.5,10.5) | 0.895(0.860,0.931) | 56.5±4.1 | 0.925(0.892,0.970) | 65.6±3.4 | 0.934(0.898,0.969) | 70.7±2.7 |
| t/Z值 | 1.22 | 1.66 | -0.88 | 1.66 | 0.38 | 1.05 | 0.65 | |
| P值 | 0.223 | 0.096 | 0.378 | 0.097 | 0.707 | 0.293 | 0.517 | |
| 咳嗽 | ||||||||
| 否 | 40 | 1.3(0.5,7.1) | 0.896(0.846,0.943) | 57.6±4.3 | 0.913(0.878,0.967) | 66.6±2.9 | 0.930(0.896,0.969) | 71.2±2.6 |
| 是 | 146 | 2.9(0.6,10.5) | 0.891(0.854,0.928) | 55.9±4.0 | 0.923(0.890,0.961) | 65.4±3.4 | 0.934(0.898,0.963) | 70.7±2.8 |
| t/Z值 | 1.95 | 0.02 | 2.23 | 0.31 | 1.93 | -0.11 | 0.99 | |
| P值 | 0.051 | 0.982 | 0.027 | 0.759 | 0.055 | 0.915 | 0.322 | |
| 咳痰 | ||||||||
| 否 | 32 | 1.0(0.6,,6.6) | 0.909(0.854,0.980) | 57.7±4.9 | 0.928(0.884,0.977) | 66.2±3.5 | 0.940(0.911,0.976) | 70.7±3.2 |
| 是 | 154 | 2.8(0.6,10.5) | 0.890(0.854,0.927) | 56.0±3.9 | 0.918(0.888,0.961) | 65.5±3.3 | 0.930(0.895,0.961) | 70.8±2.7 |
| t/Z值 | 2.95 | -1.26 | 2.16 | -0.94 | 0.96 | -1.23 | -0.26 | |
| P值 | 0.003 | 0.209 | 0.033 | 0.347 | 0.337 | 0.218 | 0.795 | |
| 喘鸣 | ||||||||
| 否 | 121 | 2.8(0.6,10.4) | 0.891(0.853,0.929) | 55.9±3.8 | 0.916(0.888,0.961) | 65.3±3.2 | 0.931(0.898,0.964) | 70.5±2.8 |
| 是 | 65 | 2.2(0.4,10.3) | 0.890(0.852,0.928) | 57.1±4.9 | 0.925(0.889,0.971) | 66.4±3.3 | 0.931(0.896,0.964) | 71.5±2.6 |
| t/Z值 | -0.51 | 0.41 | -1.87 | 0.87 | -2.10 | -0.26 | -2.32 | |
| P值 | 0.608 | 0.683 | 0.064 | 0.385 | 0.037 | 0.797 | 0.022 |
注:aM(Q1,Q3);b;mMRC为改良英国医学研究委员会呼吸困难量表,按0~1与2~4分成低分与高分两组;CAT为慢性阻塞性肺疾病评估测试评分,按<10与≥10分成低分与高分两组;按咳嗽CAT 0与1~5分成无咳嗽与咳嗽两组;按咳痰CAT 0与1~5分成无咳痰与咳痰两组;PI-950为肺气肿像素指数-950,即CT值<-950 HU的区域占整个肺体积的百分比;4~6 T为4~6代支气管平均管壁厚度,并经体表面积的平方根校正后;4~6 WA%为4~6代支气管平均管壁面积百分比,即管壁面积占气道总面积的百分比
调整年龄、性别、吸烟、合并疾病(心血管疾病、骨质疏松症、恶性肿瘤、代谢综合征和糖尿病、焦虑和抑郁、胃食管反流病、睡眠呼吸暂停综合征)及肺功能后,4~6 T、4~6 WA%与mMRC高分组,PI-950、4~6 T、4~5 WA%与喘鸣,PI-950、4~6 T、4~6 WA%与咳嗽、咳痰、CAT高分组关联均无统计学意义(均P>0.05)。PI-950每增加10%,mMRC高分组风险增加67.3%(OR=1.673,95%CI:1.052~2.658);6 WA%每增加10%,出现喘鸣的风险增加3.189倍(OR=4.18,95%CI:1.070~16.395)。详见表4。
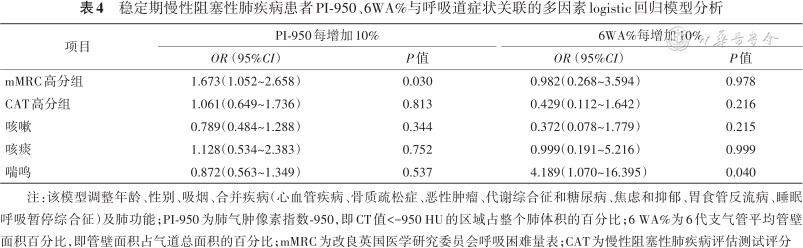
稳定期慢性阻塞性肺疾病患者PI-950、6WA%与呼吸道症状关联的多因素logistic回归模型分析
稳定期慢性阻塞性肺疾病患者PI-950、6WA%与呼吸道症状关联的多因素logistic回归模型分析
| 项目 | PI-950每增加10% | 6WA%每增加10% | ||
|---|---|---|---|---|
| OR(95%CI) | P值 | OR(95%CI) | P值 | |
| mMRC高分组 | 1.673(1.052~2.658) | 0.030 | 0.982(0.268~3.594) | 0.978 |
| CAT高分组 | 1.061(0.649~1.736) | 0.813 | 0.429(0.112~1.642) | 0.216 |
| 咳嗽 | 0.789(0.484~1.288) | 0.344 | 0.372(0.078~1.779) | 0.215 |
| 咳痰 | 1.128(0.534~2.383) | 0.752 | 0.999(0.191~5.216) | 0.999 |
| 喘鸣 | 0.872(0.563~1.349) | 0.537 | 4.189(1.070~16.395) | 0.040 |
注:该模型调整年龄、性别、吸烟、合并疾病(心血管疾病、骨质疏松症、恶性肿瘤、代谢综合征和糖尿病、焦虑和抑郁、胃食管反流病、睡眠呼吸暂停综合征)及肺功能;PI-950为肺气肿像素指数-950,即CT值<-950 HU的区域占整个肺体积的百分比;6 WA%为6代支气管平均管壁面积百分比,即管壁面积占气道总面积的百分比;mMRC为改良英国医学研究委员会呼吸困难量表;CAT为慢性阻塞性肺疾病评估测试评分
本研究结果显示,调整潜在混杂因素后,影像学参数与呼吸道症状存在关联。PI-950增高,呼吸困难加重的可能性增加,提示肺气肿与呼吸困难相关。6 WA%增加,喘鸣的可能性增加,提示近端气道改变与喘鸣相关。未发现以上参数与咳嗽、咳痰相关。这是一个有意义的发现,可以更直观、深入地从病理及病理生理角度认识慢阻肺及呼吸道症状。虽然肺功能仍是诊断慢阻肺的“金标准”,亦与呼吸道症状相关,然而并不能完美诠释慢阻肺的异质性,而且易受患者主观影响。但定量CT更加直观、客观,部分情况下可以作为肺功能的有益补充或替代方案[3, 4,13,16, 17, 18, 19]。
肺气肿增加与呼吸困难加重正相关,与国外研究结论一致。肺气肿患者的肺泡数量及肺泡表面积减少,肺毛细血管床减少,导致气体交换减少[20]。肺气肿引起肺静态和动态过度膨胀,容积变化非压力-容积曲线最佳部分,呼吸肌肉亦在长度-张力关系的次优部分,导致呼吸功增加[21]。呼吸困难与肺实质结构改变相关,使其成为慢阻肺的核心症状。
本研究中,未发现近端气道改变与呼吸困难相关。国外有研究发现Pi10(气道内周长为10 mm时管壁面积的平方根)增大与呼吸困难有关。慢阻肺以小气道改变为主,但影像学上难以直接测量小气道,常用近端气道参数间接反映[22],如右上肺尖段支气管参数[4]或Pi10 [23]。本研究结果说明近端气道重构并非呼吸困难产生的关键因素,但不排除与样本量相对小掩盖了近端气道与小气道重构的相关性。
6 WA%增加与喘鸣正相关,国外亦发现Pi10增大与喘鸣有关[13]。大气道平滑肌痉挛及管腔狭窄可导致呼气相哮鸣音。但本研究结果提示,同为近端气道,6代支气管与喘鸣相关,但未发现4~5代支气管与喘鸣的关联。
咳嗽、咳痰是慢阻肺最早出现的症状,但未发现肺气肿、近端气道改变与其相关。理论上,近端气道管壁增厚,意味着气道炎症及杯状细胞增生,产生痰液,引起咳嗽、咳痰增加。但国外大样本研究亦提示,Pi10增加与咳嗽仅有弱相关,与咳痰无关[13]。本研究样本量相对小,可能导致假阴性结果,但同时说明气道改变与咳嗽相关性不够显著。咳嗽、咳痰与吸烟状态相关,除慢阻肺患者外,亦见于未达到慢阻肺诊断标准的吸烟人群[24, 25]。说明易感人群在烟草刺激下,早期即可出现咳嗽、咳痰,先于并独立于肺部结构改变出现。
CAT作为慢阻肺的一项综合评分,并未发现肺气肿、近端气道改变与其相关 [26]。其包含胸闷、喘息、活动受限等呼吸困难相关信息,亦包含咳嗽、咳痰、睡眠多项其他症状,反而与肺部结构改变对应性不佳。
本研究有以下优势:首先,调整多种混杂因素后建立模型,增加了可靠性。其次,FACT自动测量软件的使用,提高了肺部影像学研究的效率。最后,虽然稳定期慢阻肺患者的呼吸道症状不是主要矛盾,也很容易从临床角度进行观察判断,但本研究促进临床医生更直观、深入地从病理及病理生理角度认识慢阻肺及呼吸道症状。
本研究存在以下不足:仅前瞻性收集了横断面资料,若继续纵向随访,可进一步观察、预测影像学指标与呼吸道症状的相关性。作为单中心研究,样本量相对小,后期可进一步扩充,或多中心纳入。女性及GOLD4级患者比例相对小。
总之,稳定期慢阻肺患者肺实质和气道的定量CT测量更加直观、客观,可解释呼吸道症状的存在及严重程度,部分情况下可以作为肺功能的有益补充或替代方案,进一步深化对慢阻肺的认识。今后应着力于如何将定量CT测量应用于临床实践,帮助临床医生做出更准确的诊断和治疗决策,并进行临床效益评估[27, 28, 29]。
王玉霞, 孙铁英, 李燕明, 等. 稳定期慢性阻塞性肺疾病患者胸部定量CT测量指标与呼吸道症状的关联研究[J]. 中华医学杂志, 2023, 103(38): 3017-3025. DOI: 10.3760/cma.j.cn112137-20230418-00627.
所有作者声明不存在利益冲突



























