
探讨Langerin在介导特应性皮炎(AD)小鼠模型经皮致敏中的作用。
以Langerin基因敲除(Langerin-KO)小鼠及野生型小鼠为研究对象。对小鼠耳部进行卡泊三醇(MC903)和卵清蛋白(OVA)外涂制备AD模型,设置野生型对照组、野生型AD模型组、Langerin-KO对照组及Langerin-KO AD模型组4组小鼠。每日观察各组小鼠皮损变化情况。在造模结束后检测小鼠耳部皮损炎症细胞浸润情况,小鼠耳部皮损Tslp、Il4、Il13、Il17a和Il22 mRNA表达情况,血清总IgE、OVA特异性IgE(sIgE)、OVA sIgG1和OVA sIgG2a水平,以及小鼠颈部引流淋巴结Treg细胞数量变化。
与野生型对照组小鼠相比,野生型模型组小鼠耳部皮肤出现红斑、肿胀、鳞屑,表皮增厚、真皮炎症细胞浸润,耳部皮损中Tslp、Il4、Il13、Il17a和Il22的mRNA表达上调,分别为(1.80±0.66、1.64±0.25、1.71±0.54、2.41±0.23、2.49±0.32)和(0.53±0.45、0.85±0.29、0.73±0.50、0.72±0.25、0.56±0.29)(均P<0.05)。此外,与野生型对照组小鼠相比,野生型模型组小鼠血清总IgE、OVA sIgE和OVA sIgG1水平也升高,分别为[(1 216.00±572.70)ng/ml、(597.00±538.30)ng/ml、1.59±0.09]和[(24.22±35.04)ng/ml、(20.01±41.71)ng/ml、1.16±0.03](均P<0.05)。在模型组中,Langerin-KO小鼠较野生型小鼠耳部皮肤红斑、肿胀、表皮增厚及真皮炎症细胞浸润更显著,耳部皮损中Tslp、Il4、Il13、Il17a和Il22的 mRNA表达进一步上调(8.19±6.44、2.53±0.69、2.82±0.73、3.94±1.32、3.80±1.43)(均P<0.05),血清总IgE、OVA sIgE、OVA sIgG1水平进一步升高[(2 508.00±657.10)ng/ml、(1 808.00±470.70 ng/ml)、(1.73±0.09)(均P<0.05)],颈部引流淋巴结中CD4+CD25+CD127-Treg细胞比例下降,分别为(13.25±0.96)%和(15.31±1.47)%(P<0.05)。
Langerin参与介导AD小鼠模型的经皮致敏并发挥负向免疫调控作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
朗格罕斯细胞(Langerhans cells,LCs)是存在于表皮内的树突状细胞(dendritic cells,DCs),在维持皮肤稳态中起关键作用,可能在介导特应性皮炎(atopic dermatitis,AD)经皮致敏过程中发挥重要的免疫调控作用[1]。Langerin是LCs上特征性表达的C型凝集素受体(C-type lectin receptor,CLR),可以结合和识别多种过敏原抗原[2, 3]。研究发现,虽然AD皮损处LCs数量无明显增加,但向外穿透紧密连接的树突数量明显增多,并且树突远端的Langerin表达量明显增多[4];衍生于脐带血造血干细胞的LCs可通过Langerin识别及摄取尘螨等过敏原并活化[5],在静息状态下参与介导LCs的致免疫耐受作用[6]。由此可见,Langerin在参与LCs经皮识别和结合过敏原的过程中扮演重要角色,但在疾病状态下的具体作用及机制尚不明确。本研究旨在探讨Langerin在介导AD炎症过程中的关键作用,以期能有针对性地调节LCs的活性和功能,从而为AD的预防和治疗提供新方向。
1.实验动物:6~10周龄、无特定病原体级雌性野生型C57BL/6小鼠[动物质量合格证编号SYXK(苏)2016-0011,动物使用许可证号SCXK(沪)2016-0004]购于北京维通利华公司,C57BL/6遗传背景下的Langerin基因敲除(Langerin knockout,Langerin-KO)小鼠来自于西班牙国家生物技术中心,饲养于南京医科大学动物实验中心。实验小鼠于22~24 ℃的室内温度饲养、传代,维持12 h的光/暗循环。
2. 主要试剂:卵清蛋白(ovalbumin,OVA)、胎牛血清(fetal bovine serum,FBS)和多聚甲醛为美国Sigma公司产品,卡泊三醇(Calcipotriol,MC903)购于丹麦利奥制药有限公司,无水乙醇、异丙醇和氯仿购于无锡亚盛化工有限公司,Trizol购于美国Invitrogen公司,DEPC水购于碧云天生物技术有限公司,1640培养基为以色列Biological industries公司,1×磷酸盐缓冲液(phosphate buffered saline,PBS)购于杭州四季青公司,3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB)显色液购于欣博盛生物公司,Tween-20购于华美生物工程公司,IgE检测试剂盒、IgG1检测试剂盒、IgG2a检测试剂盒购于美国BD公司,异硫氢酸荧光素(fluorescein isothiocyanate,FITC)抗鼠CD4、PE抗鼠CD25、别藻青蛋白(allophycocyanin,APC)抗鼠CD127流式抗体购于美国Biolegend公司,小鼠FcR blocking抗体购于德国Miltenyi公司,小鼠PCR引物由上海生工生物工程有限公司合成,逆转录试剂盒(PrimeScrift RT Master Mix)购于日本TAKARA公司,实时荧光定量PCR试剂盒(AceQ qPCR SYBR Green Master Mix)购于南京诺唯赞生物科技有限公司。
1.Langerin缺失小鼠鉴定:选择周龄为4周的C57BL/6遗传背景下的Langerin-KO小鼠和野生型小鼠,取鼠尾组织提取DNA,选取特异性条带设计引物,通过PCR扩增并利用凝胶电泳鉴定Langerin-KO小鼠基因型,引物序列如表1。

Langerin引物序列
Langerin引物序列
| 基因 | 引物序列(5′-3′) |
|---|---|
| 5′ Langerin 野生型 | CATTTGTAGGGTGGGTGGATAGAT |
| 3′ Langerin 野生型 | GTTTGTCCACTGTGAAGTGCGC |
| 3′ Langerin CRE | ACATTGGATATCCTCCTGTGACCT |
2.AD小鼠模型构建:设置野生型对照组、野生型AD模型组、C57BL/6 遗传背景下的Langerin基因敲除小鼠对照组及AD模型组,每组使用6只6~10周龄小鼠:(1)AD模型组先在小鼠双侧耳部均匀涂抹MC903溶液各14.3 μl,再均匀涂抹OVA溶液各25 μl(OVA溶解于PBS中至20 g/L);(2)对照组外涂100%乙醇溶液各14.3 μl;每日1次,连续涂药12 d。于实验第14天拍摄小鼠耳部皮损照片并记录耳厚度变化情况,取小鼠颈部淋巴结、小鼠耳部皮损、小鼠尾静脉血等进行相应检测。
3.耳部肿胀程度检测:通过电子游标卡尺分别测量对照组和造模组第0和14天的耳厚度,每次测量均选取耳中部。
4.小鼠耳部皮损病理学分析:在4%多聚甲醛中固定24 h后对小鼠耳部皮损进行脱水、透化、浸蜡和石蜡包埋,然后制成切片,进行苏木精-伊红(hematoxylin and eosin,HE)染色评估小鼠耳部皮肤炎症细胞浸润情况。耳部组织病理学切片制备及染色由中国医学科学院皮肤病医院病理科专业技术人员操作。
5.酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测小鼠血清总IgE、OVA特异性IgE(specific IgE,sIgE)、OVA sIgG1和OVA sIgG2a水平:用1×PBS分别稀释纯化的大鼠抗小鼠IgE、IgG1、IgG2a抗体至1 μg/ml,OVA 2 μg/ml(检测OVA sIgE),OVA 10 μg/ml(检测OVA sIgG1和OVA sIgG2a),每孔100 μl包被于96孔酶标板上,4 ℃冰箱放置过夜,按照试剂盒说明书操作染色并终止反应,置于酶联免疫分析仪405 nm读取光密度A值,检测小鼠血清总IgE及OVA sIgE、OVA sIgG1和OVA sIgG2a水平。
6.实时荧光定量PCR检测小鼠耳部皮损炎症因子表达:小鼠耳部皮损提取RNA,逆转录后进行qPCR反应。通过检索美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)GenBank设计引物,内参照校准基因为β-肌动蛋白(mouse β-actin),目的基因表达量表示为2-ΔΔCT。引物序列如表2。

炎症因子引物序列
炎症因子引物序列
| 基因 | 正向引物(5′-3′) | 反向引物(5′-3′) |
|---|---|---|
| β-actin | GTGACGTTGACATCCGTAAAGA | GCCGGACTCATCGTACTCC |
| Tslp | ACGGATGGGGCTAACTTACAA | AGTCCTCGATTTGCTCGAACT |
| Ifnγ | ATGAACGCTACACACTGCATC | CCATCCTTTTGCCAGTTCCTC |
| Il4 | GGTCTCAACCCCCAGCTAGT | GCCGATGATCTCTCTCAAGTGAT |
| Il13 | CAGCCTCCCCGATACCAAAAT | GCGAAACAGTTGCTTTGTGTAG |
| Il17a | TCAGCGTGTCCAAACACTGAG | TGAGCAACATCACACAAGACC |
| Il22 | ATGAGTTTTTCCCTTATGGGGAC | GCTGGAAGTTGGACACCTCAA |
7.流式细胞术分析:取小鼠双侧颈部淋巴结置于40 μm滤膜上,用1 ml注射器底部研磨淋巴结,并用PBS反复冲洗并离心制备单细胞悬液。调整每管细胞数目为1×106/ml,注意设置空白管、单染管、多染管。多染管配色方案如下:CD4-FITC、CD25-PE、CD127-APC。每管各加入1 μl小鼠FcR blocking抗体避光孵育15 min,加入1 ml PBS离心弃上清后加入表面抗体4 ℃避光孵育20 min。加入1 ml PBS离心弃上清后加入300 μl PBS后涡旋混匀重悬,于BD FACS Calibur上机进行流式细胞检测,并通过FlowJo软件分析流式结果。
8.统计学分析:实验数据采用SPSS 13.0、Flowjo V10和GraphpadPrism 8.0.1软件进行统计分析,符合正态分布的定量资料的数据均以±s表示,两组间比较采用t检验进行统计。双侧检验,检验水准α=0.05。
1.耳部皮肤症状变化:造模第14天时,与对照组小鼠相比,模型组小鼠耳部皮肤出现红斑、肿胀、鳞屑,其中Langerin-KO小鼠较野生型小鼠耳部皮损炎症更显著(图1)。
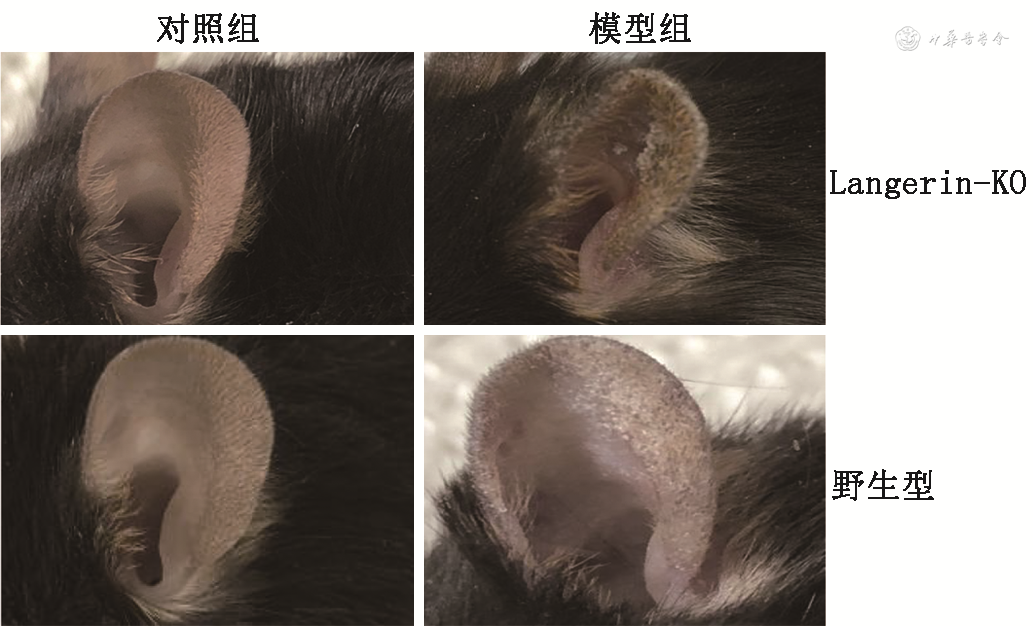

注:Langerin-KO为Langerin基因敲除小鼠;模型组先在小鼠双侧耳部均匀涂抹MC903溶液各14.3 μl,再均匀涂抹卵清蛋白(OVA)溶液各25 μl(OVA溶解于磷酸盐缓冲液中至20 g/L);对照组外涂100%乙醇溶液各14.3 μl;每日1次,连续涂药12 d建立特应性皮炎小鼠模型
2.耳部肿胀程度变化:造模前,Langerin-KO小鼠与野生型小鼠相比耳厚度差异无统计学意义(0.17±0.02和0.17±0.02;t=0.17,P=0.869)。造模后,野生型小鼠模型组耳厚度高于对照组(0.35±0.03和0.18±0.02;t=19.64,P<0.001);模型组中Langerin-KO小鼠较野生型小鼠耳厚度增加(0.39±0.03和0.35±0.03;t=3.54,P=0.002)。
3.耳部皮肤组织病理学变化:与野生型对照组小鼠相比,野生型模型组小鼠耳部皮损表皮厚度增加,真皮有炎症细胞浸润;而模型组中Langerin-KO小鼠较野生型小鼠耳部皮损表皮增厚,真皮嗜酸性粒细胞浸润明显(33.68±5.81和23.15±5.27;t=2.68,P=0.036)。见图2。
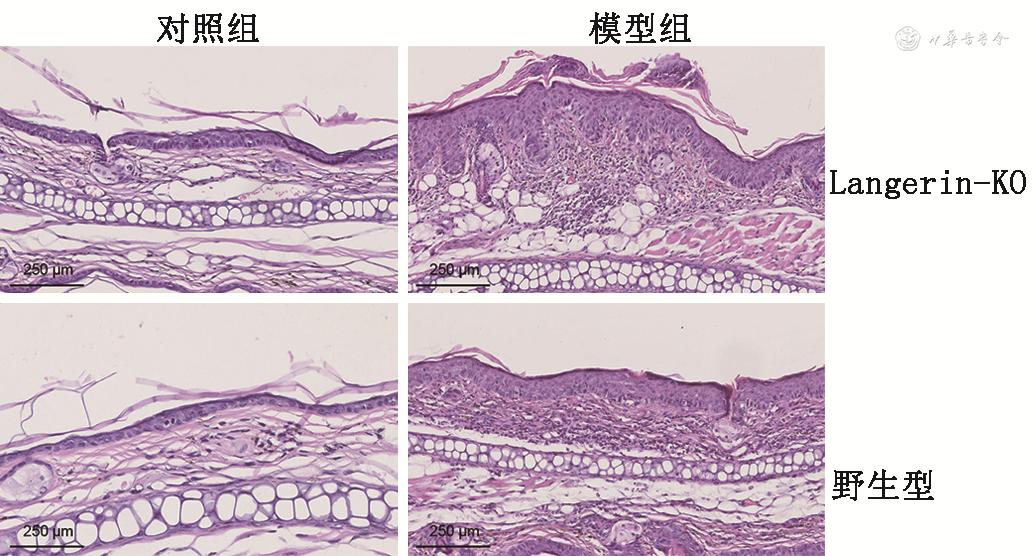

注:Langerin-KO为Langerin基因敲除小鼠
实时荧光定量PCR结果显示,野生型小鼠模型组Tslp、Il4、Il13、Il17a和Il22的mRNA水平(1.80±0.66、1.64±0.25、1.71±0.54、2.41±0.23和2.49±0.32)均较对照组(0.53±0.45、0.85±0.29、0.73±0.50、0.72±0.25和0.56±0.29)上调(t值分别为3.89、4.46、2.55、11.75、10.39,P值分别为0.003、0.002、0.043、<0.001、<0.001);Langerin-KO小鼠模型组上述细胞因子的表达水平(8.19±6.44、2.53±0.69、2.82±0.73、3.94±1.32、3.80±1.43)均较对照组(0.60±0.32、0.56±0.37、0.36±0.38、0.52±0.37、0.52±0.45)上调(t值分别为2.88、6.25、5.87、6.17、4.91,P值分别为0.016、<0.001、0.002、<0.001、0.001)。模型组中Langerin-KO小鼠上述细胞因子的表达(8.19±6.44、2.53±0.69、2.82±0.73、3.94±1.32、3.80±1.43)高于野生型小鼠(t值分别为2.42、2.44、2.50、2.59、2.87,P值分别为0.036、0.038、0.047、0.036、0.013),但Ifnγ在野生型小鼠及Langerin-KO小鼠模型组与对照组间差异无统计学意义(t值分别为0.17、1.85,P值分别为0.868、0.108)。结果说明,Langerin缺失的AD小鼠耳部皮损中Th2(Tslp、Il4、Il13)、Th17(Il17a)和Th22(Il22)型细胞因子的表达下降。
ELISA结果显示,野生型小鼠模型组体内Th2型免疫反应相关的血清总IgE、OVA sIgE和OVA sIgG1的水平[(1 216.00±572.70)ng/ml、(597.00±538.30)ng/ml、1.59±0.09]均较对照组[(24.22±35.04)ng/ml、(20.01±41.71)ng/ml、1.16±0.03]升高(t值分别为4.73、2.43、7.86,P值分别为0.002、0.045、<0.001);Langerin-KO小鼠模型组体内Th2型免疫反应相关的血清总IgE、OVA sIgE和OVA sIgG1的水平[(2 508.00±657.10)ng/ml、(1 808.00±470.70)ng/ml、1.73±0.09]均较对照组[(60.07±57.65)ng/ml、(19.36±18.03)ng/ml、0.97±0.34]升高(t值分别为7.67、8.65、5.77,P值均<0.001);而模型组中Langerin-KO小鼠上述免疫球蛋白的表达水平[(2 508.00±657.10)ng/ml、(1 808.00±470.70)ng/ml、1.73±0.09]均较野生型小鼠上调(t值分别为2.78、3.39、3.01,P值分别为0.039、0.015、0.011);Th1型免疫反应相关的OVA sIgG2a水平在野生型小鼠及Langerin-KO小鼠模型组与对照组间差异无统计学意义(t值分别为1.95、1.82,P值分别为0.080、0.119);表明AD模型中Langerin-KO小鼠较野生型小鼠血清中的Th2型免疫反应降低。
小鼠颈部引流淋巴结流式细胞术检测结果显示,野生型小鼠模型组颈部淋巴结中CD4+CD25+CD127-Treg细胞比例(15.31±1.47)%较对照组(11.41±1.28)%上调(t=5.79,P<0.001);Langerin-KO小鼠模型组颈部淋巴结中CD4+CD25+CD127-Treg细胞比例(13.25±0.96)%较对照组(11.00±1.72)%上调(t=3.06,P=0.011);而模型组中Langerin-KO小鼠Treg细胞的比例(13.25±0.96)%较野生型小鼠下降(t=3.37,P=0.004)。结果表明,Langerin缺失后AD小鼠颈部引流淋巴结中诱导的Treg细胞比例下调(图3)。
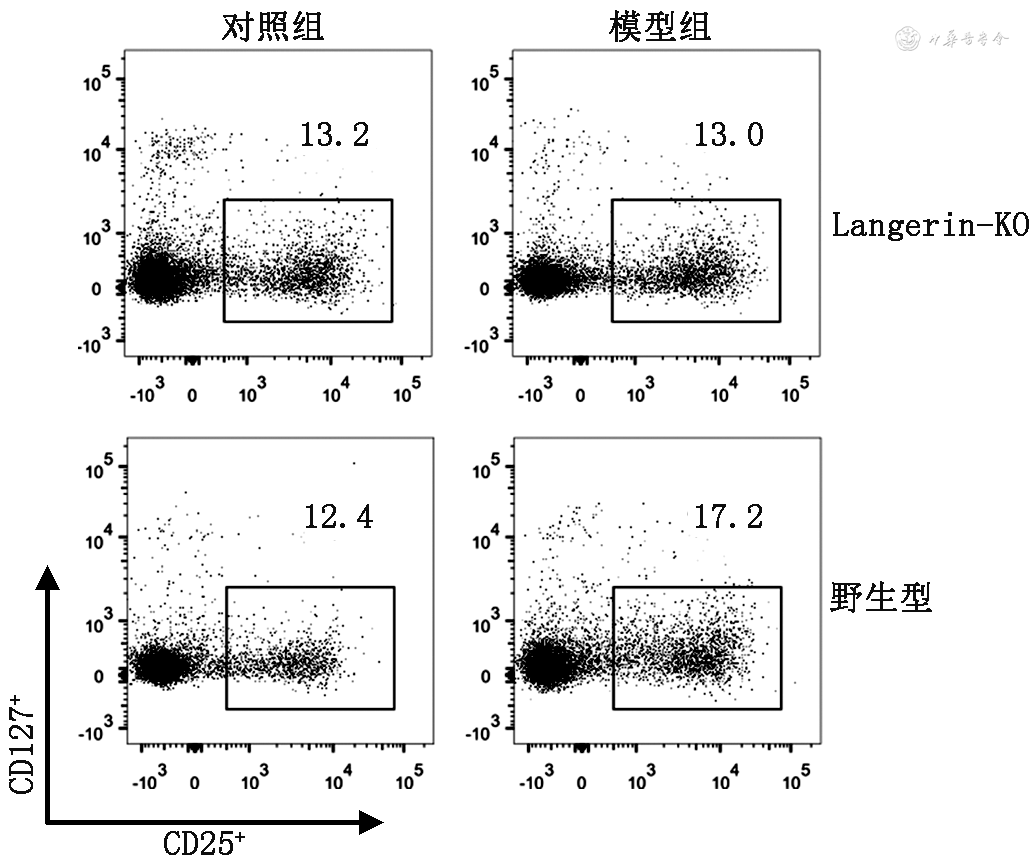

注:Langerin-KO为Langerin基因敲除小鼠
AD是一种常见的伴发终生的慢性过敏性炎症性疾病,患者常伴有过敏性鼻炎、哮喘等其他过敏性疾病,还与炎症性肠病和心血管疾病等其他炎症性疾病相关[7, 8],严重影响了患者的生活质量。遗传、环境因素、皮肤屏障功能异常和以Th2细胞为主的免疫炎症反应参与AD的发病,其中皮肤屏障功能异常和经皮致敏是AD发生发展的关键始动环节[9, 10]。现有的研究证据显示,过敏原经皮可诱导皮肤内的DCs,进而诱导过敏原特异性T细胞活化和靶器官内趋化和居留,使机体处于致敏状态[11]。研究虽然有一定的发现,但经皮致敏的确切机制仍不清楚。
LCs是表皮中最主要的DCs,作为重要的免疫屏障,参与了过敏原的经皮免疫反应[4]。既往研究显示LCs启动了适应性免疫应答,参与了接触性超敏反应(contact hypersensitivity,CHS)的敏化作用[12]。近年来通过利用选择性缺失LCs的Langerin-DTA和Langerin-DTR模式小鼠进行研究,发现LCs具有重要的致免疫耐受作用[6]。Bobr等[13]发现,当LCs和Langerin+DCs均缺失时,CHS减弱,当仅LCs缺失时,CHS反应增强,表明LCs对CHS反应起抑制作用。研究还发现,LCs可通过促进IL-10分泌、上调Treg细胞水平、诱导T细胞的无反应性和克隆删除等途径发挥致耐受作用[6,14]。但以往的研究主要集中在下游的分子机制,上游感知外界刺激和介导活化机制尚不明确。
Langerin是LCs细胞表面特征性表达的CLR,是参与形成Birbeck颗粒的关键分子[15]。研究发现,LCs表面的Langerin可以结合并内吞人类免疫缺陷病毒-1、单纯疱疹病毒和麻风杆菌等多种微生物,并将抗原递呈给CD4+和CD8+T细胞,从而诱导机体产生保护性免疫反应[16, 17]。Langerin还可识别过敏原及自身抗原,介导免疫耐受反应,如融合有OVA抗原的抗Langerin抗体可有效靶向LCs,介导机体产生针对OVA抗原的致耐受免疫应答[18];LCs可通过Langerin识别和摄取钙黏蛋白桥粒芯糖蛋白3(desmoglein 3,Dsg3),上调IL-2并诱导抗原特异性Treg细胞扩增[3]。课题组前期研究结果提示,AD患者皮肤中存在Langerin的异常表达,Langerin可与尘螨和OVA等过敏原抗原结合[5],Langerin可能在介导LCs致耐受功能的上游环节中发挥重要作用。本研究发现,造模后Langerin-KO小鼠较野生型小鼠耳部皮损红斑、鳞屑、肿胀更显著;小鼠耳部皮损中炎性细胞因子Tslp、Il4、Il13、Il17A和Il22的mRNA表达均升高;小鼠血清中Th2型免疫应答相关的总IgE、OVA sIgE和OVA sIgG1的表达水平均明显上调。以上结果提示Langerin参与了过敏原诱导的AD小鼠模型的经皮致敏过程,对小鼠皮肤和系统炎症均发挥了重要的负向免疫调控作用。此外,造模后Langerin-KO小鼠颈部引流淋巴结中可能具有致耐受作用的Treg细胞百分比较野生型小鼠显著下降,进一步证明Langerin可能通过诱导Treg细胞扩增发挥负向免疫调控作用。
综上,Langerin基因敲除后OVA联合MC903诱导的AD小鼠模型皮肤和系统炎症加重,Langerin可能是LC对外界过敏原发挥致耐受作用的关键分子,但具体分子机制有待进一步探究。本研究为揭示Langerin与AD的关系,研究调控AD的新策略提供了新的理论依据。
徐蓓蕾, 凌诗琪, 张宇, 等. Langerin参与介导特应性皮炎小鼠模型经皮致敏的研究[J]. 中华医学杂志, 2023, 103(38): 3041-3046. DOI: 10.3760/cma.j.cn112137-20230724-00084.
所有作者声明不存在利益冲突



























