
细胞外基质是肿瘤微环境的重要组成部分,而硬度是细胞外基质最主要的机械特性之一,硬度的改变能够影响肿瘤的生物学行为。本文主要介绍了细胞外基质的微观基础、细胞外基质硬度的调控机制、细胞外基质硬度对肿瘤耐药性的影响及其机制,更好地了解这些特性,有助于后续深入研究细胞外基质硬度对肿瘤耐药的调控机制。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性肿瘤目前仍然是影响人类健康的重要原因之一,据统计,全球范围内2020年有1 930万恶性肿瘤新发病例和近1 000万恶性肿瘤死亡病例[1]。虽然目前已有很多针对恶性肿瘤的药物或非药物治疗方法,极大地延长了恶性肿瘤患者的生存期,但是由于长期治疗或基因差异带来的治疗耐药仍然是一个亟须解决的问题。关于恶性肿瘤产生耐药性的机制尚不明确,已有的研究表明这一现象可能与药物靶蛋白和药物转运蛋白表达水平的改变、抗凋亡、DNA损伤修复、代谢重编程等机制相关。除此之外,细胞外基质(ECM)在近些年也被发现与肿瘤的耐药相关。
ECM是由细胞分泌到细胞外间质中的大分子物质构成的网状结构,这些大分子物质包括胶原蛋白、弹性蛋白、蛋白多糖、糖蛋白等。这种网状结构是维持正常组织和器官稳态的支架,同时也是在肿瘤发生发展过程中起到关键作用的肿瘤微环境的重要组成部分[2]。越来越多的研究发现ECM可以通过与肿瘤细胞或间质细胞之间的相互作用启动不同的信号通路,促进肿瘤的生长与转移[3]。除了组成ECM的大分子物质之外,机械性质的改变也是ECM发挥作用的重要媒介,包括硬度、应力、张力、孔隙率等,其中,ECM的硬度在肿瘤发生和发展,特别是耐药性的产生中的作用受到了越来越多的关注。
基于此,本文总结了ECM硬度对肿瘤耐药性影响的最新研究进展,并对ECM硬度研究的发展未来以及目前遇到的困难进行了探讨。
1.ECM的组成与作用:ECM中的组分往往会随着肿瘤的发生以及阶段进展而发生相应的变化。胶原蛋白是肿瘤中最丰富且被研究最多的ECM组分,迄今为止已经发现了28种不同的胶原蛋白。它们都有一个共同特征,即基本分子由三股螺旋构成,然后可以螺旋化形成纤维。胶原蛋白可以自发地组装成原纤维、膜或者凝胶,以此为肿瘤提供结构支持,而胶原蛋白的含量和排列方式与许多肿瘤的预后相关[4]。
弹性蛋白是寿命最长的蛋白质之一,也是ECM的另一个重要组成分子,其组装而成的弹性纤维是一种较大的ECM结构,主要存在于需反复拉伸的组织中。在许多恶性肿瘤中,重塑后的ECM会表达高水平的弹性蛋白,而弹性蛋白降解会导致弹性蛋白衍生多肽的产生,进一步调节肿瘤的生物学行为。
透明质酸是ECM中多糖的主要成分,也是ECM的所有组分中最大的分子,因此在ECM中起到了框架的作用[5]。由于大部分组织中都同时含有透明质酸合成酶与透明质酸酶,因此透明质酸总是处于生物合成和水解之间的动态平衡,通过不同合成和水解速率,促进肿瘤进展。
层粘连蛋白是糖蛋白的一种,是组成基底膜的成分,起到固定基底细胞的作用。在肿瘤中,基底膜的破坏或黏附性丧失是肿瘤侵袭的主要特征。因此,层粘连蛋白表达水平升高及其异常分布与肿瘤侵袭性和预后不良有关[6]。
2. ECM的机械性质:当ECM中的不同分子以有序的方式组合在一起时,结构多样的ECM组分会导致基质呈现出不同的机械性质,例如胶原蛋白水平的提高会增加ECM的硬度,这些性质对于调节细胞行为至关重要。硬度作为一种生物标志物,主要的检测方法分为两大类,应用较多的是成像类检测,包括超声、三维超声、弹性超声、磁共振成像等,主要应用于临床,侧重于检出阳性病变的敏感度及特异性,另一类则是机械方法,包括原子力显微镜、纳米压痕等,主要应用于实验室,侧重于通过对组织施加可控的机械力并测量样品的反馈,从而计算出准确的硬度测量值。健康与疾病状态的同一器官的ECM可能表现出完全不同的硬度,例如,绝大多数的肝细胞癌(HCC)都发生在肝硬化的基础上,而随着肝硬化的发生,肝脏硬度可以从2.5 kPa(1 mmHg=0.133 kPa)增加到75.5 kPa[7]。即使是在相同肿瘤的不同疾病阶段,基质硬度也会发生变化。Gleason评分是评估前列腺癌恶性程度的常用指标,根据该评分将前列腺癌患者分为高评分组与低评分组后发现,高评分组的前列腺癌硬度高于低评分组[8]。除了基质硬度的变化外,疾病的进展也可导致组织应对拉伸、剪切的能力改变。
3.ECM硬度的调控机制:ECM中胶原蛋白和弹性蛋白的水平是影响ECM硬度的主要因素,任何与其合成或降解相关的机制都能够调控ECM硬度,因此,可以降解胶原蛋白的基质金属蛋白酶(MMP)及其抑制剂在ECM硬度的调控过程中发挥了重要作用。热休克蛋白47(HSP47)是一种分子伴侣蛋白,在前胶原合成过程中至关重要,较高的HSP47水平会增加胶原蛋白的分泌,进一步提高ECM硬度。
ECM中蛋白的交联程度和排列方式也会影响硬度。在ECM中促进胶原蛋白与弹性蛋白共价交联的主要酶类是赖氨酰氧化酶(LOX),研究表明霍奇金淋巴瘤可以通过高表达LOX增加其微环境的硬度[9]。
ECM硬度的变化还与间质细胞息息相关。肿瘤相关成纤维细胞(CAF)是肿瘤微环境中一种特殊的间质细胞[10],由CAF分泌的MMP可以降解胶原蛋白以重塑基质,在口腔鳞状细胞癌中,CAF可以通过高表达LOX重塑基质胶原微环境,增加基质硬度[11]。
ECM硬化对肿瘤耐药性的影响是个非常复杂的过程(图1),细胞外基质硬度的增加可以通过以下几种途径影响肿瘤耐药:(1)调节多药耐药蛋白的表达;(2)维持肿瘤干细胞的特性;(3)调控细胞凋亡的发生;(4)上皮间质转化(EMT);(5)细胞内连接蛋白(YAP)相关信号通路;(6)整合素相关信号通路;(7)调节细胞的自噬水平。然而在不同情况下ECM硬度的变化对肿瘤耐药的影响各不相同。
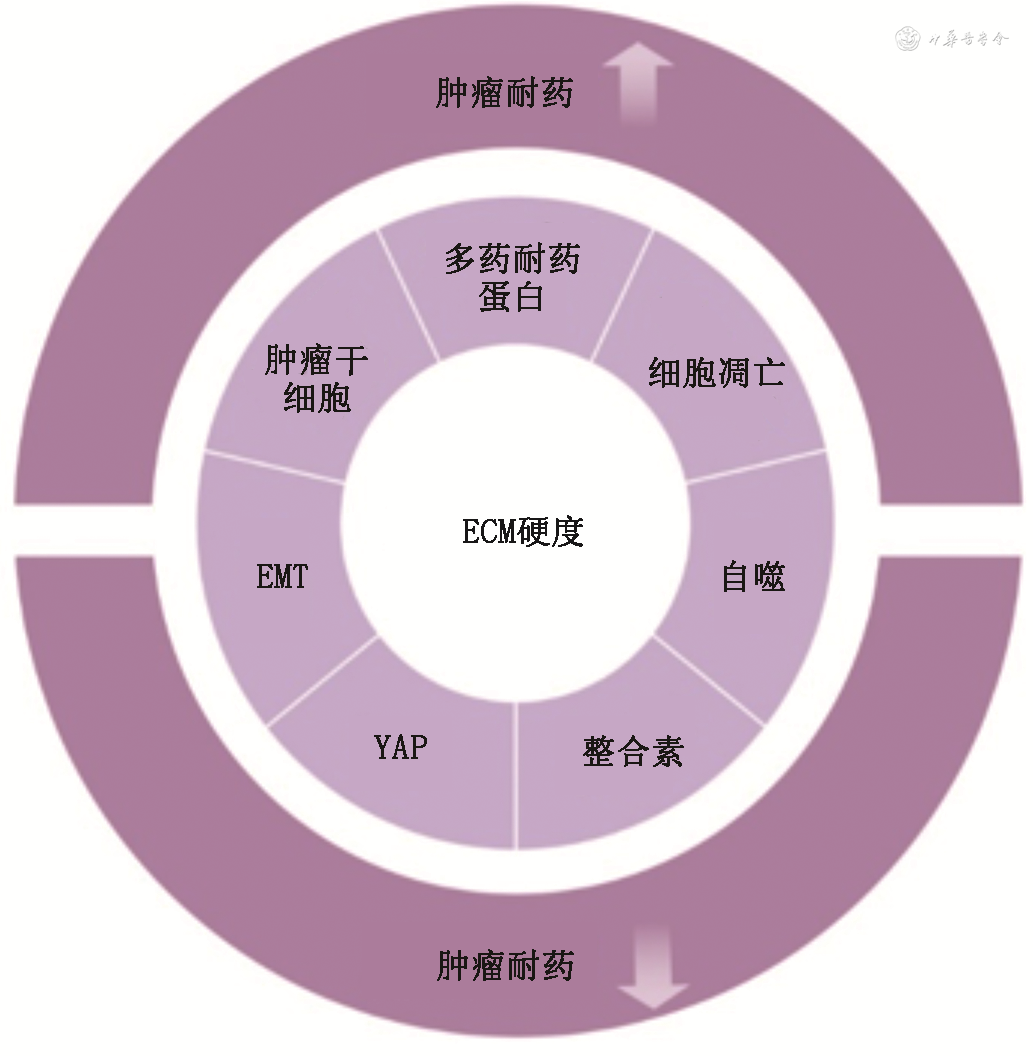

注:EMT为上皮间质转化;YAP为细胞内连接蛋白
不同肿瘤对药物的敏感性受ECM硬度影响的方式与结果有所不同。大多数肿瘤随着ECM硬度的增高呈现出药物抵抗的趋势,对于胰腺癌而言,ECM硬化可以诱导EMT从而降低胰腺癌对紫杉醇的敏感性,或是通过降低细胞增殖进而降低吉西他滨对胰腺癌的功效。在HCC中,ECM硬化同样可以促进肿瘤耐药,在高硬度底物上培养的肿瘤细胞在顺铂的作用下产生的细胞凋亡明显少于在低硬度底物上培养的肿瘤细胞。索拉非尼是晚期HCC的一线全身治疗药物之一,早期已有研究发现在硬化的ECM环境中,由于整合素/应激活化蛋白激酶(JNK)信号的激活,HCC对索拉非尼的敏感性下降,近期又有研究表明,硬化的ECM可以下调HCC中金属还原酶的表达,进而抑制索拉非尼介导HCC铁死亡的作用,间接导致HCC对索拉非尼的药物抵抗[12]。
通过应用模拟多形性胶质母细胞瘤(GBM)ECM环境的多空壳聚糖透明质酸支架对GBM细胞进行3D培养后发现,高硬度支架培养下的GBM细胞对替莫唑胺的敏感性更低,这可能和多药物转运蛋白与缺氧诱导因子-1(HIF-1)α等耐药相关基因的表达上调有关,并且这一趋势不随着体外模型的变化而改变,即使应用其他类型的3D水凝胶,高硬度条件培养下的GBM细胞仍然表现出了对替莫唑胺的耐药性[13]。此外,胃癌相关的CAF中表达上调的钙调蛋白1可以通过激活ROCK1/MLC通路,从而在胃癌中重编程ECM,使ECM硬化,而硬化的ECM进一步激活YAP,促进YAP的核转位,介导了胃癌对5-氟尿嘧啶(5-Fu)的抗性[14]。
然而也有部分肿瘤呈现出与上述情况相反的趋势,例如有文献报道,低硬度底物可以在骨肉瘤中诱导miR-29下调并增加Spin1表达从而激活磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)和Stat3信号通路,进而导致骨肉瘤对多柔比星的耐药[15]。造成这种差异的原因可能与肿瘤本身所处的细胞外基质环境不同有关。
由于涉及许多不同的机制,即使同种肿瘤对不同药物的应答效果在ECM硬化的作用下也会发生不同的变化,其中研究最多的是乳腺癌。在高硬度环境下,乳腺癌中CD16+的CAF亚群可以通过增加ECM硬度导致血管压缩,减少药物输送,从而减弱曲妥珠单抗的治疗作用[16]。在低硬度环境下,三阴性乳腺癌细胞可能由于核因子(NF)-κB活性升高和JNK活性下降而对化疗产生耐药性[17]。自噬也是肿瘤耐药的重要机制之一,而低硬度的ECM可以通过整合素信号通路下调乳腺癌细胞的自噬水平,从而增加乳腺癌细胞对他莫昔芬的治疗反应[18]。乳腺癌对多柔比星的敏感性在不同的研究之间结果略有差异,一致的是,ECM硬度的增加会使得乳腺癌对多柔比星更为敏感,但过低的ECM硬度可能同样会导致敏感性的上升,似乎ECM硬度只有处在一个合适的中间值时才会最大程度地表现出对多柔比星的抵抗作用。此外,在卵巢癌中,先前的研究发现在高硬度环境下的卵巢癌细胞具有对顺铂诱导的细胞凋亡的抵抗性[19],然而随后的研究却发现,在低硬度环境下,卵巢癌细胞中两种转运蛋白表达上升,并进一步导致了卵巢癌细胞对顺铂和紫杉醇的耐药[20],这种差异可能是由体外模型与所使用的细胞系的不同带来的,这也更体现了癌细胞在适应ECM硬度变化的过程中的可塑性。
ECM作为肿瘤生长与迁移的支架,在硬度增加的过程中会触发机械转导信号,影响肿瘤的生物学行为,而ECM硬度对癌症的生物物理影响可能会干扰药物输送和肿瘤对药物的敏感性,因此对其机制进行研究显得尤为重要。
目前的研究体现了肿瘤在ECM硬度改变时对药物敏感性变化的可塑性,不同的肿瘤或是不同的药物对ECM硬度的响应结果不同,这可能与肿瘤本身所处微环境、药物作用机制、研究中所使用不同硬度条件的培养模型的差异有关,但这也为后续靶向ECM硬度的抗肿瘤治疗的研究增加了难度。目前针对ECM硬度的研究工作主要是基于水凝胶体系来模拟ECM的不同硬度,其中,聚丙烯酰胺凝胶和聚二甲基硅氧烷(PDMS)的化学性质简单、易于生产且成本低的特点,使其成为易于制备的材料。目前,在聚丙烯酰胺凝胶或PDMS等材料上进行二维细胞培养并且通过原子力学显微镜对其弹性模量进行表征已成为基质硬度在肿瘤领域研究的重要方法。但是这种水凝胶模型仅能进行二维培养,不含有天然ECM环境中的各种成分,且不具有天然ECM的非线性力学特点,因此无法很好地模拟天然ECM环境。与此同时,现阶段也仍然缺乏通用且有效的用于模拟不同ECM硬度的动物模型,在肝细胞癌中,可以通过腹腔注射四氯化碳改变小鼠肝脏硬度用于模拟不同的ECM硬度,但该方法不适用于其他肿瘤的研究。因此对目前研究模型的改良以及全新模型的探索仍然是ECM硬度领域研究的一大难题。
由于ECM硬化与诸多肿瘤的发展以及耐药相关,因此,靶向ECM硬度的治疗策略是未来很有前景的研究领域。如前所述,整合素及YAP相关信号通路是肿瘤与ECM的互相作用中重要的机械传感器,目前已有部分相关的抑制剂在临床前试验中取得了预期结果。其中,整合素的选择性抑制剂西仑吉肽在Ⅱ期临床试验中表现出了对晚期非小细胞肺癌与多西紫杉醇相似的疗效,但Ⅲ期临床试验结果表明西仑吉肽不会改善替莫唑胺对胶质母细胞瘤的疗效。其他机械传导相关通路抑制剂均暂未在临床试验中取得更好成果。因此逆转ECM硬化有望在将来于临床上提高抗肿瘤治疗效果。随着人们对ECM硬度机械传导的深入研究,会有更多相关机制被发现,也将会有更多有临床应用希望的药物被开发用于治疗肿瘤。
陈家浩, 夏术阶. 细胞外基质硬度对肿瘤耐药性影响及其作用机制的研究进展[J]. 中华医学杂志, 2023, 103(38): 3062-3065. DOI: 10.3760/cma.j.cn112137-20230529-00879.
所有作者声明不存在利益冲突



























