
分析不同靶点重复经颅磁刺激(rTMS)治疗震颤型帕金森病(PD)的疗效。
前瞻性收集2020年4月1日至2021年3月31日就诊于上海交通大学医学院附属新华医院神经内科门诊的原发性PD患者,依据主要运动障碍临床特征选择震颤型(TD)82例入组,受试者按1∶1∶1比例根据试验随机编码的序列分为3组,即初级运动皮质区(M1)组26例、小脑组26例和双靶点(M1、小脑)组30例,每组均给予相应靶点1 Hz低频刺激,每天治疗1次,每周治疗5 d,持续治疗2周,共10次;所有组的常规药物治疗期间剂量保持不变。治疗前、治疗后2周在患者未服药状态下进行统一PD评定量表(UPDRS)、PD生活质量问卷-39(PDQ-39)评定,并测量皮质兴奋性即经颅磁刺激运动诱发电位(TMS-MEP)[包括静息运动阈值(rMT)和活动运动阈值(aMT)检查]、“起立-行走”计时测试(TUG)及肌电图震颤分析检查。
82例患者,男39例,女43例,年龄(67±8)岁。治疗前,3组患者的评价指标差异均无统计学意义(均P>0.05)。治疗后双靶点组的UPDRS-Ⅲ评分[(38.9±2.5)分 比(29.2±3.6)分]、UPDRS-震颤子评分[(23.7±2.1)分比(14.6±3.1)分]、TUG时间[(44.8±3.1)s比(33.7±4.1)s]、震颤波幅(480±126)μV比(276±94)μV、PDQ-39评分[(51±13)分比(45±13)分]、rMT[(36±17)%比(43±13)%]、aMT[(26±16)%比(31±12)%],与治疗前比较差异均有统计学意义(均P<0.01),而M1组和小脑组上述各指标差异均无统计学意义(均P>0.05)。震颤峰频率3组治疗前后差异均无统计学意义(均P>0.05)。
双靶点低频rTMS能改善PD震颤,而M1或小脑低频rTMS对PD震颤改善不明显,其机制可能是通过调节皮质兴奋性从而改善PD震颤症状。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
帕金森病(Parkinson′s disease,PD)是常见的慢性进展性神经系统变性疾病,临床上主要表现为静止性震颤、肌强直、动作迟缓和姿势障碍。左旋多巴替代疗法一直被认为是PD最经典的治疗方法,随病程进展和左旋多巴用量的增加,PD患者可出现运动并发症(症状波动和异动症),运动并发症削弱了药物治疗效果,降低PD患者生活质量[1],同时也增加照料者的负担[2]。因此临床需要寻找更有效治疗PD的方法。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种无痛、无创电生理技术,利用时变的脉冲磁场对特定脑皮质部位给予重复刺激,引起神经元兴奋性改变,调节大脑皮质相关功能。近年来荟萃分析显示,rTMS对PD的运动症状均有改善[3],但对PD患者静止性震颤的治疗研究相对较少,现有少量的研究表明,rTMS刺激初级运动皮质(primary motor cortex,M1)或刺激辅助运动区(supplementarymotor area,SMA)对震颤疗效欠佳。可能是震颤的皮质回路兴奋性与强直少动的兴奋性不一致[4]。考虑到小脑的过度活跃也与PD静止性震颤有关[5],本研究设计了双靶点(M1联合小脑)、M1和小脑3组,旨在探索双靶点和单靶点(M1或小脑)rTMS分别对震颤型PD的疗效。
前瞻性收集2020年4月1日至2021年3月31日就诊于上海交通大学医学院附属新华医院神经内科门诊的原发性PD患者。
入组标准:(1)PD诊断依照2015年MDS诊断标准,即满足[PD综合征+无绝对排除标准+≥2条支持性标准+无警示征象(red flags)][6];(2)年龄45~85岁,病程处于修订的Hoehn‐Yahr(H‐Y)分级≤3级的PD患者;(3)正在接受抗帕金森药物治疗并且症状已控制稳定,近2个月无药物种类及剂量调整。
排除标准:(1)患有其他神经系统疾病如脑血管病、癫痫等或严重心、肝、肺、肾等内科疾病;(2)存在精神症状以及认知障碍等影响试验配合度的疾病;(3)孕妇、哺乳期及可能妊娠者;(4)头颅内有金属异物、心脏起搏器者、有耳蜗植入物者。
样本量的计算:由于既往没有类似研究,因此本研究参考既往经颅磁刺激(TMS)相关随机对照试验(RCT)研究文献样本量,取α=0.05,β=0.2,利用G*Power软件计算为68例,考虑到可能有20%的脱落率因素,因此样本量确定为82例。
PD患者依据主要运动障碍临床特征为震颤型(tremor dominant,TD)的共82例(参照文献方法[7]分型:平均震颤得分/平均少动强直得分≥2为TD型)。本研究通过上海交通大学医学院附属新华医院医学伦理委员会批准(批号:XHEC‐C‐2020‐037‐3),所有受试者均被提前告知具体试验流程,对研究的目的及内容充分知情,并由受试者本人或其亲属签署知情同意书。
1.分组:82例患者按1∶1∶1比例根据试验随机编码的序列分为3组,即M1组(26例)、小脑组(26例)和双靶点组(30例)。
2. rTMS治疗:rTMS治疗采用武汉奥赛福医疗科技有限公司生产的OSF-3D型,该设备配置了两个一样的圆形刺激线圈,线圈直径为12.5 cm,两个线圈可同时产生刺激,产生的最大磁场强度均为3 T。
M1组患者的刺激区域为症状严重侧肢体对侧M1区,TMS线圈置于M1区(参照国际脑电10-20系统,左侧M1为C3,右侧M1为C4)。小脑组患者的刺激区域为症状严重侧肢体同侧小脑外侧区(位于枕骨隆突外侧3 cm和下方1 cm处),TMS线圈置于小脑外侧区。单靶点治疗模式[8]为低频rTMS:以1 Hz低频刺激,磁场强度为110% rMT,100个序列,每序列持续10 s 10个脉冲,序列间隔2 s,共1 000个脉冲,每天治疗1次,每周治疗5 d,持续治疗2周,共10次[9]。双靶点组刺激方式参考了文献[10]的设计,刺激区域为症状严重侧肢体对侧M1区及症状严重侧肢体同侧小脑外侧区,同时对侧M1区及同侧小脑外侧区刺激,治疗模式为低频rTMS:以1 Hz低频刺激,磁场强度为110% rMT,每侧为50个序列,每序列持续10 s 10个脉冲,序列间隔2 s,共1 000个脉冲,每天治疗1次,每周治疗5 d,持续治疗2周,共10次。
3. 相关量表评定:(1)入组患者治疗前及治疗后2周采用统一PD评定量表(unified Parkinson′s disease rating scale,UPDRS)进行评估,评测选未服药状态“关”期进行(患者评测前12 h暂停抗PD药物),修订的H‐Y分级评估患者的病情严重程度。平均震颤得分由UPDRS-Ⅲ的第20项和第26项评分总和(包括单个子项目的数量,共7项)除以7计算得出。这些UPDRS项目评估日常生活活动部分的震颤程度。平均少动强直得分由UPDRS的第18、19、22、27~31项评分之和(包括单个子项目的数量,共12项)除以12计算得出。这些项目评估言语、面部表情、僵硬、运动迟缓、站立能力、姿势、步态和姿势稳定性。平均震颤得分/平均少动强直得分≥2为TD型。(2)生活质量评估采用中文版PD生活质量问卷-39(39 item Parkinson′s disease questionnaire,PDQ-39)[11]评估PD患者生活质量情况,该问卷涉及了行动能力、日常生活、情绪、羞耻感、社会支持、认知、交流、疼痛8个维度,得分越高表述患者生活质量越差。
4. 经颅磁刺激运动诱发电位(transcranial magnetic stimulation-motor evoked potentials,TMS-MEP):(1)静息运动阈值(resting motor threshold,rMT)的测定:试验过程中受试者戴着有弹性、能紧贴头部的基于国际脑电10-20系统设计的定位帽(武汉依瑞德医疗设备新技术有限公司生产),TMS线圈置于定位帽上记录肢体对侧大脑皮质手运动区(即国际脑电10-20系统C3、C4区),记录肢体为症状严重侧肢体,用刺激仪器刺激皮质手运动区,在患侧上肢拇短展肌上记录运动诱发电位,记录电极贴于拇短展肌肌腹,参考电极置于远心端拇短展肌肌腱,地线贴于腕部。调整输出强度,在患者手指M1诱发出在10 次连续的刺激中至少有5次50 μV 以上的诱发电位时的最小刺激强度为rMT,rMT的110%即为该患者rTMS的刺激强度。入组患者治疗前及治疗后2周检测。(2)活动运动阈值(active motor threshold,aMT)的测定:采用电子握力计进行握力检测,检测肢体为症状严重侧肢体,测量其最大握力(maximum voluntary contraction,MVC),受检者的被测手使用20% MVC做拇指与示指对指动作,在患者手指M1诱发出刺激下,记录对侧肢体处于收缩时拇短展肌MEP,在10 次刺激中至少有5次可使拇短展肌产生>200 μV波幅MEP的最小磁刺激强度为aMT。入组患者治疗前及治疗后2周检测。
5.“起立-行走”计时测试(timed up and go test,TUG):TUG测试参考Chung等[12]描述的方法进行,记录患者从起身、行走7 m、转身到重新坐下所用的时间,测试2次,取2次所用时间的平均值,两次测试之间患者休息2 min后再进行测试。入组患者治疗前及治疗后2周进行测试。
6. 肌电图震颤分析:(1)仪器及检查方法采用肌电图仪Nicolet EDX 6(美国尼高力公司)对所有研究对象行肌电图震颤分析检查,该仪器包括4对肌电图表面电极及2个压阻加速器(灵敏度:100 μV/D,扫描速度:100 ms/D,肌电低频滤波:10.0 Hz,高频率波:10.0 kHz;加速器低频滤波:0.5 Hz,高频率波:30 Hz)。检查时记录电极置于震颤严重侧肢体的前臂尺侧腕屈肌和尺侧腕伸肌肌腹处,参考电极分别置于相应远端肌腱处,压阻加速器分别置于双手背侧第三掌指关节近端2 cm。之后在静止、姿势两种状态下采集数据:①静止:患者坐在有扶手的椅子上,前臂分别置于双侧扶手上,手腕完全放松,自然下垂;②姿势:患者双手向前平举,手腕伸直。每种姿势记录时间为30 s。(2)数据分析:采用国际认可的震颤分析软件TRAS系统(美国尼高力公司)对震颤进行数据分析。该系统对震颤数据进行傅里叶转换,形成1~30 Hz频谱图,以最大的波峰所处的频率作为震颤的峰频率。(3)观测指标:静止性震颤的主峰频率、波幅。入组患者治疗前及治疗后2周进行检测。
采用SPSS 26.0对数据进行统计学处理。对计量资料首先进行正态性检验,符合正态分布的计量资料使用表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验,同组患者治疗前后比较采用配对t检验。计数资料用例数表示,组间比较采用χ²检验。双侧检验,检验水准α=0.05。
82例震颤型PD患者中男39例,女43例,年龄(67±8)岁。3组患者在年龄、性别、教育程度、服药时间及H-Y分级等方面比较差异无统计学意义,具有可比性(表1),震颤特征见表2。
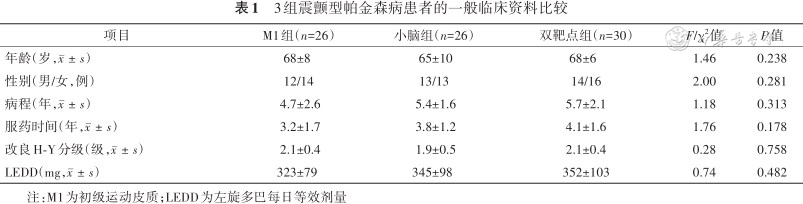
3组震颤型帕金森病患者的一般临床资料比较
3组震颤型帕金森病患者的一般临床资料比较
| 项目 | M1组(n=26) | 小脑组(n=26) | 双靶点组(n=30) | F/χ2值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁,) | 68±8 | 65±10 | 68±6 | 1.46 | 0.238 |
| 性别(男/女,例) | 12/14 | 13/13 | 14/16 | 2.00 | 0.281 |
| 病程(年,) | 4.7±2.6 | 5.4±1.6 | 5.7±2.1 | 1.18 | 0.313 |
| 服药时间(年,) | 3.2±1.7 | 3.8±1.2 | 4.1±1.6 | 1.76 | 0.178 |
| 改良H-Y分级(级,) | 2.1±0.4 | 1.9±0.5 | 2.1±0.4 | 0.28 | 0.758 |
| LEDD(mg,) | 323±79 | 345±98 | 352±103 | 0.74 | 0.482 |
注:M1为初级运动皮质;LEDD为左旋多巴每日等效剂量
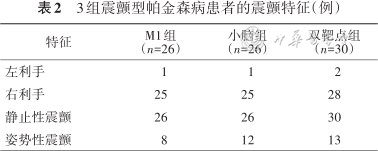
3组震颤型帕金森病患者的震颤特征(例)
3组震颤型帕金森病患者的震颤特征(例)
| 特征 | M1组(n=26) | 小脑组(n=26) | 双靶点组(n=30) |
|---|---|---|---|
| 左利手 | 1 | 1 | 2 |
| 右利手 | 25 | 25 | 28 |
| 静止性震颤 | 26 | 26 | 30 |
| 姿势性震颤 | 8 | 12 | 13 |
所有患者均完成整个治疗。3组治疗结束后,UPDRS-Ⅲ评分变化如表3所示,治疗前3组患者UPDRS-Ⅲ评分组间差异无统计学意义(P=0.801),治疗后差异有统计学意义(P<0.001)。治疗后双靶点组UPDRS-Ⅲ评分与治疗前比较有明显降低(t=22.49,P<0.01),M1组、小脑组UPDRS-Ⅲ评分与治疗前比较变化不明显(均P>0.05)。进一步分析,UPDRS-Ⅲ中的震颤子评分,治疗后双靶点组评分显著低于治疗前(t=23.34,P<0.01),而M1组、小脑组评分与治疗前比较变化不明显(均P>0.05)。同时,治疗后双靶点组UPDRS-Ⅲ评分及震颤子评分显著低于M1组及小脑组(均P<0.01)。
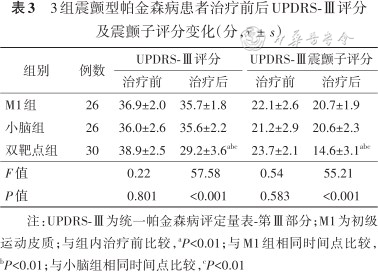
3组震颤型帕金森病患者治疗前后UPDRS-Ⅲ评分及震颤子评分变化(分,)
3组震颤型帕金森病患者治疗前后UPDRS-Ⅲ评分及震颤子评分变化(分,)
| 组别 | 例数 | UPDRS-Ⅲ评分 | UPDRS-Ⅲ震颤子评分 | ||
|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| M1组 | 26 | 36.9±2.0 | 35.7±1.8 | 22.1±2.6 | 20.7±1.9 |
| 小脑组 | 26 | 36.0±2.6 | 35.6±2.2 | 21.2±2.9 | 20.6±2.3 |
| 双靶点组 | 30 | 38.9±2.5 | 29.2±3.6abc | 23.7±2.1 | 14.6±3.1abc |
| F值 | 0.22 | 57.58 | 0.54 | 55.21 | |
| P值 | 0.801 | <0.001 | 0.583 | <0.001 | |
注:UPDRS-Ⅲ为统一帕金森病评定量表-第Ⅲ部分;M1为初级运动皮质;与组内治疗前比较,aP<0.01;与M1组相同时间点比较,bP<0.01;与小脑组相同时间点比较,cP<0.01
3组患者经rTMS治疗前TUG用时组间差异无统计学意义(F=0.52,P=0.599),治疗后差异有统计学意义(F=32.05,P<0.001)。治疗后双靶点组TUG用时[(33.7±4.1)s]较治疗前[(44.8±3.1)s]明显降低(t=13.81;P<0.01),M1组、小脑组TUG用时[(42.9±6.3)s、(41.9±3.2)s]与治疗前[(45.6±3.2)s、(44.5±2.7)s]比较变化不明显(均P>0.05)。进一步分析,治疗后双靶点组TUG用时显著低于M1组及小脑组(均P<0.01)。
3组经rTMS治疗结束后,经肌电图震颤分析比较,治疗前3组患者静止性震颤的波幅组间差异无统计学意义(P=0.599),治疗后差异有统计学意义(P<0.001)。治疗后双靶点组静止性震颤的波幅与治疗前比较有明显降低(t=4.54,P<0.01),M1组、小脑组震颤的波幅与治疗前比较变化不明显(均P>0.05)。进一步分析,治疗后双靶点组静止性震颤的波幅显著低于M1组及小脑组(均P<0.01)。各组治疗前后的静止性震颤峰频率差异无统计学意义(均P>0.05)(表4)。
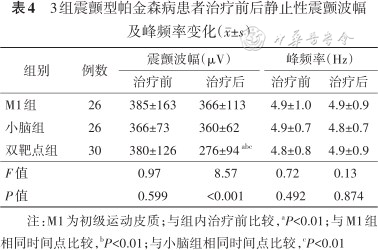
3组震颤型帕金森病患者治疗前后静止性震颤波幅及峰频率变化(±s)
3组震颤型帕金森病患者治疗前后静止性震颤波幅及峰频率变化(±s)
| 组别 | 例数 | 震颤波幅(μV) | 峰频率(Hz) | ||
|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| M1组 | 26 | 385±163 | 366±113 | 4.9±1.0 | 4.9±0.9 |
| 小脑组 | 26 | 366±73 | 360±62 | 4.9±0.7 | 4.8±0.7 |
| 双靶点组 | 30 | 380±126 | 276±94 abc | 4.8±0.8 | 4.9±0.9 |
| F值 | 0.97 | 8.57 | 0.72 | 0.13 | |
| P值 | 0.599 | <0.001 | 0.492 | 0.874 | |
注:M1为初级运动皮质;与组内治疗前比较,aP<0.01;与M1组相同时间点比较,bP<0.01;与小脑组相同时间点比较,cP<0.01
3组患者经rTMS治疗前组间差异无统计学意义(F=0.22,P=0.801),治疗后组间差异有统计学意义(F=57.58,P<0.001)。治疗后双靶点组PDQ-39评分[(45±13)分]与治疗前[(51±13)分]比较有明显降低(t=22.49,P<0.01),M1组、小脑组PDQ-39评分[(50±12)分、(50±12)分]与治疗前[(52±12)分、(51±12)分]比较变化不明显(均P>0.05)。进一步分析,治疗后双靶点组PDQ-39评分显著低于M1组及小脑组(均P<0.01)。
所有PD患者治疗前后均进行了TMS-MEP测定rMT和aMT(表5)。治疗前3组患者rMT、aMT组间差异均无统计学意义(均P>0.05),治疗后组间差异均有统计学意义(P=0.003、0.004)。治疗后双靶点组rMT、aMT与治疗前比较有明显降低(t=-4.21、-11.94,均P<0.01);M1组、小脑组rMT、aMT与治疗前比较变化不明显(均P>0.05)。进一步分析,治疗后双靶点组rMT、aMT显著低于M1组及小脑组(均P<0.01)。
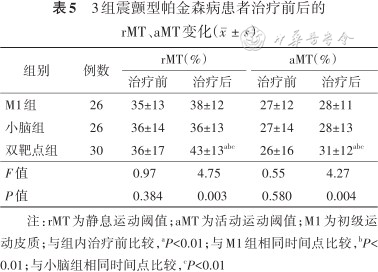
3组震颤型帕金森病患者治疗前后的rMT、aMT变化()
3组震颤型帕金森病患者治疗前后的rMT、aMT变化()
| 组别 | 例数 | rMT(%) | aMT(%) | ||
|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| M1组 | 26 | 35±13 | 38±12 | 27±12 | 28±11 |
| 小脑组 | 26 | 36±14 | 36±13 | 27±14 | 28±13 |
| 双靶点组 | 30 | 36±17 | 43±13abc | 26±16 | 31±12abc |
| F值 | 0.97 | 4.75 | 0.55 | 4.27 | |
| P值 | 0.384 | 0.003 | 0.580 | 0.004 | |
注:rMT为静息运动阈值;aMT为活动运动阈值;M1为初级运动皮质;与组内治疗前比较,aP<0.01;与M1组相同时间点比较,bP<0.01;与小脑组相同时间点比较,cP<0.01
PD起病隐匿,而长期的药物治疗会产生疗效减退、异动症等多种运动并发症。Pascual-Leone等[13]首次将rTMS用于PD患者进行对照试验,明显改善了PD患者的运动症状。但rTMS治疗PD的机制不明,可能通过皮质-基底神经节-丘脑-皮质回路纠正基底神经节功能障碍。
然而,对于PD运动症状的改善,各研究结果并不一致。影响疗效的因素包括两方面:物理因素主要有刺激线圈和刺激模式,生物因素主要为靶区皮质。既往较多研究支持高频对PD运动症状的改善作用,如Byrs等[14]的研究发现M1区的高频rTMS能改善总UPDRS的评分,但震颤、步态或轴向症状中改善不明显;Lefaucheur[15]的研究也显示高频刺激能够改善强直和运动迟缓。Chung等[12]的研究则发现,在M1区低频rTMS能改善步态。Mi等[16]发现在SMA区的高频rTMS能够改善冻结步态。Urushidani等[17]的研究,rTMS可改善震颤及共济失调的运动症状。这些研究在rTMS方案(如高、低频)、靶点方面有所不同,疗效各不相同。这些结果表明不同的rTMS治疗靶点,对PD产生的治疗效果也不一样。
静止性震颤是PD典型的运动症状之一,主要影响手的精细运动,患者可能因此感到疲劳或出现步态不稳,从而影响日常社交行为[18],严重影响患者的生活质量。因此,本研究除了评估震颤评分及震颤幅度外,还评估了患者的TUG平均用时及PDQ-39生活质量量表。既往Hamada等[19]发现高频刺激对震颤没有太大改善,而王丽敏等[20]也发现低频刺激对震颤改善不明显。本研究也发现M1区和小脑的低频单靶点治疗震颤效果不佳,由于不同类型的PD的皮质回路兴奋性是不一样的,因此对不同类型的PD应采用不同的靶点区进行rTMS治疗。
一般认为,PD患者运动前区、顶叶通路的过度活跃被认为是对受损的近纹状体、内侧额叶投射活动缺乏的代偿[21],研究发现,小脑通过小脑-丘脑-皮质连接调节M1[22],在运动执行和运动控制中发挥重要作用。因此,本研究设计了针对M1和小脑的双靶点rTMS刺激,理论上低频rTMS刺激小脑浦肯野细胞,该细胞通过小脑深核和丘脑腹外侧核的中继通过双突触途径抑制M1,而对M1的低频rTMS刺激则直接抑制该处皮质的兴奋性。尽管理论低频rTMS刺激小脑可能抑制M1,但本研究发现单靶点刺激小脑后,rMT和aMT变化均不明显,提示单靶点刺激小脑尚不足以改变患者的皮质兴奋性,其机制不明,可能与脉冲个数或疗程相关。然而通过双靶点的低频rTMS刺激,治疗后的rMT和aMT均有明显提高,患者的皮质兴奋性发生了明显变化,临床震颤的症状得到了明显的改善,本研究认为双靶点的低频rTMS刺激能够通过调节皮质的兴奋性达到改善临床症状的目的。其分子机制目前尚不清楚,研究发现在M1区上的rTMS 可以诱导腹侧纹状体内源性多巴胺的释放[23]。本研究发现通过双靶点治疗后,患者的震颤幅度得到改善,同时患者的TUG平均用时及PDQ-39生活质量评分均获得改善,提示患者的震颤改善后,步态不稳及生活质量均可改善。
既往研究震颤改善往往仅采用量表评估,从而疗效的判定不易精确。因此,本研究通过震颤肌电图的波幅检测,能够更精确地评估震颤改善的幅度,因此震颤肌电图在震颤的疗效评估中是一种非常好的评价方式。
由于本研究目的是比较不同治疗靶点的疗效,采用了优效性试验设计,因此,单靶点组采用的刺激相当于安慰剂,并没有设立假刺激组。在今后的研究中,将设立假刺激组,并进一步扩大每组的样本量,同时结合功能影像学针对刺激的靶点进行更精准的选择,探索不同的刺激模式,期望在将来获得更佳的临床疗效及长期疗效。
戚辰, 赵嘉豪, 魏雅荣, 等. 不同靶点低频重复经颅磁刺激治疗震颤型帕金森病的疗效观察[J]. 中华医学杂志, 2023, 103(39): 3112-3118. DOI: 10.3760/cma.j.cn112137-20230629-01102.
所有作者声明不存在利益冲突



























