
分析影响不明原因消化道出血(OGIB)患者胶囊内镜(CE)检查后再出血的危险因素,构建再出血的预测模型。
回顾性收集2018年7月至2021年9月东南大学附属中大医院因OGIB行CE检查的患者的临床资料,通过查阅电子病历或进行电话随访。使用单因素和多因素Cox回归模型分析影响OGIB患者再出血的影响因素。确定最优预测模型,以列线图的形式展示。采用C统计量、校准曲线和决策曲线分析进行模型评价。
共纳入130例OGIB患者,女64例,男66例,年龄(55.8±17.2)岁(18~87岁),39例(30.0%)在随访期间发生再出血。单因素和多因素Cox回归模型分析提示OGIB病程>2周(HR=3.70,95%CI:1.85~7.42,P<0.001)、既往有消化道出血病史(HR=5.25,95%CI:2.00~13.81,P<0.001)、CE结果阳性(HR=3.72,95%CI:1.66~8.33,P=0.001)、CE前最低血红蛋白<80 g/L(HR=2.00,95%CI:1.02~3.84,P=0.044)是再出血的危险因素;而特异性治疗(HR=0.25,95%CI:0.11~0.54,P<0.001)是再出血的保护因素。以上5个预测因素的对应分值分别为:OGIB病程时间>2周:79分;既往消化道出血病史:100分;胶囊内镜结果阳性:79分;行特异性治疗:-85分;CE前最低血红蛋白<80 g/L:41分。由这5个变量构建的预测模型具有良好的区分度(C统计量=0.798,95%CI:0.732~0.865)。校准曲线显示,列线图的预测概率和实际观测概率间的一致性高。决策曲线显示,当阈值概率>0.04,使用列线图预测再出血比“所有患者均再出血或无患者再出血”的假设提供更大的净获益。
本研究构建的预测模型对OGIB患者CE检查后再出血具有良好的预测能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
消化道出血持续存在或反复发作,经胃镜、结肠镜检查和小肠影像学检查(包括小肠钡剂造影、CT小肠成像和小肠MRI)后仍不能明确病因的情况,称为不明原因消化道出血(obscure gastrointestinal bleeding,OGIB)[1]、中消化道出血(mid-gastrointestinal bleeding,MGIB)[2]或可疑小肠出血(suspected small-bowel bleeding,SSBB)[3]。OGIB占胃肠出血的5%~10%,其出血病灶多位于小肠,传统的小肠内镜和影像诊断方式常难以明确病灶。近年来,随着胶囊内镜(capsule endoscopy,CE)、气囊辅助小肠镜等内镜技术的飞速发展,更多的小肠出血病灶被明确诊断。CE可实现全小肠无创性、可视化检查,已被推荐作为OGIB的一线诊断工具[3],但CE对OGIB患者治疗方式的选择和预后的影响仍存在争议。OGIB的再出血率高(16.4%~41.7%)[4, 5],是临床实践中面临的严峻挑战。再出血是评估OGIB患者预后的重要因素,可增加患者的心理负担、医疗费用及死亡风险。目前国内外尚无公认的OGIB再出血的预测模型或评分系统。因此,研究影响OGIB再出血的临床和内镜特征,并构建预测模型具有重要临床意义。本研究旨在探索影响OGIB患者再出血的危险因素,构建再出血的预测模型,以辅助临床医生针对OGIB患者制定个体化治疗和随访方案。
随访研究。选取2018年7月至2021年9月入住东南大学附属中大医院消化内科,因OGIB行CE检查的患者。纳入标准:行CE检查后的OGIB的住院患者。OGIB出血类型可分为:(1)显性出血,即肉眼可见的出血,表现为黑便或血便;(2)隐性出血,表现为贫血和(或)粪便隐血试验阳性[6]。排除标准:(1)已知或怀疑的胃肠道梗阻;(2)严重的胃肠动力障碍(如贲门失弛缓症、胃轻瘫);(3)妊娠;(4)心脏起搏器或植入电子医疗器械。本研究获得东南大学附属中大医院临床研究伦理委员会批准(批文号:2022ZDSYLL326~P01),所有患者豁免知情同意。研究报告遵循改善观察性研究报告质量声明。
1. 仪器设备和操作方法:OMOM CE(重庆金山科技有限公司)和安翰CE(武汉安翰光电技术有限公司)均由胶囊、数据记录仪套件和影像阅读工作站三部分组成。所有CE图像都由2位有超过100例CE读片经验的胃肠病学专家独立阅读,对每1例患者的视频录像的结果达成共识意见后,再出具最终报告,并记录肠道清洁程度、全小肠检查率和CE结果。
2. 患者随访和数据收集:研究人员通过回顾病历资料和电话随访收集数据。包括:(1)患者基本信息:年龄、性别、吸烟史、饮酒史、手术史、既往有无消化道出血病史、合并症、CE检查前药物服用情况、CE检查后抗凝/抗栓药物方案变化、出血类型(显性或隐性)、OGIB病程时间、CE前输血量等。(2)实验室检查结果:CE前最低血红蛋白水平、血小板计数、凝血酶原时间、活化部分凝血酶原时间,D二聚体、血清尿素水平。(3)内镜相关指标:CE检查结果,肠道清洁准备评分,全小肠检查完成率。CE检测到的小肠病变根据标准实践指南[7]进行分类:与出血高度相关的病变(P2)、与出血可疑相关的病变(P1),以及与出血低度相关的病变(P0)。将P2病变定义为CE结果阳性,将P1、P0病变或未见任何异常病变定义为CE结果阴性。根据Min等[8]的报道,将肠道清洁程度分为“良好~非常好”和“一般~差”。(4)CE检查后诊治方案:分为特异性治疗和非特异性治疗[9]。特异性治疗包括:内镜下治疗、手术治疗、血管造影下血管栓塞止血术和特异性药物治疗。非特异性治疗是仅进行支持治疗(包括补充铁剂、输血等)或仅随访观察而不采取任何干预措施。(5)随访数据:记录患者的随访结局(再出血、删失)和随访时间。再出血被定义为在出血之后至少30 d后出现活动性出血(黑便或便血)、粪便隐血阳性、血红蛋白较基线下降20 g/L及需要输血的证据[9]。
采用SPSS 25.0软件和R语言(版本4.2.3)进行统计学分析。符合正态分布的连续变量的数据用表示;不符合正态分布的连续变量的数据用M(Q1,Q3)表示;分类变量的数据用例(%)表示。将单因素Cox回归分析中P<0.1的变量纳入多因素Cox回归模型中,采用向后瓦尔德变量筛选方法确定与再出血相关的变量,构建预测模型。采用净重新分类指数(net reclassification index,NRI)决定是否在模型中加入新变量。使用R软件包绘制该模型可视化的列线图[10]。采用Bootstrap重抽样法(1 000次抽样)减少模型的过拟合偏差,从区分度(C统计量)、校准度(校准曲线[10])和临床效用(决策曲线[11])3个方面评价模型的可靠性和临床适用价值。采用X-tile软件[12]筛选列线图总分的最佳阈值,将研究人群分为不同风险组。采用Kaplan-Meier法绘制不同风险组的生存曲线,并行log-rank检验。双侧检验,检验水准α=0.05。
从CE数据库中纳入155例因消化道出血而行CE检查的患者,剔除CE检查前已检测出上/下消化道可疑出血病灶的患者13例和12例失访患者,最终纳入130例患者。研究人群的基线特征见表1。年龄(55.8±17.2)岁(18~87岁),女64例,男66例。显性OGIB患者98例,隐性OGIB患者32例。随访时间为CE检查后18.7(9.0,25.0)个月。随访第6、12、24个月的累积再出血率分别17.0%、25.6%、31.2%(经生存分析所得)。共39例(30.0%)在随访期间出血,其中仅2例在CE检查24个月后(第25和46个月)发生再出血。CE阳性组再出血28例,CE阴性组再出血11例。CE检查的病灶类型分布、OGIB患者下一步诊疗措施和相应病变的再出血情况见表2。

行胶囊内镜(CE)检查的不明原因消化道出血(OGIB)患者的一般临床特征(n=130)
行胶囊内镜(CE)检查的不明原因消化道出血(OGIB)患者的一般临床特征(n=130)
| 项目 | 结果 |
|---|---|
| 女性[例(%)] | 64(49.2) |
| 年龄(岁,) | 55.8±17.2 |
| 合并症[例(%)] | |
| 高血压 | 44(33.8) |
| 糖尿病 | 13(10.0) |
| 慢性肾病 | 4(3.1) |
| 缺血性心脏病 | 14(10.8) |
| 脑梗死 | 15(11.5) |
| 慢性肝病 | 12(9.2) |
| 消化道出血史[例(%)] | 11(8.5) |
| CE前使用抗凝或抗栓药物[例(%)] | 23(17.7) |
| OGIB相关参数[例(%)] | |
| 显性OGIB | 98(75.4) |
| OGIB病程<2周 | 86(66.2) |
| 实验室检查 | |
| CE前最低血红蛋白(g/L,) | 97.8±29.2 |
| 血清尿素[mmol/L,M(Q1,Q3)] | 5.7(4.6,6.9) |
| 凝血酶原时间(s,) | 12.39±3.18 |
| 活化部分凝血酶原时间(s,) | 29.47±3.58 |
| D二聚体>500 μg/L[例(%)] | 39(30.0) |
| 红细胞输血量[U,M(Q1,Q3)] | 0.0(0.0,3.0) |
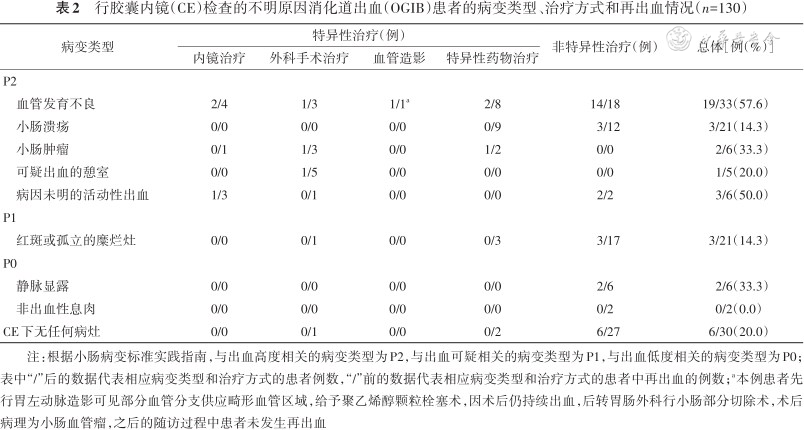
行胶囊内镜(CE)检查的不明原因消化道出血(OGIB)患者的病变类型、治疗方式和再出血情况(n=130)
行胶囊内镜(CE)检查的不明原因消化道出血(OGIB)患者的病变类型、治疗方式和再出血情况(n=130)
| 病变类型 | 特异性治疗(例) | 非特异性治疗(例) | 总体[例(%)] | |||
|---|---|---|---|---|---|---|
| 内镜治疗 | 外科手术治疗 | 血管造影 | 特异性药物治疗 | |||
| P2 | ||||||
| 血管发育不良 | 2/4 | 1/3 | 1/1a | 2/8 | 14/18 | 19/33(57.6) |
| 小肠溃疡 | 0/0 | 0/0 | 0/0 | 0/9 | 3/12 | 3/21(14.3) |
| 小肠肿瘤 | 0/1 | 1/3 | 0/0 | 1/2 | 0/0 | 2/6(33.3) |
| 可疑出血的憩室 | 0/0 | 1/5 | 0/0 | 0/0 | 0/0 | 1/5(20.0) |
| 病因未明的活动性出血 | 1/3 | 0/1 | 0/0 | 0/0 | 2/2 | 3/6(50.0) |
| P1 | ||||||
| 红斑或孤立的糜烂灶 | 0/0 | 0/1 | 0/0 | 0/3 | 3/17 | 3/21(14.3) |
| P0 | ||||||
| 静脉显露 | 0/0 | 0/0 | 0/0 | 0/0 | 2/6 | 2/6(33.3) |
| 非出血性息肉 | 0/0 | 0/0 | 0/0 | 0/0 | 0/2 | 0/2(0.0) |
| CE下无任何病灶 | 0/0 | 0/1 | 0/0 | 0/2 | 6/27 | 6/30(20.0) |
注:根据小肠病变标准实践指南,与出血高度相关的病变类型为P2,与出血可疑相关的病变类型为P1,与出血低度相关的病变类型为P0;表中“/”后的数据代表相应病变类型和治疗方式的患者例数,“/”前的数据代表相应病变类型和治疗方式的患者中再出血的例数;a本例患者先行胃左动脉造影可见部分血管分支供应畸形血管区域,给予聚乙烯醇颗粒栓塞术,因术后仍持续出血,后转胃肠外科行小肠部分切除术,术后病理为小肠血管瘤,之后的随访过程中患者未发生再出血
通过单因素Cox回归分析,从31个再出血候选因素中筛选出12个有意义的预测因素(P<0.1),即糖尿病、脑梗死、慢性肝病、既往消化道出血史、显性OGIB、OGIB病程>2周、CE前最低血红蛋白<80 g/L、肠道准备“良好~非常好”、CE结果阳性、特异性治疗、红细胞输血量>3 U、CE前使用抗凝或抗栓药物(表3)。进一步采用向后瓦尔德方法筛选的结果显示,CE前最低血红蛋白<80 g/L与再出血临界相关(P=0.066,表4)。OGIB病程>2周、既往有消化道出血病史、CE结果阳性是OGIB患者再出血的危险因素(P<0.05),特异性治疗是再出血的保护因素(P<0.05,表5)。
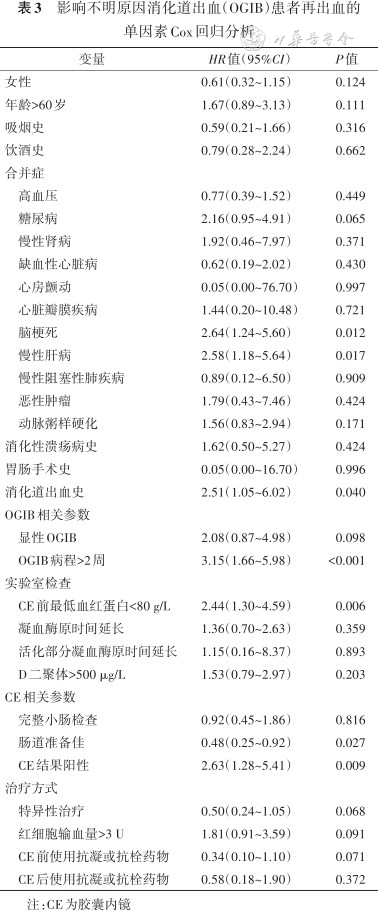
影响不明原因消化道出血(OGIB)患者再出血的单因素Cox回归分析
影响不明原因消化道出血(OGIB)患者再出血的单因素Cox回归分析
| 变量 | HR值(95%CI) | P值 |
|---|---|---|
| 女性 | 0.61(0.32~1.15) | 0.124 |
| 年龄>60岁 | 1.67(0.89~3.13) | 0.111 |
| 吸烟史 | 0.59(0.21~1.66) | 0.316 |
| 饮酒史 | 0.79(0.28~2.24) | 0.662 |
| 合并症 | ||
| 高血压 | 0.77(0.39~1.52) | 0.449 |
| 糖尿病 | 2.16(0.95~4.91) | 0.065 |
| 慢性肾病 | 1.92(0.46~7.97) | 0.371 |
| 缺血性心脏病 | 0.62(0.19~2.02) | 0.430 |
| 心房颤动 | 0.05(0.00~76.70) | 0.997 |
| 心脏瓣膜疾病 | 1.44(0.20~10.48) | 0.721 |
| 脑梗死 | 2.64(1.24~5.60) | 0.012 |
| 慢性肝病 | 2.58(1.18~5.64) | 0.017 |
| 慢性阻塞性肺疾病 | 0.89(0.12~6.50) | 0.909 |
| 恶性肿瘤 | 1.79(0.43~7.46) | 0.424 |
| 动脉粥样硬化 | 1.56(0.83~2.94) | 0.171 |
| 消化性溃疡病史 | 1.62(0.50~5.27) | 0.424 |
| 胃肠手术史 | 0.05(0.00~16.70) | 0.996 |
| 消化道出血史 | 2.51(1.05~6.02) | 0.040 |
| OGIB相关参数 | ||
| 显性OGIB | 2.08(0.87~4.98) | 0.098 |
| OGIB病程>2周 | 3.15(1.66~5.98) | <0.001 |
| 实验室检查 | ||
| CE前最低血红蛋白<80 g/L | 2.44(1.30~4.59) | 0.006 |
| 凝血酶原时间延长 | 1.36(0.70~2.63) | 0.359 |
| 活化部分凝血酶原时间延长 | 1.15(0.16~8.37) | 0.893 |
| D二聚体>500 μg/L | 1.53(0.79~2.97) | 0.203 |
| CE相关参数 | ||
| 完整小肠检查 | 0.92(0.45~1.86) | 0.816 |
| 肠道准备佳 | 0.48(0.25~0.92) | 0.027 |
| CE结果阳性 | 2.63(1.28~5.41) | 0.009 |
| 治疗方式 | ||
| 特异性治疗 | 0.50(0.24~1.05) | 0.068 |
| 红细胞输血量>3 U | 1.81(0.91~3.59) | 0.091 |
| CE前使用抗凝或抗栓药物 | 0.34(0.10~1.10) | 0.071 |
| CE后使用抗凝或抗栓药物 | 0.58(0.18~1.90) | 0.372 |
注:CE为胶囊内镜
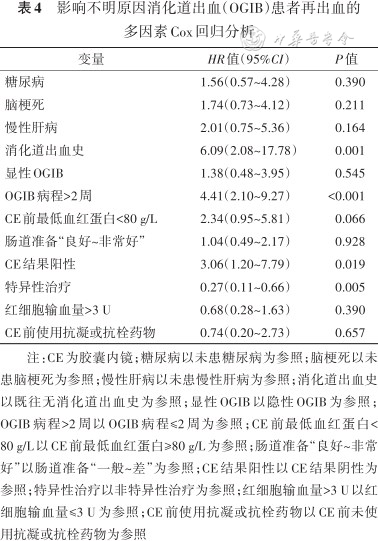
影响不明原因消化道出血(OGIB)患者再出血的多因素Cox回归分析
影响不明原因消化道出血(OGIB)患者再出血的多因素Cox回归分析
| 变量 | HR值(95%CI) | P值 |
|---|---|---|
| 糖尿病 | 1.56(0.57~4.28) | 0.390 |
| 脑梗死 | 1.74(0.73~4.12) | 0.211 |
| 慢性肝病 | 2.01(0.75~5.36) | 0.164 |
| 消化道出血史 | 6.09(2.08~17.78) | 0.001 |
| 显性OGIB | 1.38(0.48~3.95) | 0.545 |
| OGIB病程>2周 | 4.41(2.10~9.27) | <0.001 |
| CE前最低血红蛋白<80 g/L | 2.34(0.95~5.81) | 0.066 |
| 肠道准备“良好~非常好” | 1.04(0.49~2.17) | 0.928 |
| CE结果阳性 | 3.06(1.20~7.79) | 0.019 |
| 特异性治疗 | 0.27(0.11~0.66) | 0.005 |
| 红细胞输血量>3 U | 0.68(0.28~1.63) | 0.390 |
| CE前使用抗凝或抗栓药物 | 0.74(0.20~2.73) | 0.657 |
注:CE为胶囊内镜;糖尿病以未患糖尿病为参照;脑梗死以未患脑梗死为参照;慢性肝病以未患慢性肝病为参照;消化道出血史以既往无消化道出血史为参照;显性OGIB以隐性OGIB为参照;OGIB病程>2周以OGIB病程≤2周为参照;CE前最低血红蛋白<80 g/L以CE前最低血红蛋白≥80 g/L为参照;肠道准备“良好~非常好”以肠道准备“一般~差”为参照;CE结果阳性以CE结果阴性为参照;特异性治疗以非特异性治疗为参照;红细胞输血量>3 U以红细胞输血量≤3 U为参照;CE前使用抗凝或抗栓药物以CE前未使用抗凝或抗栓药物为参照
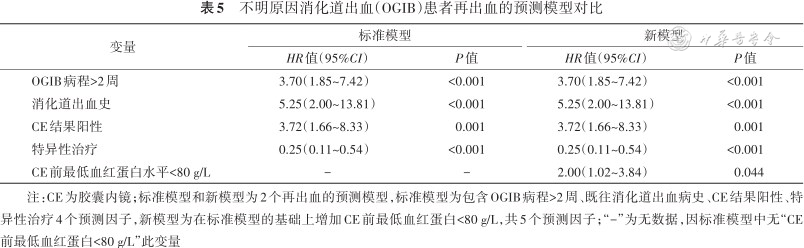
不明原因消化道出血(OGIB)患者再出血的预测模型对比
不明原因消化道出血(OGIB)患者再出血的预测模型对比
| 变量 | 标准模型 | 新模型 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| OGIB病程>2周 | 3.70(1.85~7.42) | <0.001 | 3.70(1.85~7.42) | <0.001 |
| 消化道出血史 | 5.25(2.00~13.81) | <0.001 | 5.25(2.00~13.81) | <0.001 |
| CE结果阳性 | 3.72(1.66~8.33) | 0.001 | 3.72(1.66~8.33) | 0.001 |
| 特异性治疗 | 0.25(0.11~0.54) | <0.001 | 0.25(0.11~0.54) | <0.001 |
| CE前最低血红蛋白水平<80 g/L | - | - | 2.00(1.02~3.84) | 0.044 |
注:CE为胶囊内镜;标准模型和新模型为2个再出血的预测模型,标准模型为包含OGIB病程>2周、既往消化道出血病史、CE结果阳性、特异性治疗4个预测因子,新模型为在标准模型的基础上增加CE前最低血红蛋白<80 g/L,共5个预测因子;“-”为无数据,因标准模型中无“CE前最低血红蛋白<80 g/L”此变量
为明确是否将CE前最低血红蛋白<80 g/L纳入到最终的预测模型,本研究构建和比较了2个再出血的预测模型:即标准模型(只包含OGIB病程>2周、既往消化道出血病史、CE结果阳性、特异性治疗4个预测因子)和新模型(在标准模型的基础上增加CE前最低血红蛋白<80 g/L,共5个预测因子,表5)。结果发现新模型比标准模型的C统计量[0.798(0.732,0.865)比0.770(0.693,0.846),P<0.05]和预测性能均改善(6、12和24个月的NRI分别为0.284、0.253和0.300,P<0.05)。因此,本研究将CE前最低血红蛋白<80 g/L纳入最终的再出血预测模型。结果显示:OGIB病程>2周(HR=3.70,95%CI:1.85~7.42,P<0.001)、既往有消化道出血病史(HR=5.25,95%CI:2.00~13.81,P<0.001)、CE结果阳性(HR=3.72,95%CI:1.66~8.33,P=0.001)、CE前最低血红蛋白<80 g/L(HR=2.00,95%CI:1.02~3.84,P=0.044)是再出血的危险因素;而特异性治疗(HR=0.25,95%CI:0.11~0.54,P<0.001)是再出血的保护因素。
根据筛选的独立预测因素,建立再出血Cox预测模型,并以列线图展示(图1)。5个预测因素的对应分值分别为:OGIB病程时间>2周:79分;既往消化道出血病史:100分;CE结果阳性:79分;行特异性治疗:-85分;CE前最低血红蛋白<80 g/L:41分。


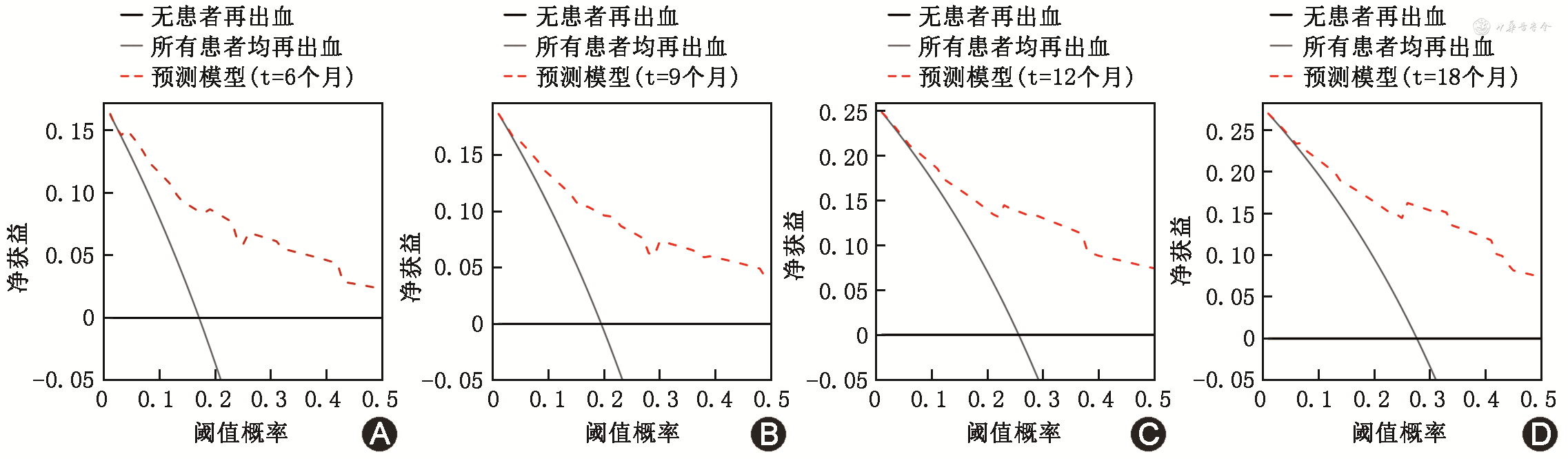
计算预测模型的C统计量为0.798(95%CI:0.732~0.865),即列线图正确预测OGIB患者发生再出血事件的概率为79.8%。校准曲线显示,列线图的预测概率和实际观测概率间的一致性高(图2)。决策曲线显示,当阈值概率>0.04,使用列线图预测再出血比“所有患者均再出血或无患者再出血”的假设提供更大的净获益(图3)。
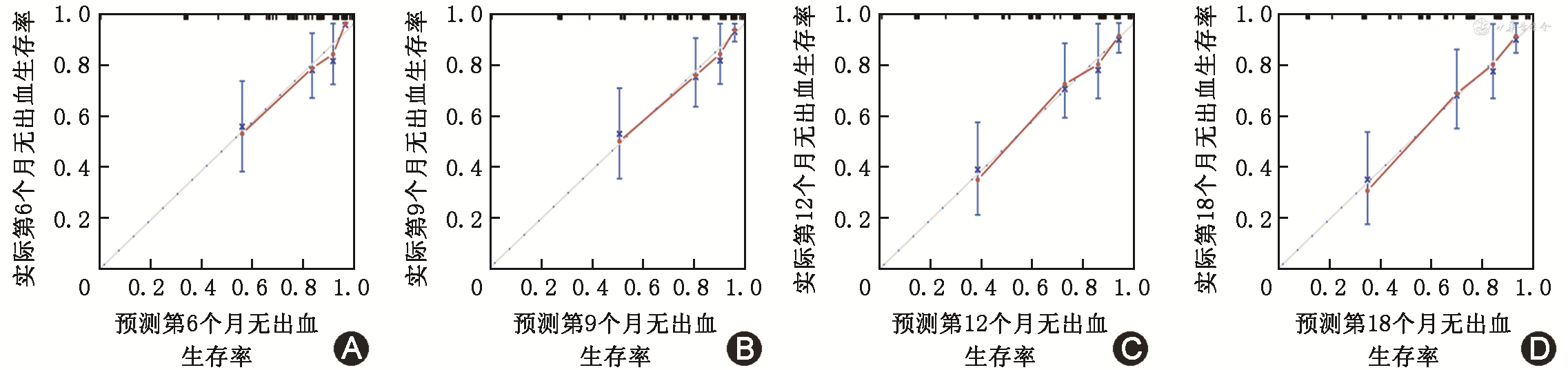

注:蓝色虚线代表模型理想预测能力,红色线代表模型实际预测能力,蓝色实线代表各组实际观测概率的95%CI

计算每例患者的列线图总分,通过X-tile软件选择最佳阈值(126分和226分),将研究人群分为:低危组(≤126分,62例),中危组(127~226分,52例),高危组(≥227分,16例)。通过Kaplan-Meier方法绘制危险分层的生存曲线(图4),采用log-rank比较3组间累积再出血率:中危组是低危组的4.43倍(95%CI:1.77~11.09);高危组是低危组的15.97倍(95%CI:5.98~42.60);中危组是高危组的0.28倍(95%CI:0.14~0.57),即高危组是中危组的3.57倍,组间差异均有统计学意义(均P<0.05)。高危组的中位生存时间为6.0(95%CI:4.7~7.3)个月。
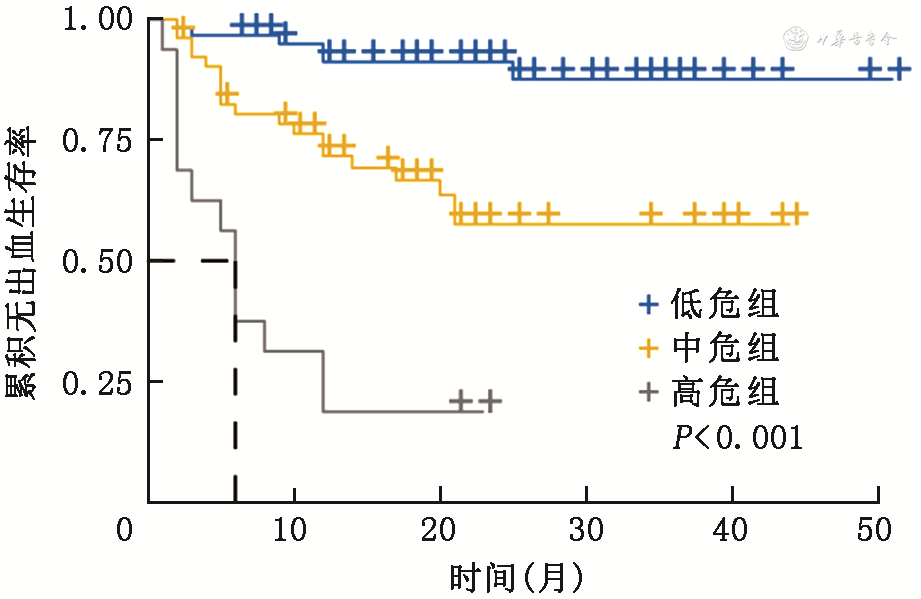

注:高危组为列线图总分≥227分的患者;中危组为列线图总分127~226分的患者;低危组为列线图总分≤126分的患者
本研究中OGIB患者再出血率30.0%,符合Otani等[4]和Riccioni等[5]报道的再出血率。仅2例患者在CE检查24个月以后发生再出血。这与Tan等[9]和虞竹雯等[13]的研究结果一致。本研究从OGIB患者的共31项临床和内镜特征中筛选出5个相关的预测因素纳入模型中。部分预测因素符合既往文献报道的OGIB患者再出血的危险因素。
本研究中CE阳性结果是OGIB患者发生再出血的危险因素,其再出血风险是CE阴性组的3.70倍。Lai等[14]和Niikura等[15]也报道了CE阳性结果与再出血相关。本研究中血管发育不良病变的再出血率较高(57.6%),病灶不明确的小肠活动性出血次之(50.0%),均高于其他类型阳性病灶和CE阴性患者的再出血率,这与刘慧芳和王孟春[16]、Mussetto等[17]的报道一致。因此,本研究推荐临床医生对于血管发育不良病变和病灶不明确的小肠活动性出血进行积极干预和密切随访。
根据2015年美国胃肠病学院的临床实践指南[18],对于CE阳性患者应进行特异性治疗,而CE阴性患者可随诊观察。本研究中,CE阳性组中39例(54.9%)进行特异性治疗,CE阴性组中7例(11.9%)进行特异性治疗。特异性治疗是OGIB患者再出血的保护因素。这与Tziatzios等[19]的研究结果一致。基于此,本研究建议对于有治疗指征的OGIB患者,在患者身体条件能耐受的情况下,尽量施行特异性治疗,以降低后期再出血风险。
Min等[8]发现“OGIB的病程时间>3个月”是OGIB患者再出血的危险因素。本研究根据数据特征,将OGIB患者分成“OGIB的持续时间≤2周”和“OGIB的持续时间>2周”两类。结果显示“OGIB的持续时间>2周”的患者发生再出血的风险是“OGIB的持续时间≤2周”患者的3.72倍。该结论符合欧洲胃肠道内窥镜学会的建议,即在OGIB出血发作后尽量在14 d内行CE[2]。CE阳性结果可指导进一步特异性治疗,从而解决出血病灶和改善患者的再出血预后。另外,既往有消化道出血史是本研究中的危险因素之一,与Wetwittayakhlang等[20]的报道一致。
血红蛋白水平作为重要的危险因素,被多项上消化道出血的预后评分系统引用[21, 22]。OGIB预后相关文献均评估血红蛋白水平的作用,结论不一致[23, 24]。本研究中,CE前最低血红蛋白<80 g/L在多因素Cox分析中与再出血临界相关。为进一步明确其作用,本研究分别构建标准模型和新模型,通过比较模型的C统计量和NRI,肯定了血红蛋白在预测OGIB再出血中的重要意义。
本研究仍存在一些局限性:首先,本研究为单中心回顾性研究,可能存在选择性偏倚;其次,研究队列中再出血事件39例,而模型中纳入了5个预测因子,尚未能满足“每个自变量的事件数”≥10的样本量计算经验法则[25],可能导致模型不稳定。因此,本研究拟进一步延长随访时间,并多中心收集病例,以调整和验证该预测模型的合理性。
综上,本研究基于Cox多因素预测模型创建了一个简易直观的列线图,包含的5个预测因子在不同人群中具有普适性,易于普及。根据该列线图,可以方便准确地预测所有CE检查后的OGIB患者不同时间的再出血概率,以便临床医生制定个体化治疗和随访方案。
唐夏姣, 李明月, 赵晓丹, 等. 不明原因消化道出血患者胶囊内镜检查后再出血的预测模型构建[J]. 中华医学杂志, 2023, 103(39): 3119-3126. DOI: 10.3760/cma.j.cn112137-20230513-00780.
所有作者声明不存在利益冲突



























