自2022年3月起,国外出现了跨洲的不明原因儿童严重急性肝炎流行,已有35个国家或地区报道了超过1 000例病例。其致病因素至今仍未完全确定,但提示腺相关病毒2型(AAV2)、人腺病毒和新型冠状病毒感染,以及相关管控措施所致婴幼儿和儿童的早期病原体暴露减少和免疫训练不足可能与其发生相关,且宿主遗传易感性在发病中的作用也不容忽视。回顾2022年全球性不明原因儿童严重急性肝炎的世界流行情况和临床症状,探讨最受关注的人腺病毒、AAV2、新型冠状病毒可能的致病机制,并从病毒流行情况和不同人群的遗传差异等角度进行分析,探讨我国出现不明原因儿童严重急性肝炎发生的可能性,未来应尽快厘清其发病机制并制订相应的诊疗措施和方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
与以往的零星病例不同,2022年出现的全球性不明原因儿童严重急性肝炎至今已在世界多个国家和地区报道了1 000余例,曾一度引起全球医药卫生学界的重点关注及社会层面的恐慌。这次不明原因儿童严重急性肝炎多见于0~10岁的儿童,可及的数据显示78%的患儿年龄<6岁,且患儿群体未出现明显的性别差异(48%为男性)[1]。其中病情严重者需要肝移植,并出现了至少22例死亡病例[1]。尽管在2022年5月后新发已呈下降趋势,但其尚未明确的病因和治疗方式依然引起种种隐忧。
本研究回顾2022年暴发的全球性不明原因儿童严重急性肝炎的流行趋势、临床症状,讨论分析可疑病原体腺相关病毒2型(adeno-associated virus 2,AAV2)、人腺病毒和新型冠状病毒的可能致病机制。推测可能的发病机制:新型冠状病毒感染封控措施导致早期对自然病原体接触不足的特定遗传背景幼儿,在感染AAV2、人腺病毒等后产生异常免疫反应,从而引起严重急性肝炎。此外,本研究通过对比国内外封控措施下幼儿人腺病毒感染率的不同和遗传差异,说明我国发生不明原因儿童严重急性肝炎的概率较小。
依照WHO的诊断标准,2022年全球性不明原因儿童严重急性肝炎疑似病例是指年龄<16岁的患者出现急性肝炎症状(排除甲型至戊型肝炎)且血清AST或ALT>500 IU/L,其最常出现的临床症状为恶心、呕吐(54%),黄疸(49%),全身无力(45%),以及腹痛(45%),也有少数患者出现发热和呼吸道症状[1]。
自2022年3月31日苏格兰公共卫生部接到警报发现5例3~5岁的儿童因不明原因严重急性肝炎入院以来[2],类似的病例相继出现在全球35个国家和地区,其中以2022年3月至5月报告的疑似诊断病例最多,此后明显减少[1]。截至2022年7月8日,WHO报道了约1 010例不明原因儿童肝炎和22例死亡病例,其中以欧洲和美洲的病例最多,分别为484例(48%)和334例(33%),西太平洋地区和东南亚则分别报道了70例(其中日本67例,新加坡3例)和19例[1]。而我国至今尚未出现不明原因儿童严重急性肝炎暴发的相关报道。
不明原因儿童严重急性肝炎初期整体呈散发趋势,病例间缺乏显著的流行病学关联和疫区旅行史特征,未见特征性的毒物、药品、食品和饮水等暴露史[3]。在致病病原体的溯源上,2022年5月英国和美国已有的数据发现患儿人腺病毒整体感染率为45%~77%,明显超出英国同年度0~4岁儿童中人腺病毒的感染率(2022年的峰值为13%),且肝移植患儿血中人腺病毒DNA更高,其中具有分型信息的毒株均为人腺病毒41亚型,因此一度怀疑该不明原因儿童严重急性肝炎可能是由人腺病毒感染引起的[2,4,5,6],但缺少确凿的证据。
除人腺病毒(特别是人腺病毒41亚型)外,新型冠状病毒也得到一定关注,考虑到这些疑似病例多出现在欧美等国家和地区解除或调整社交管控,以及奥密克戎变异株感染在包括婴幼儿和儿童在内的全人群中暴发流行之后,Brodin和Arditi[7]于2022年5月提出了"新型冠状病毒超抗原参与不明原因儿童严重急性肝炎发病"的假说。其核心内容是新型冠状病毒感染儿童其胃肠组织在病毒清除后的一定时间内可能仍有病毒超抗原存在,并持续刺激、激活患儿的免疫系统[8]。他们认为新型冠状病毒刺突蛋白中可能存在类似于葡萄球菌肠毒素B的超抗原基序,并介导了患病儿童T淋巴细胞的广泛和非特异性激活[9]。这种超抗原介导的免疫细胞活化被认为是包括儿童在内的多系统炎症综合征的致病机制[10],但对该假说的最大疑问是其无法解释何以造成患病儿童的肝特异性损伤表现。此外,EB病毒和人类CMV等其他病毒或某种新病原体也曾被一度怀疑,但患儿临床症状与EB病毒引起的传染性单核细胞增多症并不相符[3]。
值得注意的是,英国卫生安全局(UK Health Security Agency,UKHSA)在其第2次发布的儿童不明原因肝炎专题报道中就提到,AAV2在不明原因严重急性肝炎患儿中有极高的检出率[11]。尽管包括AAV2在内的多个人腺病毒相关病毒血清型都有嗜肝性,但很少有腺相关病毒(adeno-associated virus,AAV)感染致病的报道。不仅如此,AAV的低免疫原性和安全性使其被广泛用作基因治疗的载体[12]。加之AAV2在儿童中普遍感染[13],其作为致病病原体的嫌疑当时并未受到太多关注。然而,Nature在2023年3月接连发表3篇研究,均指出AAV2可能在不明原因儿童严重急性肝炎的发病中有重要作用[14,15,16]。研究者独立地对来自英国和美国的不明原因儿童严重急性肝炎患者的多个不同组织样本进行病原学检测发现,患儿AAV2感染率尤其是近期感染率显著高于对照者,提示这些儿童肝炎的发生或与AAV2早期感染有关。特别是Ho等[14]在患儿肝脏活体组织检查中观测到AAV2的特征性包涵体和T淋巴细胞浸润,为此推测提供了更为直观的证据。
AAV属于细小病毒科依赖性巴氏病毒属,至少存在13种血清型,每个血清型都有不同的组织嗜性,在人类肝脏、血细胞、子宫颈、阴茎、上皮细胞、子宫、羊水等组织或细胞中均可检测到,以肝脏、脾脏、骨髓为最常见的感染部位[13,17]。大多数AAV感染无明显临床症状,其低免疫原性和选择性组织嗜性使其成为了受青睐的基因治疗载体[12];但亦有研究表明AAV感染与HCC的发生相关[13]。AAV一般被认为是复制缺陷病毒,单独感染时表现为潜伏性感染,需要在人腺病毒、人类疱疹病毒、人类CMV等辅助病毒共感染的情况下方可复制,但适当的理化因素处理可使受AAV感染的细胞在无辅助病毒的情况下支持AAV的复制[18]。这提示AAV的复制并非依赖辅助病毒的联合感染而是依靠特定的细胞环境,这或许可部分解释这次不明原因儿童严重急性肝炎并非都检出了复制辅助病毒的现象。
在AAV感染何以造成患病儿童的肝特异性损伤表现方面,研究提到了患儿感染的AAV2大多存在衣壳蛋白编码基因突变[14,15]。这些突变影响了AAV2衣壳与硫酸肝素多糖蛋白(heparin sulfate proteoglycan)的结合结构域,使其免受肝素竞争的影响[15],或许可部分解释突变型AAV2肝脏嗜性增加的现象。另外,这些突变也被发现能促进免疫逃逸和病毒增殖,并增强了病毒颗粒的稳定性[14]。但突变型AAV2是否具有更强的感染性和致病性,仍有待进一步研究。
Ho等[14]通过原位杂交技术证实,所有不明原因肝炎患儿肝脏活体组织检查样本中都有AAV2 RNA存在于被T淋巴细胞围绕的肿胀肝细胞和动脉内皮细胞的细胞核和细胞质中,提示AAV2直接感染肝脏细胞并发生了复制。除直接感染外,活化的CD4+、CD8+T淋巴细胞和CD20+B细胞增多,以及干扰素诱导蛋白的高表达均表明免疫反应的激活,提示免疫介导肝炎的可能性。有观点认为儿童肝炎发病根源更可能是异常的免疫反应而非AAV2的直接肝毒性[19];因为Morfopoulou等[15]虽然发现大多数病例感染了支持AAV2复制的辅助病毒如人腺病毒和人类疱疹病毒6B型(human herpesvirus-6B,HHV-6B),但在肝脏样本中并未检测到特征性的病毒包涵体,或人腺病毒或AAV2的病毒蛋白或病毒颗粒,而且适应性免疫细胞和免疫球蛋白、补体蛋白等免疫相关蛋白的含量显著上升。
尽管这些研究都不是金标准的前瞻性研究,但跨洲病例均出现AAV2的极高检出率使其成为关注热点。在确证AAV是此次儿童严重急性肝炎的致病病原体之前,需要解决以下两个关键的科学问题:现有的数据和知识仍无法确定回答AAV2是否为致病根源;如果AAV2是致病的主要原因,那么过去认为只会引起非常轻微的免疫反应和只有极微弱致病力的AAV如何导致这么严重以致出现死亡的儿童肝炎?未来在进一步探明及监测、预测AAV2感染流行情况的同时,还有待更细致的免疫和病理证据来帮助明确发病机制和确定治疗方案。
尽管在不明原因儿童严重急性肝炎患儿体内的新型冠状病毒检出率远不如人腺病毒和AAV2那样瞩目[20],但其参与致病的可能性始终未被排除。除了新型冠状病毒感染本身所致肝炎的假说外,还有从异常免疫反应导致肝炎的"病毒超抗原"假说,以及新型冠状病毒感染流行期间的封控措施导致幼儿对既往广泛流行并不严重致病的人腺病毒和AAV等病毒早期接触不足,从而在封控解除后其感染此类病毒出现了异常的免疫反应。
新型冠状病毒的超抗原介导肝炎发生假说与儿童多系统炎症综合征的机制假说类似,新型冠状病毒感染后可导致持续的病毒刺突蛋白释放,该蛋白上具有类似于葡萄球菌肠毒素B的超抗原基序,其触发的广泛而非特异的T淋巴细胞激活很可能引起宿主炎症[7,21]。Brodin和Arditi[7]认为不明原因儿童严重急性肝炎的发作机制或可类比小鼠模型中腺病毒和葡萄球菌肠毒素B共同引发过度γ干扰素产生及其介导的肝细胞凋亡的机制,提议对患病儿童的新型冠状病毒持续感染、T淋巴细胞偏倚和γ干扰素进行监测。如果此假说属实,那么对严重肝炎患儿进行免疫调节治疗就有了理论依据。不过该假说要求患病儿童至少存在新型冠状病毒和人腺病毒的先后感染或共感染,与现有数据契合有限,尚需更多证据支持。
另外一个被较为广泛认可的假说是新型冠状病毒感染的封控措施导致幼儿早期对自然病原体的暴露不足,从而使免疫系统缺乏早期的"training",造成封控解除后感染人腺病毒或AAV2引发过度免疫反应。根据UKHSA公布的数据,英国10岁以下儿童人腺病毒的感染率在2020年4月至2021年8月的封控期间仅为不到封控前1/3的水平,而在2021年10月,人腺病毒的流行情况出现了补偿性的激增,在1~4岁儿童中此现象尤为明显[11]。尽管封控措施导致幼儿早期对人腺病毒和AAV接触不足的事实十分确定,但这种早期接触的缺失会导致怎样的结果并无定论。如果早期接触缺乏的假说属实,那么未来的疫情防控措施和基因治疗载体的选择可能需更慎重。需要说明的是,尽管过去已有多起人腺病毒相关性肝炎的报道,但这些病例多见于免疫功能低下的儿童,在免疫功能正常的健康儿童中十分罕见[17]。
新型冠状病毒感染后有14.8%~53%的成人患者会出现肝功能异常,一般认为患者的肝脏受累多是多系统炎症的症状之一[22],但此种急性感染导致儿童特异性肝脏损伤的报道少见。新型冠状病毒的受体血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)的表达具有高度组织特异性,主要局限在心脏、远端肾小管上皮细胞、肾脏内皮细胞、睾丸和消化道。肝脏中的胆管上皮细胞高度存在ACE2的表达,但在肝细胞中表达极低[23],而新型冠状病毒作为对胆汁极为敏感的包膜病毒,难以通过腔缘表达的ACE2感染胆管上皮细胞[24]。但当肝脏损伤后,汇管区的胆管上皮细胞去分化增殖形成新生肝细胞时部分仍保持表达ACE2的特性,这种情况可能造成新型冠状病毒对肝细胞的直接感染[25],但既往未发现有明确证据支持儿童增殖发育的肝脏有类似机制以支持新型冠状病毒直接感染肝细胞,对成人新型冠状病毒感染患者和死亡病例的肝组织病理分析也未观察到病毒包涵体[26],并且这次不明原因儿童严重急性肝炎患者的肝脏组织中也未发现新型冠状病毒感染肝细胞的证据。部分研究结合新型冠状病毒在不明原因肝炎患儿中的感染史、检出率和地区流行率后认为,新型冠状病毒与急性肝炎的暴发并不存在直接联系[14,15,16]。我国于2022年12月7日解除社交限制后,奥密克戎变异株感染在全国范围内暴发流行,导致短期内包括儿童在内的大多数国人感染[27]。然而,感染高峰回落至今已有数月,国内并无一例不明原因儿童严重急性肝炎病例被报道。
在时间顺序上,不明原因儿童严重急性肝炎相对集中地出现于欧美当地管控措施放松后,其高峰时段稍滞后于社会人群出现大规模奥密克戎变异株感染流行的峰值。考虑到我国在2022年12月7日前对新型冠状病毒的严控,之后奥密克戎变异株感染大暴发导致包括幼儿在内的人群普遍感染,以及国外患儿中不乏有需要进行肝移植甚至出现死亡的严重情况,故对我国是否会出现不明原因儿童严重急性肝炎流行的担忧不无道理。
从已报道病例的地理分布来看,不明原因儿童严重急性肝炎主要出现在欧美地区,尤其是英国与美国,其报告病例数远高于亚太地区和东南亚地区,而人口基数较大的中国却无相关病例的报道[1]。根据现有证据,推测这次不明原因儿童严重急性肝炎的发病可能需多个因素:AAV2及辅助病毒的感染、儿童早期对AAV2及辅助病毒的免疫接触不足,以及遗传学上与异常免疫应答相关的易感表型。基于以上因素,国内出现大范围不明原因儿童严重急性肝炎病例的可能性较低。
在常规环境下,儿童中AAV2与人腺病毒的感染流行十分常见[13],但在全球新型冠状病毒感染流行期间各国所采取的社会管控措施一度使得AAV2和人腺病毒的幼儿感染率显著下降[11,28]。
对比我国(以北京市为例)与英国出现不明原因儿童严重急性肝炎前后人腺病毒的流行情况,国内与英国儿童感染人腺病毒的病例数均随疫情的封控措施骤减,而随封控的放开又出现了一定的回升[11,28]。英国政府初期并未采取积极的管控干预,但在疫情形势较为严峻的2020年3月23日至6月实行了相对严格的管控措施,其间幼儿人腺病毒感染病例数显著减少[11]。2020年11月因奥密克戎变异株的出现至英国新型冠状病毒感染疫情复发,全国再次封锁,至2021年3月限制再度放松[29],此后出现了幼儿人腺病毒感染率的急剧升高及不明原因儿童严重急性肝炎的病例报道。北京市自2020年1月24日起采取最严格的封控措施,但在4月至7月间逐步下调管控等级,这种逐步开放的疫情管控同样体现在了幼儿人腺病毒感染流行的回升上[28]。
英国儿童从2020年4月至2021年4月人腺病毒感染率始终处于低水平[11],近一年儿童处于获得免疫的相对空白期。在封控解除后,人腺病毒感染率迅速回升,1~4岁儿童的感染率甚至明显超越了管控措施前的水平[11],随之而来的是病例的集中出现,患儿年龄上也与不明原因儿童严重急性肝炎中78%为6岁以下儿童一致[1]。相对而言,我国在2022年底恢复正常社会生产、生活前的管控措施已经过一系列逐步放宽的调整,如社区内部居民特别是儿童间的相对自由接触等。考虑到我国人口密度相对更高等原因,幼儿的早期病原体接触空白或许并不严重[28]。基于距我国2022年底相对放开新型冠状病毒感染疫情防控措施至今近6个月的时间内国内始终未出现相关病例的报道,可认为儿童早期对人腺病毒和AAV接触不足所带来的影响在我国或许相对有限。
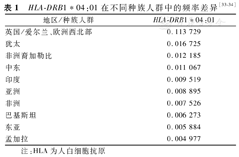
HLA Ⅱ类组织相容性复合体的经典等位基因HLA-DRB1*04:01是编码DRB1多肽67至72位6个氨基酸序列LLEQKR的HLA等位基因之一[30],是已确定的自身免疫性肝炎的易感基因型[31]。此外,也有研究发现HLA-DRB1*04:01对新型冠状病毒感染后的临床严重程度有显著影响[32]。Ho等[14]报道在不明原因严重急性肝炎患儿中,HLA-DRB1*04:01出现的频率高达93%(25/27),而在背景人群中的频率仅为16%(10/64)。不仅如此,更有研究显示暴露于AAV2感染极有可能引发CD4+Th介导的免疫应答,从而诱导肝炎发生,这与受影响儿童的Ⅱ类HLA-DRB1*04:01等位基因频率显著更高一致[15]。因此,Ho等[14]认为HLA-DRB1*04:01可能是AAV2导致不明原因儿童严重急性肝炎的易感基因,可能影响不明原因儿童严重急性肝炎的发病。
然而,不同种族间HLA-DRB1*04:01的频率存在较大差异,在英国/爱尔兰、欧洲西北部的人种中出现的频率最高,其次为犹太、非洲裔加勒比和中东人群,亚洲种族中该等位基因型出现的频率不足欧洲地区的1/10,见表1[33,34]。易感基因的人群差异或许可解释不同地区不明原因儿童肝炎的发病频率差异,并且由于亚洲人群HLA-DRB1*04:01频率较低,所以从遗传易感性上支持了国内发生不明原因儿童严重急性肝炎的可能性不高的推论。
目前,对于儿童严重急性肝炎的发病机制尚无定论,结合现有的理论依据和临床数据,推测不明原因儿童肝炎的发病可能与多因素有关(图1):因疫情而采取的社交管控导致儿童普遍对自然界病原体暴露减少和早期免疫训练不足,致使某些特定基因型幼儿在感染相关病原体(如AAV2、人腺病毒)后可能出现严重急性肝炎。另外,新型冠状病毒是否通过直接感染或"病毒超抗原"异常激活免疫的形式参与发病的可能性暂未完全排除。未来期待进一步的研究以获得更确凿的免疫学和病理学证据,便于明确不明原因严重急性儿童肝炎的具体发病机制并制订适宜的诊疗指南。
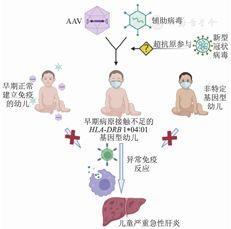

注:AAV为腺相关病毒;HLA为人白细胞抗原
考虑到我国人口密度相对更高和疫情防控措施采取逐步放开的形式,我国幼儿对自然界病原体接触空白情况或许相对较轻。同时,基于亚洲人群HLA-DRB1*04:01频率远低于欧洲西北部人群的遗传学特征,以及自国内恢复正常社会生产、生活后近6个月内并未出现不明原因儿童严重急性肝炎相关报道的前提下,认为国内在奥密克戎变异株感染大规模暴发后集中出现不明原因儿童严重急性肝炎的风险较低。未来国内外若再次出现不明原因儿童严重急性肝炎的病例,则仍需迅速跟进并做出更进一步的判断。
所有作者均声明不存在利益冲突