
调查河南省信阳市2022年连续两起发热伴血小板减少综合征聚集性疫情,分析其发生原因、传播方式、影响因素及病毒遗传变异特征。根据病例定义展开病例搜索,采集病例、家属、邻居血液样本和生物媒介样本,进行逆转录-聚合酶链反应检测发热伴血小板减少综合征病毒(SFTSV)核酸。通过全基因组测序,构建系统进化树,分析核苷酸同源性和氨基酸变异位点。两起聚集性疫情涉及首发病例2例,续发病例10例,均涉及家庭聚集性病例,其中9例续发病例曾直接接触首发病例血液,判定直接接触血液是两起聚集性疫情的主要危险因素。经基因组测序分析发现,本次聚集性疫情SFTSV基因型为A型,与该地区既往流行株亲缘关系近,病例的SFTSV核苷酸序列高度同源,共9个编码区氨基酸突变位点,不排除其变异位点对疫情暴发可能产生影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)是由发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV)引起的以发热、白细胞减少、血小板减少为主要临床表现的感染性疾病[1]。SFTS的临床症状是非特异性的,常见胃肠道症状、局部淋巴结肿胀[2],并有出血倾向,严重者出现全身弥散性血管内凝血(disseminated intravascular coagulation,DIC)和多器官功能衰竭(multiple organ dysfunction syndrome,MODS)甚至死亡[3]。目前对该病的研究仍处于初始阶段,传播途径、发病机制尚不明确。自2010年SFTS开始报告以来,发病率上升趋势明显[4]。SFTS主要传播途径为蜱虫叮咬和接触急性期病例及尸体血液及血液分泌物[5],其主要传播媒介为长角血蜱,由蜱虫叮咬感染的患者病情更重,预后不良风险更高[6]。随着各地SFTS病例报告增加,聚集性疫情较往年频发[7, 8, 9]。本研究对2022年上半年河南省信阳地区在3月和5月发生的两起SFTS聚集性疫情进行比对分析,了解发病危险因素和流行病学特点,并对毒株进行分离、测序、序列比对和变异位点分析,为进一步加强对SFTS监测和防控提供依据。
2022年3—5月,河南省信阳市发生两起SFTS聚集性疫情,根据《发热伴血小板减少综合征防治指南(2010版)》的诊断标准[10],判定两起聚集性疫情确诊病例12例,同时将12名确诊病例、确诊病例的密切接触者、同村健康人群及捕捉到的寄生蜱和游离蜱纳入研究。
对确诊病例周边村庄开展病例主动搜索,追踪SFTS病例的密切接触者,采用统一调查表对所有符合病例定义者逐一调查,主要信息包括基本情况、临床特征、流行病学接触史等。
收集确诊病例急性期、密切接触者及同村健康人群血液样本共99份,其中病例急性期和密切接触者的血液样本10份、健康人群血液样本89份,4 ℃,1 700×g,离心10 min,分离血清,于-80 ℃保存。在首发病例家及周围农场、水库等多点捕捉寄生蜱和游离蜱(布旗法)35只,进行媒介监测。
采用酶联免疫吸附试验(ELISA)检测方法对收集的同村健康人群血液样本进行SFTSV的IgM、IgG 抗体水平进行检测;对采集的蜱虫标本进行荧光定量RT-PCR检测SFTSV核酸。
采用硕世病毒核酸提取试剂盒(苏泰械备20190090号),按照试剂盒说明书操作提取患者急性期和密切接触者血清样本RNA,提取的RNA于-80 ℃储存待用。所有样本均进行RT-PCR检测SFTSV核酸。
对RT-PCR检测核酸阳性的样本,采用Invitrogen公司(美国)SuperScriptⅢ逆转录试剂盒,以提取到的总RNA为模板,按照试剂盒说明书逆转录RNA获得cDNA。沿用本课题组设计的特异性引物对上述逆转录出的cDNA进行多重PCR扩增,引物及扩增方法参考文献[11],采用Illumina MiSeq测序仪(美国),使用MiSeq v2上机试剂盒进行双端测序。
使用CLC workbench12.0软件进行测序数据分析,拼接校对获得完整序列。使用MEGA 6.06软件对毒株全基因组核苷酸序列与GenBank中已知的SFTSV病毒核苷酸序列进行比对,进行同源性、氨基酸变异位点分析,以及采用邻接法构建系统发育树,选择bootstrap进行树的检验,bootstrap值设为1 000。
第一起聚集性病例首发病例为81岁男性,2022年3月12日出现发热、乏力症状至村诊所就诊;5 d后症状加重,于3月17日转至当地县医院感染科,入院血常规检测白细胞4.13×109/L,中性细胞比率81.4%,淋巴细胞比率9.8%,血小板60×109/L;3月19日复查血常规:白细胞1.93×109/L,中性细胞比率89.6%,淋巴细胞比率8.3%,血小板30×109/L;由于患者症状加重,于3月19日下午转至省立医院,于3月20日被诊断为SFTS实验室确诊病例,并进行网络报告,病情迅速恶化,3月21日下午去世。后续出现5例续发病例,其中1例续发病例死亡,4例好转康复。
第二起聚集性病例首发病例为74岁男性,4月24日自感身体不适至村诊所就诊,接受林可霉素和地塞米松输液治疗;4月27日出现发热、乏力症状;4月28日突发头晕、伴轻度步态不稳并频发呃逆,无呕吐、无发热,无腹痛及腹泻等不适到当地县医院门诊就诊,初步检查为缺血性脑血管病和上呼吸道感染;4月30日,低热37.8 ℃,呃逆、胃部不适日至村诊所就诊开口服药吗丁啉,建议去医院就诊;5月1日至当地县医院肾病学科就诊,由于患者症状加重于下午转至市中心医院;于5月2日被诊断为SFTS临床诊断病例,并进行网络报告;5月5日下午去世。后续出现5例续发病例,其中4例续发病例死亡,1例好转康复。
两起聚集性病例首发病例均居住在农村瓦房,周围有杂草、树林,卫生条件一般,经常在田间地头从事农活,家中养有狗、鸡,蜱虫叮咬史均不详。累计10名续发病例均为首发病例亲戚和邻居,在首发病例住院期间或丧葬期间曾与之有过接触,在接触后8~13 d出现发热、乏力、腹泻等临床症状,根据病例定义确诊为SFTS病例,见表1。首例及续发病例的36名密切接触者及其他26名近距离接触者均未发病。
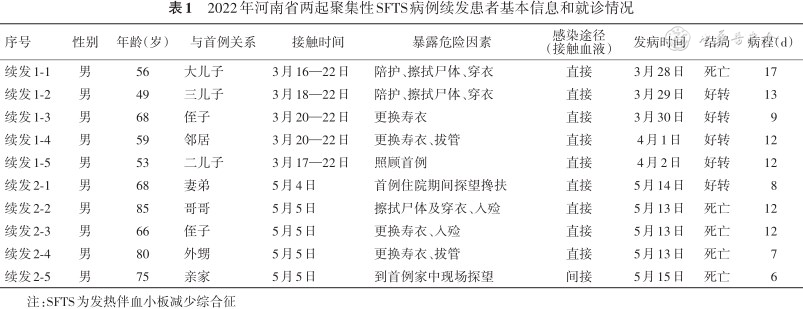
2022年河南省两起聚集性SFTS病例续发患者基本信息和就诊情况
2022年河南省两起聚集性SFTS病例续发患者基本信息和就诊情况
| 序号 | 性别 | 年龄(岁) | 与首例关系 | 接触时间 | 暴露危险因素 | 感染途径(接触血液) | 发病时间 | 结局 | 病程(d) |
|---|---|---|---|---|---|---|---|---|---|
| 续发1-1 | 男 | 56 | 大儿子 | 3月16—22日 | 陪护、擦拭尸体、穿衣 | 直接 | 3月28日 | 死亡 | 17 |
| 续发1-2 | 男 | 49 | 三儿子 | 3月18—22日 | 陪护、擦拭尸体、穿衣 | 直接 | 3月29日 | 好转 | 13 |
| 续发1-3 | 男 | 68 | 侄子 | 3月20—22日 | 更换寿衣 | 直接 | 3月30日 | 好转 | 9 |
| 续发1-4 | 男 | 59 | 邻居 | 3月20—22日 | 更换寿衣、拔管 | 直接 | 4月1日 | 好转 | 12 |
| 续发1-5 | 男 | 53 | 二儿子 | 3月17—22日 | 照顾首例 | 直接 | 4月2日 | 好转 | 12 |
| 续发2-1 | 男 | 68 | 妻弟 | 5月4日 | 首例住院期间探望搀扶 | 直接 | 5月14日 | 好转 | 8 |
| 续发2-2 | 男 | 85 | 哥哥 | 5月5日 | 擦拭尸体及穿衣、入殓 | 直接 | 5月13日 | 死亡 | 12 |
| 续发2-3 | 男 | 66 | 侄子 | 5月5日 | 更换寿衣、入殓 | 直接 | 5月13日 | 死亡 | 12 |
| 续发2-4 | 男 | 80 | 外甥 | 5月5日 | 更换寿衣、拔管 | 直接 | 5月13日 | 死亡 | 7 |
| 续发2-5 | 男 | 75 | 亲家 | 5月5日 | 到首例家中现场探望 | 间接 | 5月15日 | 死亡 | 6 |
注:SFTS为发热伴血小板减少综合征
两起疫情的10例续发病例中,9例为患者亲属、1例为同村村民,具有高度家庭聚集性特点;续发病例均为男性,年龄49~85岁,平均年龄为65.9岁。5例死亡病例,年龄56~85岁,平均年龄72.4岁。2名首发病例分别于3月20日、4月5日死亡,9名续发病例在首发病例去世当天处理尸体时接触过患者血液,剩余1名续发病例在首发病例去世当天看望过患者。续发病例在首发病例去世后8~13 d发病,平均9.5 d,其中4例集中在首例去世后第8天发病。
共采集人血清样本89份,1份IgM、IgG抗体均为阳性(阳性率为1.12%),IgG阳性15份(阳性率为16.85%),与往年流行季节IgG阳性率17.1%(95%CI 11.7%~23.7%)接近[12],提示当地SFTSV抗体阳性率处于较高水平。在首发病例家及周围农场、水库等多点捕捉寄生蜱和游离蜱(布旗法),累计捕获35只,RT-PCR检测SFTSV均为阴性。
对首发病例、续发病例及密切接触者血清样本进行RT-PCR检测,其中首发病例、续发病例核酸检测结果均为阳性,平均Ct值为29.56±2.93,密切接触者的核酸检测结果均为阴性。由于第二起聚集性病例没有收集到样本进行进一步检测,仅第一起聚集性病例样本进行测序。经构建系统进化树分析,所测序列S、M、L片段均在A型分支上,与河南毒株BL136亲缘关系较近(图1)。
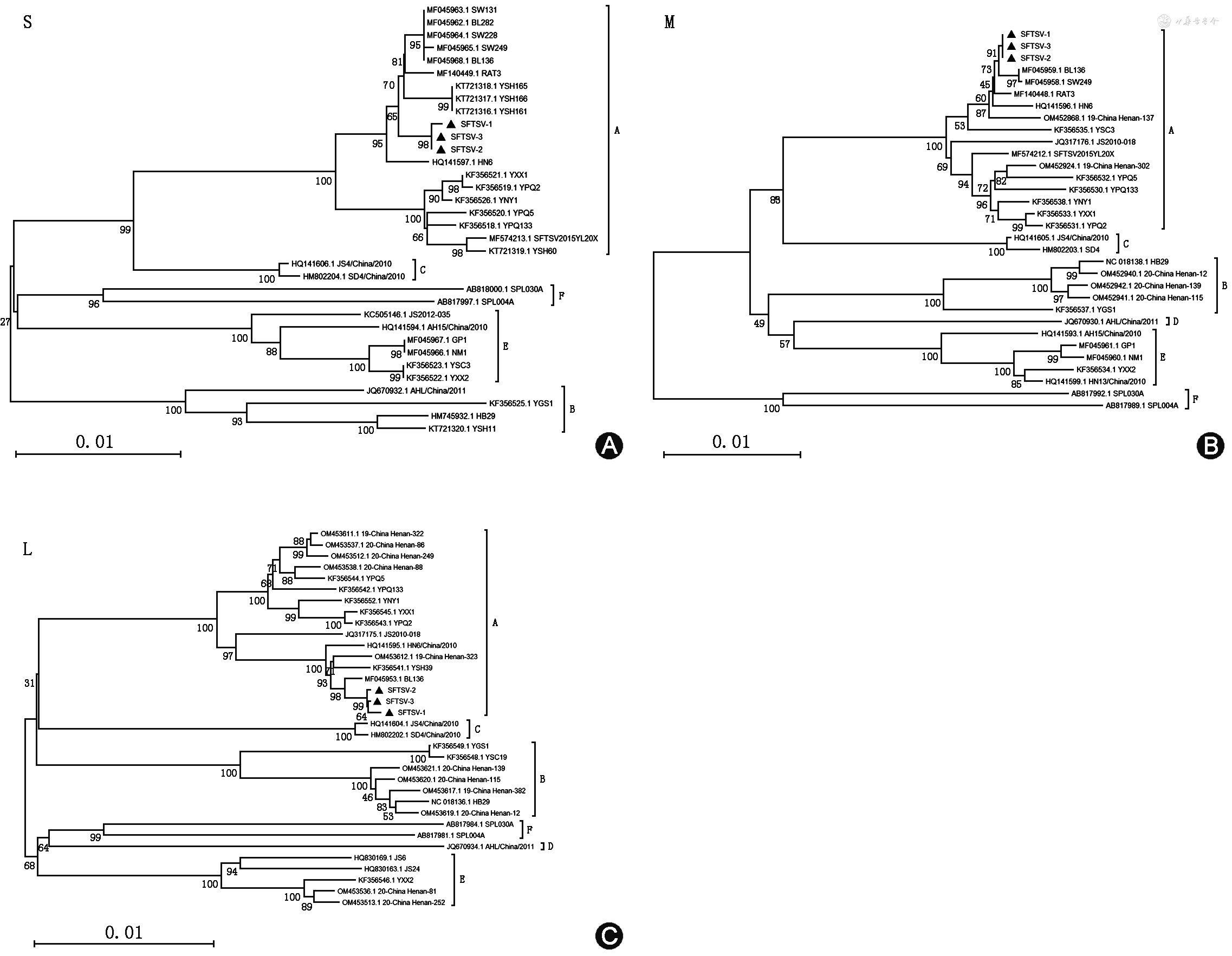

▲本研究所测SFTSV阳性血清样本病毒株;SFTSV:发热伴血小板减少综合征病毒
经测序所获得三株SFTSV序列高度同源,同源性为99.9%~100%,与GenBank中已知的SFTSV病毒核苷酸序列进行比对,L片段同源性为95.6%~99.8%,与YSC3(KF356547.1)核苷酸序列同源性最高;M片段同源性为94.4%~99.8%,与RAT3、SW249、BL136(MF140448.1、MF045958.1、MF045959.1)核苷酸序列同源性最高;S片段同源性为94.6%~99.6%,与SW131、BL282(MF045963.1、MF045962.1)核苷酸序列同源性最高。变异位点分析使用SFTSV HN6 用作参考序列(GenBank 登录号:HQ141595、HQ141596 和 HQ141597 L、M 和 S 段),所获得的序列共有57个(S片段11个、M片段12个、L片段34个)核苷酸突变位点。其中编码区氨基酸突变位点共9个,S片段核蛋白(nonstructural protein,NP)编码区存在1个变异位点(A119T)和非结构蛋白(nonstructural proteins,NSs)编码区存在1个变异位点(I272T),M片段膜蛋白前体(membrane glycoprotein polyprotein,GP)编码区存在4个变异位点(V506M、M743V、T926K、I1018S),L片段RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,RdRP)编码区存在3个变异位点(K1535R、I1651M、G1904D)。
SFTSV于2019年被国际病毒分类委员会更名为大别班达病毒,属于布尼亚病毒目,白蛉纤细病毒科,班达病毒属。基因组包含三个RNA片段,分别为S、M、L,片段末端与白蛉病毒科其他病毒相似[13]。其基因型分类较多使用的是A-F型分类[14],河南、湖北、安徽三省主要流行株为A型,日本、韩国、中国浙江毒株大多数为F型,山东、辽宁是B型株主要流行地区。之前研究提示,SFTSV基因亚型、毒株遗传序列变异位点可能与病例严重程度相关[15, 16]。
经系统进化树分析,引发本研究聚集性疫情的SFTSV毒株属于A型,与既往信阳地区流行株遗传距离较近,和GenBank中已知的SFTSV病毒核苷酸序列进行比对同源性在94.4%~99.8%,变异较小。将SFTSV HN6作为参比序列,本研究毒株在编码区共存在9个氨基酸变异位点,其中M片段GP编码区V506M突变与SFTS患者死亡结局相关(OR=1.767,P<0.05)[16]。糖蛋白前体GP被宿主蛋白酶切割为两个糖蛋白(N端糖蛋白Gn和C 端糖蛋白Gc),分布在病毒表面,与细胞表面受体结合,介导病毒进入宿主细胞[17]。之前研究结果表明Gc编码区R624W氨基酸变异位点对细胞融合产生影响,940(940H)位置的组氨酸对病毒复制有重要性[18]。V506M突变位于糖蛋白Gn编码区,Gn蛋白在病毒侵入细胞过程中的结构和功能尚不明确,该突变位点是否会增强病毒蛋白对靶细胞的吸附能力,影响病毒传播,导致不良结局,需要进一步验证。
蜱虫作为SFTS的常见传染媒介,通过叮咬使人感染SFTSV[19]。此次共捉寄生蜱和游离蜱35只,RT-PCR检测SFTSV均为阴性。阴性结果的出现与蜱种群中携带SFTSV的蜱比例较低有关,既往也有研究说明蜱虫中SFTSV带毒率较低[20, 21],在下一步研究过程中,考虑扩大采样范围的同时选择日出前或日落后的蜱虫活动高峰时期进行抓捕,从而提高蜱虫数量进行媒介宿主的调查。两起聚集性病例所在村落健康人群SFTSV血清学调查显示,当地SFTSV IgG抗体阳性率为16.85%,与往年流行季节IgG阳性率17.1%(95%CI:11.7%~23.7%)接近[12],提示存在隐性感染,当地发病趋势相对稳定。
本研究两起聚集性病例首发病例均为死亡病例,在确诊后3 d内死亡,仍处于疾病早期阶段,两例首发病例去世后拔管过程中均有血液溅出。续发病例在首发病例去世当天暴露感染的可能性较大。推算潜伏期为8~13 d,与之前研究继发病例潜伏期为3~15 d相似[22]。其中4例集中在首例去世后第8天发病。10例续发病例均为首发病例密切接触者,其中9名续发病例在处理首发病例尸体时接触过其血液,说明死亡病例血液中病毒载量高,死亡后仍具有较强传染性。首发病例死亡、出血以及接触SFTS病例体液均是造成SFTS人-人传播的危险因素[23]。1名续发病例在首发病例去世当天看望,由于SFTS病例死亡当天或死亡前一天会大量出血,SFTSV可以在患者血液、尿液和粪便中检测到[24],这些排泄物有可能形成病毒气溶胶,经气溶胶传播感染[25]。与蜱虫叮咬途径不同,可以通过正确安全的处理SFTS病例和做好个人防护避免直接接触带血排泄物等措施达到有效预防,减少SFTS聚集性疫情。第一起聚集性疫情中续发病例49~68岁,1例续发病例死亡,其余4例续发病例好转;第二起聚集性疫情中续发患者年龄在66~85岁,4例续发病例死亡,1例续发病例好转。提示高龄是SFTS患者的死亡高危因素,与既往研究结果一致[26]。
单一病例报告存在一定局限性,本研究将同一地区发生时间较近的两起发热伴血小板减少综合征聚集性疫情进行综合整理,但发热伴血小板减少综合征病毒聚集性疫情的相关报道和研究较为缺乏,聚集性疫情发生的原因需要进一步分析。
李懿, 王笑阳, 李亚飞, 等. 2022年河南省两起发热伴血小板减少综合征聚集性疫情流行病学及病原学调查[J]. 中华预防医学杂志, 2023, 57(10): 1719-1724. DOI: 10.3760/cma.j.cn112150-20221130-01162.
所有作者声明无利益冲突



























