
分析各种类型帕金森综合征(PS)患者的氟[18F]-氟代脱氧葡萄糖(18F-FDG)PET/CT影像特征,建立PS的18F-FDG PET/CT“诊断树”模型。
回顾性收集2019年1月至2021年12月就诊于复旦大学附属华山医院神经内科的帕金森病(PD)患者、进行性核上性麻痹(PSP)患者、多系统萎缩-小脑型(MSA-C)患者、多系统萎缩-帕金森型(MSA-P)患者,进行18F-FDG PET/CT检查;所有患者完善临床资料采集和随访,确定患者的临床诊断;分析各种类型PS患者脑葡萄糖代谢的特异性改变模式以及在疾病鉴别诊断中的价值;建立18F-FDG PET/CT显像“诊断树”模型并验证其对PS的鉴别诊断价值。
共纳入320例患者,男性187例,女性133例,年龄(62±9)岁,包括80例PD、90例PSP、114例MSA-C、36例MSA-P。有鉴别诊断意义的脑区葡萄糖代谢特点如下:PD的壳核代谢增高;PSP尾状核、丘脑、中脑、额叶代谢减低;MSA-C小脑代谢减低;MSA-P壳核代谢减低、小脑代谢减低。建立“诊断树”模型,对PD诊断的灵敏度为88.75%,特异度为91.25%;对PSP诊断的灵敏度为54.44%,特异度为96.96%;对MSA-C诊断的灵敏度为87.72%,特异度为86.41%;对MSA-P诊断的灵敏度为55.56%,特异度为91.55%。“诊断树”模型可正确分类75%(240/320)的患者。
PD、PSP、MSA-C、MSA-P的18F-FDG PET/CT显像呈现不同的脑区葡萄糖代谢改变特点,对鉴别诊断有重要价值,“诊断树”模型有助于进行临床诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
帕金森综合征(Parkinsonian syndromes,PS)作为一类常见的神经系统运动障碍疾病,具有相似的临床特征,即运动迟缓、静止性震颤和肌强直。PS包括帕金森病(Parkinson′s disease,PD)、遗传性PS、非典型帕金森综合征(atypical Parkinsonian syndromes,aPS,亦称帕金森叠加综合征)和继发性帕金森综合征(如血管性PS、药源性PS等)[1]。由于临床特征的高度重叠,PS早期鉴别诊断十分困难。PD的临床诊断准确率仅为80.6%[2],对于未经治疗或对药物反应不明显的早期PD,诊断准确率仅为26%[3];其中最大的挑战是区分PD与aPS,临床病理学研究显示,PD与aPS患者的临床诊断中,错误率为7%~35%,误诊的aPS主要为多系统萎缩(multiple-system atrophy,MSA)和进行性核上性麻痹(progressive supranuclear palsy,PSP)[2, 3]。
用于PS诊断和鉴别诊断的影像工具广泛、多样[4, 5],其中正电子发射断层显像(positron emission tomography,PET)具有不可忽视的价值[6, 7]。本研究通过对比总结大样本量PD/aPS患者的[18F]-氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)PET中脑区葡萄糖代谢改变的特点,分析其在疾病鉴别诊断中的价值,并提出适用于临床的“诊断树”模型,使得对18F-FDG PET/CT报告的解读清晰易懂,有助于PS早期的准确诊断和鉴别诊断。
回顾性选取2019年1月至2021年12月就诊于复旦大学附属华山医院神经内科的PD、PSP、多系统萎缩-小脑型(multiple system atrophy-cerebellar phenotype,MSA-C)、多系统萎缩-帕金森型(multiple system atrophy-parkinsonian phenotype,MSA-P)患者。临床诊断通过为期3个月至3年的随访得出。PD诊断根据国际运动障碍协会(Movement Disorder Society,MDS)2015版临床诊断标准[8],符合临床确诊的PD或临床很可能的PD;PSP诊断根据2017年MDS诊断标准[9],符合临床很可能的PSP或临床可能的PSP;MSA-C及MSA-P诊断根据2022版MDS诊断标准[10],符合临床确诊的MSA或临床很可能的MSA,以帕金森症状为主要特征的患者诊断为MSA-P,以小脑性共济失调为主要特征的患者诊断为MSA-C。排除标准:(1)各种继发性PS(如药源性、血管性、脑炎、外伤等)、痴呆、精神疾病、肿瘤性疾病和其他颅内病变等;(2)合并严重心、肺等系统性疾病。
本研究为横断面研究,通过复旦大学附属华山医院伦理委员会审批(伦理批件号:KY2020-1161),所有患者均签署知情同意书。
1.临床资料采集:入组患者均进行临床资料采集,包括年龄、性别、病程、临床症状、体格检查、Hoehn&Yahr分期、简易智力状态检查量表(mini-mental state examination,MMSE)评分,完善外周血常规、肝肾功能、血脂、甲状腺功能等化验和头颅MRI平扫检查以排除其他疾病。所有患者随访至少3个月,部分初次诊断存疑的患者至少随访2年以得出临床诊断。
2.18F-FDG PET/CT检查:受试者检查前空腹6 h以上,停止服用抗帕金森药物12 h以上,检查前血糖控制在11.1 mmol/L以下[11]。PET显像仪为Siemens mCT Flow型PET/CT,18F-FDG示踪剂合成均在自动化18F-FDG合成模块(北京派特生物技术有限公司)上完成,放射化学纯度>98%。受检者静脉注射0.1 mCi/kg(3.7 MBq/kg)18F-FDG,注射后于安静、避光环境中休息(60±2)min后进行脑部PET/CT扫描。先采集CT图像用于定位及衰减校正,采集参数:电压120 kV,电流 150 mAs,层厚3.0~5.0 mm,扫描时间16~20 s;后在同一视野进行静态PET采集,采集时间10 min。PET图像应用CT数据进行衰减校正,迭代法重建后(迭代次数4,子集数24。Gaussian滤波为2 mm,Zoom为3.0,矩阵256×256×148,体素为2 mm×2 mm×3 mm),分别得到脑横断面、冠状面和矢状面PET图像。
3.图像处理:由2位经验丰富的核医学科医师(工作经验超过5年,且接受过神经系统脑部18F-FDG PET/CT领域系统培训)以盲法对所有患者的PET图像进行整体的视觉分析。与正常人群脑显像特征进行对比,得出每例患者的脑区代谢改变结果[12, 13],关注脑区包括:壳核、尾状核、丘脑、小脑、脑干(中脑、脑桥)、皮质(额叶、顶叶、颞叶、枕叶、后扣带回)。如果两位医师读片结果有冲突,则由第3位医师盲法读片后获得最终读片结果。
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料用表示;不符合正态分布的计量资料用M(Q1,Q3)表示;计数资料用例数(百分数)表示,组间比较采用χ2检验。步骤一,应用R×C χ2检验对比不同脑区的葡萄糖代谢改变在PD、PSP、MSA-C、MSA-P各组间的差异,多因素的二元logistic回归模型(Forward:LR法)比较组间有意义的影响因素。步骤二,根据步骤一的结果,建立“诊断树”模型,并以“诊断树”模型的结果得出模拟诊断,与临床诊断相对比,计算“诊断树”模型分别对PD、PSP、MSA-C、MSA-P诊断的特异度和灵敏度。双侧检验,检验水准α=0.05。
共纳入320例患者,男187例,女133例,年龄(62±9)岁。根据临床表现、MRI结果和为期3个月至3年的随访,最终临床诊断为80例PD、90例PSP、114例MSA-C、36例MSA-P(表1)。
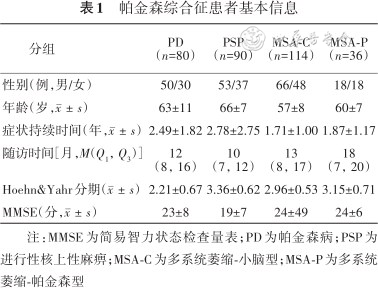
帕金森综合征患者基本信息
帕金森综合征患者基本信息
| 分组 | PD(n=80) | PSP(n=90) | MSA-C(n=114) | MSA-P(n=36) |
|---|---|---|---|---|
| 性别(例,男/女) | 50/30 | 53/37 | 66/48 | 18/18 |
| 年龄(岁,) | 63±11 | 66±7 | 57±8 | 60±7 |
| 症状持续时间(年,) | 2.49±1.82 | 2.78±2.75 | 1.71±1.00 | 1.87±1.17 |
| 随访时间[月,M(Q1,Q3)] | 12(8,16) | 10(7,12) | 13(8,17) | 18(7,20) |
| Hoehn&Yahr分期() | 2.21±0.67 | 3.36±0.62 | 2.96±0.53 | 3.15±0.71 |
| MMSE(分,) | 23±8 | 19±7 | 24±49 | 24±6 |
注:MMSE为简易智力状态检查量表;PD为帕金森病;PSP为进行性核上性麻痹;MSA-C为多系统萎缩-小脑型;MSA-P为多系统萎缩-帕金森型
4组患者在壳核、尾状核、丘脑、小脑、脑干(中脑)、皮质(额叶、顶叶、颞叶)的葡萄糖代谢改变方面差异有统计学意义(表2)。不同患者18F-FDG PET代谢模式不同,PD患者表现为壳核FDG代谢增高,PSP患者尾状核、丘脑、中脑、额叶FDG代谢减低,MSA-C患者小脑FDG代谢减低,MSA-P患者壳核、小脑FDG代谢减低(表3)。特征性头颅MRI及18F-FDG PET/CT图像见图1。
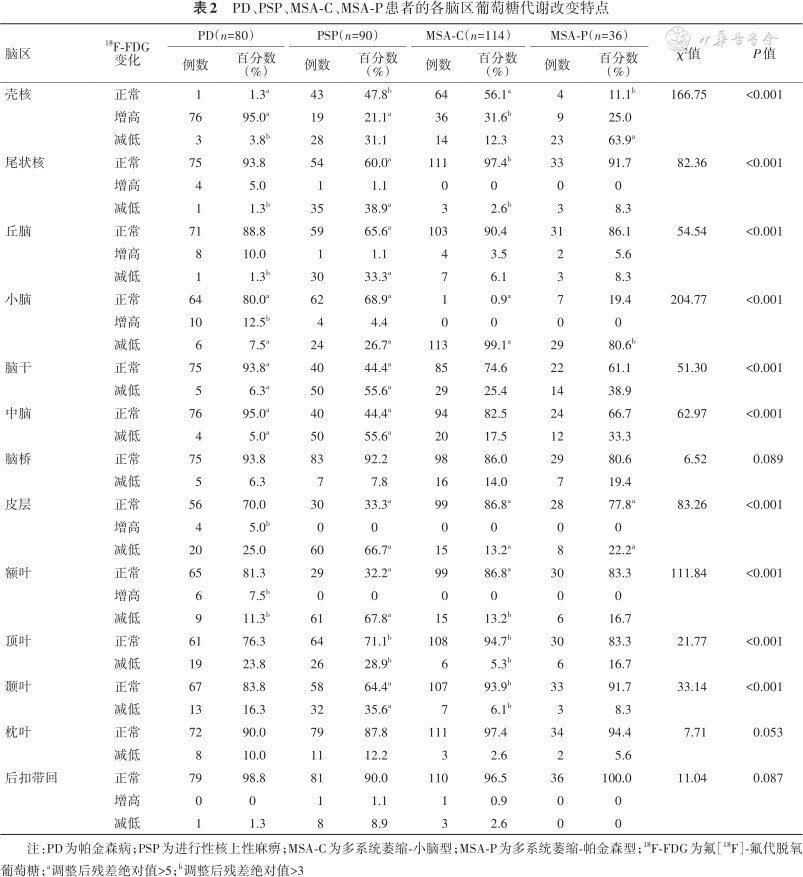
PD、PSP、MSA-C、MSA-P患者的各脑区葡萄糖代谢改变特点
PD、PSP、MSA-C、MSA-P患者的各脑区葡萄糖代谢改变特点
| 脑区 | 18F-FDG变化 | PD(n=80) | PSP(n=90) | MSA-C(n=114) | MSA-P(n=36) | χ²值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 例数 | 百分数(%) | 例数 | 百分数(%) | 例数 | 百分数(%) | 例数 | 百分数(%) | ||||
| 壳核 | 正常 | 1 | 1.3a | 43 | 47.8b | 64 | 56.1a | 4 | 11.1b | 166.75 | <0.001 |
| 增高 | 76 | 95.0a | 19 | 21.1a | 36 | 31.6b | 9 | 25.0 | |||
| 减低 | 3 | 3.8b | 28 | 31.1 | 14 | 12.3 | 23 | 63.9a | |||
| 尾状核 | 正常 | 75 | 93.8 | 54 | 60.0a | 111 | 97.4b | 33 | 91.7 | 82.36 | <0.001 |
| 增高 | 4 | 5.0 | 1 | 1.1 | 0 | 0 | 0 | 0 | |||
| 减低 | 1 | 1.3b | 35 | 38.9a | 3 | 2.6b | 3 | 8.3 | |||
| 丘脑 | 正常 | 71 | 88.8 | 59 | 65.6a | 103 | 90.4 | 31 | 86.1 | 54.54 | <0.001 |
| 增高 | 8 | 10.0 | 1 | 1.1 | 4 | 3.5 | 2 | 5.6 | |||
| 减低 | 1 | 1.3b | 30 | 33.3a | 7 | 6.1 | 3 | 8.3 | |||
| 小脑 | 正常 | 64 | 80.0a | 62 | 68.9a | 1 | 0.9a | 7 | 19.4 | 204.77 | <0.001 |
| 增高 | 10 | 12.5b | 4 | 4.4 | 0 | 0 | 0 | 0 | |||
| 减低 | 6 | 7.5a | 24 | 26.7a | 113 | 99.1a | 29 | 80.6b | |||
| 脑干 | 正常 | 75 | 93.8a | 40 | 44.4a | 85 | 74.6 | 22 | 61.1 | 51.30 | <0.001 |
| 减低 | 5 | 6.3a | 50 | 55.6a | 29 | 25.4 | 14 | 38.9 | |||
| 中脑 | 正常 | 76 | 95.0a | 40 | 44.4a | 94 | 82.5 | 24 | 66.7 | 62.97 | <0.001 |
| 减低 | 4 | 5.0a | 50 | 55.6a | 20 | 17.5 | 12 | 33.3 | |||
| 脑桥 | 正常 | 75 | 93.8 | 83 | 92.2 | 98 | 86.0 | 29 | 80.6 | 6.52 | 0.089 |
| 减低 | 5 | 6.3 | 7 | 7.8 | 16 | 14.0 | 7 | 19.4 | |||
| 皮层 | 正常 | 56 | 70.0 | 30 | 33.3a | 99 | 86.8a | 28 | 77.8a | 83.26 | <0.001 |
| 增高 | 4 | 5.0b | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 减低 | 20 | 25.0 | 60 | 66.7a | 15 | 13.2a | 8 | 22.2a | |||
| 额叶 | 正常 | 65 | 81.3 | 29 | 32.2a | 99 | 86.8a | 30 | 83.3 | 111.84 | <0.001 |
| 增高 | 6 | 7.5b | 0 | 0 | 0 | 0 | 0 | 0 | |||
| 减低 | 9 | 11.3b | 61 | 67.8a | 15 | 13.2b | 6 | 16.7 | |||
| 顶叶 | 正常 | 61 | 76.3 | 64 | 71.1b | 108 | 94.7b | 30 | 83.3 | 21.77 | <0.001 |
| 减低 | 19 | 23.8 | 26 | 28.9b | 6 | 5.3b | 6 | 16.7 | |||
| 颞叶 | 正常 | 67 | 83.8 | 58 | 64.4a | 107 | 93.9b | 33 | 91.7 | 33.14 | <0.001 |
| 减低 | 13 | 16.3 | 32 | 35.6a | 7 | 6.1b | 3 | 8.3 | |||
| 枕叶 | 正常 | 72 | 90.0 | 79 | 87.8 | 111 | 97.4 | 34 | 94.4 | 7.71 | 0.053 |
| 减低 | 8 | 10.0 | 11 | 12.2 | 3 | 2.6 | 2 | 5.6 | |||
| 后扣带回 | 正常 | 79 | 98.8 | 81 | 90.0 | 110 | 96.5 | 36 | 100.0 | 11.04 | 0.087 |
| 增高 | 0 | 0 | 1 | 1.1 | 1 | 0.9 | 0 | 0 | |||
| 减低 | 1 | 1.3 | 8 | 8.9 | 3 | 2.6 | 0 | 0 | |||
注:PD为帕金森病;PSP为进行性核上性麻痹;MSA-C为多系统萎缩-小脑型;MSA-P为多系统萎缩-帕金森型;18F-FDG为氟[18F]-氟代脱氧葡萄糖;a调整后残差绝对值>5;b调整后残差绝对值>3

PD、PSP、MSA-C、MSA-P患者具有鉴别诊断价值的脑区葡萄糖代谢改变
PD、PSP、MSA-C、MSA-P患者具有鉴别诊断价值的脑区葡萄糖代谢改变
| 组别 | 具有诊断价值 | 具有排除诊断价值 |
|---|---|---|
| PD | 壳核代谢增高 | 小脑代谢减低,中脑代谢减低,丘脑代谢减低 |
| PSP | 尾状核、丘脑、中脑、额叶代谢减低 | 壳核代谢增高,小脑代谢减低 |
| MSA-C | 小脑代谢减低 | 壳核、尾状核、额叶代谢减低 |
| MSA-P | 壳核代谢减低,小脑代谢减低 | 丘脑代谢减低 |
注:PD为帕金森病;PSP为进行性核上性麻痹;MSA-C为多系统萎缩-小脑型;MSA-P为多系统萎缩-帕金森型
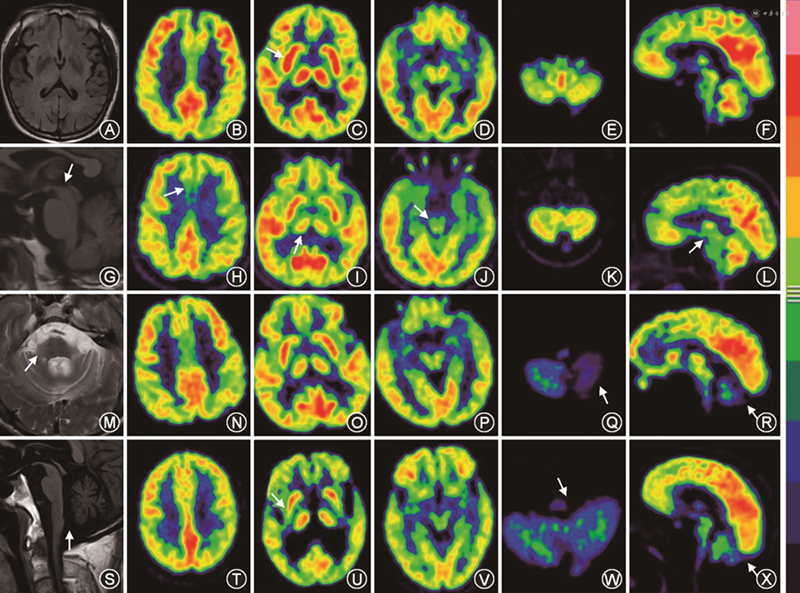

基于上述特点总结,明确了对PS具有鉴别意义的脑区主要包括壳核、尾状核、丘脑、小脑、中脑、额叶、顶叶、颞叶,由于在1例患者的脑内,常常同时出现多个脑区葡萄糖代谢的改变,本研究采用层次分析方法进行诊断,建立“诊断树”模型(图2)。若患者的壳核代谢增高、小脑代谢增高/正常,则诊断为PD;若壳核代谢增高,小脑代谢减低,则诊断为MSA-C;其他具体诊断流程见图2。在320例患者中,使用该模型的诊断结果与临床诊断相符合的为240例(75%)(表4)。采用“诊断树”模型诊断PD的灵敏度为88.75%,特异度为91.25%,阳性预测值77.17%,阴性预测值96.05%;诊断PSP的灵敏度为54.44%,特异度为96.96%,阳性预测值87.50%,阴性预测值84.47%;诊断MSA-C的灵敏度为87.72%,特异度为86.41%,阳性预测值78.13%,阴性预测值92.71%;诊断MSA-P的灵敏度为55.56%,特异度为91.55%,阳性预测值45.45%,阴性预测值94.20%。

注:PD为帕金森病;MSA-C为多系统萎缩-小脑型;PSP为进行性核上性麻痹;MSA-P为多系统萎缩-帕金森型
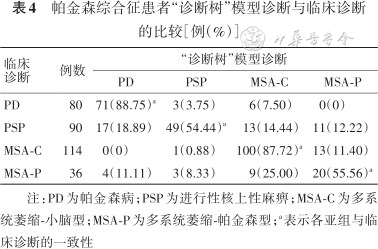
帕金森综合征患者“诊断树”模型诊断与临床诊断的比较[例(%)]
帕金森综合征患者“诊断树”模型诊断与临床诊断的比较[例(%)]
| 临床诊断 | 例数 | “诊断树”模型诊断 | |||
|---|---|---|---|---|---|
| PD | PSP | MSA-C | MSA-P | ||
| PD | 80 | 71(88.75)a | 3(3.75) | 6(7.50) | 0(0) |
| PSP | 90 | 17(18.89) | 49(54.44)a | 13(14.44) | 11(12.22) |
| MSA-C | 114 | 0(0) | 1(0.88) | 100(87.72)a | 13(11.40) |
| MSA-P | 36 | 4(11.11) | 3(8.33) | 9(25.00) | 20(55.56)a |
注:PD为帕金森病;PSP为进行性核上性麻痹;MSA-C为多系统萎缩-小脑型;MSA-P为多系统萎缩-帕金森型;a表示各亚组与临床诊断的一致性
本研究重点分析了不同PS患者脑18F-FDG PET/CT葡萄糖代谢改变情况,并建立“诊断树”模型,通过该“诊断树”模型对不同类型PS患者进行验证,准确率可达75%,既往关于PS的研究中建立“诊断树”模型的研究少见。
在PS诊断中有重要价值的多巴胺功能PET,如多巴胺转运体(dopamine transporter,DAT)PET反映了黑质纹状体的功能,可有效排除非退行性疾病如特发性震颤、药源性PS、血管性PS和阿尔茨海默病,但由于所有退行性PS患者均存在不同程度的多巴胺能示踪剂摄取减少,其在退行性PS鉴别诊断中价值非常有限[14]。相比而言,18F-FDG PET/CT技术更为成熟,国内各级诊疗机构已广泛开展,近年来多项研究显示出特定的疾病葡萄糖代谢模式[15, 16],对PS进行鉴别诊断具有良好的准确性[17, 18]。
既往关于PS脑代谢的研究提示不同类型PS具有各自不同的代谢特点。PD脑代谢改变特点是双侧纹状体(壳核为主、苍白球)、丘脑、小脑、脑桥、运动皮质代谢增高,大脑运动前区皮质、辅助运动区和顶叶代谢减低[12,15,17]。MSA脑代谢改变的特点是双侧额叶下皮质、纹状体(壳核为主)和小脑代谢减低,而感觉运动、顶叶、枕叶的代谢增加,其中MSA-C主要累及小脑,而MSA-P同步累及壳核和小脑[19];PSP特征性代谢改变是中脑、双侧额叶内侧、尾状核、丘脑内侧代谢减低[15,20, 21],而海马、岛叶和颞顶叶的代谢相对增加[20]。本研究结果与既往研究结果不尽相同。本研究发现76.25%的PD患者表现为壳核代谢增高、小脑代谢正常,仅12.5%的PD患者壳核、小脑代谢增高;MSA-C患者的皮质(额、顶、颞、枕叶)代谢改变不明显;部分PSP患者出现顶叶及颞叶代谢减低。这种差异可能与本研究的图像处理方法不同相关。既往的研究多数是基于体素或统计参数图的视觉分析方法[22, 23]或运用独立于观察者的代谢模式自动化分析方法[15],而本研究采用的是直接的视觉分析方法。直接的视觉分析方法优点在于无需特殊图像处理软件即可完成,便于临床医师操作。
上述结果表明,各种PS的代谢改变复杂多变,且不同PS代谢改变可能存在相似。在本研究中,壳核代谢减低作为MSA-P的特征性表现,见于63.9%的MSA-P患者,同样可见于31.1%的PSP患者;中脑代谢减低是PSP的特征性表现,见于55.6%的PSP患者,同样可以出现在33.3%的MSA-P患者中;小脑代谢减低同时作为MSA-C和MSA-P的特征性表现之一,见于99.1%的MSA-C患者和80.6%的MSA-P患者;以上特点严重混淆了鉴别诊断。另外,尽管标准化摄取值可提供一些半定量信息,主成分分析、独立成分分析等方法可提供更直观的信息,但目前PS的18F-FDG PET/CT结果读取仍然依赖有经验的核医学专家整体的视觉分析[12],而掌握了更多临床资料的神经科医师对于影像的解读经验不足[24]。为了让临床医师能更好地借助18F-FDG PET/CT结果来提高PS的诊断和鉴别诊断效能,本研究运用“诊断树”模型,根据不同部位的代谢模式,逐层深入进行分析,最终得出疾病诊断。这种标准化的读片方法有很强的可操作性。即便非运动障碍亚专科医师,根据“诊断树”模型,也能做出高准确率的诊断及鉴别诊断。在本研究的“诊断树”模型中,鉴别PD的灵敏度高达88.75%,与既往较为复杂的图形处理方法有相似的灵敏度(83%~86%)[25]。各类PS疾病诊断特异度均较高(86.41%~96.96%)。但是在该“诊断树”模型中,PSP及MSA-P的灵敏度较低。PSP灵敏度低可能与PSP疾病本身复杂性有关,PSP表型众多,不同表型皮质及皮质下代谢模式不尽相同,难以统一。而MSA-P在本研究中例数相对较少,对于其结果的解释需谨慎,这同时也是本研究的局限性。
综上所述,PD/aPS的早期诊断对疾病治疗策略的制定和患者预后有重要的影响,18F-FDG PET/CT可为疾病的鉴别诊断提供重要的客观依据,作为目前国内广泛开展的检查手段,在PS中的应用前景广阔。基于18F-FDG PET/CT结果的“诊断树”模型,有助于快速对PS患者进行诊断分类,为临床诊断提供更多的帮助,提高神经内科医师对于PS的鉴别诊断能力,具有很高的实用价值。
古祺, 陈淑芬, 陈科良, 等. 脑18F-FDG PET/CT显像在帕金森综合征诊断及鉴别诊断中的临床应用价值[J]. 中华医学杂志, 2023, 103(41): 3294-3300. DOI: 10.3760/cma.j.cn112137-20230707-01181.
所有作者声明不存在利益冲突



























