
探讨INHBA在结直肠癌中的表达及其与微卫星状态、临床病理特征之间的关系。
基于基因表达综合(GEO)数据库及基因表达谱交互分析(GEPIA)数据库进行生物信息学分析,选定结直肠癌差异表达预后相关目标基因。收集2016年1月至2022年6月于锦州医科大学附属第三医院行手术治疗的107例结直肠癌患者蜡块组织,制备组织芯片,采用免疫组织化学法检测结直肠癌组织中微卫星状态[错配修复(MMR)蛋白MLH1、MSH2、MSH6、PMS2均为阳性表达为错配修复完整(pMMR),代表微卫星低度不稳定或微卫星稳定;若其中任何一个指标为阴性,则判定为错配修复缺陷(dMMR),代表微卫星高度不稳定]和INHBA的表达情况。回顾性分析患者临床病理资料,分析INHBA与微卫星状态及临床病理特征之间的关系。
从GEO数据库筛选出结直肠癌3个数据集:GSE110223(13个癌组织、13个癌旁组织)、GSE110224(17个癌组织、17个癌旁组织)、GSE113513(14个癌组织、14个癌旁组织),筛选出癌组织和癌旁组织间差异表达上调和下调的前50个基因,经韦恩图分析3个数据集的交集基因,筛选出上调基因12个,下调基因17个;根据GEPIA数据库,共有的上调和下调差异基因中AQP8、ZG16、INHBA基因与结直肠癌预后相关,INHBA在结直肠癌组织中表达水平较癌旁(距肿瘤边缘≥5 cm)组织高(P<0.05),选定INHBA基因进行分析。对收集的结直肠癌蜡块组织进行免疫组织化学检测显示,结直肠癌组织INHBA高表达患者比例高于癌旁组织INHBA高表达患者比例[85.05%(91/107)比67.29%(72/107),P<0.05]。癌组织INHBA高表达与病灶部位[右半结肠比左半结直肠:94.00%(47/50)比77.19%(44/57)]、肿瘤长径[>5 cm比≤5 cm:92.73%(51/55)比76.92%(40/52)]、浸润深度[T3~4期比T1~2期:96.43%(54/56)比72.55%(37/51)]、分化程度[低、中分化比高分化:91.04%(61/67)比75.00%(30/40)]、淋巴结转移[是比否:93.02%(40/43)比78.13%(50/64)]均有关(均P<0.05),与年龄、性别、脉管癌栓、神经侵犯情况均不相关(均P>0.05)。pMMR组结直肠癌组织INHBA高表达患者比例高于dMMR组患者[93.22%(55/59)比75.00%(36/48),χ2=6.91,P=0.008]。
INHBA在结直肠癌组织中高表达,并且高表达的INHBA与结直肠癌的临床病理特征以及微卫星状态密切相关;INBHA可能为结直肠癌诊断、治疗及预后的新标靶。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是全球常见的恶性肿瘤之一,严重威胁人类的健康,有着预后差、5年生存率低的特点[1],主要与大多数患者发现时即为晚期、缺乏有效的治疗方式有关[2]。目前微卫星重复为结直肠癌临床上常用的检测指标,微卫星不稳定性(MSI)对结直肠癌患者的预后和治疗以及林奇综合征的筛查均有重要的指导意义[3,4],而新型生物标志物的研究仍然是许多癌症的研究热点。INHBA基因能通过调控TGF-β/Smad信号通路参与肿瘤的发生、发展,还可以通过诱导上皮间质转化、促进血管生成、表观遗传改变等作用机制促进恶性肿瘤的侵袭、转移[5,6]。2022年中国临床肿瘤学会(CSCO)结直肠癌病理诊断原则指出,MSI多由错配修复(MMR)基因突变及功能缺失导致,也可以通过检测MMR蛋白缺失来反映MSI状态。一般而言,错配修复缺陷(dMMR)相当于微卫星高度不稳定(MSI-H),错配修复完整(pMMR)相当于微卫星低度不稳定(MSI-L)或微卫星稳定(MSS)。本研究通过生物信息学方法筛选并结合免疫组织化学法验证,研究INHBA在结直肠癌中的表达水平及其与临床病理特征、微卫星状态的关系,以期为结直肠癌的诊断、治疗及评估预后提供理论和实验支持。
(1)基因表达综合(GEO)数据库芯片筛选:检索NCBI数据库(https://www.Ncbi.Nlm.Nih.gov/),选择GEO Datasets,检索Colorectal cancer,物种选择Homo sapiens,共检索出15 179个芯片,选取2020年1月至2022年6月的芯片。最终确定结直肠癌3个数据集,分别为GSE110223(13个癌组织、13个癌旁组织)、GSE110224(17个癌组织、17个癌旁组织)、GSE113513(14个癌组织、14个癌旁组织),3组共纳入88个样本。(2)差异基因筛选:进入芯片数据库,选择GEO数据库自带分析工具Analyze with GEO2R,点击Define groups进行分组,将数据分为癌组织和癌旁组织两组,点击Analyze进行分析,保存分析数据,以logFC>0为上调基因,以logFC<0为下调基因,分别筛选出上调和下调的前50个癌组织和癌旁组织间差异表达的基因。使用R语言对差异表达基因绘制火山图,并标注明显差异表达基因。(3)绘制韦恩图:采用制作软件venny2.1对检索出的差异基因绘制韦恩图,查找3个数据集共有基因。(4)共有基因预后分析:进入基因表达谱交互分析(GEPIA)数据库,选择single gene analysis,点击进入survival analysis,分析共有基因与结直肠癌预后患者的相关性。
收集2016年1月至2022年6月于我院进行结直肠癌手术的107例患者蜡块组织,包括癌组织和距肿瘤至少5 cm的癌旁组织。纳入标准:经病理检查明确诊断为结直肠癌;术前未接受化疗或放疗;临床病理资料完整。排除标准:手术围期出现严重并发症;非原发性肿瘤或合并其他恶性肿瘤、重要脏器疾病;未接受手术治疗;行新辅助治疗。本研究经锦州医科大学附属第三医院医学伦理委员会批准(批准文号:KX2022011),所有患者及家属均签订知情同意书。
根据之前对107例结直肠癌组织标本行微卫星状态相关蛋白(检测MLH1、MSH2、MSH6、PMS2蛋白)免疫组织化学染色结果将107例标本分成pMMR组和dMMR组。在107例结直肠癌的癌组织切片中挑选最具代表性的位点,找到切片对应的蜡块并进行标记,精准穿刺,用直径2 mm的采样针钳取组织块,按照预先排好的阵列将对应的组织块放入空白蜡块中,组织芯片蜡块微卫星pMMR组和dMMR组各1个,然后使用切片机以3 μm厚进行切片。
将组织芯片蜡块切片在75 ℃恒温烤箱中烘烤60 min,放入梯度二甲苯及乙醇溶液中进行脱蜡,之后用磷酸盐缓冲液(PBS)、自来水冲洗;将切片放入乙二胺四乙酸(EDTA)抗原修复液中,用高压锅煮沸,待自然冷却后用PBS冲洗;加入内源性过氧化物酶阻断剂,室温下反应15 min;加入按照1∶150比例稀释的抗INHBA抗体或微卫星状态相关指标MLH1、MSH2、MSH6、PMS2的抗体(武汉三鹰生物技术有限公司)(用以验证之前免疫组织化学法检测结果,如与之前不一致,另选位点进行检测至一致),室温下反应60 min,PBS冲洗;室温下滴加相应二抗(福州迈新生物技术开发有限公司);DAB显色(福州迈新生物技术开发有限公司)和对比染色后用中性树胶封片,在光学显微镜下观察。
免疫组织化学结果由两名高年资主治及以上医师判定。(1)INHBA定位于细胞质,以细胞质呈现黄色、棕黄色、棕褐色为阳性。阳性细胞比例评分:阳性细胞占比<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色强度评分:未显色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,黑褐色为4分。将两项得分相乘为最终评分,其中0分为阴性,1~2分为弱阳性,3~4分为中等阳性,≥6分为强阳性;阴性和弱阳性判定为低表达,中等阳性和强阳性判定为高表达。(2)MLH1、MSH2、MSH6、PMS2均以肿瘤细胞核出现明显强于周围间质细胞的黄色、棕黄色、棕褐色为阳性。若MLH1、MSH2、MSH6、PMS2均为阳性表达,则判定为pMMR;若其中任何一个指标为阴性,则判定为dMMR。
差异基因的预测采用R语言进行统计学分析,采用limma包,以|log2差异倍数|≥0为标准对差异表达基因进行鉴定;采用Kaplan-Meier法进行总生存(OS)分析,P<0.05为差异具有统计学意义。采用SPSS 22.0统计软件分析我院临床数据。计数资料以频数(%)表示,组间比较用配对χ2检验或χ2检验,以P<0.05为差异有统计学意义。
GEO数据库中,从GSE110223数据集26个样本中共筛选出22 283个差异基因,其中上调基因10 962个,下调基因11 321个;从GSE110224数据集34个样本中共筛选出54 675个差异基因,其中上调基因29 031个,下调基因25 644个;从GSE113513数据集28个样本中共筛选出49 395个差异基因,其中上调基因27 368个,下调基因22 027个(图1)。在3个数据集筛选结果中分别选择上调和下调基因各前50个,经韦恩图分析,有29个共同基因,其中上调基因12个,分别为MMP3、INHBA、REG1A、CEMIP、MMP1、COL11A1、CXCL8、SERPINB5、CXCL3、CDH3、TACSTD2、TRIM29;下调基因17个,分别为CLCA4、MS4A12、AQP8、CA1、CA4、ADH1B、GUCA2A、CLDN8、ABCA8、GUCA2B、ZG16、CEACAM7、ABCG2、CD177、ADH1C、SLC26A2、MT1M。
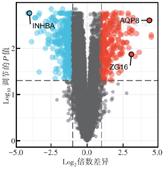

注:GEO为基因表达综合;蓝色代表上调,红色代表下调,黑色代表表达无差异
在GEPIA数据库中分析从GEO数据库筛选的共有差异基因与结直肠癌患者OS的相关性,结果显示AQP8、ZG16、INHBA基因表达水平与OS密切相关;其中,INHBA基因低表达结直肠癌患者OS好于INHBA基因高表达患者(P=0.045)(图2A)。对以上3个基因进行癌及癌旁组织差异表达预测,发现INHBA在结直肠癌组织中高表达,差异具有统计学意义(P<0.05)(图2B)。故选择INHBA基因进一步分析。
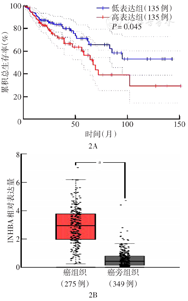

注:GEPIA为基因表达谱交互分析;aP<0.05
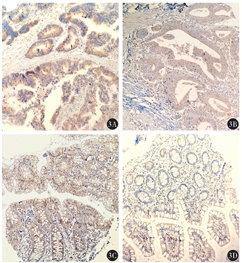
107例结直肠癌组织及配对的癌旁组织中,INHBA蛋白主要定位于细胞质中(图3),结直肠癌组织INHBA高表达患者比例高于癌旁组织INHBA高表达患者比例[85.05%(91/107)比67.29%(72/107)],差异有统计学意义(χ2=9.29,P=0.002)。

结直肠癌组织中INHBA的表达水平与肿瘤发生部位、浸润深度、分化程度、长径、淋巴结是否转移均有关(均P<0.05),与年龄、性别、有无脉管癌栓、是否神经侵犯均无关(均P>0.05)(表1)。微卫星dMMR组INHBA高表达患者比例低于pMMR组(P=0.008)。
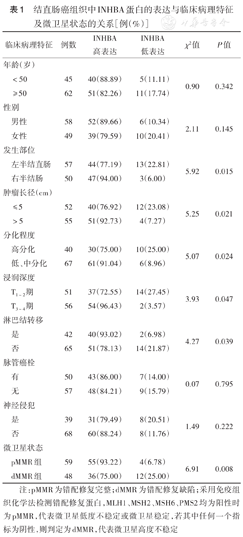
结直肠癌组织中INHBA蛋白的表达与临床病理特征及微卫星状态的关系[例(%)]
结直肠癌组织中INHBA蛋白的表达与临床病理特征及微卫星状态的关系[例(%)]
| 临床病理特征 | 例数 | INHBA高表达 | INHBA低表达 | χ2值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁) | |||||
| <50 | 45 | 40(88.89) | 5(11.11) | 0.90 | 0.342 |
| ≥50 | 62 | 51(82.26) | 11(17.74) | ||
| 性别 | |||||
| 男性 | 58 | 52(89.66) | 6(10.34) | 2.11 | 0.145 |
| 女性 | 49 | 39(79.59) | 10(20.41) | ||
| 发生部位 | |||||
| 左半结直肠 | 57 | 44(77.19) | 13(22.81) | 5.92 | 0.015 |
| 右半结肠 | 50 | 47(94.00) | 3(6.00) | ||
| 肿瘤长径(cm) | |||||
| ≤5 | 52 | 40(76.92) | 12(23.08) | 5.25 | 0.021 |
| >5 | 55 | 51(92.73) | 4(7.27) | ||
| 分化程度 | |||||
| 高分化 | 40 | 30(75.00) | 10(25.00) | 5.07 | 0.024 |
| 低、中分化 | 67 | 61(91.04) | 6(8.96) | ||
| 浸润深度 | |||||
| T1~2期 | 51 | 37(72.55) | 14(27.45) | 3.93 | 0.047 |
| T3~4期 | 56 | 54(96.43) | 2(3.57) | ||
| 淋巴结转移 | |||||
| 是 | 42 | 40(93.02) | 2(6.98) | 4.27 | 0.039 |
| 否 | 65 | 51(78.13) | 14(21.87) | ||
| 脉管癌栓 | |||||
| 有 | 50 | 43(86.00) | 7(14.00) | 0.07 | 0.795 |
| 无 | 57 | 48(84.21) | 9(15.79) | ||
| 神经侵犯 | |||||
| 是 | 39 | 31(79.49) | 8(20.51) | 1.49 | 0.222 |
| 否 | 68 | 60(88.24) | 8(11.76) | ||
| 微卫星状态 | |||||
| pMMR组 | 59 | 55(93.22) | 4(6.78) | 6.91 | 0.008 |
| dMMR组 | 48 | 36(75.00) | 12(25.00) |
注:pMMR为错配修复完整;dMMR为错配修复缺陷;采用免疫组织化学法检测错配修复蛋白,MLH1、MSH2、MSH6、PMS2均为阳性时为pMMR,代表微卫星低度不稳定或微卫星稳定,若其中任何一个指标为阴性,则判定为dMMR,代表微卫星高度不稳定
癌症是全世界范围内一个重大的公共卫生挑战。根据美国癌症协会2022年的统计数据,结直肠癌是癌症死亡的第2大原因,且50岁以下成年人的结直肠癌发病率正在上升[7]。因此,为了改善生存结局,迫切需要有效的结直肠癌筛选及治疗方法。随着医学的发展,分子靶向药物及免疫治疗的应用为肿瘤患者带来了曙光,但并不是所有患者都能从中获益,中晚期结直肠癌患者的5年生存率仍然不尽如人意[8,9]。怎样才能预估患者治疗效果,最大限度地节约资源,避免资源浪费值得探讨。随着个体化治疗的不断发展,一些生物标志物被发现并用于预估靶向和免疫治疗的疗效,为结直肠癌的精准治疗提供了方向。
随着基因测序技术的深入研究和快速发展,GEO和GEPIA等数据库在生物信息学分析中发挥着越来越重要的作用,越来越多的新型生物标志物被挖掘出来。INHBA基因位于染色体7p15-p14上,由两个外显子组成,是转化生长因子β(TGF-β)家族的成员,INHBA与其他亚基形成二聚体激活素,在下丘脑-垂体-性腺轴中发挥重要作用[10,11,12]。INHBA基因在胃癌、食管癌、卵巢癌、乳腺癌等组织中都有表达[13,14,15,16]。随着近年来研究的深入,研究者发现INHBA基因与结直肠肿瘤的发生、发展密切相关。He等[17]运用癌症基因组图谱(TCGA)数据库分析INHBA的表达及评估其与结直肠癌患者预后的相关性,结果显示,INHBA基因在结直肠癌组织中高表达,并且与INHBA低表达者相比,INHBA高表达者复发率显著升高;随后对从临床搜集的150例结直肠癌患者进行免疫组织化学检测并随访,证实了INHBA高表达的患者生存期较短;之后进行的结直肠癌细胞实验结果也显示,敲低INHBA-1的结直肠癌细胞中TGF-β通路相关分子的表达被抑制。这些结果表明INHBA高表达可以促进结直肠肿瘤细胞增殖、迁移和侵袭,是结直肠癌患者预后不良的危险因素,因此,INHBA可能是结直肠癌治疗的潜在目标。但是,关于INHBA基因与结直肠癌患者临床病理特征以及与微卫星状态之间关系的研究国内鲜见报道。
本研究通过对GEO和GEPIA数据库联合分析,发现INHBA在结直肠癌组织中高表达,且与患者预后密切相关。然而从GEO数据库挖掘出的3个芯片集是由国外学者研究发表的,对国内结直肠癌的研究是否同样适用还需要进一步验证。我们还从临床收集了107例结直肠癌组织及与其配对的癌旁组织,为了降低实验误差、节约经费,我们先将其制成组织芯片,再进行免疫组织化学染色。结果显示,癌组织INHBA高表达患者的比例明显高于其配对的癌旁组织,这一结果与前期预测相符,提示INHBA可能与结直肠癌的发生有关。进一步分析发现,结直肠癌浸润越深、分化程度越低、肿瘤长径越大、存在淋巴结转移,癌组织INHBA的高表达患者比例就越高,这与Li等[18]的研究结果一致。同时,我们还发现INHBA可能在右半结肠癌的发生和演进过程中发挥重要作用,与周薇等[19]研究结果一致。在近期Qu等[20]报道的研究中,他们采用第三代测序技术对mRNA谱进行了全面的研究,证明了INHBA在结直肠癌细胞中显著增加,更重要的是,它是识别dMMR(MSI)的潜在生物标志物。我们根据MMR相关蛋白表达情况,将结直肠癌组织标本分为pMMR和dMMR组,分析INHBA与微卫星状态的关系。结果显示,与dMMR组相比,pMMR组INHBA高表达患者比例明显升高,可能是环境因素、种族或者饮食习惯等存在差异所致。
本研究中关于结直肠癌中INHBA与微卫星状态相关性及作用的研究还处于组织学阶段,后续将对患者进行随访,来验证数据库中INHBA与结直肠癌预后的相关性,并在细胞及癌组织和癌旁组织INHBA蛋白表达丰度变化等方面进一步研究INHBA基因在结直肠癌发病中的可能机制。INHBA基因有望成为预估结直肠癌侵袭、转移及预后的重要生物标志物。
所有作者均声明不存在利益冲突



























