
探讨稳定的猪-猴异种原位全肝移植模型制作方法,为异种肝移植的临床前研究提供良好的实验工具。
回顾性分析中南大学湘雅二医院异种肝脏移植研究团队施行的7例猪-猴异种原位全肝移植的围手术期情况及结局。供体选用基因编辑的版纳小型猪,受体选用解剖特征、生理生化及免疫机制同人类十分接近的恒河猴。在参照临床经典原位全肝移植术式的基础上,进行猪-猴异种原位全肝移植术,并对手术过程进行改进,以减少术中出血、缩短无肝期。在胆管插管留置外引流,以观察胆汁分泌情况。术前免疫诱导采用"抗胸腺细胞球蛋白+利妥昔单抗+眼镜蛇毒因子+他克莫司";术后免疫维持采用"他克莫司+吗替麦考酚酯+甲泼尼龙",同时给予抗菌抗病毒治疗、输注凝血酶调节受体凝血功能。
共行猪-猴异种原位全肝移植7例,在建模成熟稳定的第7例模型制作中,供体获取手术时间42 min,无热缺血时间,供体修整时间87 min,供体冷保存时间为128 min;受体手术时间123 min,无肝期27 min,肝下下腔静脉阻断38 min,手术全程出血量约10 ml。术后存活4例,术后最长存活时间为27 h。3例未存活模型中,1例为麻醉意外,2例为早期手术练习。第7例模型受体术后分泌胆汁86 ml。
良好的供体获取、高质量的血管吻合、术中减少出血量、缩短无肝期、严格的液体管理及细致全面的监护是提高猪-猴异种肝移植模型成功率的关键,优化供体基因组合及合理免疫抑制方案是进一步实现猪-猴异种肝移植模型长期存活的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
移植是治疗急慢性肝衰竭、晚期肝硬化等终末期肝病唯一有效的治疗手段。在中国,每年有20余万人在等待进行肝移植,但因供体短缺,仅70 00例左右的患者能够获得肝脏供体,绝大多数患者在等待供体的过程中死亡[1]。因此,解决肝脏供体短缺问题是关乎国计民生,满足人类生命健康的重大需求。异种移植作为解决器官短缺最具潜力的方法之一,一直是生物医学领域关注的焦点,而且随着现代大动物基因编辑技术、免疫学、畜牧学的发展,阻碍异种移植临床应用的免疫排斥、生物安全性等问题正逐步得到解决。
Calne[2]从1968年就开始了基于大动物异种肝移植模型的实验研究。由于具有传代周期短、生长快速、肝脏等实体器官解剖生理结构与人类相似等优势,小型猪被认为是最理想的异种移植供体来源[3]。但猪器官移植到人类或非人灵长类动物体内后可能会引发多种生物学障碍,包括免疫排斥、补体攻击移植物、凝血功能障碍和顽固的炎症反应等,单独依赖药物治疗不仅难以完全克服,还伴随着一系列的药物毒性。随着基因编辑技术的迅猛发展,转基因供体猪越来越多地应用到异种移植领域,取得了不错的效果,如运用CRISPR-Cas9技术灭活猪内源性逆转录病毒[4],敲除猪的β2M和CIITA基因降低T细胞免疫应答[5]等,显著提高了供体器官的安全性和实用性。
转基因猪供体肝脏原位移植到非人灵长类动物受体并能获得长期生存,是将转基因猪肝脏应用于临床的前期基础和必要条件。中南大学湘雅二医院异种肝脏移植研究团队在学习国内外各种猪-猴异种肝脏移植模型方法的基础上,尝试对手术过程进行改进,以减少术中出血、缩短无肝期,现报道如下。
供体为云南农业大学魏红江教授团队采用CRISPR/Cas9体细胞克隆及SCNT胚胎植入技术进行基因编辑的版纳小型猪,雄性,年龄2~5个月,体质量4~5 kg,基因型见表1。受体恒河猴为云南农业大学魏红江教授团队提供(来自中科院昆明动物研究所),雄性,年龄7~13岁,体质量约10 kg。为保证动物模型的顺利完成,供受体体质量比控制范围1∶2~1∶4,且供、受体动物的淋巴细胞毒性试验均为阴性。本实验中所用动物的使用和饲养均遵循了国家有关实验动物管理和使用规定。本研究已获得中南大学湘雅二医院实验动物伦理审查委员会审查批准(批准号:2021098)。
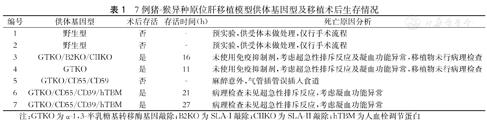
7例猪-猴异种原位肝移植模型供体基因型及移植术后生存情况
7例猪-猴异种原位肝移植模型供体基因型及移植术后生存情况
| 编号 | 供体基因型 | 术后存活 | 存活时间(h) | 死亡原因分析 |
|---|---|---|---|---|
| 1 | 野生型 | 否 | - | 预实验,供受体未做处理,仅行手术流程 |
| 2 | 野生型 | 否 | - | 预实验,供受体未做处理,仅行手术流程 |
| 3 | GTKO/B2KO/CIIKO | 是 | 16 | 未使用免疫抑制剂,考虑超急性排斥反应及凝血功能异常,移植物未行病理检查 |
| 4 | GTKO | 是 | 11 | 未使用免疫抑制剂,考虑超急性排斥反应及凝血功能异常,移植物未行病理检查 |
| 5 | GTKO/CD55/CD59 | 否 | - | 麻醉意外,气管插管误插入食道 |
| 6 | GTKO/CD55/CD39/hTBM | 是 | 21 | 病理检查未见超急性排斥反应,考虑凝血功能异常 |
| 7 | GTKO/CD55/CD39/hTBM | 是 | 27 | 病理检查未见超急性排斥反应,考虑凝血功能异常 |
注:GTKO为α-1,3-半乳糖基转移酶基因敲除;B2KO为SLA-I敲除;CIIKO为SLA-II敲除;hTBM为人血栓调节蛋白
抗胸腺细胞免疫球蛋白、地塞米松、甲氧氯普胺、苯海拉明、多巴胺、利妥昔单抗(CD20单抗)、他克莫司、眼镜蛇毒因子(cobra venom factor,CVF)、甲泼尼龙、吗替麦考酚酯(mycophenolate mofetil,MMF)、前列地尔、西维来司他钠、甲磺酸加贝脂、埃索美拉唑、头孢唑林、更昔洛韦、布托啡诺、异氟烷(1.0%~1.5%)、低分子肝素、5%葡萄糖、0.9%氯化钠。
术前禁食12 h,不禁饮,术前半小时肌肉注射阿托品0.04 mg/kg,术前15 min肌肉注射盐酸替来他明盐酸唑拉西泮7~15 mg/kg。
术前予以免疫诱导,术前3 d应用抗胸腺细胞免疫球蛋白,术前2 d应用CD20单抗和他克莫司0.2 mg·kg-1·d-1,术前1 d应用CVF 100 μg/kg。术前禁食12 h,不禁饮,术前半小时肌肉注射阿托品0.01 mg/kg,术前15 min肌肉注射氯胺酮20 mg/kg。
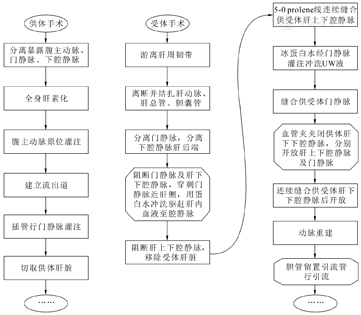

将供体镇静后,仰卧位固定于手术床,异氟烷气体面罩麻醉。手术区备皮,耳缘静脉置入留置针,保持呼吸机辅助通气。手术区域消毒;取腹部十字切口,暴露腹腔;分离暴露腹主动脉、门静脉、下腔静脉、胆管;离断镰状韧带、三角韧带,注意不损伤膈静脉;分离下腔静脉与肝脏周围间隙组织;全身肝素化;腹主动脉根部结扎,切开腹主动脉插入灌注管,剪开膈肌,夹闭降主动脉,开始原位灌注;剪开右心房、肝下下腔静脉建立流出道;分离肠系膜上静脉,插管行门静脉灌注;切取供体肝脏:先离断胆道、门静脉,至腹主动脉处离断肝动脉;将切下的肝脏保存于装满复方氯化钠沙冰的盆内,进行供肝修整。
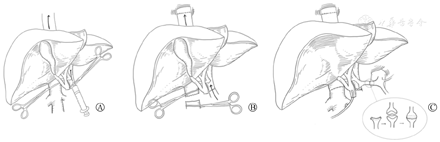
既往的异种原位移植手术中,一般是先完成肝上腔静脉的吻合,再吻合肝下腔静脉和门静脉;进行肝脏再灌注后,将供体肝动脉与受体肝动脉端端吻合;最后完成供、受体胆管的端端吻合[6,7,8]。在此基础上,本研究团队经过一系列实践,总结出以下3点改进方案:(1)为减少术中出血,在阻断门静脉及肝下下腔静脉后,穿刺门静脉近肝侧,用蛋白水冲洗驱赶肝内血液至腔静脉,然后阻断肝上下腔静脉,切除受体肝脏,将受体肝脏内残余血液回收至受体体内(图2A);(2)为缩短无肝期,在吻合完成供受体肝上下腔静脉及门静脉后即开放,再吻合肝下下腔静脉(图2B);(3)应用供体腹腔干与脾动脉做血管瓣与受体肝固有动脉与胃十二指肠动脉做血管瓣吻合(图2C)。

具体手术流程如下:将动物带至手术室,面罩下异氟烷麻醉诱导后予以外周静脉置管,气管插管,维持麻醉及呼吸机辅助呼吸;颈内静脉置管,动脉置管监测有创血压。手术区域备皮、消毒;取上腹部奔驰样切口,逐层入腹;游离肝脏周围韧带;游离左右肝动脉、肝固有动脉及肝总动脉和胃十二场动脉起始部,结扎离断左右肝动脉;离断并结扎肝总管、胆囊管;分离门静脉,上至左右分叉处、下至肝总动脉边缘;分离下腔静脉肝后端,小心分离肾上腺,端扎肾上腺静脉;阻断门静脉及肝下下腔静脉后,穿刺门静脉近肝侧,用蛋白水冲洗驱赶肝内血液至腔静脉,阻断肝上下腔静脉,分别离断门静脉、肝上下腔静脉及肝下下腔静脉;充分止血;将肝上下腔静脉与肝静脉残端成型,5-0 prolene线连续缝合供受体肝上下腔静脉;冰蛋白水经门静脉灌注冲洗UW液;7-0 prolene线连续缝合供受体门静脉;血管夹夹闭供体肝下下腔静脉,分别开放肝上下腔静脉及门静脉,温水复温;止血后,6-0 prolene线连续缝合供受体肝下下腔静脉,并开放;应用供体腹腔干与脾动脉成型的动脉瓣和受体肝固有动脉与胃十二指肠动脉成型的动脉瓣,8-0 prolene线连续缝合;胆管留置引流管行外引流;充分止血后逐层关腹。
在建模成熟的第6、7例模型中,术后采用他克莫司0.2 mg·kg-1·d-1、甲泼尼龙10 mg·kg-1·d-1、MMF 110 mg·kg-1·d-1进行免疫抑制治疗。同时给予头孢唑林50 mg·kg-1·d-1抗菌、更昔洛韦10 mg·kg-1·d-1抗病毒治疗、输注凝血酶调节受体凝血功能。
详细记录建模各阶段手术资料与术中供体获取手术时间、无热缺血时间、供体修整时间、供体冷保存时间、受体手术时间、无肝期、手术出血量;术后严格记录受体生命体征、存活时间及胆汁分泌情况,并于新肝灌注后1 h检测血常规、肝肾功能电解质、凝血、体液、细胞免疫、细胞因子;供体病理检测分别于灌注后1 h及受体死亡后进行。
共行猪-猴异种原位全肝移植7例,第1、2例为预实验,供受体未做特殊处理,仅行手术流程;第3、4例受体未使用免疫抑制剂;第5例出现麻醉意外;第6、7例,严格按照模型制作流程进行。在建模成熟稳定的第7例模型制作中,供体获取手术时间为42 min,无热缺血时间,供体修整时间为87 min,供体冷保存时间为128 min,受体手术时间为123 min,无肝期为27 min,肝下下腔静脉阻断时间为38 min,手术全程出血量约10 ml。7例模型术后存活4例,术后最长存活时间为27 h;3例未存活模型中,1例为麻醉意外,2例为早期手术练习(表1)。第7例模型术后分泌86 ml血性胆汁。移植肝术后病理活检结果显示,在供肝灌注后1 h及受体死亡2个时间节点,供肝中免疫排斥及补体激活均不明显,未发生血栓栓塞;相较于灌注后1 h,受体死亡时供肝的肝窦淤血加重,坏死肝细胞增多(图3)。但门管区内未见炎症细胞浸润、小叶间胆管炎,未见小叶间静脉和小叶间动脉内膜炎,小叶间动、静脉和肝小叶内中央静脉均未见血管内血栓栓塞。


二十世纪九十年代,美国医生开始了异种肝脏移植的临床应用。1992年Starzl等[9]尝试将2例狒狒的肝脏移植给了人类受者,结果第1例受者于术后70 d死于复合性感染,第2例受者于术后26 d死于胆道并发症腹膜炎。同年,美国另一家医院尝试将猪肝脏临时移植给一位暴发性肝昏迷的受者,结果受者在完成移植24 h后死亡[10]。异种肝脏移植尝试的失败,引发了不少争议,最终导致异种肝脏移植的临床应用被停止。
目前,异种移植的重点转向了以猪作为供体、非人灵长类动物作为受体的临床前研究。在各种类型的动物模型中,原位移植所面临的困难很多,但原位移植仍然是移植向临床转化的必经之路[11]。近年来,得益于基因编辑领域的技术突破和新型共刺激信号阻断免疫抑制剂的研发,异种器官移植领域取得了许多突破性进展[12]。截至成稿,异种肾移植的最长存活时间为499 d[13],原位心脏移植的最长存活时间为199 d[14]。而肝脏移植的存活期明显短于其他实体器官,当前最长存活时间为29 d[7]。我国异种肝脏移植研究的起步较晚,但近年也取得了较快发展,为更好推进我国异种肝脏移植研究,中南大学湘雅二医院异种肝脏移植团队开始了建立基因编辑猪-猴原位全肝移植模型的尝试。
在猪-猴异种全肝移植模型制作过程中,手术失血过多和无肝期过长是导致模型制作失败的关键原因。本研究团队在模型制作过程中针对这2个关键因素在传统手术方法的基础上加以改进。第一,为减少失血,本研究团队在阻断门静脉及肝下下腔静脉后,穿刺门静脉近肝侧,用蛋白水冲洗驱赶肝内血液至腔静脉,然后阻断肝上下腔静脉,切除受体肝脏,成功将受体肝脏内残余血液回收至受体体内;第二,为缩短无肝期,本研究团队在吻合完成供受体肝上下腔静脉及门静脉后即分别开放,然后吻合肝下下腔静脉。最终,在第7例模型制作中,本研究组成功的将无肝期控制在了27 min。
移植术后受体生存时间是评估免疫抑制方案、免疫耐受诱导手段、凝血异常干预措施、转基因供体肝脏移植效果等最为直观的指标[15]。本次研究所建模型中,受体存活时间最长的仅27 h,考虑为先天性免疫细胞或抗体介导的超急性/急性排斥反应激活凝血系统,导致严重的凝血异常,最终受体死亡。分析其主要原因为:(1)受限于可供选择的受体(恒河猴)数量较少等因素,术前供受体配型达不到很理想的结果,受体体内含有较多针对供体的天然抗体,这可能是诱发超急性/急性排斥反应的主要原因;(2)CVF的应用虽然在一定程度上耗竭了受体体内的补体系统,但供体来源的补体以及受体体内残存的补体,仍会促进排斥反应;(3)凝血调节相关基因在异种肝移植中的需求较高,单纯的凝血调节蛋白基因(thrombomodulin,TBM)无法控制异种肝移植受体体内的凝血异常;(4)受体体内炎症风暴,促进了受体体内凝血异常反应及排斥反应,并导致受体急性肾功能衰竭及其他重要脏器的损伤,加快了受体的死亡。
为更好地延长异种肝移植受体的生存时间,可以加强多项干预:(1)严格筛查术前供受体配型;(2)调整CVF应用方案,术后加用CVF,彻底抑制早期补体系统激活;(3)应用其他调节凝血异常的基因供体或多基因调节凝血的供体;(4)应用抗炎症风暴药物方案。
另外,严格的液体管理有利于术中、术后循环系统稳定,提高存活率。术中严格控制液体入量,保持出入平衡,如果输入大量的晶体液和胶体液,极易导致急性肺水肿和左心衰竭。同时,术前应充分备血,以供术中和术后使用。如有条件尽量避免输注全血,以防白细胞引发排斥反应;无法进行血液成分分离时,可应用射线照射血液,以降低输血可能带来的免疫排斥反应。本研究组在建模术中,严格控制液体出入量,术中均未行输血处理。第6、7例受体术后出血凝血功能障碍导致血色素降低后,输注了同型全血200 ml。
目前认为,对于临床试验而言,基因编辑供体猪的"α-1,3-半乳糖基转移酶基因敲除/β-1,4-N-乙酰半乳糖氨酸转移酶2基因敲除/CMP-N-乙酰肌苷羟化酶基因敲除"(GTKO/β4GalNT2-KO/CMAH-KO)是必需的,在此基础上适当转入人源化的补体抑制因子、凝血调节因子和抗炎抗吞噬因子会在一定程度上改善移植物功能[16]。
有赖于α-1,3-半乳糖基转移酶基因敲除猪供体的使用及CD40抗体、贝拉希普及术后人凝血因子复合物,目前美国麻省总医院的研究团队已将猪-非人灵长类动物异种肝移植的存活时间延长至29 d[7]。国内杭州启函生物科技有限公司和云南农业大学动物医学院已成功培育出实现了"13种基因编辑"的基因编辑猪,该基因编辑小型猪除完全敲除了猪内在性反转录病毒,还敲除了诱发异种超急性排斥反应的3个主要抗原,并导入了9个人源化基因,很大程度上减轻了异种移植的排斥反应[12]。本研究中第6、7例模型制作中应用的供体基因型为GTKO/CD55/CD39/hTBM,未见超急性排斥反应的发生。
目前认为,对于供体猪的基因编辑并不是越多越好,过多的基因编辑不仅会降低供体猪的存活率,还会增加新异种抗原暴露的机会。此外需要注意的是,基因编辑可缩小但不能完全消除供受体的种间差异,有效的免疫抑制治疗仍是必须的。有研究采用他克莫司+MMF+甲泼尼龙+CD40抗体的免疫抑制方案,取得了不错的效果[12]。但还需要更为优化的免疫抑制方案促进异种肝脏移植受体的长期存活。
总之,良好的供体获取、高质量的血管吻合、减少术中出血量、缩短无肝期、严格的液体管理及细致全面的监护是提高猪-猴异种肝移植模型成功率的关键,优化供体基因组合及合理免疫抑制方案的制定是进一步实现猪-猴异种肝移植模型长期存活的关键。
所有作者声明无利益冲突



























