
肿瘤免疫治疗已成为继手术、放疗和化疗之后癌症的主要治疗方法。随着对肿瘤免疫学、细胞生物学和分子技术的深入研究,发现肿瘤微环境是免疫抑制性的,肿瘤的发展和转移与之密切相关。肿瘤免疫疗法是利用机体自身的免疫系统杀伤肿瘤细胞,目前主流的肿瘤免疫治疗方法主要有单克隆抗体疗法、免疫检查点抑制剂疗法、免疫细胞疗法和肿瘤疫苗,主要介绍这4种免疫疗法的优势与局限,并阐述其临床及上市的研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
癌症是导致人类死亡的第2大疾病[1],2020年全球癌症新增病例约为1 930万,死亡人数高达1 000万,其中我国占比约10.59%,也就是说仅一年的时间,我国就会因癌症死亡105.9万人。预计到2040年,癌症新增病例将超过2 800万[2]。尽管医学和科技取得了重大进步,癌症仍然是一种治疗方法有限的疾病。目前癌症的传统治疗方法包括手术治疗、放疗和化疗,但是治疗效果都比较有限,特别是对于晚期和转移性癌症[3]。相比之下,针对自身免疫系统的免疫治疗药物在临床癌症治疗中的应用前景广阔,近年来受到了世界各地临床医生和癌症患者的广泛关注。
1863年,关于炎症与肿瘤之间关联的提出,被认为是肿瘤免疫治疗的最早起源[4]。30年后,报道了利用急性细菌感染消退或完全治愈肿瘤的案例[5]。但由于当时免疫学的机制不清楚以及致病性感染的高危性,这些案例并未引起重视,肿瘤免疫由此陷入了停滞期,肿瘤治疗还是以手术和放化疗为主。直到20世纪50年代,免疫监视和肿瘤抗原等相关理论提出并被鉴定,2002年肿瘤免疫编辑学说以及2012年肿瘤免疫逃逸学说的提出,科学家们对肿瘤免疫的理论认识不断深入,使得后续多种肿瘤免疫治疗的策略得到开发和应用[6]。
免疫疗法与传统疗法不同,它是通过激活或构建免疫系统,来清除癌细胞,发挥对恶性肿瘤的治疗效果,并减少肿瘤转移和预防肿瘤复发[7]。免疫治疗之所以能够在肿瘤治疗中发挥如此重要的作用,是因为免疫系统在肿瘤发生和发展中的每一个环节无处不在,包括正常组织发生增生的免疫增强,增生组织向肿瘤生成的免疫系统激活以及肿瘤生成、浸润和转移的免疫耐受和免疫逃逸形成等[6]。因此,对免疫系统进行合理的调控,能够制定抑制肿瘤发生发展的有效策略,目前发展起来的肿瘤免疫疗法包括单克隆抗体疗法、免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)疗法、免疫细胞疗法和肿瘤疫苗等。
单克隆抗体是基于杂交瘤等相关技术发展的,通过特异性靶向抗原,利用抗体中和、抗体依赖的细胞毒和补体依赖的细胞毒等作用来发挥杀伤肿瘤细胞效果。1986年,第1个鼠源单克隆抗体药物莫罗单抗‐CD3被美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市,这也是第1代鼠源单克隆抗体,但是该抗体是鼠源性的,会引起人体免疫原性因而很快就被停用了。为减少单克隆抗体中的鼠源成分,第2代嵌合鼠人抗体、第3代人源化单抗以及第4代全人源单抗接连被开发[8]。目前全球已有超过100种单抗上市,在癌症治疗中占据着领导地位[9]。具有肿瘤治疗划时代意义的经典药物利妥昔单抗是一种抗CD20人鼠嵌合性单克隆抗体,也是第1个被批准用于肿瘤治疗的单克隆抗体,主要应用于B细胞非霍奇金淋巴瘤治疗[10]。还有靶向转移性乳腺癌阳性标志人表皮生长因子受体2的曲妥珠单抗,靶向血管内皮生长因子用于抗肿瘤血管生成的贝伐珠单抗等[9]。随着对抗体研究的深入,抗体偶联药物、双特异性抗体以及抗体片段等技术不断出现,极大地推动了肿瘤免疫治疗的发展[11]。
ICIs是近几年最引人注目的肿瘤免疫治疗手段之一。抑制免疫检查点在活化T细胞发挥抗肿瘤免疫中发挥重要作用。细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和程序性死亡受体1(programmed cell death-1,PD-1)是目前最有吸引力的2个免疫检查点靶标,相关抗体在临床上取得了巨大的突破,在多种癌症包括肺癌、胃癌、结直肠癌和黑色素瘤等中显示出临床疗效[12,13]。2011年,FDA批准了首款靶向CTLA-4的ICIs伊匹木单抗应用于晚期黑色素瘤治疗[14]。2014年,研究最为火热的PD-1靶点抗体帕博利珠单抗和纳武单抗获批上市,这标志着肿瘤免疫进入了黄金发展新时代[15]。基于ICIs在肿瘤免疫中的突破性进展,2018年诺贝尔医学奖被授予ICIs的创始人James Allison和Tasuku Honjo[16]。继CTLA-4和PD-1/细胞程序性死亡-配体1(programmed cell death-ligand 1,PD-L1)之后,开发了以淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)为代表的新一代免疫检查点。2022年,LAG-3抗体瑞拉利单抗也被获批应用于转移性黑色素瘤临床治疗[17]。如表1所示,截至2022年,已经有15款ICIs获批上市,还有许多相关研究正在开展,在临床转化上展现出极大潜力[18,19]。但是,ICIs在临床实际应用中也存在不可忽视的问题,如免疫检查点在大多数肿瘤患者中表达水平低,肿瘤免疫抑制微环境,药物强烈的免疫不良事件以及后期的耐药性等,使得从该疗法获得临床益处的患者数量有限,很大程度地限制了其应用[7]。因此,需要大量开发诊断方法以筛选能够从ICIs疗法中获益的患者,并且需要深入了解药物的免疫机制以解决耐药和毒副作用的限制。已有研究证实,各种因素如微生物菌群、宿主因素以及所处环境,对ICIs的疗效和毒副作用均具有显著影响。根据这些影响因素制定相应的解决策略,被认为是当前ICIs的发展方向[19,20]。
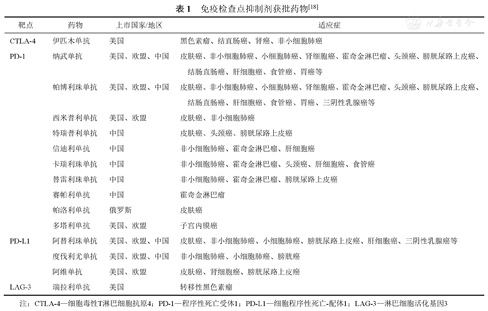
免疫检查点抑制剂获批药物[18]
免疫检查点抑制剂获批药物[18]
| 靶点 | 药物 | 上市国家/地区 | 适应症 |
|---|---|---|---|
| CTLA-4 | 伊匹木单抗 | 美国 | 黑色素瘤、结直肠癌、肾癌、非小细胞肺癌 |
| PD-1 | 纳武单抗 | 美国、欧盟、中国 | 皮肤癌、非小细胞肺癌、小细胞肺癌、肾细胞癌、霍奇金淋巴瘤、头颈癌、膀胱尿路上皮癌、结肠直肠癌、肝细胞癌、食管癌、胃癌等 |
| 帕博利珠单抗 | 美国、欧盟、中国 | 皮肤癌、非小细胞肺癌、小细胞肺癌、肾细胞癌、霍奇金淋巴瘤、头颈癌、膀胱尿路上皮癌、结肠直肠癌、肝细胞癌、食管癌、胃癌、三阴性乳腺癌等 | |
| 西米普利单抗 | 美国、欧盟 | 皮肤癌、非小细胞肺癌 | |
| 特瑞普利单抗 | 中国 | 皮肤癌、头颈癌、膀胱尿路上皮癌 | |
| 信迪利单抗 | 中国 | 非小细胞肺癌、霍奇金淋巴瘤、肝细胞癌 | |
| 卡瑞利珠单抗 | 中国 | 非小细胞肺癌、霍奇金淋巴瘤、头颈癌、肝细胞癌、食管癌 | |
| 替雷利珠单抗 | 中国 | 非小细胞肺癌、霍奇金淋巴瘤、膀胱尿路上皮癌 | |
| 赛帕利单抗 | 中国 | 霍奇金淋巴瘤 | |
| 帕洛利单抗 | 俄罗斯 | 皮肤癌 | |
| 多塔利单抗 | 美国、欧盟 | 子宫内膜癌 | |
| PD-L1 | 阿替利珠单抗 | 美国、欧盟、中国 | 皮肤癌、非小细胞肺癌、小细胞肺癌、膀胱尿路上皮癌、肝细胞癌、三阴性乳腺癌等 |
| 度伐利尤单抗 | 美国、欧盟、中国 | 非小细胞肺癌、小细胞肺癌、膀胱癌 | |
| 阿维单抗 | 美国、欧盟 | 皮肤癌、肾细胞癌、膀胱尿路上皮癌 | |
| LAG-3 | 瑞拉利单抗 | 美国 | 转移性黑色素瘤 |
注:CTLA-4—细胞毒性T淋巴细胞抗原4;PD-1—程序性死亡受体1;PD-L1—细胞程序性死亡-配体1;LAG-3—淋巴细胞活化基因3
免疫细胞治疗,也被称为过继性免疫治疗(adoptive cell transfer therapy,ACT),是指从肿瘤患者体内分离免疫活性细胞,进行体外扩增和功能鉴定,然后回输进患者体内产生具有特异性的细胞免疫,从而达到直接杀伤肿瘤细胞的目的[21]。基于T细胞的免疫治疗是当今一大研究热门,获得国际认可的主要有通过基因改造T细胞受体-T细胞(T cell receptor-gene engineered T cell,TCR-T)疗法和嵌合抗原受体-T细胞(chimeric antigen receptor T cell,CAR-T)疗法。TCR-T是利用基因工程在体外将能特异性识别肿瘤细胞抗原TCR基因转导进入T细胞,使T细胞能高效识别肿瘤细胞发挥杀伤作用。但该疗法受抗原肽-主要组织相容性复合体(major histocompatibility complex,MHC)分子复合物识别依赖性的限制,并且识别抗原范围有限,对患者个性化定制要求高,所以应用范围大大受限[22]。相比之下,CAR-T是通过对患者T细胞基因修饰上能识别靶细胞的"嵌合抗原受体"CAR,CAR结构中融合单链可变片段(scFv)的细胞外抗原靶向域与源自TCR的细胞内信号域,且不具有MHC识别地依赖性[23]。伴随着免疫学的发展,CAR-T也经历多个发展阶段,包括从初始CAR结构中共刺激信号的引入,极大增强了T细胞活力,进而细胞因子的表达,进一步提供活化信号和细胞体内存续的信号,使得CAR-T技术逐渐走向成熟,对其临床效果的发挥起到了积极作用[23]。随之,CAR-T治疗产品司利弗明、阿基仑赛和brexucabtagene autoleucel获批,这3个CAR-T疗法都是通过靶向血液肿瘤领域主要靶点CD19,用于治疗白血病和淋巴癌疾病。近年来,CAR-T的治疗领域在不断扩大,包括实体瘤、病毒感染、自身免疫性疾病和心脏病等[24]。但是,CAR-T细胞的应用也同样面临挑战,一是由于受到缺乏肿瘤特异性抗原以及免疫抑制微环境等的限制,相比于血液肿瘤CAR-T疗法对于实体瘤治疗效果欠佳。二是临床上CAR-T的使用存在明显的毒性,其中细胞因子释放综合征(cytokine release syndrome,CRS)尤为显著。三是CAR-T在慢性感染和癌症治疗中由于T细胞耗竭问题使其在内疗效的持久力相对较差。四是目前CAR-T的制备成本非常高昂,严重限制了它走向临床的脚步[23,25,26]。目前许多研究正在致力于解决这些问题,如对CAR结构中scFv片段进行靶向2种及以上抗原设计优化来增强CAR-T靶向和杀伤肿瘤效力,通过降低CAR-T剂量以及使用类固醇疗法或阻断白细胞介素-6R(interleukin-6R,IL-6R)的抗体来治疗CRS,通过基因敲除技术改造CAR-T来控制T细胞耗竭,通过建立优化CAR-T的生产平台来降低其制备成本等[27,28,29]。除了T细胞外,自然杀伤细胞、树突状细胞、肿瘤浸润性淋巴细胞以及巨噬细胞等其他免疫细胞在ACT疗法治疗肿瘤中也显示出巨大的应用前景,相关临床试验正在如火如荼地进行中[24]。
1991年,肿瘤抗原的发现,为肿瘤疫苗开发奠定了技术基础[30]。肿瘤疫苗主要通过递送载体将抗原/佐剂特异性地递送到树突状细胞,促进抗原加工,促使树突状细胞上的MHC分子向T细胞上的TCR呈递,从而激活初始T细胞并诱导CTL免疫反应来对抗肿瘤[31]。
肿瘤疫苗不仅能够预防肿瘤,还能治疗肿瘤以及抑制肿瘤复发。预防性癌症疫苗目前上市的有人乳头瘤病毒(human papillomavirus,HPV)疫苗和乙型肝炎病毒(hepatitis B,HBV)疫苗,其中HPV对于降低女性患宫颈、阴道和生殖器病变的风险具有显著效果[32]。目前上市的治疗性疫苗有用于治疗早期膀胱癌的卡介苗[33],以及用于治疗前列腺癌的普罗文奇。普罗文奇是一种树突状细胞,于2010年获批,其能够延长晚期前列腺癌患者4个月的存活期[34,35]。肿瘤疫苗的类型包括但不局限于细胞载体疫苗、蛋白/多肽疫苗、病毒载体疫苗和核酸(mRNA或DNA)疫苗等。相对于肿瘤相关抗原,新抗原的发现为癌症疫苗的抗原筛选开辟了新的路径。2022年12月13日,编码最多至34种新抗原的个性化肿瘤疫苗mRNA-4157,与PD-1抗体联合治疗黑色素瘤的Ⅱb期临床已经达到临床主要终点,联合治疗可以将复发或死亡风险降低44%。因此,近日这款mRNA疫苗被FDA授予"突破性疗法认定",为其快速获批上市铺平道路。目前肿瘤疫苗疗法有几千项的临床试验,主要应用于黑色素瘤、乳腺癌和肺癌等恶性肿瘤的治疗[36]。虽然新抗原是抗肿瘤免疫治疗的最佳选择,但个体化肿瘤独特抗原的获取阻碍了其应用,主要是由于癌细胞固有的改变以及促进免疫抑制的肿瘤微环境变化[26]。因此已经开发了集中策略来克服这些困难,包括使用免疫刺激佐剂,以及与其他治疗方法如ICIs疗法和免疫细胞疗法的联合治疗等。
免疫佐剂作为疫苗的主要成分之一,在增强肿瘤疫苗适应性免疫反应强度、广度和持久性方面具有显著作用。如1926年最早出现的铝盐佐剂[37]和欧洲批准的为流感疫苗佐剂的水包油乳剂MF59[38]。目前被获批应用于人体的佐剂还有AS01(如用于带状疱疹疫苗Shingrix和疟疾疫苗Mosquirix)、AS04(如用于乙肝疫苗Fendrix和人乳头瘤疫苗Cervarix),AS03(如用于大流行性流感疫苗Pandemix和Arepanrix)和CpG(如用于乙型肝炎疫苗Heplisav-B)等[39]。并且这些佐剂在新型冠状病毒疫苗的开发中也被广泛使用[40]。不同种类佐剂的作用机制有所不同,且其实际分子机制目前尚未完全清晰。目前普遍接受的理论是,疫苗佐剂可以利用模式抗原识别受体(pattern recognition receptors,PRRs)病原体相关分子模式(pathogen associated molecular patterns,PAMPs)来激活机体的先天免疫反应。后来发现,PRRs还可以被组织和细胞损伤释放的损伤相关分子模式(damage associated molecular patterns,DAMPs)激活,进而诱发适应性免疫。最常见的模式识别受体有Toll样受体(Toll-like receptors,TLRs)、核苷酸结合寡聚化结构域样受体(nucleotide binding oligomerization domain-like receptors,NLRs),C型凝集素受体(C-type lectin receptors,CLRs)和细胞质DNA/RNA受体等,针对这些靶点设计相应配体可作为疫苗佐剂使用[41]。在所有研究的佐剂中,TLR配体佐剂是研究最多的免疫佐剂[7]。与传统的铝盐和乳化佐剂相比,此类配体具有更强免疫刺激作用并且研究机制比较明确[42]。
除了上面这些获批的佐剂外,由于现有的亚单位疫苗存在免疫原性弱、稳定性差、生理微环境中易降解等问题,加上对佐剂机制研究的不断认识,越来越多新兴的抗原递送类佐剂被研发和设计出来,且其在疫苗领域具有良好的应用前景[43]。此类佐剂不仅可以本身作为免疫佐剂来刺激机体引发先天免疫和适应性免疫反应,还可以递送蛋白质抗原,其关键优势是能够以与病原体类似的方式同时将多种有效载荷(如佐剂和抗原)靶向抗原提呈细胞,并具有持续释放抗原作用,从而持续刺激有效的CTL反应来对抗肿瘤,这导致纳米载体通常被称为"病原体样颗粒"[44]。此外,直径在20~200 nm范围的纳米载体在给药后可以有效地流入淋巴结进行内化[45]。迄今为止,许多纳米颗粒已被用于诱导预防性和治疗性抗肿瘤免疫反应,如病毒样颗粒(viral like particles,VLPs)、细菌外膜囊泡(out membrane vesicles,OMVs)、脂质体、自组装多肽以及二氧化硅纳米颗粒等[46]。
脂质体具有优异的多功能性和可塑性,是临床上最常用的纳米疫苗载体之一。脂质体能同时递送水溶性抗原和亲脂性化合物(佐剂、抗原和靶向多肽等),尤其适合最近非常有前景的核酸疫苗的递送[47]。此外,脂质体还能在其表面进行功能性修饰,赋予纳米疫苗特异的靶向或刺激能力,促进药物内涵体逃逸,促进抗原交叉呈递,有效增强疫苗的免疫功能[48]。
基于肿瘤微环境中活性氧(reactive oxygen species,ROS)和谷胱甘肽(glutathione,GSH)水平考虑,Zhou等[49]构建了2个脂质体佐剂递送系统,利用亲水性内腔分别装载马来酰胺和辣根过氧化物酶(horseradish peroxidase,HRP)及其底物三氧化二氮试剂(nitrogen trioxide reagent,ABTS)&HRP,被定义为马来酰亚胺脂质体(maleimide liposome,ML)和ABTS&HRP脂质体(AHL),以促进肿瘤微环境GSH耗竭,ROS水平上调,诱导免疫原性细胞死亡和树突状细胞成熟,从而加强乳腺癌的光热免疫治疗。其中,HL作为光热佐剂,在H2O2存在的情况下,通过HRP将ABTS氧化为ABTS+,ABTS+可吸收特定近红外光,从而发挥光热治疗作用;ML作为GSH耗竭佐剂,一方面可以消耗肿瘤细胞的细胞内GSH,以促进H2O2的产生,增强ABTS的光热效应;另一方面通过上调主要组织相容性复合体Ⅰ类和CD80/86,诱导树突状细胞中ROS的产生,以促进树突状细胞的成熟和抗原呈递。实验表明,这些治疗系统可以促进CD8+ T细胞在肿瘤组织中的活化和浸润,增强对远处肿瘤的抑制作用和癌症的抗转移作用。Chen等[50]采用类脂质体分子,显著增加了原位免疫疗法效果。首先研究人员筛选出能捕获化疗产生的肿瘤相关抗原(tumor associated antigens,TAAs),并将TAAs递送到引流淋巴结中的类脂质体93-O17S。因此,先对原发性肿瘤注射小剂量阿霉素,诱导肿瘤细胞免疫原性死亡和TAAs释放。再用类脂质体递送干扰素基因刺激蛋白(stimulator of interferon genes,STING)的激动剂2′5′-3′5′-环磷酸鸟苷-磷酸腺苷(2′5′-3′5′-cyclic guanosine monophosphate-adenosine phosphate,cGAMP)到肿瘤部位,该体系能捕获释放的肿瘤抗原。随后TAA和cGAMP共同被脂质体携带,通过抗原提呈细胞捕获和溶酶体逃逸效应在抗原呈递细胞的细胞质中释放。释放的肿瘤抗原由主要组织相容性复合物Ⅰ类呈递以激活T细胞,而细胞质中释放的cGAMP激活了STING通路并诱导产生Ⅰ型干扰素和其他促炎细胞因子,这也促进了T细胞的活化。增强的抗原交叉呈递和STING激活的结合可以促进用于肿瘤免疫治疗的原位疫苗接种。与基于溶瘤病毒的癌症免疫治疗相比,合成的脂质纳米颗粒具有相当大的优势,包括更高的安全性且易于扩大生产规模。并且,与基于其他非病毒的原位疫苗接种系统相比,本系统具有抗原捕获、递送和交叉呈递的优点,因而具有更好的治疗效果。
类似脂质体结构,并且具有更高度可调的理化性质的聚合物囊泡在此领域也有应用。Wei等[51]用生物可降解聚碳酸酯和精胺制备了载脂蛋白E肽锚定的聚合物囊泡用于递送TLR9激动剂CpG。相比于游离GpG给药限制,该纳米系统能够通过静脉和鼻内给药,实现CpG跨越血脑屏障有效递送于胶质瘤和颈部淋巴结,从而可以强烈刺激树突状细胞的成熟、体内抗原交叉呈递和促炎细胞因子的产生,为胶质瘤小鼠带来显著的生存益处。
值得注意的是,无论是脂质体还是聚合物囊泡,其本身很少具有免疫刺激作用,主要作为疫苗递送系统应用,都需要引入额外的佐剂才能达到所需的免疫效果。相比之下,来源于病原体的很多成分都兼具佐剂和载体的双重性质,这些佐剂系统不仅类似脂质体和聚合物囊泡类似的药物负载和功能调控功能,还能够有效激活天然免疫,在免疫增效、疫苗靶向以及联合治疗方面都有非常广阔的前景[52]。其中,基于细胞膜的纳米粒也因其模仿其源细胞抗原蛋白所具有的一些特征的潜力而引起了越来越多的关注。肿瘤来源的细胞膜囊泡表面存在大量肿瘤特异性抗原(tumor specific antigens,TSAs)和TAAs,可诱导抗原呈递细胞的成熟[53]。Fang等[54]通过在聚合物纳米颗粒表面包裹上肿瘤源性细胞膜,构建了可携带多种癌细胞膜抗原的核壳型纳米颗粒。这些纳米结构共递送抗原和佐剂可以刺激肿瘤相关抗原免疫反应。而来源于免疫细胞的细胞膜囊泡可影响肿瘤免疫微环境并通过自身的生物学功能在免疫激活作用中发挥重要作用[55]。受人体对细菌入侵的天然免疫防御机制的启发,细菌具有较高的致病性,来自于革兰阴性菌自然释放的外膜囊泡材料不仅与细菌具有相似的组成成分,大量的病原体相关分子模式,而且相比于细菌本身毒性更低,使其成为理想的天然佐剂[53]。并且与其他纳米疫苗载体相比,外膜囊泡脂质双层分子结构使其可以分别或同时负载亲水性和疏水性药物的潜力,使得外膜囊泡在肿瘤疫苗与其他疗法结合的联合治疗平台上具有有前途的开发前景。Liang等[56]在外膜囊泡基础上建立了多功能化个性化肿瘤疫苗平台。首先,研究人员利用基因工程技术在外膜囊泡表面修饰了能够靶向树突状细胞的人工抗体以及可修饰的多肽分子胶水,表达的人工抗体可解决外膜囊泡表面脂多糖与树突状细胞TLR-4相互作用刺激树突状细胞快速成熟的自然途径引起树突状细胞对抗原摄取关闭,即"细胞成熟导致的摄取障碍"问题;另外,可修饰的分子胶水,保留了外膜囊泡的表面可修饰性,即"抗原即插即用",具有癌症新抗原鉴定的适用性。最后,鉴于肿瘤免疫抑制微环境的骨髓抑制细胞的影响,利用外膜囊泡疫苗联合ICIs和激酶抗体依鲁替尼来耗竭骨髓抑制细胞。实验证明了该外膜囊泡系统可作为肿瘤疫苗载体的有效性,还通过快速抗原展示证明了这种纳米疫苗在识别人类肿瘤新抗原方面的可用性。
肿瘤免疫治疗已经成为对抗癌症的强有力工具,肿瘤临床免疫治疗中使用ICIs、过继性细胞免疫治疗和癌症疫苗治疗的效果远高于化疗药物,同时机体对这些免疫靶向治疗方法比传统化疗药物具有更高的耐受能力。但由于肿瘤患者体内的免疫抑制因素,免疫单药治疗的疗效可能并不理想。因而肿瘤免疫与其他方式的联合治疗代表了免疫治疗未来的发展方向。
肿瘤免疫治疗作为一种内科治疗手段,它的发展促进了对机体免疫系统的抗肿瘤作用机制和途径的认识,其出现为某些恶性肿瘤的治疗提供了新的思路和方向。未来肿瘤免疫治疗发展的趋势是更安全、更有效、更经济以及与放疗、化疗或与靶向疗法以及免疫治疗之间的联合应用。
所有作者均声明不存在利益冲突



























