
评价不同方式母乳强化(human milk fortifier,HMF)喂养对早产儿生长发育的影响。
计算机检索PubMed、Embase、Clinicaltrial、Cochrane图书馆和中国生物医学文献、中国知网、万方、维普、中华医学期刊全文数据库建库至2022年12月1日收录的文献,纳入研究对象为胎龄<37周、母乳强化喂养的随机对照研究(randomized controlled study,RCT),采用Cochrane偏倚分析工具对纳入文献质量进行评价,应用RevMan5.3软件进行Meta分析,对比个体强化和标准强化、目标强化和调整强化母乳喂养对早产儿体重、身长、头围生长速率,以及支气管肺发育不良、骨质减少、喂养不耐受、坏死性小肠结肠炎的影响。
共纳入11篇RCT,10篇为中低偏倚,1篇偏倚风险较高。Meta分析结果显示,与标准强化相比,个体强化可提高早产儿体重增长速率(SMD=0.87,95%CI 0.36~1.38,P<0.001),对身长和头围增长速率的影响差异无统计学意义(SMD=0.64,95%CI -0.07~1.34,P=0.08;SMD=0.58,95%CI -0.06~1.22,P=0.08);个体强化可降低喂养不耐受和坏死性小肠结肠炎发生率(RR=0.45,95%CI 0.22~0.89,P=0.02;RR=0.32,95%CI 0.13~0.78,P=0.01),对支气管肺发育不良发生率的影响差异无统计学意义(RR=0.93,95%CI 0.76~1.20,P=0.67)。有2篇RCT比较了目标强化与调整强化早产儿的生长发育指标,但未得到一致结果。仅1篇RCT结果显示目标强化组骨质减少发生率和调整强化组差异无统计学意义(P>0.05)。
相对于标准强化,个体强化母乳喂养能更好地促进早产儿早期生长发育,但目标强化和调整强化对早产儿生长发育的影响差异不显著。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全球范围内每年约有1 500万早产儿出生,大多数国家早产率呈上升趋势[1]。早产儿首选喂养方式为母乳喂养,但单纯的母乳喂养无法完全满足早产儿的需求[2, 3]。为预防宫外发育迟缓和避免营养成分缺乏,目前国际推荐早产儿早期母乳强化(human milk fortifier,HMF)喂养[4, 5, 6]。HMF的最佳状态是为每个早产儿提供适合的能量及营养素需求[7, 8]。目前母乳强化分为标准强化和个体强化两种,个体强化又分为调整强化和目标强化。早产儿采取何种强化方式目前存在争议,尚缺乏公认的临床标准。本研究收集了标准强化和个体强化对早产儿生长发育影响的相关文献,采用Meta分析方法对比两种强化方式对早产儿生长发育的影响,为临床决策提供依据。
计算机检索PubMed、Embase、Clinicaltrial、Cochrane图书馆和中国生物医学文献、中国知网、万方、维普、中华医学期刊全文数据库,检索时间自建库至2022年12月1日,检索语种为中文和英文,搜集早产儿强化母乳喂养的随机对照研究(randomized controlled study,RCT)。采用主题词和自由词相结合的方式,并追溯纳入文献的参考文献。中文检索词:母乳、强化、目标强化、标准强化、调整强化、早产儿、生长发育;英文检索词:milk、fortification、individualized fortification、standard fortification、targeted fortification、adjustable fortification、growth、preterm infant。
1. 纳入标准:(1)已公开发表的RCT;(2)研究对象胎龄<37周、无先天性疾病和畸形;(3)不同强化方法描述明确;(4)对早产儿生长发育判断有明确的测量指标,观察结局为早产儿体重、身长、头围增长速率,以及支气管肺发育不良、骨质减少、喂养不耐受、坏死性小肠结肠炎等并发症发生率。
2. 排除标准:(1)文献类型为综述、评论、指南等非原始研究;(2)评价指标不完整;(3)所提供的数据不能进行Meta分析;(4)同一中心研究的多篇文献,阅读全文后排除重复病例。
1. 资料提取:由2名研究者独立筛选文献、提取资料并交叉核对。如有分歧则通过讨论或与第3方协商解决。资料提取内容包括:(1)纳入研究的题目、第一作者、发表年份、发表杂志等;(2)研究对象的干预措施;(3)结局指标:体重、身长、头围增长速率以及支气管肺发育不良、骨质减少、喂养不耐受、坏死性小肠结肠炎等发生率。
2. 文献质量评价:由2名研究者独立进行,如有分歧,则通过讨论或与第3方协商解决。RCT研究采用Cochrane系统评价手册文献质量评价标准[9]:(1)随机化分组是否恰当;(2)有无分配隐藏,方法是否正确;(3)实施者与参与者是否双盲;(4)结果评估中的盲法;(5)结局数据是否完整;(6)发表偏倚;(7)是否存在其他偏倚来源。每项指标按发生偏倚分为低风险、中风险、高风险3级。满足5项指标及以上为低偏倚风险;满足3~4项指标为中偏倚风险;满足3项指标以下为高偏倚风险。
应用RevMan5.3统计软件对数据进行Meta分析。若I2≤50%且P≥0.1,则各研究间不具有统计学异质性,采用固定效应模型;若I2>50%或P<0.1,则各研究间具有统计学异质性,采用随机效应模型。计数资料采用相对危险度(relative risk,RR)和95%可信区间(confidence interval,CI)评价,计量资料采用标准化均数差(standardized mean difference,SMD)和95%CI评价。P<0.05为差异有统计学意义。采用漏斗图定性评估发表偏倚,当结局指标纳入的文献少于5篇时,考虑到检验效能太低而不进行发表偏倚分析。
共检索到1 099篇相关文献,去除重复文献443篇,通过阅读文献题目和摘要去除不相关和非RCT文献583篇,初筛纳入73篇,进一步阅读全文,排除非严格RCT 22篇、强化方法不明确9篇、结局指标与研究目的不相符19篇、生长发育指标不明确5篇、重复文献7篇,最终有11篇RCT进入Meta分析。发表时间为1995—2022年,其中9篇比较了接受个体强化与标准强化的早产儿生长发育指标,2篇比较了接受目标强化与调整强化的早产儿生长发育指标。见表1。
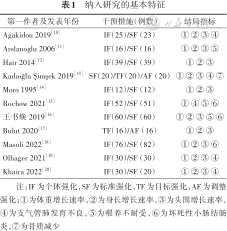
纳入研究的基本特征
纳入研究的基本特征
| 第一作者及发表年份 | 干预措施(例数) | 结局指标 |
|---|---|---|
| Agakidou 2019[10] | IF(25)/SF(23) | ① ② ③ ④ |
| Arslanoglu 2006[11] | IF(16)/SF(16) | ① ② ③ ⑤ |
| Hair 2014[12] | IF(39)/SF(39) | ① ② ③ |
| Kadıoğlu Şimşek 2019[13] | SF(20)/TF(20)/AF(20) | ① ② ③ ④ ⑦ |
| Moro 1995[14] | IF(12)/SF(12) | ① ② ③ |
| Rochow 2021[15] | IF(52)/SF(51) | ① ④ ⑤ ⑥ |
| 王书焕 2019[16] | IF(60)/SF(60) | ① ② ③ ⑤ ⑥ |
| Bulut 2020[17] | TF(16)/AF(16) | ① ② ③ |
| Masoli 2022[18] | IF(76)/SF(82) | ① ② ③ ⑥ |
| Olhager 2021[19] | IF(30)/SF(30) | ① ② ③ ④ |
| Khaira 2022[20] | IF(30)/SF(20) | ① ② ③ ④ |
注:IF为个体强化,SF为标准强化,TF为目标强化,AF为调整强化;①为体重增长速率,②为身长增长速率,③为头围增长速率,④为支气管肺发育不良,⑤为喂养不耐受,⑥为坏死性小肠结肠炎,⑦为骨质减少
对纳入文献采用Cochrane风险偏移评估,6篇低风险[10,15,17- 20],4篇中风险[11, 12, 13,16],1篇高风险[14]。见表2。
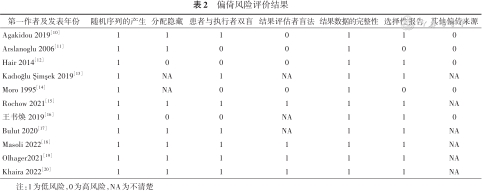
偏倚风险评价结果
偏倚风险评价结果
| 第一作者及发表年份 | 随机序列的产生 | 分配隐藏 | 患者与执行者双盲 | 结果评估者盲法 | 结果数据的完整性 | 选择性报告 | 其他偏倚来源 |
|---|---|---|---|---|---|---|---|
| Agakidou 2019[10] | 1 | 1 | 1 | 0 | 1 | 1 | 0 |
| Arslanoglu 2006[11] | 1 | 1 | 0 | 0 | 1 | 0 | 0 |
| Hair 2014[12] | 1 | 0 | 0 | 0 | 1 | 1 | 0 |
| Kadıoğlu Şimşek 2019[13] | 1 | NA | 1 | NA | 1 | 1 | NA |
| Moro 1995[14] | 1 | NA | 0 | 0 | 1 | 0 | 0 |
| Rochow 2021[15] | 1 | 1 | 1 | 1 | 1 | 1 | NA |
| 王书焕 2019[16] | 1 | 0 | 0 | NA | 1 | 1 | 0 |
| Bulut 2020[17] | 1 | 1 | 1 | NA | 1 | 1 | NA |
| Masoli 2022[18] | 1 | 1 | 1 | 1 | 1 | 1 | NA |
| Olhager2021[19] | 1 | 1 | 1 | 1 | 1 | 1 | NA |
| Khaira 2022[20] | 1 | 1 | 1 | 1 | 1 | 1 | NA |
注:1为低风险,0为高风险,NA为不清楚
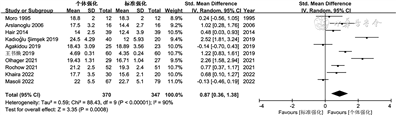
1.不同方式母乳强化喂养对早产儿体重增长的影响:共有10篇文献[10, 11, 12, 13, 14, 15, 16,18, 19, 20]比较了接受个体强化与标准强化早产儿的体重增长速率,I2=90%,P<0.001,研究间存在一定异质性,采用随机效应模型。Meta分析结果显示,与标准强化相比,个体强化可提高早产儿体重增长速率(SMD=0.87,95%CI 0.36~1.38,P<0.001),见图1。

因为目标强化和调整强化比较的文献数量较少,未做Meta定量合并,仅予定性描述。其中1篇目标强化组体重增长速率高于调整强化组,两组相差0.35 g/(kg·d),但差异无统计学意义(P=0.27)[13];另1篇目标强化组体重增长速率亦高于调整强化组,两组相差1.00 g/(kg·d),差异有统计学意义(P<0.01)[17]。
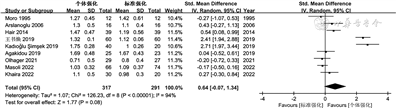
2.不同方式母乳强化喂养对早产儿身长增长的影响:共有9篇文献[10, 11, 12, 13, 14,16,18, 19, 20]比较了接受个体强化与标准强化早产儿的身长增长速率,I2=94%,P<0.001,研究间存在一定异质性,采用随机效应模型。Meta分析结果显示,虽然个体强化组身长增长速率更高,但两组差异无统计学意义(SMD=0.64,95%CI -0.07~1.34,P=0.08),见图2。

因为目标强化和调整强化比较的文献数量较少,未做Meta定量合并,仅予定性描述。其中1篇目标强化组身长增长速率低于调整强化组,两组相差0.75 mm/d,差异有统计学意义(P=0.02)[13];另1篇目标强化组身长增长速率高于调整强化组,两组相差0.57 mm/d,但差异无统计学意义(P=0.11)[17]。
3.不同方式母乳强化喂养对早产儿头围增长的影响:共有9篇文献[10, 11, 12, 13, 14,16,18, 19, 20]比较了接受个体强化与标准强化早产儿的头围增长速率,I2=93%,P<0.001,研究间存在一定异质性,采用随机效应模型。Meta分析结果显示,虽然个体强化组早产儿头围增长速率稍高,但两组差异无统计学意义(SMD=0.58,95%CI -0.06~1.22,P=0.08),见图3。
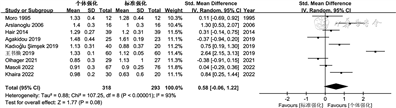

因为目标强化和调整强化比较的文献数量较少,未做Meta定量合并,仅予定性描述。其中1篇目标强化组头围增长速率低于调整强化组,两组相差0.84 mm/d,差异有统计学意义(P=0.01)[13];另1篇目标强化组头围增长速率高于调整强化组,两组相差0.75 mm/d,差异有统计学意义(P=0.04)[17]。
4.不同方式母乳强化喂养对早产儿支气管肺发育不良及骨质减少的影响:共有5篇文献[10,13,15,19, 20]比较了接受个体强化与接受标准强化早产儿的支气管肺发育不良发生率,I2=0.0%,P=0.92,纳入研究无异质性,采用固定效应模式。Meta分析结果显示,两组支气管肺发育不良发生率差异无统计学意义(RR=0.95,95%CI 0.76~1.20,P=0.67),见图4。
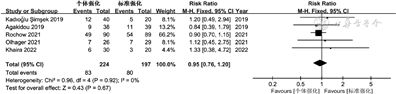

仅1篇文献比较了接受目标强化与接受调整强化早产儿的支气管肺发育不良和骨质减少发生率,差异均无统计学意义(P=1.00)[13]。
5.不同方式母乳强化喂养对早产儿喂养不耐受的影响:共有3篇文献[11,15, 16]比较了接受个体强化与标准强化早产儿的喂养不耐受发生率,I2=0%,P=0.40,纳入研究无异质性,采用固定效应模式。Meta分析结果显示,个体强化组喂养不耐受发生率低于标准强化组,差异有统计学意义(RR=0.45,95%CI 0.22~0.89,P=0.02),见图5。
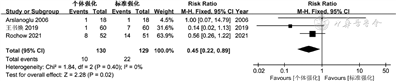

6.不同方式母乳强化喂养对早产儿坏死性小肠结肠炎的影响:共有3篇文献[15, 16,18]比较了接受个体强化与标准强化早产儿的坏死性小肠结肠炎发生率,I2=0%,P=0.51,纳入研究无异质性,采用固定效应模式。Meta分析结果显示,个体强化组坏死性小肠结肠炎发生率低于标准强化组,差异有统计学意义(RR=0.32,95%CI 0.13~0.78,P=0.01),见图6。
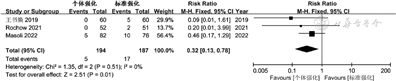

7.敏感性分析及发表偏倚分析:目标强化与调整强化比较的文献仅有2篇[13,17],文中仅对个体强化与标准强化比较的各结局进行敏感性分析,逐一删除各结局后的合并效应量均落在总合并效应量的95%CI内,且逐一剔除研究后合并效应量未发生显著改变,提示单个研究对总合并效应量影响不显著,结果具有一定稳定性。
其他结局纳入文献少于5篇,考虑到发表偏倚分析的效能,仅对个体强化与标准强化比较的早产体重增长速率、身长增长速率、头围增长速率以及支气管肺发育不良、喂养不耐受、坏死性小肠结肠炎发生率进行发表偏倚分析,漏斗图基本对称、Egger's检验P值均>0.05,提示不存在显著的发表偏倚风险。
标准强化的优势在于操作简单,预估母乳中蛋白质含量为1.5 g/dl,在不考虑个体差异和时间变化的情况下,当肠内营养达50~100 ml/(kg·d)时可定量添加强化剂[7,21]。Maly等[22]研究显示,母乳蛋白质浓度随着哺乳时间的延长而下降,在第4~6周下降至1 g/dl左右。因此,在整个强化期的大部分时间内早产儿蛋白质摄入量不足[23],标准强化往往不能满足早产儿的生长需求[22,24]。目前个体强化是多数专家小组推荐的方法,其能解决蛋白质摄入不足的问题[25, 26, 27]。Ergenekon等[28]文献报道,与标准强化相比,个体强化的婴儿在校正18月龄时体重、头围增加更好,智力发育分数更高。Quan等[26]的研究中也发现个体强化能更好地提高早产儿体重和营养代谢指数。
本次Meta分析结果显示,个体强化可提高早产儿体重增长速率,但对身长和头围的影响不明显。在不良结局中,个体强化早产儿喂养不耐受、坏死性小肠结肠炎发生率低于标准强化组,但两组支气管肺发育不良发生率差异无统计学意义。另外,本研究选择骨质减少作为早产儿并发症的结局指标,但没有研究探讨个体强化和标准强化之间的差异,故未进一步分析。
调整强化方案基于蛋白质代谢情况,蛋白质摄入量与血尿素氮水平有关[11,29],最初由Moro等[14]提出,后来由Arslanoglu等[11]标准化。调整强化不需对母乳进行分析,临床实用性更强[13],早产儿耐受性更好,可在不增加总能量和体液量的情况下促进早产儿生长[30, 31]。但调整强化缺乏早产儿宫外生长速度及相应胎龄胎儿宫内生长速度的最佳血尿素氮安全阈值。目标强化则采用仪器监测母乳宏量营养素,并以此为依据补充营养素,当计算的蛋白质摄入量低于4.5 g/(kg·d)时需额外补充蛋白质[17,32]。目标强化需要经常留取母乳样品进行检测,且对测量仪器的精准度要求较高,因此在临床应用中受到一定限制[21,24,33, 34, 35]。一项RCT表明,目标强化可改善早产儿早期蛋白质和能量的摄入,可能改善极早产儿大脑发育[36]。Fabrizio等[37]研究显示调整强化能改善体重、身长、头围的增长速率。
本次Meta分析纳入的文献中关于调整强化和目标强化的研究较少,因此未做Meta定量合并,仅予定性描述。1篇文章中目标强化组身长和头围增长速率低于调整强化组[13],另1篇文章中目标强化组体重和头围增长速率优于调整强化组,差异均有统计学意义[17]。因此目前研究结果尚不统一。目标强化组和调整强化组支气管肺发育不良和骨质减少发生率差异均无统计学意义。因此,调整强化和目标强化各有利弊,本次Meta分析发现调整强化和目标强化均可促进早产儿生长发育,但两组病例数太少,仍需进一步证实。
综上所述,早产儿的最佳生长发育依赖于足够的能量摄入,HMF是必要的,个体强化可以改善早产儿蛋白质摄入、体重和身长的生长,优于标准强化。但本文各研究间存在一定异质性,虽然已采用随机效应模型分析,仍不能除外偏倚。另外,目前研究的是牛乳强化剂,没有比较牛乳与人乳强化剂的有效性和安全性。有研究显示,人乳强化剂喂养的早产儿坏死性小肠结肠炎发生率更低[38],但也有研究显示纯母乳喂养的早产儿使用人乳强化剂和牛乳强化剂无明显差异。这均需要进一步研究评估HMF对早产儿短期和长期的影响[39]。
罗蓓, 王亚娟. 不同母乳强化方法对早产儿生长发育影响的Meta分析[J]. 中华新生儿科杂志, 2023, 38(11): 679-685. DOI: 10.3760/cma.j.issn.2096-2932.2023.11.009.
所有作者声明无利益冲突



























