
研究中性粒细胞外陷阱(NETs)在程序性细胞死亡受体-1(PD-1)抑制剂相关心肌炎中的作用,探索靶向NETs的免疫检查点抑制剂相关心肌炎(ICIAM)治疗靶点。
选6周龄健康雄性BALB/c小鼠30只,分别编号并随机分为对照组(n=10)、模型组(n=10)和治疗组(n=10)。除对照组外,分别于第1和7天给小鼠皮下注射100 μl含有250 μg小鼠心肌肌钙蛋白I(TnI)肽段的弗氏完全佐剂(CFA)。第8天起每2天腹腔注射一次PD-1抑制剂(15 μg/只),共5次。PF-1355治疗组从造模开始前1天起连续16 d腹腔注射PF-1355(50 mg·kg-1·d-1)。观察各组小鼠一般状态,实时荧光定量聚合酶链式反应(RTFQ-PCR)评估中性粒细胞相关趋化因子、NETs和焦亡相关因子、促炎细胞因子的转录水平调控,免疫组化、免疫荧光检测和蛋白质印迹法反映焦亡相关分子的蛋白水平变化,超声心动图展示主要心功能指标改变,心肌病理对比炎性浸润程度。
模型组小鼠较对照组小鼠心肌NETs免疫荧光强度明显增加(2.49±0.08和0.99±0.26,P<0.001)。模型组心肌组织焦亡相关NOD样受体热蛋白结构域相关蛋白3(NLRP3)、剪切的含半胱氨酸的天冬氨酸蛋白水解酶(cleaved-Caspase 1)、含半胱氨酸的天冬氨酸蛋白水解酶1(Caspase 1)、剪切的Gasdermin-D(cleaved-GSDMD)、Gasdermin-D(GSDMD)、白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)的蛋白表达水平较对照组上调(均P<0.05)。PF-1355治疗后,相比于模型组,治疗组小鼠左心室射血分数(LVEF)(73.58%±5.31%和58.12%±3.19%,P<0.001)、左室缩短分数(LVFS)(39.78%±4.31%和33.89%±2.19%,P<0.001)升高;苏木精-伊红染色结果显示与模型组相比,治疗组炎性浸润面积百分比减少(30.12%±3.57%和14.92%±2.46%,P<0.001);治疗组免疫荧光NETs生成较模型组减少(2.52±0.04和1.03±0.05,P<0.001);治疗组NLRP3等焦亡相关分子水平较模型组下调(均P<0.05)。
在PD-1抑制剂相关的心肌炎中,NETs通过激活NLRP3炎症小体导致心肌细胞焦亡。特异性髓过氧化物酶抑制剂PF-1355通过调控NETs来下调NLRP3炎症小体激活,可能进一步挽救和逆转NETs介导的心肌焦亡损伤。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫检查点抑制剂相关心肌炎(immune checkpoint inhibitor-associated myocarditis,ICIAM)发病后死亡率高达27%~67%[1, 2, 3, 4],正成为以程序性细胞死亡受体-1(programmed death protein-1,PD-1)抑制剂为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)应用过程中最受关注的免疫相关不良事件(immune-related adverse event,irAE)[2, 3,5, 6]。
中性粒细胞外陷阱(neutrophil extracellular traps,NETs)是以中性粒细胞为基础的固有免疫防御机制,其形成以核膜破坏、染色质网状展开,蛋白酶、组蛋白和胞浆蛋白等组分被挤压进该网络状结构为核心特征[7]。NETs已被证实和多种抗肿瘤药物诱发的神经炎症、脏器不良反应密切相关[7, 8];也被证实在机体对抗炎症的早期环节中与细胞焦亡、组织病理变化以及脏器损伤关联紧密[9]。髓过氧化物酶(myeloperoxidase,MPO)是NETs的重要组成部分,体外实验提示对其抑制可以部分逆转NETs的形成和发展[7]。
目前,NETs在ICIAM中是否及如何发挥作用,以及抑制MPO能否治疗ICIAM均未得到证实。本研究将从探究机制和辅助治疗的角度出发,更为详细地展示NETs的致病机制,以及针对性调控NETs是否有潜力作为ICIAM治疗的新靶点。
1. 实验动物:30只6周龄健康雄性BALB/c小鼠(生产许可证号:320114000129353,南京卡莱斯生物科技有限公司),体重(22.5±2.5)g。经复旦大学附属中山医院伦理委员会批准(审批号:2023-206),实验操作符合3R原则。
2. 主要试剂和仪器:肌钙蛋白I[troponin I,TnI,生工生物工程(上海)股份有限公司],弗式完全佐剂(complete Freund adjuvant,CFA;美国Sigma公司),PD-1抑制剂(anti-mouse PD-1,美国InVivoMab公司CD279号),PF-1355(美国Medchemexpress公司),磷酸盐缓冲液[phosphate buffered saline,PBS,生工生物工程(上海)股份有限公司],RNAiso Plus RNA提取试剂(日本Takara公司),PrimeScript™反转录试剂盒(日本Takara公司),SYBR Green定量聚合酶链式反应预混液(日本Takara公司),BCA蛋白质测定试剂盒(美国Thermo公司),多聚甲醛[生工生物工程(上海)股份有限公司],苏木精-伊红(hematoxylin-eosin,H-E)染色试剂盒(北京索莱宝科技有限公司),山羊血清[生工生物工程(上海)股份有限公司],辣根过氧化物酶偶联SignalStain® Boost免疫组化检测试剂(美国CST公司),三羟甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA)溶液(碧云天生物科技有限公司),NOD样受体热蛋白结构域相关蛋白3抗体(英国Abcam公司ab270449号),Gasdermin-D抗体(英国Abcam公司ab219800号),含半胱氨酸的天冬氨酸蛋白水解酶1/p20/p10多克隆抗体(武汉Proteintech公司22915-1-AP号),白细胞介素(IL)-1β抗体(美国CST公司31202号),IL-18抗体(美国CST公司57058号),β微管蛋白抗体(美国CST公司2128号),DylightTM800 4XPEG偶联山羊抗兔IgG(H+L)抗体(美国CST公司79408号),DylightTM800 4XPEG偶联山羊抗小鼠IgG(H+L)抗体(美国CST公司59997号),MPO抗体(英国Abcam公司ab208670号),瓜氨酸化组蛋白H3抗体(英国Abcam公司ab219407号),淋巴细胞抗原6复合位点G抗体(英国Abcam公司ab261916号),山羊抗兔IgG(H+L)(美国CST公司8889、4412号),戊巴比妥钠(上海国药集团化学试剂公司)。Vevo2100超声及分析系统(加拿大VisualSonics公司),ABI 7300荧光定量PCR仪(美国ABI公司),蛋白电泳、电转系统、凝胶成像系统(美国Bio-rad公司),ImageJ分析软件(美国National Institutes of Health公司),荧光显微镜(日本Nikon公司)。
1. PD-1抑制剂相关心肌炎小鼠模型制备及药物干预:将30只6周龄雄性BALB/c小鼠按随机数字表法分为3组,分别设为对照组、模型组和治疗组,每组10只。根据PD-1抑制剂相关心肌炎小鼠模型造模方法[10],采用皮下注射TnI+CFA法制备该模型,小鼠出现心外膜炎症细胞浸润、心超左心室射血分数(left ventricular ejection fraction,LVEF)下降,则认为此模型诱导成功。具体方法如下:模型组及治疗组分别在第1和7天皮下注射TnI+CFA(TnI 250 μg/只,设计序列:HARVDKVDEERYDVE
AKVTKNITEIADLTQKIYDLRGKFKRPTLRRVRIS;CFA 100 μl/只),于造模第8天起每2天腹腔注射1次PD-1抑制剂(15 μg/只),共5次;对照组予以等剂量生理盐水以相同方式操作。根据既往文献报道[7],治疗组从造模开始前1 d起连续16 d腹腔注射PF-1355(50 mg·kg-1·d-1),对照组及模型组从造模开始前1 d起注射与PF-1355等量的生理盐水。造模第17天检测小鼠心脏彩超,予以1%戊巴比妥钠麻醉后处死小鼠,摘除心脏进行病理及分子水平检测。
2. 一般状态观察和指标测算:逐日称量、记录和描记小鼠造模及治疗开始前、期间及第17天结束时体重变化曲线,对同日不同组小鼠的体重进行组间相互比较。造模第17天将各组小鼠全部处死,开胸,沿主动脉根部游离出心脏,用手术剪将大血管残端、筋膜和脂肪组织剔除,分离出全心,灌注预先配制好的PBS冲去残留血液,滤纸吸水,分析天平称量全心湿质量,计算心重/体重比:心重/体重比=全心湿质量(mg)/小鼠体重(g)。剥离小鼠双侧胫骨,用手术剪剔除残余筋膜和肌肉组织,用游标卡尺测量胫骨长度,取双侧胫骨平均值,计算心重/胫骨长度比:心重/胫骨长度比=全心湿质量(mg)/小鼠胫骨长度平均值(cm)。
3. 免疫荧光染色评估中性粒细胞浸润、NETs形成和焦亡水平:心脏切片同上,将心脏切片脱蜡、再水化并在Tris-EDTA溶液中进行20 min的抗原修复。然后,用5%山羊血清室温封闭2 h,分别与MPO抗体(1∶100),瓜氨酸化组蛋白H3抗体(1∶100),淋巴细胞抗原6复合位点G抗体(1∶50),NOD样受体热蛋白结构域相关蛋白3抗体(1∶50)一抗4 ℃孵育过夜。将载玻片复温至37 ℃,彻底清洗并与山羊抗兔IgG(H+L)(1∶500)室温孵育1 h。细胞核用DAPI复染。最后用Nikon荧光显微镜观察染色切片(放大200或400倍或局部放大1 200倍)。采用MPO(绿色)和Ly6G(深红色)的荧光共定位(橙色)直观表征中性粒细胞心肌浸润情况;采用NETs的典型形态,即失去规则细胞核形态DAPI包绕着共定位的MPO(绿色)和H3Cit(浅红色),形成网络状结构(黄色)评估NETs水平;采用NOD样受体热蛋白结构域相关蛋白3荧光强度反映心肌组织焦亡程度。
4. 实时荧光定量聚合酶链式反应(RTFQ-PCR)检测小鼠心脏炎症及焦亡因子表达:使用RNAiso Plus提取细胞或心脏组织的mRNA,并以PrimeScript™反转录试剂盒反转录1 μg RNA使之成为cDNA。在ABI 7300检测系统中用SYBR Green PCR模式进行RTFQ-PCR。通过检索美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)GenBank设计引物,内参照校准基因为抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)。每20 μl RTFQ-PCR反应混合物包含:10 μl SYBR Green定量聚合酶链式反应预混液、0.4 μl引物顺义链、0.4 μl引物反义链、1 μl cDNA模板和1 μl无菌去离子水。RTFQ-PCR反应循环条件为:95 ℃预变性30 s,之后95 ℃ 10 s、60 ℃ 30 s循环40次。目的基因表达量表示为2-ΔΔCt。引物序列如表1。

实时荧光定量聚合酶链式反应引物序列
实时荧光定量聚合酶链式反应引物序列
| 项目 | 序列(5′-3′) | 片段大小(bp) |
|---|---|---|
| CXCL2 | 108 | |
| 正向 | CCAACCACCAGGCTACAGG | |
| 反向 | GCGTCACACTCAAGCTCTG | |
| IL-1β | 89 | |
| 正向 | CACTACAGGCTCCGAGATGAACAAC | |
| 反向 | TGTCGTTGCTTGGTTCTCCTTGTAC | |
| IL-6 | 101 | |
| 正向 | TAGTCCTTCCTACCCCAATTTCC | |
| 反向 | TTGGTCCTTAGCCACTCCTTC | |
| IL-17 | 127 | |
| 正向 | TTTAACTCCCTTGGCGCAAAA | |
| 反向 | CTTTCCCTCCGCATTGACAC | |
| IL-18 | 133 | |
| 正向 | GACTCTTGCGTCAACTTCAAGG | |
| 反向 | CAGGCTGTCTTTTGTCAACGA | |
| IFN-γ | 106 | |
| 正向 | CTGGAGGAACTGGCAAAAGGATGG | |
| 反向 | GACGCTTATGTTGTTGCTGATGGC | |
| TNF-α | 122 | |
| 正向 | CGCTCTTCTGTCTACTGAACTTCGG | |
| 反向 | GTGGTTTGTGAGTGTGAGGGTCTG | |
| Ly6G | 162 | |
| 正向 | GCTCATCCTTCTTGTGGTCCTACTG | |
| 反向 | TTGTGTTGCAGGAAGTCTCAGGTG | |
| MPO | 136 | |
| 正向 | GCTCCTTGCCTGCCTCATTGG | |
| 反向 | TGCCAGTGTTGTCACAGATGATACG | |
| NLRP3 | 141 | |
| 正向 | ATTACCCGCCCGAGAAAGG | |
| 反向 | TCGCAGCAAAGATCCACACAG | |
| GAPDH | 123 | |
| 正向 | AGGTCGGTGTGAACGGATTTG | |
| 反向 | TGTAGACCATGTAGTTGAGGTCA |
注:CXCL2为趋化因子CXC配体2;IL-1β为白细胞介素-1β;IL-6为白细胞介素-6;IL-17为白细胞介素-17;IL-18为白细胞介素-18;IFN-γ为干扰素-γ;TNF-α为肿瘤坏死因-α;Ly6G为淋巴细胞抗原6复合位点G;MPO为髓过氧化物酶;NLRP3为NOD样受体热蛋白结构域相关蛋白3;GAPDH为甘油醛-3-磷酸脱氢酶
5. 细胞焦亡相关蛋白表达水平蛋白质印迹法检测:裂解缓冲液中加入蛋白酶和磷酸酶抑制剂并预冷至4 ℃,加入心室组织匀浆。用BCA蛋白质测定试剂盒进行蛋白质浓度定量。将蛋白质(30 μg/泳道)加到十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)上电泳,后转移到PVDF膜上。用5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭2 h,分别与NLRP3抗体(1∶1 000),Gasdermin-D抗体(1∶1 000),含半胱氨酸的天冬氨酸蛋白水解酶1/p20/p10 多克隆抗体(1∶1 000),IL-1β抗体(1∶1 000),IL-18抗体(1∶1 000),β微管蛋白抗体(1∶1 000)一抗4 ℃孵育过夜后,以TBST洗涤,再将膜与DylightTM800 4XPEG偶联山羊抗兔IgG(H+L)抗体和DylightTM800 4XPEG偶联山羊抗小鼠IgG(H+L)抗体(1∶10 000)室温孵育1 h。设定β微管蛋白(β-tubulin)为内参,用cleaved-Caspase 1/Caspase 1和cleaved-GSDMD/GSDMD比值变化反映Caspase 1和GSDMD的活化程度。使用Bio-rad凝胶成像系统曝光,用ImageJ 软件定量分析条带灰度值。
6. 二维超声心动图检查:在第17天时用Vevo2100超声及分析系统(VisualSonics,Canada)对对照组、模型组和治疗组行二维超声心动图检查,30 MHz高频扫描探头采集图像。小鼠胸前区备皮,吸入异氟烷维持麻醉,取仰卧位。在胸骨旁左心室长轴切面左心室内径最大处显示M型图像,分析LVEF、左心室缩短分数(left ventricular fractional shortening,LVFS)、左室前壁厚度(left ventricular anterior wall,LVAW)、左室后壁厚度(left ventricular posterior wall,LVPW)。所有测量结果均取连续3个心动周期的平均值。
7. 心肌组织H-E染色评估炎症浸润水平:第17天处死小鼠后,用PBS心脏灌流,分离称重,再用4%的多聚甲醛固定24 h后石蜡包埋,然后制成厚5 μm的水平切片。采用H-E染色,选取光镜下代表性图像(放大200或400倍),分析心肌组织炎性细胞浸润占视野总面积的百分比,评估其炎症浸润水平。
8. 免疫组化染色评估NETs水平:心脏切片同上,将心脏切片脱蜡、再水化,在室温下用3%过氧化氢阻断内源性过氧化物酶活性30 min。然后用5%山羊血清室温封闭30 min,与MPO抗体(1∶1 000)、H3Cit抗体(1∶1 000)一抗4 ℃孵育过夜。随后彻底清洗并与辣根过氧化物酶偶联SignalStain® Boost免疫组化检测试剂室温孵育1 h。用二氨基联苯胺显色,选取光镜下代表性图像(放大200和400倍或局部放大1 200倍),通过NETs组分MPO、H3Cit的组化阳性面积占视野总面积的百分比,分析造模及治疗对NETs水平影响。
9. 统计学分析:使用Prism 8.0软件进行数据分析。符合正态分布的计量资料采用表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。双侧检验,检验水准α=0.05。
在造模过程中及第17天结束时对各组小鼠进行检测评估。根据“材料和方法”中PD-1抑制剂相关心肌炎小鼠模型标准,所有小鼠模型构建成功,心肌组织H-E染色可见明显炎性细胞浸润,伴心超LVEF下降[10]。造模第10天后观察到模型组体重开始下降,在第10天、第15天、第17天,模型组小鼠的体重[(23.22±1.13)、(22.60±1.01)、(22.01±0.99)g]均较对照组[(26.15±1.20)、(26.60±1.30)、(27.10±1.41)g]下调(t值分别为5.49、7.57、9.36,P值分别为0.001、<0.001、<0.001)。对照组和模型组间心重[(0.14±0.01)和(0.15±0.01)mg;t=2.24,P=0.05]、心重/胫骨长度比(0.08±0.01和0.09±0.01;t=1.41,P=0.18)差异无统计学意义,但对照组的心重/体重比显著低于模型组(5.14±0.25和6.07±0.10;t=10.46,P<0.001)。
1. PD-1抑制剂相关心肌炎的中性粒细胞心肌浸润变化:小鼠心肌双标免疫荧光染色及代表性局部放大图显示,模型组小鼠心肌MPO、Ly6G荧光信号(7.03±0.29、4.88±0.23)均较对照组(0.98±0.03、0.94±0.03)升高(t值分别为61.42、49.84,P值均<0.001)。模型组小鼠较对照组小鼠中性粒细胞心肌浸润明显增加(6.37±0.30和0.10±0.02;t=57.38,P<0.001)(图1)。
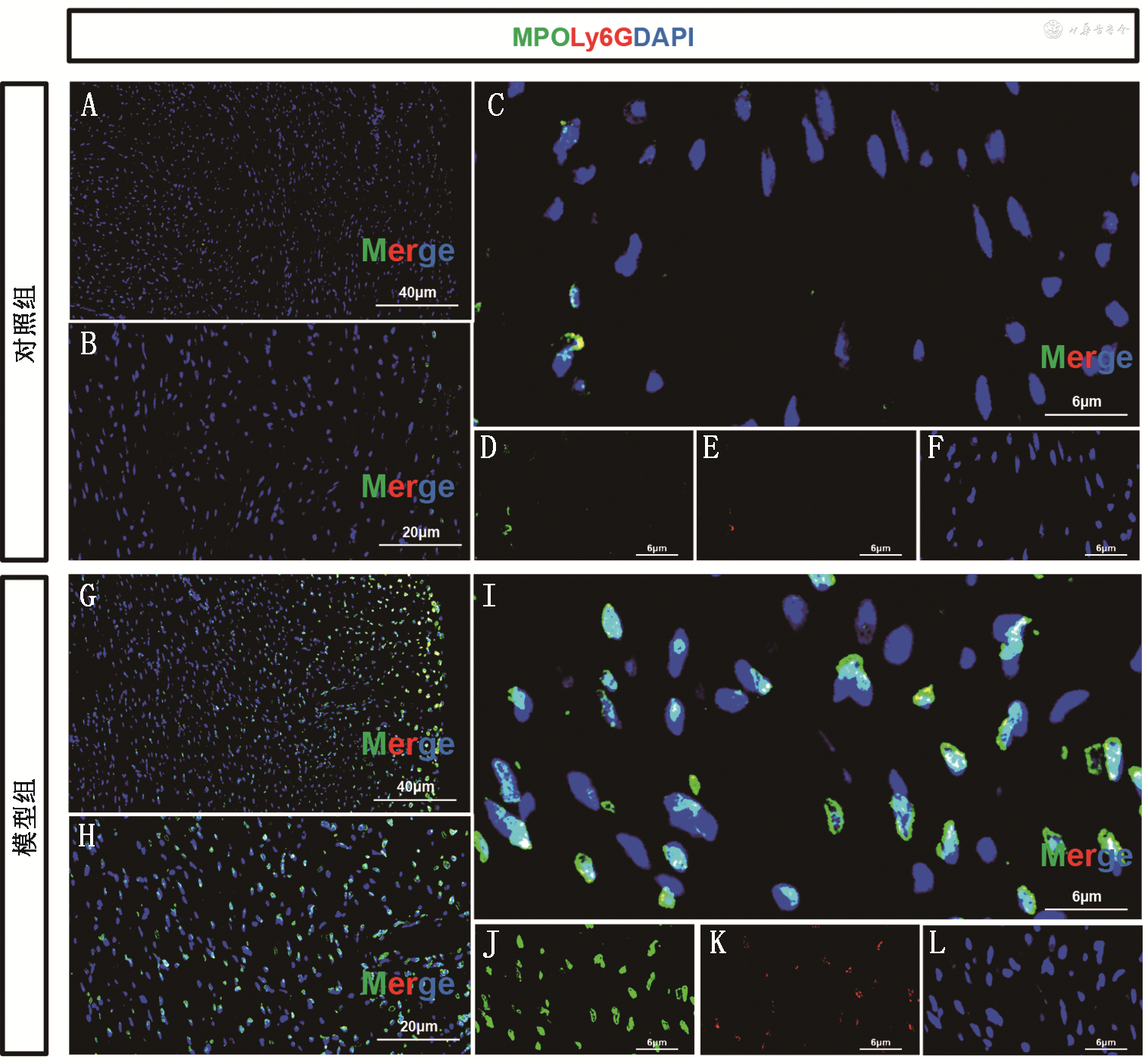

注:黄色荧光共定位表示中性粒细胞;PD-1为程序性细胞死亡受体-1;MPO为髓过氧化物酶;Ly6G为淋巴细胞抗原6复合位点G;DAPI为4′,6-二脒基-2-苯基吲哚
2. PD-1抑制剂相关心肌炎的炎症及焦亡因子表达情况:小鼠心肌MPO、H3Cit荧光共定位结果提示,模型组NETs水平远高于对照组(2.49±0.08比0.99±0.26;t=25.87,P<0.001)。同步NLRP3荧光证明:模型组小鼠较对照组小鼠心肌组织NLRP3炎症小体水平明显上调(3.26±0.25比0.96±0.01;t=15.79,P<0.001)(图2)。
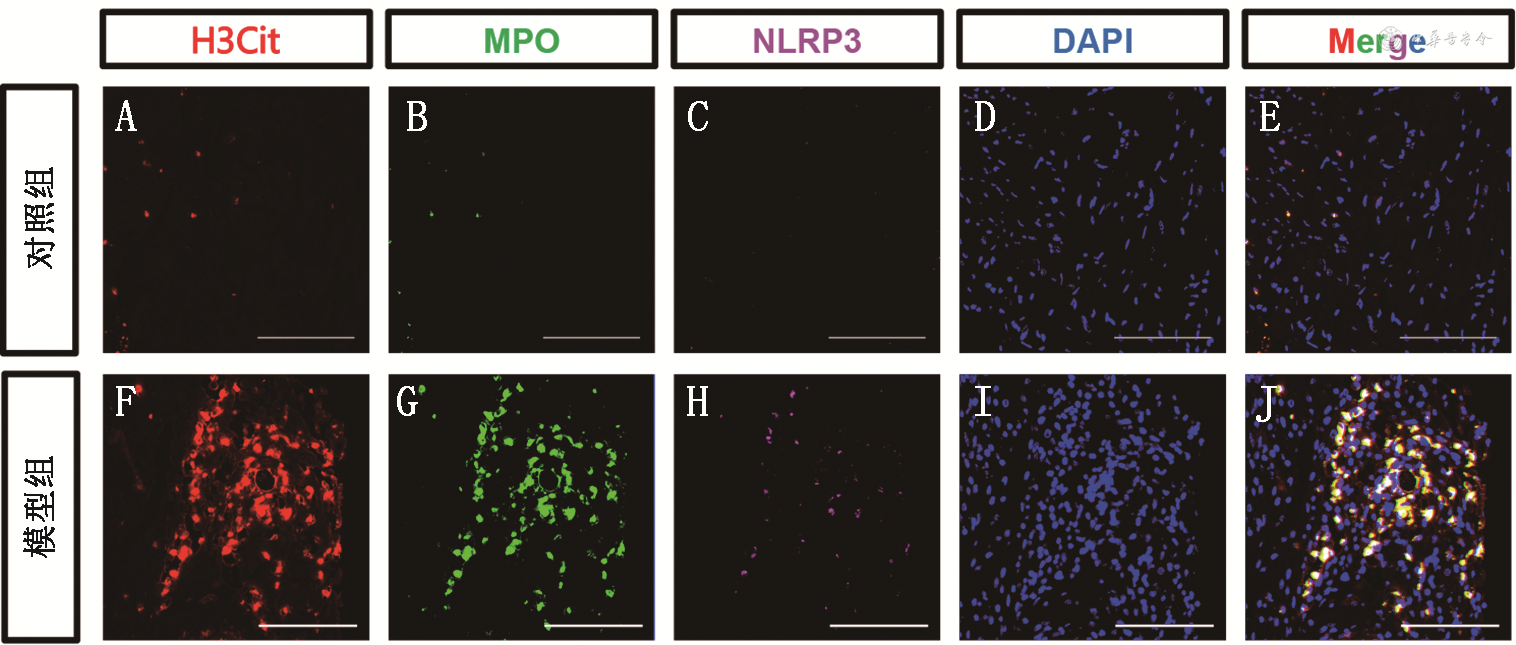

注:E、J图中橙色荧光共定位表示NETs形成;H3Cit为瓜氨酸化组蛋白H3;MPO为髓过氧化物酶;NLRP3为NOD样受体热蛋白结构域相关蛋白3;DAPI为4′,6-二脒基-2-苯基吲哚;NETs为中性粒细胞外陷阱;PD-1为程序性细胞死亡受体-1
各组RTFQ-PCR结果提示,模型组小鼠心肌中性粒细胞相关趋化因子CXCL2、IL-17、IL-18、IFN-γ的mRNA水平(47.63±9.91、21.65±4.49、46.87±9.85、138.80±15.38)均较对照组(1.00±0.02、0.99±0.01、1.00±0.02、1.00±0.04)上调(t值分别为14.11、13.81、14.13、26.87,均P<0.001);NETs相关因子Ly6G、MPO的mRNA水平(150.40±10.97和597.30±66.77)均较对照组(1.01±0.11和1.12±0.03)上调(t值为40.86和26.79,P值均<0.001);PD-1抑制剂还显著增加焦亡相关促炎细胞因子IL-6、TNF-α、IL-1β的mRNA水平,模型组上述细胞因子的表达水平(15.71±1.43、436.60±61.46、601.50±95.16)均较对照组(0.95±0.04、1.04±0.17、1.06±0.06)上调(t值分别为31.02、21.26、18.93,均P<0.001);小鼠模型组心肌炎症小体NLRP3转录水平高于对照组(22.25±6.61比0.96±0.02;t=9.66,P<0.001)。
蛋白质印迹法检测结果进一步显示,模型组心肌组织焦亡相关NLRP3、cleaved-Caspase 1、Caspase 1、cleaved-GSDMD、GSDMD、IL-1β和IL-18的蛋白表达水平(1.53±0.11、0.71±0.05、0.47±0.06、0.09±0.01、0.07±0.01、0.82±0.05、0.82±0.05)均较对照组(1.15±0.12、0.24±0.06、0.18±0.03、0.05±0.01、0.06±0.01、0.63±0.06、0.63±0.06)上调(t值分别为4.01、9.78、7.68、7.12、12.52、4.11、4.11,P值分别为0.004、<0.001、0.016、0.002、<0.001、0.015、<0.001)(图3)。同时,模型组cleaved-Caspase 1/Caspase 1、cleaved-GSDMD/GSDMD水平(0.47±0.06和1.23±0.13)高于对照组(0.18±0.03和0.78±0.13)(t值为7.68和4.35,P值为0.002和0.012)。
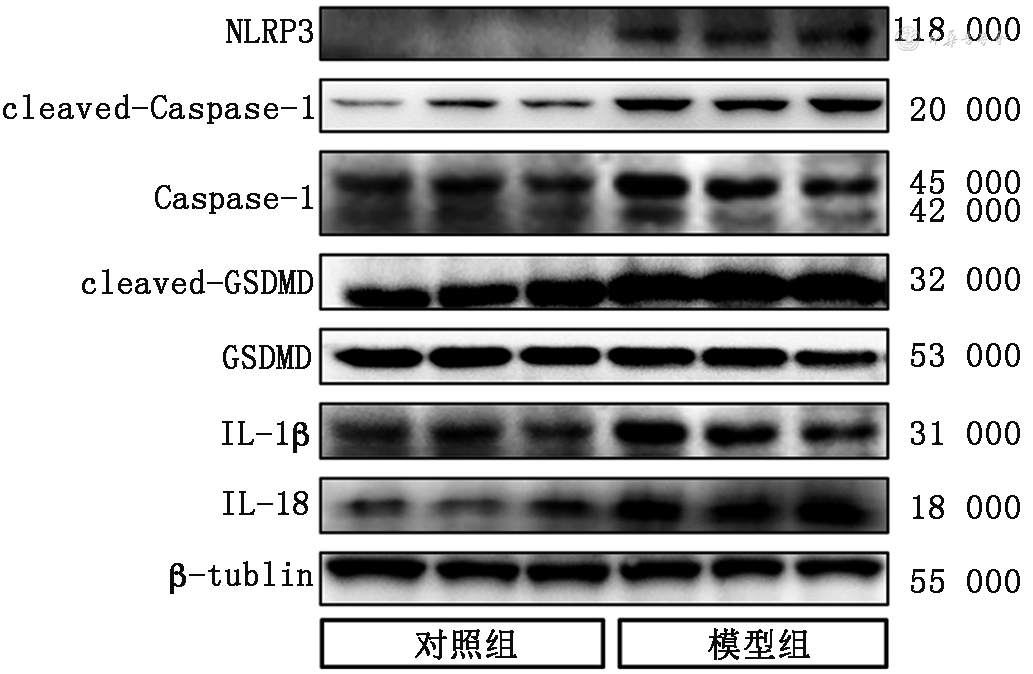

注:NLRP3为NOD样受体热蛋白结构域相关蛋白3;cleaved-Caspase 1为剪切的含半胱氨酸的天冬氨酸蛋白水解酶1;Caspase 1为含半胱氨酸的天冬氨酸蛋白水解酶1;cleaved-GSDMD为剪切的Gasdermin-D;IL-1β为白细胞介素-1β;IL-18为白细胞介素-18;β-tubulin为β微管蛋白;PD-1为程序性细胞死亡受体-1
3. PF-1355治疗组表型、组织病理和NETs形成的变化:在造模过程中连续腹腔注射PF-1355对PD-1抑制剂相关心肌炎起到保护作用。PF-1355的保护作用延缓了小鼠一般状态恶化,3组间比较,治疗组直到造模第17天才出现体重下降[(27.00±1.42)、(23.38±1.21)、(26.00±0.52)g;F=6.70,P<0.001)](图4A)。3组在心重[(0.14±0.01)、(0.13±0.02)、(0.13±0.01)mg]、心重/胫骨长度比[(0.08±0.01)、(0.09±0.01)、(0.08±0.01)mg/cm]之间差异均无统计学意义。但治疗组小鼠心重/体重比低于模型组,对照组小鼠为(5.21±0.27)mg/g,模型组为(6.16±0.09)mg/g,治疗组为(5.31±0.19)mg/g(F=61.76,P<0.001)。
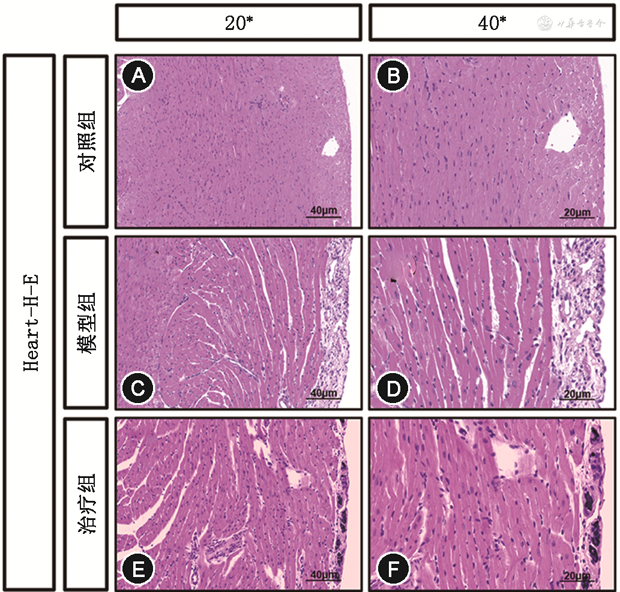

注:H-E为苏木精-伊红染色;PD-1为程序性细胞死亡受体-1
通过对3组超声心动图分析,发现治疗组小鼠LVEF和LVFS明显改善(均P<0.001),收缩期和舒张期LVAW均恢复到接近正常水平(均P<0.001),但收缩期和舒张期LVPW较模型组无明显变化(表2)。治疗组小鼠比模型组小鼠LVEF高10.40%±3.12%,LVFS高11.60%±2.09%。治疗组小鼠比模型组小鼠收缩期LVAW低(0.39±0.07)mm,舒张期LVAW低(0.19±0.02)mm。
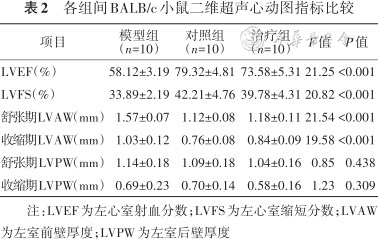
各组间BALB/c小鼠二维超声心动图指标比较
各组间BALB/c小鼠二维超声心动图指标比较
| 项目 | 模型组(n=10) | 对照组(n=10) | 治疗组(n=10) | F值 | P值 |
|---|---|---|---|---|---|
| LVEF(%) | 58.12±3.19 | 79.32±4.81 | 73.58±5.31 | 21.25 | <0.001 |
| LVFS(%) | 33.89±2.19 | 42.21±4.76 | 39.78±4.31 | 20.82 | <0.001 |
| 舒张期LVAW(mm) | 1.57±0.07 | 1.12±0.08 | 1.18±0.11 | 21.54 | <0.001 |
| 收缩期LVAW(mm) | 1.03±0.12 | 0.76±0.08 | 0.84±0.09 | 19.58 | <0.001 |
| 舒张期LVPW(mm) | 1.14±0.18 | 1.09±0.18 | 1.04±0.16 | 0.85 | 0.438 |
| 收缩期LVPW(mm) | 0.69±0.23 | 0.70±0.14 | 0.58±0.16 | 1.23 | 0.309 |
注:LVEF为左心室射血分数;LVFS为左心室缩短分数;LVAW为左室前壁厚度;LVPW为左室后壁厚度
心脏病理切片H-E染色进一步证明PF-1355的治疗效果。模型组心脏炎症浸润面积30.12%±3.57%(图4C、D)多于对照组的0.03%±0.01%(图4A、B)和治疗组的14.92%±2.46%(F=325.70,P<0.001)(图4)。
模型组NETs大量形成,免疫组化中模型组MPO、H3Cit(红色箭头标记)的表达(43.41%±1.07%和44.71%±0.82%)(图5C、D、I、J)较对照组(4.77%±0.73%和5.40%±0.50%)(图5A、B、G、H)和治疗组(11.92%±1.10%和17.84%±1.23%)(图5E、F、K、L)上调(F值分别为396.2和446.4,均P<0.001)。
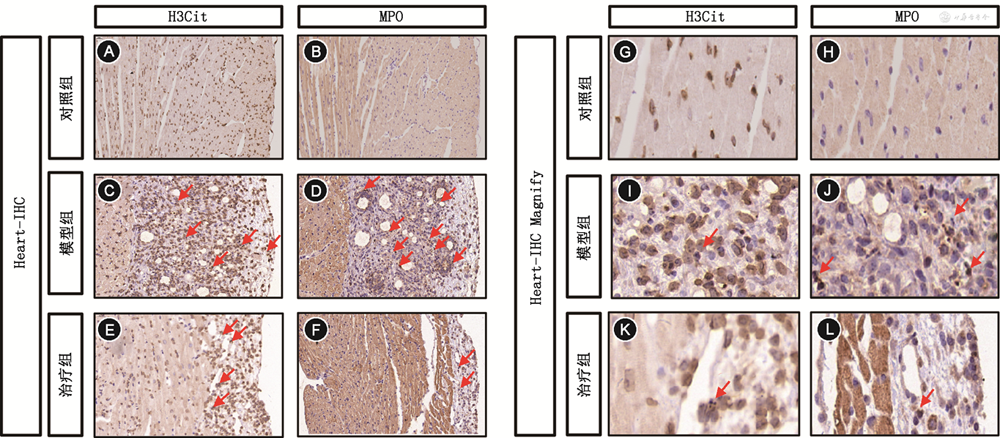

注:IHC为免疫组织化学染色;Magnify为局部放大;H3Cit为瓜氨酸化组蛋白H3;MPO为髓过氧化物酶;PD-1为程序性细胞死亡受体-1
4. PF-1355治疗组心肌焦亡水平的变化:小鼠心肌免疫荧光染色提示,治疗组心肌NETs和NLRP3水平均较模型组明显下调。模型组NETs水平为2.52±0.04,高于对照组的0.98±0.05和治疗组的1.03±0.05(F=121.6,P<0.001)。模型组NLRP3水平为3.40±0.03,高于对照组的0.96±0.03和治疗组的1.01±0.02(F=691.9,P<0.001)(图6)。
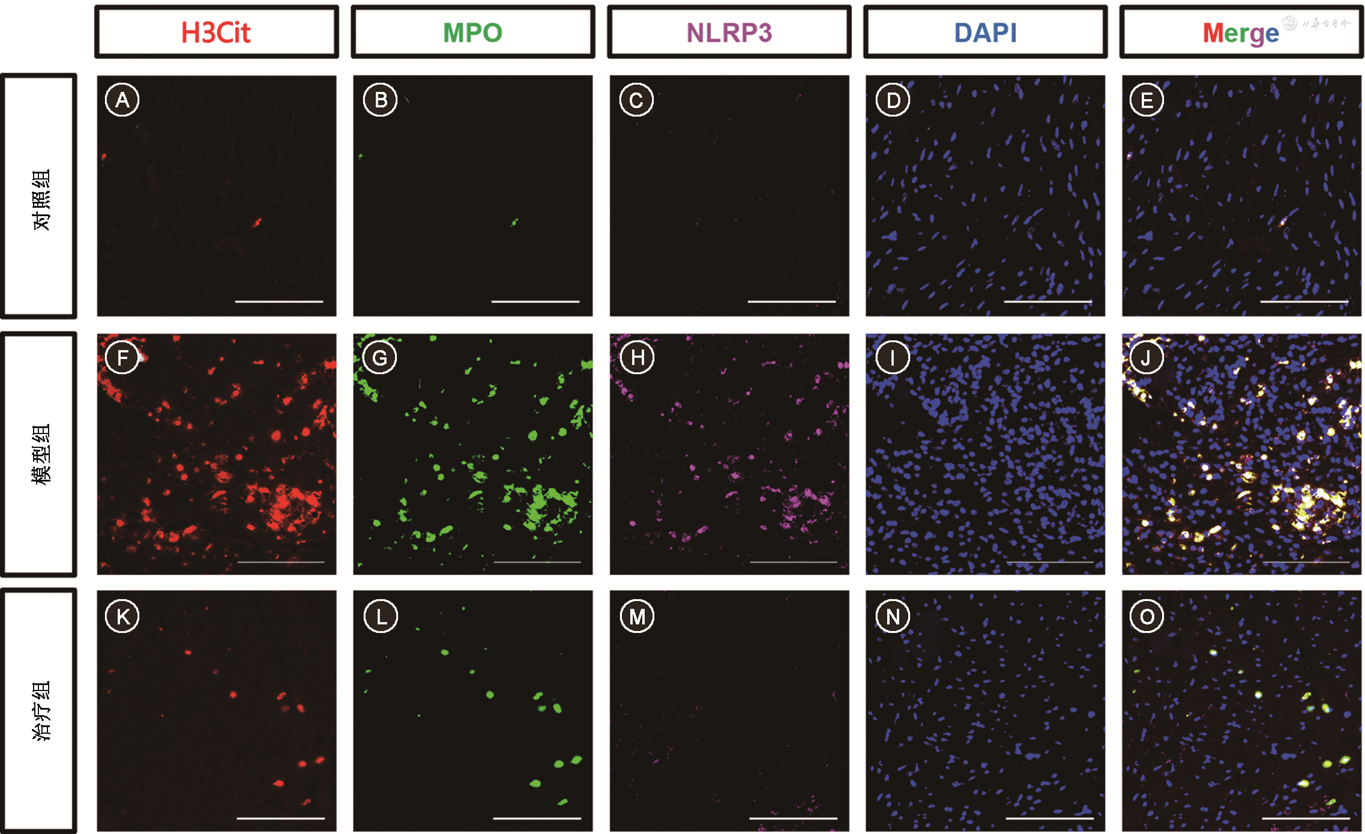

注:E、J、O图橙色荧光共定位表示NETs形成;H3Cit为瓜氨酸化组蛋白H3;MPO为髓过氧化物酶;DAPI为4′,6-二脒基-2-苯基吲哚;PD-1为程序性细胞死亡受体-1
蛋白质印迹法检测结果进一步显示,模型组心肌组织焦亡相关NLRP3、cleaved-Caspase 1、Caspase 1、cleaved-GSDMD、GSDMD、IL-1β和IL-18的蛋白表达水平均较对照组和治疗组上调(均P<0.05)。同时,模型组cleaved-Caspase 1/Caspase 1、cleaved-GSDMD/GSDMD水平(1.71±0.11和0.77±0.09)高于对照组(1.02±0.13和1.13±0.07),治疗组上述指标的水平均较模型组下调(1.07±0.11和1.32±0.05)(F值分别为33.96和60.95,均P<0.001)(图7)。
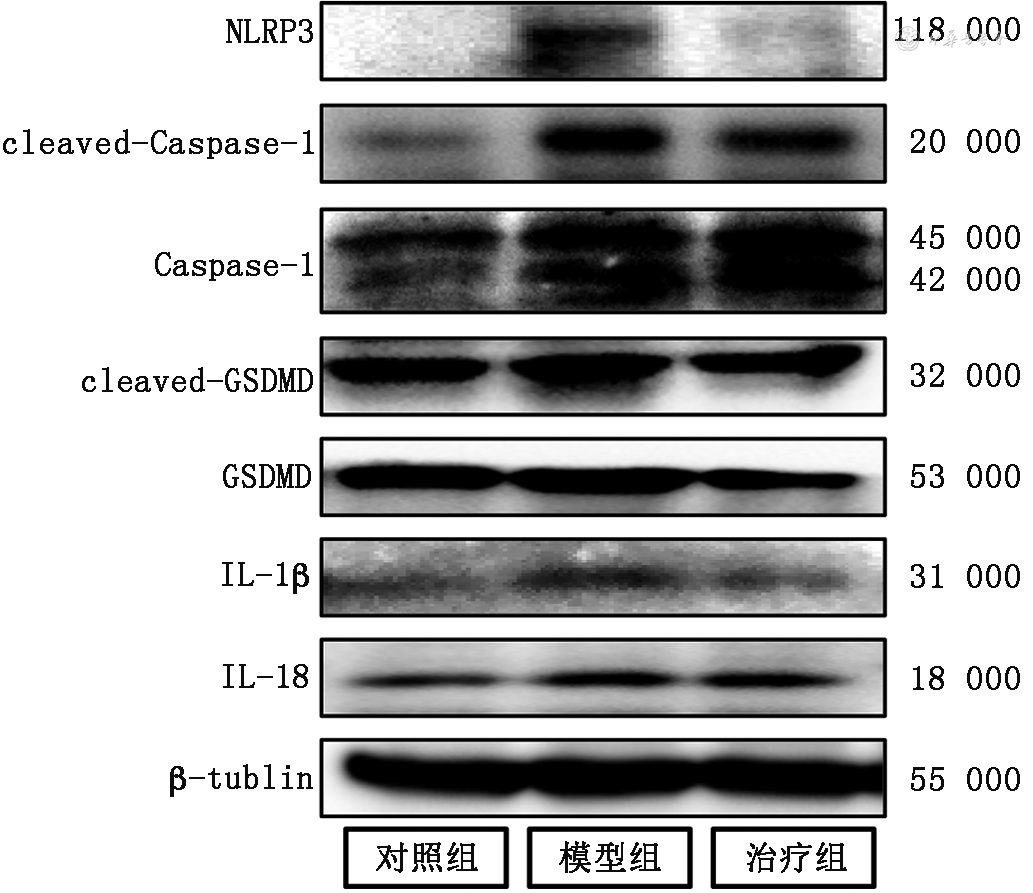

注:NLRP3为NOD样受体热蛋白结构域相关蛋白3;cleaved-Caspase 1为剪切的含半胱氨酸的天冬氨酸蛋白水解酶1;Caspase 1为含半胱氨酸的天冬氨酸蛋白水解酶1;cleaved-GSDMD为剪切的Gasdermin-D;IL-1β为白细胞介素-1β;IL-18为白细胞介素-18;β-tubulin为β微管蛋白;PD-1为程序性细胞死亡受体-1;PF-1355为特异性髓过氧化物酶抑制剂
PD-1抑制剂过度激活的免疫内环境会造成ICIAM等凶险的并发症[11, 12, 13]。糖皮质激素冲击虽为目前一线ICIAM治疗方案,但其容易诱发激素相关复杂感染和系统内环境失调,亟需探索治疗ICIAM切实有效的新靶点。免疫调控疗法中,中性粒细胞在免疫平衡中的关键地位受到高度关注[14]。NETs在多种血栓炎症性疾病中的负面影响都曾被报道[9,15]。此外,更多研究还证实了失衡的NETs和神经、内皮细胞焦亡之间的紧密联系[7,16]。
为了探究NETs在ICIAM中的作用及治疗心肌炎的新疗法,本研究在PD-1抑制剂相关心肌炎小鼠模型中探讨了NETs形成和其导致心肌损伤的潜在机制,并探索了调控NETs对ICIAM的疗效。
PD-1抑制剂诱导小鼠心肌炎模型的成功构建以小鼠一般情况恶化和免疫细胞心肌浸润为主要特征。模型组中,小鼠心重/体重变化明显,心肌病理也提示炎症浸润面积百分比明显上升。同时,模型组心肌炎症浸润部位出现增高的MPO和Ly6G荧光共定位信号,心肌RTFQ-PCR示该组中性粒细胞相关趋化因子的明显升高,提示中性粒细胞趋化并浸润于病变部位。
本研究进一步探究了NETs形成并诱发心肌焦亡的可能性。ICIAM模型中NETs和焦亡水平均上调;进而,免疫荧光提示炎症浸润部位依赖于NETs的NLRP3水平上升;其后,细胞焦亡相关蛋白表达水平蛋白质印迹法检测更深入证实了NLRP3介导的心肌焦亡通路全面上调。在ICIAM的病理过程中,激活的NETs-NLRP3炎症小体轴造成心肌细胞焦亡是关键的心肌损伤途径。
因此,阻断NETs和其重要组分的形成或功能,有望成为治疗ICIAM的潜在靶点。虽然直接靶向NETs的抑制剂在减少心肌炎小鼠的炎症和组织损伤中的作用已得到初步验证[17],但是该抑制剂的脱靶风险和相对高昂的成本也阻止了其进一步的临床转化[18]。MPO是NETs的重要组分,特异性MPO抑制剂PF-1355在既往小鼠免疫性疾病治疗中获得切实疗效[19],并兼具高效性、脱靶风险低的特点,但目前其在ICIAM中的治疗优势还没有被发掘[20]。
本研究尝试将PF-1355应用于治疗ICIAM后,发现治疗组小鼠心功能改善,炎症浸润减少,NETs依赖的焦亡途径激活得到缓解。由此可得,特异性MPO抑制剂PF-1355通过控制NETs的形成,进而挽救和逆转NLRP3炎症小体介导的心肌细胞焦亡损伤,有望作为PD-1抑制剂诱发ICIAM的独特治疗策略。本研究采用PD-1抑制剂相关心肌炎小鼠模型来探究ICIAM中以中性粒细胞免疫调控失衡为主导的心肌损伤机制和治疗策略。但鉴于患者间在免疫遗传背景、肿瘤治疗策略、辅助用药方案中的诸多差异,PF-1355治疗ICIAM的临床普适性和安全性仍需要在严谨设计的大范围、多中心随机临床试验中做长期探索。
总之,本研究探究了PD-1抑制剂诱导的ICIAM中NETs的作用和治疗方式。虽然目前结论还需要更多大范围的临床试验验证,但阻断NETs的形成有望成为治疗ICIAM的新策略,而MPO抑制剂PF-1355是一种极有潜力的治疗药物。
陈怡帆, 程蕾蕾, 沈毅辉, 等. 中性粒细胞外陷阱在治疗程序性细胞死亡受体-1抑制剂相关心肌炎中的作用研究[J]. 中华医学杂志, 2023, 103(42): 3384-3393. DOI: 10.3760/cma.j.cn112137-20230901-00357.
所有作者声明不存在利益冲突































