
评价重组人凝血酶对经外科常规止血后依然渗血的肝脏创面的止血疗效、安全性和免疫原性。
采用多中心、分层随机、双盲、安慰剂对照Ⅲ期试验,计划在33家研究中心入组510例受试者,凝血酶组与安慰剂组为2∶1分层随机分配。在大约70%受试者完成观察后进行期中分析,期中分析结果支持有效则研究提前终止。主要疗效终点为可评价出血点的6 min内止血率。术后1个月进行安全性分析,同时评估抗药物抗体(ADA)及中和抗体的阳性率。
截止期中分析,共348例受试者接受随机且给予研究药物,其中男215例,女133例,年龄19~69(52.9±10.9)岁,凝血酶组232例,安慰剂组116例,两组基线特征均衡可比。6 min内止血率凝血酶组和安慰剂组分别为71.6%(95%CI:65.75%~77.36%)和44.0%(95%CI:34.93%~53.00%),组间比较差异有统计学意义(P<0.001)。研究中无≥3级药物相关不良事件和药物相关死亡报告。受试者在使用重组人凝血酶后,无免疫增强ADA发生,也无免疫诱导ADA发生。
重组人凝血酶用于肝脏切除术中创面渗血的止血效果显著,安全性良好,且显示出低免疫原性特征。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
出血是任何外科手术都会碰到并需要解决的关键问题,良好的止血是手术安全进行的前提和保障[1, 2, 3],局部止血可减少患者的出血量,避免全身止血药物的不良反应,缩短止血时间和手术总时间[3]。凝血酶是常用的术中局部止血药[2],通过直接作用于血液凝固过程的最后一步,使血液快速形成稳定的凝血块[4, 5],是凝血机制中的关键酶[6, 7, 8]。此外,凝血酶还被证明是平滑肌和内皮细胞增殖的有效刺激因子[4,9, 10],止血的同时或能促进细胞的有丝分裂,加速创伤愈合[4,11, 12]。外用凝血酶的来源有3种[13]:动物(牛/猪)血来源、人血来源和重组来源。重组人凝血酶可以更好地消除传染性疾病风险以及减少异种蛋白引发的免疫原性问题[2,14, 15, 16],因此是血浆衍生凝血酶的更安全潜在替代品。
目前,全球唯一上市的重组人凝血酶为 ZymoGenetics公司开发的Recothrom[17, 18],但未在中国上市。本研究旨在评价重组人凝血酶对外科常规止血处理后依然渗血的肝脏创面的止血疗效,并将安全性及免疫原性作为次要目的进行评估。
这是一项在中国33家医院研究中心开展的分层随机、双盲、安慰剂对照、Ⅲ期临床试验,纳入执行肝脏楔形切除或肝脏解剖性切除的受试者。纳入标准:年龄18~70岁(包含18岁和70岁)、肝功能储备为A级(Child-Pugh评分≤6分)、入组前4周内未接受过其他治疗性外科手术、术前24 h内未使用过血液制品、术中患者经标准外科止血术控制后仍有轻/中度出血灶者(渗血,非动脉出血)、签署知情同意书。排除标准:已知患有血液系统疾病者(包括凝血功能障碍或有出血倾向者)、对人血浆来源凝血酶/蛇毒血清或仓鼠蛋白过敏者、入组前4周内参加过其他药物临床试验者、其他研究者认为不适合参加试验者。研究方案经浙江大学医学院附属第一医院医学伦理委员会批准(2019伦审第(90)号),经所有参研单位伦理委员会批准,所有患者在筛选前充分了解试验相关内容并获得所有患者知情同意。
凝血酶组与安慰剂组按2∶1执行分层随机分配,分层因素为性别、年龄(18岁≤年龄<60岁/60岁≤年龄≤70岁)。采用中心化随机分组的方法,各中心竞争入组,试验药物由苏州泽璟生物制药股份有限公司统一提供。药物配置:盲法状态下将重组人凝血酶(5 000 IU/支,苏州泽璟生物制药股份有限公司,生产批号5120190802,V5120201103)或安慰剂(不含活性重组人凝血酶成分,苏州泽璟生物制药股份有限公司,生产批号5320190702,5320210502)按同样方法与生理盐水配置成澄清透明液体后(1支药用5 ml无菌生理盐水溶解,使用2支,总药物溶解液为10 ml),与可吸收性明胶海绵[每片(6 cm×2 cm×0.5 cm),2片×10袋/盒,每次使用1片,金陵药业股份有限公司南京金陵制药厂,生产批号181203,190915]联合使用。将充分浸泡研究药物溶液的明胶海绵放置在可评价出血点上(不可用力按压),再用消毒纱布覆盖到明胶海绵顶部,每30 s更换1次纱布,直至完全止血或完成6 min观察,记录止血时间和发生的任何不良事件(adverse event,AE)。经研究者判定为止血无效后,允许使用其他止血措施作为解救治疗,但所采取的解救治疗需避免混淆安全性和免疫原性评估。
术后随访1个月,详细记录受试者随访期间的AE,在用药前和用药后28 d各进行 1次抗药物抗体(anti-drug antibody,ADA)检测以评估免疫原性。
1.研究终点:主要研究终点为可评价出血点6 min内的止血率。次要研究终点包括可评价出血点的止血时间、受试者的AE发生率、抗凝血酶抗体及中和抗体的阳性率。
2.可评价出血点标准:术中明显出血部位经标准外科止血操作(如缝合、结扎或烧灼)处理后,仍旧有轻/中度出血(渗血,非动脉出血)的病灶。
3.止血标准:出血点不再渗出(渗出指透过明胶海绵或向明胶海绵周围渗血)。
4.可评价出血点的止血时间:给予研究药物后,每30 s评价一次止血疗效,直至出血点完全止血或完成6 min观察,记录止血观察时间。若在用药后6 min内未止血,或6 min内使用解救药物,疗效评价则记录为无效。
5.AE判定标准:依据美国国家癌症研究所(National Cancer Institute,NCI)不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0标准判断AE严重程度。采用电化学免疫测定法进行免疫原性检测。
应用SAS 9.4软件对数据进行分析。符合正态分布的定量指标以表示,组间比较采用方差分析;不符合正态分布的定量指标以中位数M(Q1,Q3)进行表示,组间比较采用Wilcoxon 秩和检验。分类指标以例数(%)形式表示,组间比较采用χ2检验、Fisher精确检验或CMH检验。等级资料采用Wilcoxon秩和检验。时间-事件变量采用Kaplan-Meier法计算事件发生时间变量的中位数及其95%置信区间(CI),组间比较采用分层log-rank检验,并通过分层Cox比例风险模型估计组间比较的风险比(HR)及其95%CI。所有的统计检验均采用双侧检验,检验水准α=0.05。计划在33家医院研究中心入组510例受试者,在大约70%受试者完成观察后进行期中分析,结果支持有效则研究提前终止。根据实际期中分析时的人数,基于O'Brien-Flemming消耗函数重新计算有效终止的界值为0.013 3(双侧)。期中分析由独立数据监查委员会进行评估,同时由独立统计师分析数据和汇报结果。
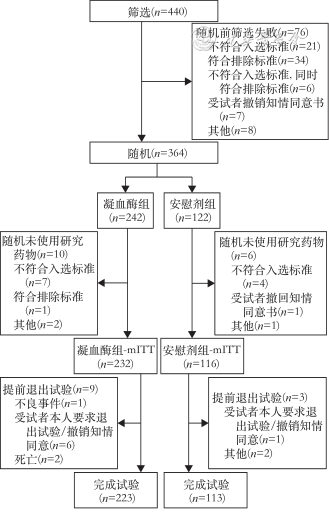
截至2021年7月23日(期中分析),共筛选了440例肝脏手术受试者,最终接受随机并使用研究药物者共计348例(达计划入组例数的68.2%),全部进入改良意向性分析集(modified intention-to-treat,mITT),凝血酶组232例,安慰剂组116例(图1)。进入安全性分析集(safety set,SS)348例(凝血酶组232例,安慰剂组116例),进入免疫原分析集(immunogen analysis set,IAS)333例(凝血酶组222例,安慰剂组111例)。受试者基线见表1,受试者入组前6个月既往及现患疾病见表2。mITT集:所有已经随机且使用研究药物的受试者。SS集:所有已经随机,并至少使用过1次研究药物的受试者。IAS集:所有已经随机,在用药前完成免疫原性检测,至少用药1次,并在术后 28 d免疫原性检测的受试者。

肝脏手术患者的人口统计学数据
肝脏手术患者的人口统计学数据
| 项目 | 凝血酶组(n=232) | 安慰剂组(n=116) | Z/χ2/F值 | P值 |
|---|---|---|---|---|
| 年龄(岁)[M(Q1,Q3)] | 54.0(47.0,62.0) | 53.0(44.5,62.0) | -0.70 | 0.486a |
| 性别[例(%)] | 0.10 | 0.755b | ||
| 男性 | 142(61.2) | 73(62.9) | ||
| 女性 | 90(38.8) | 43(37.1) | ||
| Child-Pugh评分[例(%)] | 0.92 | 0.360a | ||
| 5分 | 213(91.8) | 103(88.8) | ||
| 6分 | 19(8.2) | 13(11.2) | ||
| 凝血酶时间(s,) | 17.1±1.6 | 17.0±1.5b | 0.49 | 0.485c |
| 凝血酶原时间(s,) | 12.1±1.2 | 12.3±1.0 | 2.12 | 0.146c |
| 纤维蛋白原(g/L,) | 3.0±0.9 | 3.2±1.0 | 2.59 | 0.109c |
| 国际标准化比值() | 1.0±0.1 | 1.0±0.1 | 1.17 | 0.279c |
| 血小板计数(×109/L,) | 199.4±70.1 | 207.8±77.5 | 1.04 | 0.309c |
| 过敏史[例(%)] | 19(8.2) | 8(6.9) | 0.18 | 0.671b |
| 入组前4周内手术治疗史[例(%)] | 2(0.9) | 0(0.0) | NA | 0.554d |
| 手术方式[例(%)] | 0.59 | 0.441b | ||
| 开腹手术 | 140(60.3) | 65(56.0) | ||
| 腹腔镜手术 | 92(39.7) | 51(44.0) | ||
| 手术切除方式[例(%)] | 0.57 | 0.448b | ||
| 肝脏楔形切除术 | 120(51.7) | 55(47.4) | ||
| 肝脏解剖切除术 | 112(48.3) | 61(52.6) | ||
| 术后出血程度[例(%)] | NA | 0.051d | ||
| 轻度 | 179(77.5) | 78(67.2) | ||
| 中度 | 52(22.5) | 38(32.8) | ||
| 缺失 | 1e | 0 |
注:aWilcoxon秩和检验;bχ2检验;c采用方差分析模型计算;dFisher精确检验;e经研究者确认该受试者术后出血程度实际为重度,但由于EDC系统中没有重度的选项,所以显示为缺失;NA为无统计值
患病率≥5%的入组前6个月既往及现患疾病[例数(%)]
患病率≥5%的入组前6个月既往及现患疾病[例数(%)]
| 疾病类型 | 凝血酶(n=232) | 安慰剂(n=116) | 疾病类型 | 凝血酶(n=232) | 安慰剂(n=116) | |
|---|---|---|---|---|---|---|
| 肝胆系统疾病 | 167(72.0) | 78(67.2) | 肾脏及泌尿系统疾病 | 62(26.7) | 32(27.6) | |
| 肝硬化 | 56(24.1) | 24(20.7) | 肾脏囊肿 | 55(23.7) | 25(21.6) | |
| 肝脏肿块 | 50(21.6) | 26(22.4) | 肾石症 | 12(5.2) | 6(5.2) | |
| 肝囊肿 | 48(20.7) | 21(18.1) | 血管与淋巴管类疾病 | 55(23.7) | 24(20.7) | |
| 胆管结石 | 30(12.9) | 17(14.7) | 高血压 | 41(17.7) | 20(17.2) | |
| 胆石症 | 23(9.9) | 13(11.2) | 呼吸系统、胸及纵隔疾病 | 46(19.8) | 22(19.0) | |
| 胆囊息肉 | 15(6.5) | 8(6.9) | 肺部肿块 | 17(7.3) | 11(9.5) | |
| 慢性胆囊炎 | 14(6.0) | 11(9.5) | 肺气肿 | 12(5.2) | 5(4.3) | |
| 肝脂肪变性 | 12(5.2) | 5(4.3) | 胃肠系统疾病 | 46(19.8) | 25(21.6) | |
| 良性、恶性及性质不明的肿瘤 | 162(69.8) | 82(70.7) | 慢性胃炎 | 17(7.3) | 9(7.8) | |
| 肝癌 | 56(24.1) | 31(26.7) | 代谢及营养类疾病 | 44(19.0) | 20(17.2) | |
| 肝细胞癌 | 21(9.1) | 9(7.8) | 低钾血症 | 14(6.0) | 5(4.3) | |
| 复发性肝癌 | 10(4.3) | 6(5.2) | 2型糖尿病 | 10(4.3) | 7(6.0) | |
| 肝血管瘤 | 45(19.4) | 27(23.3) | 各种手术及医疗操作 | 40(17.2) | 18(15.5) | |
| 感染及侵染类疾病 | 130(56.0) | 69(59.5) | 胆囊切除术 | 12(5.2) | 4(3.4) | |
| 乙型肝炎 | 58(25.0) | 39(33.6) | 血液及淋巴系统疾病 | 31(13.4) | 17(14.7) | |
| 慢性乙型肝炎 | 40(17.2) | 14(12.1) | 脾肿大 | 21(9.1) | 9(7.8) | |
| 贫血 | 8(3.4) | 6(5.2) |
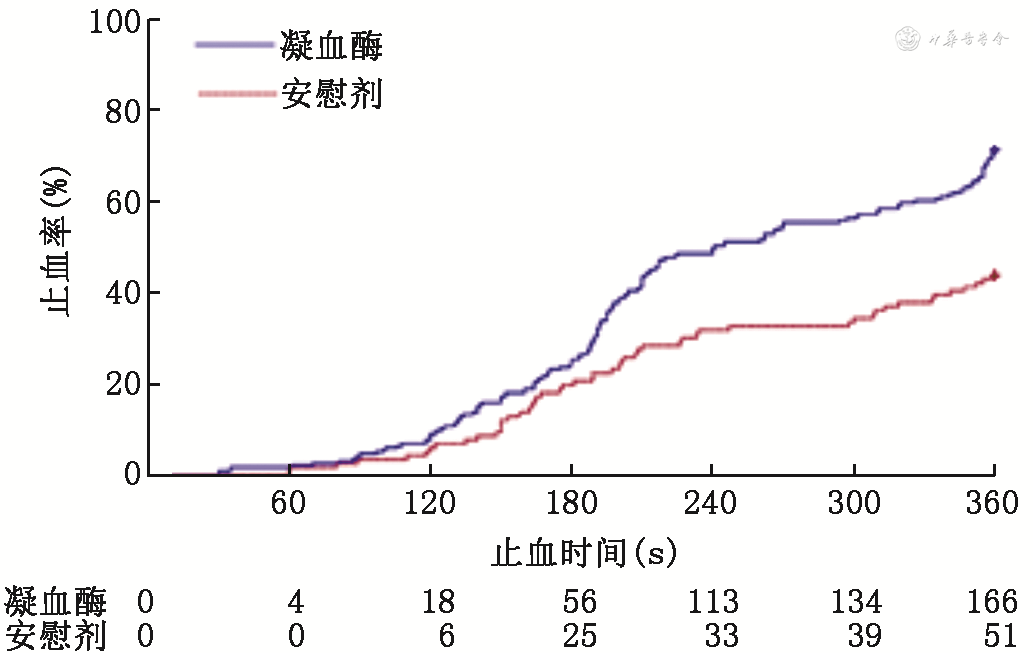
主要疗效分析基于mITT集,可评价出血点6 min内的止血率在凝血酶组和安慰剂组分别为71.6%(95%CI:65.8%~77.4%)和44.0%(95%CI:34.9%~53.0%),组间比较差异有统计学意义(χ2=25.02,P<0.001),校正分层因素后止血率差为27.6%(95%CI:16.9%~38.4%)。凝血酶组和安慰剂组中位止血时间分别为240.5 s(95%CI:210.0~297.0)和NA(NA表示截止到用药后观察6 min,中位止血时间尚未达到95%CI:341.0~NA)(图2)。分层Cox比例风险模型分析结果显示:凝血酶组可评价出血点的止血成功的概率是安慰剂组的2.04倍(HR=2.04,95%CI:1.49~2.79),组间差异有统计学意义(分层Log-Rank检验P<0.001)。随着时间的延长,凝血酶组止血成功率优势逐渐扩大。

安全性分析基于SS集,治疗期间与研究药物相关的AE:凝血酶组为3例(1.3%),安慰剂组为4例(3.4%)(表3)。研究中未发生≥3级药物相关AE和药物相关死亡。有2例(0.9%)受试者发生导致死亡的AE,均发生在凝血酶组(1例多器官功能不全综合征、1例急性心肌梗死),经研究者判定均与研究药物无关。
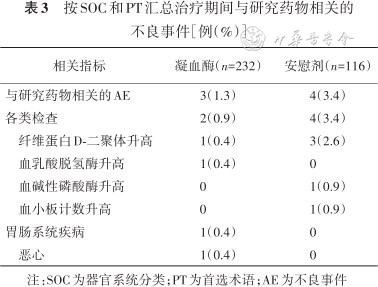
按SOC和PT汇总治疗期间与研究药物相关的不良事件[例(%)]
按SOC和PT汇总治疗期间与研究药物相关的不良事件[例(%)]
| 相关指标 | 凝血酶(n=232) | 安慰剂(n=116) |
|---|---|---|
| 与研究药物相关的AE | 3(1.3) | 4(3.4) |
| 各类检查 | 2(0.9) | 4(3.4) |
| 纤维蛋白D-二聚体升高 | 1(0.4) | 3(2.6) |
| 血乳酸脱氢酶升高 | 1(0.4) | 0 |
| 血碱性磷酸酶升高 | 0 | 1(0.9) |
| 血小板计数升高 | 0 | 1(0.9) |
| 胃肠系统疾病 | 1(0.4) | 0 |
| 恶心 | 1(0.4) | 0 |
注:SOC为器官系统分类;PT为首选术语;AE为不良事件
免疫原性评估基于IAS集,给药前ADA检测为阳性的受试者有38例(凝血酶组27例,安慰剂组11例)(滴度范围:5~14),这38例受试者在给药后28 d执行ADA检测时均未检测到免疫增强。295例给药前ADA检测为阴性的受试者中(凝血酶组195例,安慰剂组100例),3例给药后ADA检测为阳性,均发生在安慰剂组,滴度均为5[最低稀释倍数(MRD)=5]。对于ADA检测结果为阳性的受试者(包括给药前检测和给药后检测)均进一步进行了中和抗体检测,结果均为阴性。
本研究评估了重组人凝血酶对外科常规止血处理后依然渗血的肝脏创面的止血疗效,取得了满意结果,重组人凝血酶相较于安慰剂表现出了显著的止血疗效,可评价出血点6 min内止血率差为27.6%,止血率差的95%CI下限达16.9%,远超预设的优效界值(10%)。由于该研究的主要疗效评价指标选择的是6 min内止血率,与ZymoGenetics公司的重组人凝血酶Recothrom在其Ⅲ期临床研究中所选择的10 min内止血率[17]作为主要疗效评价指标存在差别,故两款重组人凝血酶产品的关键性研究中的主要止血疗效数据之间无可参照性。临床前药效学研究表明:两款重组人凝血酶产品止血疗效相当(数据尚未发表)。值得关注的是,Recothrom在其Ⅲ期研究的亚组分析(外周动脉搭桥受试者)中报道了6 min内止血率结果,重组人凝血酶组为76.0%,牛凝血酶组为67.0%[18],数值上与本研究中重组人凝血酶组6 min内止血率结果(71.6%)相似,提示本研究中的重组人凝血酶与既往凝血酶产品在6 min内止血率上成绩相当。但由于手术技术、研究人群和其他变量的差异,更准确的比较还需进行严谨的对照研究以进一步探索。
安全性方面,重组人凝血酶组与研究药物相关的任何级别AE发生率仅为1.3%,数值上甚至低于安慰剂组(3.4%)。研究过程中发生的≥3级的AE以及严重不良事件(SAE)主要与基础疾病、手术和围手术期用药有关,经研究者判定均与研究药物无关,且未发生与研究药物相关的死亡事件,提示重组人凝血酶安全性良好。
目前,中国仅有动物血来源及人血来源的凝血酶上市,但这两种来源的凝血酶产品均存在一定的安全性风险,其中动物血来源的凝血酶异种蛋白诱导产生抗体的问题引起了美国食品药品监督管理局(FDA)的高度警惕,并在1996年发布了黑框警告,特别警告“具有牛凝血酶制剂抗体的患者不应再暴露于这些产品”[9,13]。因为这些抗体能够与人内源性凝血蛋白发生交叉反应,这可能会导致凝血相关的实验室检测指标异常,甚至严重的凝血障碍或血栓形成[13,19, 20, 21, 22, 23, 24]。本研究的免疫原性结果显示:受试者在使用重组人凝血酶后,无免疫增强ADA发生,也无免疫诱导ADA发生,中和抗体检测均呈阴性,提示重组人凝血酶具备低免疫原性特征。Recothrom在其Ⅲ期临床研究中的免疫原性结果[17]亦支持重组人凝血酶具备低免疫原性的结论(与牛凝血酶做的头对头比较)。从免疫原性特征考虑,重组人凝血酶或是更安全的选择[2,15,24]。本研究中安慰剂组有3例给药前ADA检测为阴性者,在给药后ADA检测时为阳性,滴度均为5(MRD=5),从给药前后样品原始的样品平均信号值/板的阴性质控(S/N)来看并无很大的差异,阳性结果可能是由于样品信号在阈值附近产生波动所导致的。
本研究虽然采取了双盲、安慰剂对照的研究设计,但并未设置市面上已有凝血酶产品的对照组,因为中国市面上已有的凝血酶产品源头厂家较多,没有公认的可以作为对照的产品,故无法得出该款重组人凝血酶直接对比市面上已有凝血酶产品的疗效的结论。此外,本研究仅入组了执行肝脏切除术的受试者,既往研究提示同种凝血酶产品在不同手术人群中的止血疗效是不完全相同的[17],因此该款重组人凝血酶在其他手术(创面)中的止血效果有待进一步的研究。既往有在超声引导下经皮注射凝血酶治疗肺假性动脉瘤成功的案例报道[25],提示凝血酶这一大类产品的使用方法并非局限于创面外用,但该使用方法在本研究中并未体现,故研究中涉及的重组人凝血酶的其他使用方法有待进一步的探索。
总之,该款产品是国内用于术中局部外用止血的重组人凝血酶,与安慰剂相比止血效果良好,可显著提高止血成功率,缩短止血时间,且具有更优的生物安全性(低免疫原性特征),为临床手术提供了一项辅助止血新选择。
严盛, 涂朝勇, 杜成友, 等. 重组人凝血酶在肝脏切除术中止血效果的随机对照Ⅲ期临床试验观察[J]. 中华医学杂志, 2023, 103(42): 3416-3423. DOI: 10.3760/cma.j.cn112137-20230911-00438.
参与本试验的所有受试者及其家属、研究者和团队;中国独立数据监测委员会(IDMC)主席周俭对数据的监测和审查
所有作者声明不存在利益冲突



























