
神经母细胞瘤是婴幼儿最常见的颅外神经系统来源的实体肿瘤,异质性较强,不同分期的预后差异极大,高危组预后不良。神经母细胞瘤的治疗方案包括手术、化疗、放疗及造血干细胞移植等,各具优缺点。目前高剂量化疗联合自体干细胞移植是儿童高危神经母细胞瘤的一线治疗方法。现综述近年有关神经母细胞瘤造血干细胞移植治疗的新进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经母细胞瘤(neuroblastoma,NB)是儿童最常见的颅外实体恶性肿瘤[1],属于胚胎源性肿瘤,平均发病年龄低,在形态、生物学和遗传学特征等方面均有较强的异质性。高危患儿发病隐匿、易发生转移,恶性程度高,往往预后不良[2]。目前,神经母细胞瘤的主要治疗方法包括手术和化疗。免疫疗法近年来已成为包括NB在内的多种恶性肿瘤治疗研究的热点,并在不少方向取得进展,如细胞因子、树突状细胞疫苗、抗GD2抗体等,其中以抗GD2单抗类药物相对最为成熟[3]。细胞因子疗法通过自身对免疫系统的诱导和激活为免疫疗法的应用提供了更多可能性[4]。中高危组NB患儿的治疗方案除手术和化疗外,还可进行局部放疗和造血干细胞移植治疗[5]。近年来,小儿神经母细胞瘤的患病率逐年递增[6],随着诊疗的规范化及新技术的推广,患儿的预后得到了明显提高,但中高危神经母细胞瘤患儿总体预后仍然不理想[7,8,9]。即使采用了高强度的综合治疗,Ⅲ~Ⅳ期的高危及极高危患儿5年生存率仍仅为30%~50%[10]。目前,大剂量化疗联合自体造血干细胞移植(high-dose chemotherapy with autologous stem cell rescue,HDC/ASCR)已成为改善儿童神经母细胞瘤的重要治疗策略,尤其是针对难治性高危神经母细胞瘤。对此类患儿进行造血干细胞移植治疗的目的在于恢复患儿的免疫功能与造血功能,以提高其无瘤生存率。大剂量化疗联合自体外周血造血干细胞移植用于治疗高危神经母细胞瘤,虽在移植前达到完全缓解时可取得较好疗效,但复发率仍高。为了提高干细胞移植对晚期NB的疗效,还需要进一步探索和优化预处理方案及体外技术,进行更大规模的临床研究,以获取更可靠的数据[11]。现就近年来儿童神经母细胞瘤在造血干细胞移植治疗方面中的研究进展予以综述,以供临床参考。
造血干细胞(hematopoietic stem cell,HSC)是存在于骨髓、外周血或脐血中的一种干细胞,具有自我复制和更新的能力,可以分化成多种血细胞前体细胞,最终生成各种血细胞成分。造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是指给予患儿大剂量的放疗或化疗,摧毁其体内的造血和免疫系统,再输入一定数量的造血干细胞使之重建的过程[12]。根据采集的造血干细胞来源于患儿本身还是健康供者的不同,可分为自体造血干细胞移植和异体造血干细胞移植;按造血干细胞的组织来源种类可分为外周血造血干细胞移植、骨髓造血干细胞移植和脐带血造血干细胞移植。由于骨髓移植的采集方式对供者损伤较大,现已很少采用,而多通过采集外周血中的造血干细胞进行移植。
自体造血干细胞移植时,移植排斥、移植物抗宿主病(graft versus host disease,GVHD)等移植并发症少[13],移植相关死亡率较低,但由于移植物抗肿瘤作用不足,且移植物中残留肿瘤细胞的可能性较大[12,14],故复发率高。异体造血干细胞移植时,造血干细胞来自正常供体,无肿瘤细胞污染,且具有移植物抗肿瘤作用[15],长期无病生存率高;但供体来源有限,易发生GVHD等移植并发症,患儿需长期使用免疫抑制剂,影响生活质量[16]。
大剂量化疗和自体造血干细胞移植(HDC/ASCR)已成为改善儿童神经母细胞瘤的重要治疗策略,尤其是高危神经母细胞瘤[17]。由于NB为实体瘤,即便肿瘤细胞已出现骨髓转移,骨髓本身几乎不会发生病变,故一般认为即便是已经发生了骨髓转移的患儿,经过大剂量化疗后再进行自体外周血造血干细胞移植也是可行和安全的[18]。经大剂量化疗后,肿瘤细胞和微小残留灶被清除的同时,骨髓造血功能和机体免疫功能受药物影响极度低下,利用造血干细胞的更新和分化能力可促进多系重建,使受者恢复正常造血及免疫系统。吴怡隽等[19]将南京医科大学附属儿童医院确诊为神经母细胞瘤并接受外周血自体造血干细胞移植术的16例患儿与未进行移植的30例患儿进行回顾性研究发现,自体造血干细胞移植可不同程度地延缓疾病进展,具有短期内改善预后的趋势,但最终结局的改善和总体生存率的提高并不显著,这可能与病例数目和预处理化疗方案有关。
造血干细胞移植联合大剂量化疗显著改善了高危NB患儿的5年无事件生存率[20,21]。目前常用的化疗预处理方案主要有卡铂-依托泊苷-美法仑(CEM)和白消安-美法仑(BuMel)两种,不同化疗方案的毒性反应有所不同。根据早年儿童肿瘤学协作组(Children's Oncology Group,COG)对CEM方案的临床试验和国际儿科肿瘤学会欧洲神经母细胞瘤组(International Society of Paediatric Oncology Europe Neuroblastoma Group,SIOPEN)对BuMel方案的临床试验结果,接受BuMel治疗的患儿的生存率与比接受CEM治疗的患儿更高(3年无事件生存率分别为50%和38%,P<0.001)[22]。Elborai等[23]的随机试验结果也显示,BuMel治疗组的无病生存率高于CEM组,3年无事件生存率分别为48%和33%。然而采用BuMel治疗方案的肝毒性发生率显著高于CEM方案,且随机接受BuMel治疗的267例患儿中有60例(22%)出现肝窦阻塞综合征,而接受CEM治疗的239例患儿中仅发生21例(9%)[24]。从历史研究中看,CEM方案的口腔黏膜炎、肾毒性、肺部和感染等并发症的严重程度比BuMel方案更高[25]。Desai等[26]发现BuMel方案治疗后,肺动脉高压的发生率较高,达20%。张朝霞等[27]对首都儿科研究所附属儿童医院收治的经大剂量化疗联合自体HSCT治疗的高危NB患儿进行随访,结果显示CEM和BuMel两种化疗方案作为移植前的预处理措施均安全有效,未见严重并发症,BuMel方案较CEM方案不良反应发生率低。
上述各项研究结果表明,BuMel方案或许更适合作为造血干细胞移植前的预处理方案,但需特别注意预防肝窦阻塞综合征和肺动脉高压。治疗相关髓系肿瘤是接受大剂量化疗联合自体HSCT患儿的常见并发症和主要死亡原因。现有研究显示,尽早进行造血干细胞移植可提高儿童治疗相关髓系肿瘤的生存率[28]。现仍有大量的相关临床试验正在进行,将为高危神经母细胞瘤患儿干细胞移植预处理方案的选择提供更多参考依据。
已有临床研究显示,相较于单次外周血造血干细胞移植,双次移植甚至多次自体移植能进一步提升高危NB患儿的生存率。Pasqualini等[29]对26例进展期高危NB患儿进行了双次序贯移植,3年无事件生存率为37.3%。在COG开展的ANBL0532试验中,Park等[30]发现双次自体造血干细胞移植组的3年无事件生存率优于单次移植组(分别为61.6%和48.4%,P=0.006),但3年总生存率并无显著差异,且双次组的急性并发症及严重不良事件的发生率没有明显增加。Kletzel等[31]对接受了3次和2次序贯自体干细胞移植的高危NB患儿进行观察随访,相较于单次移植,生存率有所提升,总体耐受良好、未见严重并发症。
国内对多次干细胞移植的研究结果较少,毛蕾等[32]对73名高危神经母细胞瘤患儿进行回顾性分析,其中接受单次HDC/ASCR治疗的有51例,双次22例;相对于单次移植,双次移植组的3年无事件生存率和3年总生存率皆略有升高,但差异无统计学意义;单次和双次HDC/ASCR造血重建时间差异并无统计学意义;接受双次HDC/ASCR的患儿粒细胞缺乏伴发热和艰难梭菌感染的发生率均高于单次移植组,分别为91%和86%(P=0.710)、27%和14%(P=0.190);患儿对双次HDC/ASCR耐受尚可,未出现严重不良事件。此研究可能受样本量较少及随访时间不足、预处理方案等原因影响,序贯移植的生存率及造血重建时间未见明显提升,其疗效有待进一步随访观察,后续仍需进一步探讨更加适合序贯移植的预处理方案,以减少相关并发症、综合评估多次自体造血干细胞移植的安全性及预后。
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)由于供体来源广泛和不受肿瘤细胞污染,且具有移植物抗肿瘤效应,近年来逐渐成为高危神经母细胞瘤患儿的治疗手段之一。其中,单倍体相合造血干细胞移植(haploidentical hematopoietic stem cell transplantation,HID-HSCT)取得了突出进展[12]。近年来,多种新型药物和生物制剂如抗胸腺细胞球蛋白等的研发和应用,已使人类白细胞抗原(human leukocyte antigen,HLA)单倍体相合骨髓移植排斥率由原先的40%降至0%~5%[33]。人HID-HSCT的主要并发症有移植物排斥、GVHD和移植后免疫重建迟缓。肠道急性GVHD是异基因造血干细胞移植后最常见的并发症之一[34],由供体免疫活性T细胞攻击健康受体组织导致,可能与患儿存在lncRNA和mRNA的差异表达有关,目前各种治疗手段均预后不良。生长障碍也是异基因移植的常见后遗症[35],Haghiri等[36]在对145例接受移植治疗5年后无其他疾病的患儿进行随访分析时发现,约有20%的异基因造血干细胞移植受者伴有生长迟缓,其相关机制仍待研究。此外,仍有临床随访显示患儿在接受allo-HSCT后出现性腺功能不全、肾损害、严重听力损伤、甲状腺结节等进行性的晚期迟发损害,但被认为与移植前大剂量化疗所用药物有关,特别是与烷化剂的剂量密切相关[37]。这些晚期致残效应发病率不在少数,且近几十年来还在逐渐增加。因此,未来应对接受大剂量化疗和异基因造血干细胞移植治疗的高危神经母细胞瘤幸存者进行长期随访。
Batesl等[38]将NK细胞输注用于异基因造血干细胞移植,通过构建小鼠模型,证实NK细胞有抗肿瘤活性,可通过限制供体T细胞在受者体内的增殖和浸润从而控制感染和抑制GVHD的发生,增强异基因造血干细胞移植伴随的移植物抗肿瘤效应,从而达到清除NB细胞的疗效。未来或许可将NK细胞输注作为造血干细胞移植的辅助疗法。
人类脐血中含有多种类型的干细胞,相比于骨髓和外周血,脐带血中的造血干细胞更原始,有更强的自我更新、增殖和扩展能力。脐血富含CD34+细胞,其中大部分为髓系祖细胞和原始髓系细胞,对异体抗原刺激反应低,移植成活率高。尽管CD34+细胞的功能现在还未完全明晰,但研究表明,CD34+细胞涉及维持造血祖细胞的未分化状态,是造血干细胞移植中供体组织长期再生潜力的主要来源[39]。与骨髓造血干细胞和外周血造血干细胞相比,脐带血移植更容易突破HLA屏障[40],对供者来说几乎无风险,来源丰富并且易于采集和处理,快速可用,预示着脐血干细胞具有更广阔的应用前景[41]。虽然脐带血中干细胞数量有限,但目前已可以通过较为成熟的实验室手段实现扩增。
自人类首次使用脐带血移植以来,脐血移植领域有了显著发展,脐血库的数目也飞速增加。脐带血造血干细胞移植已在血液系统恶性肿瘤及多种非血液系统疾病治疗中应用。近年来,国内外有利用CD34+分选纯化后的脐血移植治疗儿童NB的报道,但病例数有限,对其疗效及安全性评价不一[39,42,43],尚难下定论。
间充质干细胞(mesenchymal stem cell,MSC)是能够维持造血干细胞的自我更新、保持干细胞的各系分化平衡,且具有免疫调控功能和感知炎症能力的多能干细胞。与造血干细胞联合移植时,可增加供者HSC部分表面黏附分子受体的表达,更利于干细胞的黏附和植入;其含有的趋化性使其能够迁移到受损组织,进入肿瘤生长的微环境发挥调节肿瘤细胞生长的作用[44];MSC还可降低供者T细胞的异基因识别反应,从而减轻移植后受体发生的GVHD等[45]。现有研究显示,骨髓间充质干细胞可能有支持造血干细胞和造血祖细胞在骨髓造血生态位中的植入和修复受损组织的潜力,在清髓化疗后促进造血功能的恢复。
目前在治疗神经母细胞瘤时,间充质干细胞多是以与造血干细胞共同移植的方式发挥作用。从其他恶性肿瘤患儿接受间充质干细胞治疗的研究和临床试验中可推断得到MSC具有抗GVHD和支持异基因造血干细胞移植的作用。骨髓间充质干细胞与异基因造血干细胞联合移植,可明显减少因受体与移植物之间的免疫反应而发生GVHD的风险,并可以促进供体造血干细胞在受者体内的植入[46]。如Lazarus等[47]对46例血液系统恶性肿瘤患儿进行的研究就证明了这种MSC联合移植疗法的安全性和可行性。Wu等[48]发现,接受MSC和造血干细胞联合移植的患儿,其外周血中血小板和中性粒细胞计数的恢复时间明显更短。但也有研究表明,与对照组相比,MSC组的复发率显著增加[49]。
目前使用骨髓间充质干细胞作为抗癌治疗手段的局限性主要是生物利用度低。MSC作为一种多能干细胞,本身具有潜在的肿瘤支持作用。目前已经提出了多种改善MSC靶向性的方法,如基因工程和放射线等,以增强其向骨髓或肿瘤部位的定向迁移[50]。目前研究认为MSC联合HSC移植在多种肿瘤的治疗中都可以产生有益的效果;至于该方案用于治疗NB患儿,仍需大量的研究以进一步阐明其作用机制和证实其疗效。
我国治疗低中危组NB已经取得了令人瞩目的成就,长期无瘤生存率显著提高。然而,总体预后显著低于欧美等发达国家[51]。此外,在全球范围内,高危神经母细胞瘤的治愈率仍然很低,干细胞移植技术的治疗方案各有优劣(表1)。晚期NB有着复杂的生物学特性,恶性程度高、侵袭性强,因此探寻高危NB的治疗手段和防止复发是关键所在。现有治疗手段不仅存在诸多不良反应和严重耐药的情况,还有着较大的复发风险,且复发后死亡率极高。大剂量化疗结合自体造血干细胞移植治疗是目前高危NB的常用治疗手段,虽然仍有诸多细节问题需进一步研究,但根据现有的多项研究,自体HSCT能明显提高高危NB患儿的生存率。可能由于社会文化及宣传科普不足的原因,国内患儿家长对化疗联合自体移植的治疗方案接受度不高,此方向的研究样本较少。接受大剂量化疗联合自体造血干细胞移植的患儿生存率与移植次数和化疗强度有关,骨髓能否耐受大剂量化疗将密切影响患儿预后。进一步探讨合适的预处理强度和方案,或进行序贯移植,将是今后NB造血干细胞移植治疗的研究重点。
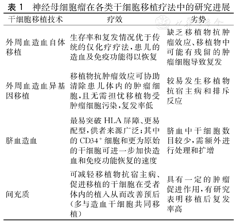
神经母细胞瘤在各类干细胞移植疗法中的研究进展
神经母细胞瘤在各类干细胞移植疗法中的研究进展
| 干细胞移植技术 | 疗效 | 劣势 |
|---|---|---|
| 外周血造血自体移植 | 生存率和复发情况优于传统的仅化疗疗法,患儿的造血及免疫功能得以恢复 | 缺乏移植物抗肿瘤效应、移植物中可能有残留的肿瘤细胞导致复发 |
| 外周血造血异基因移植 | 移植物抗肿瘤效应可协助清除患儿体内的肿瘤细胞,且无需担忧移植物受肿瘤细胞污染,复发率低 | 较易发生移植物抗宿主病和排斥反应 |
| 脐血造血 | 最易突破HLA屏障、更易配型,供者来源广泛;其中的CD34+细胞和更为原始的干细胞可进一步加快造血和免疫功能恢复的速度 | 脐血中干细胞数目较少,需额外进行处理和扩增 |
| 间充质 | 可减轻移植物抗宿主病、促进移植的干细胞在受者体内的植入从而改善预后(多与造血干细胞共同移植) | 具有一定的肿瘤促进作用,有研究表明移植后复发率高 |
所有作者均声明不存在利益冲突



























