
慢性无菌性骨髓炎又称为慢性复发性多灶性骨髓炎,是一种影响儿童和青少年的炎症性骨病,发病率约为百万分之一,属于罕见病的范畴。儿童慢性无菌性骨髓炎的临床表现主要为夜间复发性炎症性骨痛,疼痛具有反复发作与间断缓解的特征。目前诊断主要依靠排除诊断,除外如感染性骨髓炎和骨肿瘤等疾病。本研究简要介绍了儿童慢性无菌性骨髓炎的发病机制,重点综述了疾病诊断、治疗的研究进展,以期为临床提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性无菌性骨髓炎(chronic nonbacterial osteomyelitis,CNO)又称为慢性复发性多灶性骨髓炎(chronic recurrent multifocal osteomyelitis,CRMO),是一种自发性炎症反应性疾病,发病率约为百万分之一。CNO主要发生在儿童及青少年,平均发病年龄为9岁,男女比例为1∶2。主要临床症状为反复骨痛,有时也可伴随一些关节外的表现,比如银屑病、掌跖脓疱病、克罗恩病、痤疮、Sweet综合征等。在成人中,散发性CNO通常被诊断为SAPHO综合征的范畴,一种由滑膜炎、痤疮、脓疱病、骨质增生和骨炎组成的症状复合体[1,2,3,4]。散发性CNO具有复杂的临床表现,从单一病灶到严重的复发性多灶性骨髓炎。慢性无菌性骨髓炎在欧洲国家的发病率高于国内。本研究主要从CNO的发病机制、临床表现、辅助检查、诊断及治疗等方面进行系统性综述。
目前CNO的发病机制尚未完全阐明,CNO既往一直被认为是慢性感染性疾病,但长期的抗生素治疗并没有改变疾病的发展,包括聚合酶链反应在内的多种微生物技术都没有能够证实感染是潜在的原因[5]。有学者已经从CNO患儿的骨骼组织病变中分离出痤疮丙酸杆菌,但这一观点仍然受到了极大的挑战,不过这一观点也激发了研究者对病原菌是CNO发病机制的探索[6]。CNO疾病是一种遗传性疾病,50%患儿的一级或二级亲属也有相关症状,具有家族聚集性[5]。Golla等[7]在家族性CNO患儿的18q21.3-22染色体位点发现了CNO的易感基因,并且在CNO小鼠模型的染色体中也存在同源区域。Cox等[8]通过全外显子测序发现2名CNO患儿的纯合FBLIM1基因错义突变,而进一步在CNO小鼠的骨髓细胞DNA芯片分析中发现FBLIM1基因是表达差异最大的基因。然而,这些基因突变位点并未能在大规模、独立队列研究中获得证实。
目前主流的观点认为CNO疾病是一种自身炎症性疾病,因为该疾病有炎症的自发侵袭性,缺乏高效价的自身抗体和自身免疫性T细胞,早期病灶组织中以中性粒细胞渗入为主[9]。最新研究表明先天免疫细胞因子表达失调是导致CNO的主要原因,Hoffman等[10]的研究也证实免疫系统失调是CNO炎症的主要原因,特别是白细胞介素-10(IL-10)和白细胞介素-19(IL-19)通路,在疾病的发病机制中发挥重要的作用。Hoffman等[11]测定了CNO患儿的单核细胞中IL-10的表达,并将其与健康对照组在脂多糖刺激下的反应进行了比较,他们发现CNO单核细胞的IL-10显著减少,未治疗的CNO血清中IL-6和TNF-α水平升高,由此说明CNO疾病是由IL-10、IL-6、TNF-α的表达不平衡导致[10,11,12,13]。通过对家族性CNO患儿以及CNO小鼠动物模型进行基因分析,发现影响骨炎症相关的基因位点发生的突变,包括小鼠的pstpip2基因和人IL1RN基因,这些突变主要导致NLRP3炎症小体激活,促炎细胞因子IL-1β、TNF-α和IL-18的大量产生,进一步证实CNO的发生与炎症因子失调密切相关[14]。
CNO是一种罕见的疾病,临床表现多种多样,从单一病灶的无症状或轻度症状,到多病灶的严重骨痛均有表现[15]。CNO在所有年龄段都可以发病,主要发生在儿童及青少年,平均发病年龄在9岁左右,男女比例为1∶2[16]。几乎所有患儿的初始症状都是骨痛,骨痛可发生在任何时间,通常夜间骨痛更明显。骨痛可发生在全身所有骨骼中,常受影响的部位包括下肢长骨、椎骨、锁骨和下颌骨[4]。疾病发作时,骨痛可伴随发热,也可伴发骨骼外症状,如皮肤病(银屑病、掌跖脓疱病、痤疮、坏疽性脓皮病)和炎症性肠病(克罗恩病、溃疡性结肠炎),还有极少数病例会累及肾脏[17]。CNO容易被忽视的部位是下颌骨,因为它极少见,主要发生在青少年及成人,而CNO大多是在儿童中进行研究,因此累及下颌骨的成人易被忽视[18]。该病呈慢性或复发性发病,病程通常可延长至数年,并伴有周期性恶化,确诊周期大约为18个月[19]。
X线是临床上最常用的检查,通常X线在疾病初期无明显改变,随着疾病的进展,X线可显示早期溶骨性病变、硬化、骨扩张或后期呈混合性显像[20,21](图1)。在临床工作中,经验丰富的影像医生才能通过X线检查将CNO与骨肿瘤、感染性骨髓炎鉴别区分。对于无症状的CNO疾病,放射性核素骨显像是常用方法,但因其具有辐射,临床上广泛应用受到限制[22]。MRI是目前最具特异性的影像诊断方法,典型的MRI表现为初期的骨髓水肿,到后期的骨皮质变薄、溶骨性破坏伴硬化(图2、图3、图4)。全身MRI检查在急性炎症期最具有特异性,在MRI可以表现出T1序列低信号和T2序列高信号[21,23]。全身MRI检查在疾病的早期诊断中具有重要的意义,因为它能够在骨溶解、骨硬化之前检测到骨髓水肿和无症状骨病变,并且没有辐射,可用来监测随访骨骼病变的进展演变[24]。(图1、图2、图3、图4中影像学资料均来自同一患者)
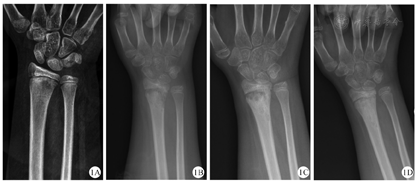

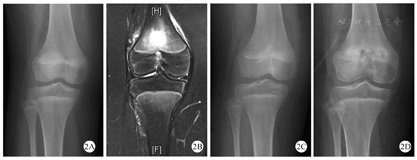

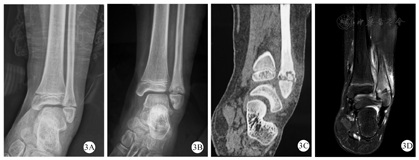

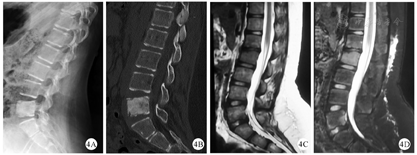

目前尚无特异性的实验室诊断指标,因此实验室检查结果不能确诊和监测CNO疾病的病程和疗效。有文献报道大约70%的CNO患儿会有轻微的炎症指标升高,肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)在CNO患儿中也会稍有增高,这些指标提示机体呈炎症状态,但是都没有特异性[11,19,25]。
CNO患儿组织病理特点为非特异性骨炎、无特异性表现,早期主要有中性粒细胞浸润,中期以巨噬细胞、淋巴细胞等炎性细胞浸润为主,晚期可见溶骨性改变、反应性成骨、骨硬化等,重点鉴别感染性骨髓炎及肿瘤[2,19]。有研究指出当CNO患儿有全身症状、单发局灶性病变或夜间骨痛时应该进行骨活检[4,26]。而当多局灶性病变或疾病复发时,则不建议进行骨活检,此时应该进行MDT对疾病进行诊断[9]。当存在CNO症状相似的疾病,如淋巴瘤、白血病患儿也应当进行骨活检进行鉴别[27,28]。
1972年,CNO首次由Gideon等[29]报道,但目前尚无统一的诊断标准指南,疾病的诊断是结合临床、影像学和组织病理学检查等进行全面分析,重点排除包括恶性肿瘤(白血病、淋巴瘤、原发或转移性骨肿瘤)、朗格汉斯组织细胞增多症和感染性疾病在内的其他诊断。在1987年,King等[30]就依据7位患儿的随访结果提出自己的诊断标准。目前国际上公认的诊断标准主要是Jansson评分系统和Bristol诊断标准,得到一定的认可,应用较为广泛,可以提高诊断率、缩短诊断时间,降低骨活检率。
Jansson等[31]通过收集224例患儿,根据临床表现,实验室检查,异常X线及全身影像学检查,提出了一套诊断评分系统,该评分系统根据7个标准进行诊断,包括正常红细胞13分、对称性病变10分、伴有边缘硬化10分、正常体温9分、椎体锁骨或胸骨病变8分、2处以上放射学证实的病灶7分、C反应蛋白>10 mg/L 6分。该评分标准总分为63分,总分≤28分时CNO阴性预测率为97%,而总分≥39分的CNO阳性预测率为97%或以上。Wipff等[22]在一项法国的CNO队列研究中回顾性应用该评分系统,评估该CNO评分标准是否有助于避免骨活检,结果显示在110例患儿分析中,有27例可以在免于骨活检的情况下确诊CNO,证实了该CNO评分标准的准确性。
Roderick等[19]通过一项CNO队列研究中,提出Bristol诊断标准,该标准可以缩短诊断时间、提高确诊率、降低患儿的骨活检率,此标准需要满足以下两项必要条件及一项其他条件即可确诊。
两项必要条件:①典型的临床表现,骨痛可伴有或不伴局部肿胀,且不伴有明显的局部、系统性感染表现;②典型的影像学表现,X线可见溶骨性病变、硬化及新骨形成,MRI提示骨髓水肿,伴有或不伴局部肿胀、骨溶解、骨膜反应。
其他可选条件:①多于一处骨骼受累(或锁骨受累),且无C反应蛋白增高(<30 mg/L);②如果是除锁骨之外的单病灶受累,或者C反应蛋白>30 mg/L时骨活检提示炎性改变(浆细胞、破骨细胞、纤维化或硬化表现)且抗炎治疗无效、无细菌生长。
Oliver等[32]学者为了制定CNO诊断指南,在儿科和成人风湿病学界进行了一项国际合作的德尔菲调查研究,旨在筛选出CNO候选诊断标准,全球259名儿科风湿病学家参加,筛选出31项候选标准。该调查表明诊断阳性标准最重要的三项指标是多病灶性,排除恶性肿瘤、感染以及典型影像学特征,而当C反应蛋白、血沉值大于正常上限3倍时诊断阴性的可能性最高。
现阶段CNO由于缺乏特异性诊断指标,已提出的部分诊断标准缺乏前瞻性研究证实,其可靠性、接受度不一,X线、MRI影像学的诊断更加依赖影像科医师的经验。部分国外学者提倡进行全身MRI进行全面诊断,但对医院设备、技术要求较高,且价格昂贵、单次检查耗时较长,难以大规模推广应用。因此,CNO主要是排除诊断,除外感染性骨髓炎、骨肿瘤等疾病,结合患儿的临床表现、影像学检查、实验室检查、组织病理学结果综合判定。
CNO的主要治疗目标是缓解患儿临床症状、促进骨愈合、避免畸形和预防复发[33]。目前临床治疗的药物包括非甾体抗炎药(NSAIDs)、皮质类固醇类、抗风湿病药物(甲氨蝶呤或磺胺嘧啶等)、肿瘤坏死因子(TNF-α)抑制剂及双磷酸盐类[34]。
NSAIDs通常作为不伴有脊柱病变的CNO患儿治疗的一线用药[35],萘普生是儿童CNO治疗的常用药,一般的剂量是10 mg/kg一天两次口服。其他的NSAIDs药物,如吲哚美辛、布洛芬、双氯芬酸、塞来昔布也可用于儿童CNO治疗[34]。Beck等[36]在一项前瞻性研究发现,大部分儿童CNO患儿在服用NSAIDs1年之后症状得到明显改善。NSAIDs治疗之后需要进行评估,治疗4周后活动性病变无改善、治疗12周后MRI检查骨髓水肿无改善时则考虑为NSAIDs难治性CNO。对于NSAIDs药物难治性CNO或者有活跃性脊柱病灶的CNO应该考虑二线用药。活跃性脊柱病灶CNO单独列出是因为其具有椎体骨折的风险[37]。北美儿童关节炎和风湿病学研究联盟(Childhood Arthritis and Rheumatology Research Alliance)针对NSAIDs难治性CNO或者有活跃性脊柱病灶的CNO患儿治疗方案共识建议[34],推荐使用三种方案治疗。
第一种:非生物型改善病情抗风湿药(disease modifying anti-rheumatic drug,DMARDs)包括甲氨蝶呤和柳氮磺嘧啶。
第二种方案:TNF-α抑制剂,包括阿达木单抗、依那西普和英夫利昔单抗。Bustamante等[38]在19例难治性CNO儿童中应用TNF-α抑制剂阿达木单抗、英夫利昔单抗治疗,均获得有效、安全的治疗效果。Moussa等[39]在7例CNO患儿中应用了英夫利昔单抗治疗,大部分患儿均得到明显的症状改善。Batu等[40]报道了5例难治性CNO患儿应用依那西普可明显逆转骨骼病变,改善临床症状。
第三种方案:二膦酸盐类,常用药物有帕米膦酸二钠以及唑来膦酸钠。Sulko等[41]通过回顾性分析41例NSAIDs治疗无效的CNO患儿,应用帕米膦酸二钠治疗,32例患儿的症状明显改善,且无明显副作用发生,证实了帕米膦酸二钠作为二线用药的安全性、有效性。在一项多中心的回顾性研究中,26例难治性CNO患儿应用二磷酸盐类治疗(11例奈立膦酸钠,15例帕米膦酸二钠),共有73%(19/26)获得明显的症状改善[42]。
这三种治疗方案都是针对NSAIDs药物难治性CNO的标准化的方案,治疗时选择其中一种方案、每3个月评估治疗效果,若治疗效果良好则持续该方案6~12个月;若症状未改善甚至加重,建议更换治疗方案、1~3个月后再次评估治疗效果[34]。上述三种方案均可伴随使用NSAIDs药物或短期使用糖皮质激素。其中糖皮质激素每日上限为2 mg/kg(最高剂量60 mg/d,或者等剂量的泼尼松),使用周期最长为6周。
也有部分病例报道应用了生物制剂如IL-1、IL-23、IL-17的抑制剂,也可取得良好的疗效[43],Wendling等[44]在一项临床试验中,对6例SHAPO综合征患儿应用IL-1R拮抗剂阿那白滞素治疗后,5例症状改善。IL-23抑制剂乌司奴单抗,IL-17抑制剂苏金单抗均有报告其在SHAPO综合征中可改善患儿症状[45,46]。
多学科诊疗MDT在CNO疾病诊断、治疗过程中起着非常重要的作用。CNO患儿的初始症状多为骨痛,一般由小儿骨科或骨科医师首诊,在疾病的诊断过程中需要影像科、检验科、病理科、免疫风湿科、感染疾病科等众多学科的支持,确诊之后由免疫风湿科医师给予药物治疗,部分患儿需要外科医师进行骨活检以明确诊断。CNO累及脊柱椎体时需及时给予脊柱保护性支持、减少地面活动,避免产生脊柱侧凸、后凸畸形,当出现明显神经压迫症状后可行手术治疗。Hospach等[37]在大样本队列研究中发现约26%的CNO患儿存在脊柱病变,Pastore等[42]在研究中发现,累及脊柱的CNO患儿全部留下畸形或后遗症,建议重点关注。Baulot等[47]曾报道1例累及胸椎的CNO患儿,脊柱后凸逐渐加重,压迫椎管神经导致下肢无力、行走障碍,手术给予胸椎前路减压内固定术,术中用自体髂骨移植恢复椎体高度,术后12 d神经压迫症状完全消失,术后随访2年活动良好、神经压迫症状未复发,但留下了轻度的脊柱后凸畸形。
近年来研究表明,二磷酸盐类药物在累及脊柱的CNO治疗中效果显著,可以改善疼痛症状、有助于椎体畸形的重建,建议早期应用预防严重脊柱畸形发生[37,42,48]。虽然CNO为良性疾病,但由于该疾病诊断周期较长,治疗不及时可导致骨骼畸形发生,多学科诊疗应贯穿于整个治疗周期,为患儿提供系统性、续贯性治疗方案,减轻痛苦、改善症状、避免畸形的发生。
目前CNO发病机制不明、缺乏特异性诊断指标、尚无统一治疗标准,因此未来主要研究目标是阐明CNO的病因及发病机制,提高诊断治疗水平,避免骨骼畸形发生、改善患儿预后。
所有作者均声明不存在利益冲突



























