
对河南省艾滋病患者抗病毒治疗(ART)失败后的基因型耐药检测,分析ART失败的耐药特征。
研究对象为2018年1月至2021年5月河南省18个城市接受ART时间≥6个月且病毒载量≥1 000拷贝数/ml艾滋病患者,收集艾滋病患者血液样本、社会人口学特征和ART信息。采用In-house方法进行HIV-1基因型耐药检测,将基因序列提交到美国斯坦福HIV-1耐药数据库分析耐药突变位点和药物耐药情况。
在887例ART失败的艾滋病患者中,样本成功扩增率为91.54%(812/887),总耐药率为83.25%(676/812),其中核苷类反转录酶抑制剂(NRTIs)、非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)和整合酶抑制剂(INSTIs)的耐药率分别为73.40%(596/812)、80.54%(654/812)、5.54%(45/812)和2.56%(17/663),4类药物的耐药率差异有统计学意义(χ²=1 686.34,P<0.001),对2类药物同时耐药率为66.38%(539/812),对3类药物同时耐药率为5.79%(47/812)。共检出9个HIV-1基因亚型,以B亚型为主(59.61%,484/812),其次是CRF01_AE亚型(22.17%,180/812)和CRF07_BC亚型(9.48%,77/812),不同基因亚型的耐药率差异有统计学意义(χ²=21.33,P=0.001)。NRTIs相关突变位点中,M184V/I突变率最高(63.42%,515/812),其次是K65R(27.46%,223/812);NNRTIs相关突变位点中,突变率位居前3位的是K103N/S(34.98%,284/812)、G190A/S(26.11%,212/812)和V106M/I(24.63%,200/812);PIs相关突变位点中,突变率位居前3位的是M46I(4.31%,35/812)、V82A/F(3.82%,31/812)和I54V/MV(3.69%,30/812);INSTIs相关突变位点中,E157Q/EQ突变率最高(3.47%,23/663),其次是R263K和G140A(均为0.75%,5/663)。在NRTIs中,拉米夫定和恩曲他滨以高度耐药为主(65.52%,532/812);在NNRTIs中,奈韦拉平(77.46%,629/812)和依非韦伦(71.18%,578/812)以高度耐药为主;在PIs中,洛匹那韦/利托那韦中/高度耐药占比仅为4.19%(34/812);在INSTIs中,艾维雷韦和拉替拉韦中、高度耐药分别占1.66%(11/663)和1.21%(8/663),未发现比克替拉韦和多替拉韦的高度耐药。
河南省艾滋病患者ART失败的耐药率高,表现以NRTIs和NNRTIs耐药率高、耐药突变多样且复杂为特点。建议选择高耐药屏障药物,同时加强ART后病毒载量和耐药监测。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2002年河南省启动国家艾滋病免费抗病毒治疗(ART),是全国艾滋病患者较多和ART开展较早的省份之一。随着ART时间延长,依从性的下降,部分患者出现了ART失败。为应对ART失败,2009年河南省开始使用含有洛匹那韦/利托那韦的二线ART方案。但洛匹那韦/利托那韦存在腹泻、高脂血症、血糖异常等不良反应,且与多种慢性疾病的药物存在着药物相互作用,在一定程度上会影响ART依从性和ART疗效。整合酶抑制剂(INSTIs)具有强效抑制病毒、高耐药屏障、药物不良反应小、药物相互作用少的优势。河南省从2017年底开始陆续使用多替拉韦等INSTIs药物,更换洛匹那韦/利托那韦以减少其副作用,在改善ART耐受性和依从性的同时,极大地提高ART成功率。截至2020年底,河南省在治艾滋病患者60 521人,ART成功率达94.7%[1](病毒载量<1 000拷贝数/ml)。但是,由于河南省艾滋病患者ART时间较长和人数较多,而且绝大多数患者在县或县级以下定点医疗机构接受ART或在外长期务工,存在着ART失败和耐药的风险。为了更好地管理ART失败和耐药患者,郑州市第六人民医院自2018年开展耐药检测工作,免费为河南省ART失败患者进行基因型耐药检测(GRT)。本研究分析河南省ART失败艾滋病患者耐药特征,为河南省应对HIV-1耐药提供参考依据。
1. 研究对象:2018年1月至2021年5月河南省18个城市接受ART的艾滋病患者。纳入标准:①ART时间≥6个月;②病毒载量≥1 000拷贝数/ml;③ART停药≤4周;④基本信息完整;⑤签署知情同意书。本研究已通过郑州市第六人民医院伦理委员会审查(批准文号:2019-04)。
2. 研究方法:
(1)一般资料:收集艾滋病患者血液样本、社会人口学特征和ART信息。内容包括性别、年龄、职业、感染途径、ART方案,耐药检测时最近1次CD4+T淋巴细胞(CD4)计数和病毒载量。人口学资料来源于HIV-1耐药登记记录,ART信息来源于国家ART数据库。血样标本均在门诊或住院部抽取。
(2)采用In-house方法进行HIV-1基因型耐药检测:均在郑州市第六人民医院转化医学研究中心完成。①HIV-1 RNA的提取与核酸扩增:按照标准操作程序,应用上海之江生物科技股份有限公司的核酸提取试剂盒(磁珠法)进行RNA的提取。以HIV-1 pol区蛋白酶(全长)、反转录酶(1~318个氨基酸)和整合酶基因(全长)为扩增区域,使用巢式PCR方法进行PCR扩增,扩增使用LA Taq™ Version 2.0(TaKaRa,Shiga,日本)DNA聚合酶。蛋白酶及反转录酶区域巢式PCR第一轮引物为PRO-F1和RT-R1,第二轮PCR引物为PRO-F2和 RT-R2,对应目的片段长度约1 300 bp。整合酶区域巢式PCR第一轮引物为F4181和 R5073,第二轮PCR引物为F4379和R5057,对应目的片段长度约700 bp。引物序列见表1。扩增产物经1%琼脂糖凝胶电泳初步鉴定后,阳性样本送上海生工生物公司进行纯化和测序。②序列拼接与处理:使用DNAMAN和Chromas软件对目的基因序列进行拼接和分析,包括反转录酶区域、蛋白酶区域和整合酶区域的耐药突变位点。③耐药分析:耐药定义为任何一种ART药物出现低度及以上耐药。将得到的完整序列提交斯坦福大学的HIV-1耐药数据库(http://hivdb.stanford.edu/)在线网站分析,参照WHO的耐药突变位点列表,确定耐药突变位点和对各种ART药物的耐药程度。

本研究的引物序列
本研究的引物序列
| 引物 | 序列(5'~3') |
|---|---|
| RT引物 | |
| R5073 | CCACACAATCATCACCTGCC |
| 蛋白酶及反转录酶扩增引物 | |
| PRO-F1 | TTGGAAATGTGGAAAGGAAGGAC |
| RT-R1 | CTGTATTTCTGCTATTAAGTCTTT TGATGGG |
| PRO-F2 | CAGAGCCAACAGCCCCACCA |
| RT-R2 | CTGCCAGTTCTAGCTCTGCTTC |
| 整合酶扩增引物 | |
| F4181 | AATGAACAAGTAGATAAATTAGT |
| R5073 | CCACACAATCATCACCTGCC |
| F4379 | CATGGACAAGTAGACTGTAGTCC |
| R5057 | GCCATCTGTTTTCCATA |
蛋白酶及反转录酶扩增 引物测序引物 | |
| CF1 | CACTCTTTGGCAACGACCC |
| CR2 | AATTGGGCCTGAAAATCC |
| CF3 | GGATTTTCAGGCCCAATT |
| CR4 | GGAATATTGCTGGTGATCC |
| CF2 | GTTGACTCAGATTGGTTG |
| CF4 | TGGAGAAAATTAGTAGATTT |
| CR1 | ATAAAACCTCCAATTCC |
| CR3 | CTGTCCTTTTTCTTTAT |
| 整合酶测序引物 | |
| CF5 | TAGCAGGAAGATGGCCAGT |
| CR5 | GCTGGTCCTTTCCAAA |
| CF6 | AGAAAAGGGGGGATTGG |
| R5057 | GCCATCTGTTTTCCATA |
3. 统计学分析:采用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料采用x±s表示;偏态分布计量资料用M(Q1,Q3)表示,比较采用秩和检验;计数资料用例数和百分数表示,比较采用χ2检验。双侧检验,检验水准α=0.05。
1. 患者基本情况及耐药检测结果:
(1)患者基本情况:在887例ART失败的艾滋病患者中,样本成功扩增率为91.54%(812/887)。812例患者年龄(42.10±15.02)岁,年龄范围5~77岁,男性占73.28%(595/812),农民/农民工占44.70%(363/812),传播途径以性传播为主(52.34%,425/812),ART时间M(Q1,Q3)为5.18(1.96,9.77)年,ART方案以2个核苷类反转录酶抑制剂(NRTIs)联合非核苷类反转录酶抑制剂(NNRTIs)方案为主(73.40%,596/812)。最近1次CD4计数M(Q1,Q3)为76(22,200)个/μl,范围1~1 647个/μl。见表2。
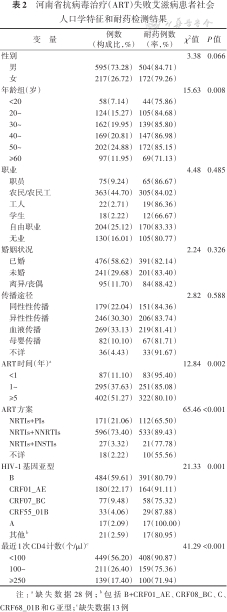
河南省抗病毒治疗(ART)失败艾滋病患者社会人口学特征和耐药检测结果
河南省抗病毒治疗(ART)失败艾滋病患者社会人口学特征和耐药检测结果
| 变 量 | 例数 (构成比,%) | 耐药例数 (率,%) | χ2值 | P值 |
|---|---|---|---|---|
| 性别 | 3.38 | 0.066 | ||
| 男 | 595(73.28) | 504(84.71) | ||
| 女 | 217(26.72) | 172(79.26) | ||
| 年龄组(岁) | 15.63 | 0.008 | ||
| <20 | 58(7.14) | 44(75.86) | ||
| 20~ | 124(15.27) | 105(84.68) | ||
| 30~ | 162(19.95) | 139(85.80) | ||
| 40~ | 169(20.81) | 147(86.98) | ||
| 50~ | 202(24.88) | 172(85.15) | ||
| ≥60 | 97(11.95) | 69(71.13) | ||
| 职业 | 4.48 | 0.485 | ||
| 职员 | 75(9.24) | 65(86.67) | ||
| 农民/农民工 | 363(44.70) | 305(84.02) | ||
| 工人 | 22(2.71) | 19(86.36) | ||
| 学生 | 18(2.22) | 12(66.67) | ||
| 自由职业 | 204(25.12) | 170(83.33) | ||
| 无业 | 130(16.01) | 105(80.77) | ||
| 婚姻状况 | 2.24 | 0.326 | ||
| 已婚 | 476(58.62) | 391(82.14) | ||
| 未婚 | 241(29.68) | 201(83.40) | ||
| 离异/丧偶 | 95(11.70) | 84(88.42) | ||
| 传播途径 | 2.82 | 0.588 | ||
| 同性性传播 | 179(22.04) | 151(84.36) | ||
| 异性性传播 | 246(30.30) | 206(83.74) | ||
| 血液传播 | 269(33.13) | 219(81.41) | ||
| 母婴传播 | 82(10.10) | 67(81.71) | ||
| 不详 | 36(4.43) | 33(91.67) | ||
| ART时间(年)a | 12.84 | 0.002 | ||
| <1 | 87(11.10) | 83(95.40) | ||
| 1~ | 295(37.63) | 251(85.08) | ||
| ≥5 | 402(51.27) | 322(80.10) | ||
| ART方案 | 65.46 | <0.001 | ||
| NRTIs+PIs | 171(21.06) | 112(65.50) | ||
| NRTIs+NNRTIs | 596(73.40) | 533(89.43) | ||
| NRTIs+INSTIs | 27(3.32) | 21(77.78) | ||
| 不详 | 18(2.22) | 10(55.56) | ||
| HIV-1基因亚型 | 21.33 | 0.001 | ||
| B | 484(59.61) | 391(80.79) | ||
| CRF01_AE | 180(22.17) | 164(91.11) | ||
| CRF07_BC | 77(9.48) | 58(75.32) | ||
| CRF55_01B | 33(4.06) | 29(87.88) | ||
| A | 17(2.09) | 17(100.00) | ||
| 其他b | 21(2.59) | 17(80.95) | ||
| 最近1次CD4计数(个/μl)c | 41.29 | <0.001 | ||
| <100 | 449(56.20) | 408(90.87) | ||
| 100~ | 211(26.40) | 159(75.36) | ||
| ≥250 | 139(17.40) | 100(71.94) |
注:a缺失数据28例;b包括B+CRF01_AE、CRF08_BC、C、CRF68_01B和G亚型;c缺失数据13例
(2)耐药检测结果:在完成NRTIs、NNRTIs和蛋白酶抑制剂(PIs)的耐药检测812例患者中,完成INSTIs耐药检测663例,原因是2019年之前尚未全部开展INSTIs耐药检测。总的耐药率为83.25%(676/812),其中NRTIs、NNRTIs、PIs和INSTIs耐药率分别为73.40%(596/812)、80.54%(654/812)、5.54%(45/812)和2.56%(17/663),4类药物的耐药率差异有统计学意义(χ²=1 686.34,P<0.001)。对2类药物同时耐药率为66.38%(539/812),对3类药物同时耐药率为5.79%(47/812)。在耐药≥2类药物者中,以NRTIs和NNRTIs同时耐药为主(71.67%,582/812)。
共检出9个HIV-1基因亚型,以B亚型为主(59.61%,484/812),其次为CRF01_AE亚型(22.17%,180/812)和CRF07_BC亚型(9.48%,77/812),不同基因亚型耐药率的差异有统计学意义(χ²=21.33,P=0.001)。不同的年龄、ART时长、ART方案和最近1次CD4计数的耐药率的差异有统计学意义(均P<0.05)。见表2。
2. 不同基因亚型对抗病毒药物的耐药情况:不同基因亚型对NRTIs和NNRTIs耐药率不同,差异均有统计学意义(χ2=31.14和χ2=27.36,均P<0.001),A亚型耐药率最高,其次是CRF55_01B和CRF01_AE;不同基因亚型对PIs和INSTIs耐药率的差异无统计学意义(χ2=9.73,P=0.083;χ2=1.67,P=0.948)。见表3。
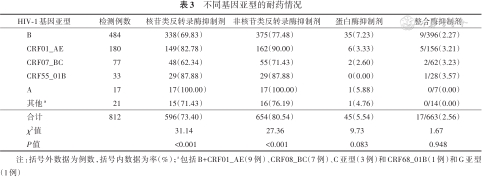
不同基因亚型的耐药情况
不同基因亚型的耐药情况
| HIV-1基因亚型 | 检测例数 | 核苷类反转录酶抑制剂 | 非核苷类反转录酶抑制剂 | 蛋白酶抑制剂 | 整合酶抑制剂 |
|---|---|---|---|---|---|
| B | 484 | 338(69.83) | 375(77.48) | 35(7.23) | 9/396(2.27) |
| CRF01_AE | 180 | 149(82.78) | 162(90.00) | 6(3.33) | 5/156(3.21) |
| CRF07_BC | 77 | 48(62.34) | 55(71.43) | 2(2.60) | 2/62(3.23) |
| CRF55_01B | 33 | 29(87.88) | 29(87.88) | 0(0.00) | 1/28(3.57) |
| A | 17 | 17(100.00) | 17(100.00) | 1(5.88) | 0/7(0.00) |
| 其他a | 21 | 15(71.43) | 16(76.19) | 1(4.76) | 0/14(0.00) |
| 合计 | 812 | 596(73.40) | 654(80.54) | 45(5.54) | 17/663(2.56) |
| χ2值 | 31.14 | 27.36 | 9.73 | 1.67 | |
| P值 | <0.001 | <0.001 | 0.083 | 0.948 |
注:括号外数据为例数,括号内数据为率(%);a包括B+CRF01_AE(9例)、CRF08_BC(7例)、C亚型(3例)和CRF68_01B(1例)和G亚型(1例)
3. 耐药突变位点和耐药突变:共检出67个耐药突变位点,其中NRTIs相关突变位点17个,包括184、65、70、215、67、115、41、151等,M184V/I突变率最高达63.42%(515/812),其次是K65R(27.46%,223/812)、K70R(23.28%,189/812)、T215Y(16.5%,134/812)。M184V/I且K65/R突变率为(21.67%,176/812),≥1个TAMs(基因位点41、67、70、210、215、219)突变率为50.25%(408/812),M184V/I且TAMs突变率为42.98%(349/812)。NNRTIs相关耐药突变位点17个,主要有103、190、106、181、179、221、101等。突变率位居前5位的分别是主要突变K103N/S(34.98%,284/812)、G190A/S(26.11%,212/812)、V106M/I(24.63%,200/812)、Y181C/I(24.14%,196/812)和次要突变V179D/E(20.81%,169/812)。PIs相关耐药突变位点21个,主要是46、82、54、33、10、47、58等,主要突变M46I、V82A/F、I54V/MV突变率分别为4.31%(35/812)、3.82%(31/812)、3.69%(30/812),次要突变L33F、L10F/FI突变率分别为1.97%(16/812)、1.85%(15/812),M46I、I54V和V82A同时突变率为1.60%(13/812)。INSTIs相关耐药突变位点12个,主要为157、263、140、138、163、97、155等,次要突变E157 Q/EQ突变率最高(3.47%,23/663),而主要突变R263K(0.75%,5/663)、G140A(0.75%,5/663)、E138EK(0.60%,4/663)突变率低。
4. 抗病毒药物耐药程度:在NRTIs中,拉米夫定和恩曲他滨耐药程度一致,以高度耐药为主(65.52%,532/812);阿巴卡韦和替诺福韦中/高度耐药分别占58.74%(477/812)和42.86%(348/812);齐多夫定的中/高度耐药占比最低(18.35%,149/812)。在NNRTIs中,奈韦拉平(77.46%,629/812)和依非韦伦(71.18%,578/812)以高度耐药为主;多拉韦林和利匹韦林的中/高度耐药分别占56.77%(436/768)和46.80%(380/812)。在PIs中,洛匹那韦/利托那韦中/高度耐药占比仅为4.19%(34/812)。INSTIs中,艾维雷韦和拉替拉韦耐药程度比较一致,中/高度耐药分别占1.66%(11/663)和1.21%(8/663),未发现比克替拉韦和多替拉韦的高度耐药。见表4。
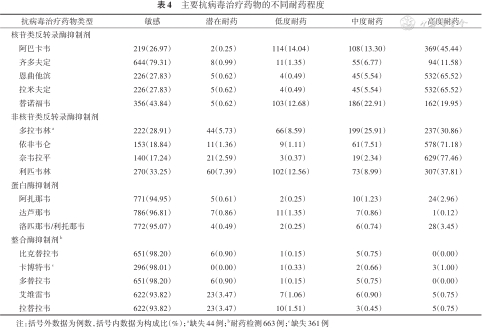
主要抗病毒治疗药物的不同耐药程度
主要抗病毒治疗药物的不同耐药程度
| 抗病毒治疗药物类型 | 敏感 | 潜在耐药 | 低度耐药 | 中度耐药 | 高度耐药 |
|---|---|---|---|---|---|
| 核苷类反转录酶抑制剂 | |||||
| 阿巴卡韦 | 219(26.97) | 2(0.25) | 114(14.04) | 108(13.30) | 369(45.44) |
| 齐多夫定 | 644(79.31) | 8(0.99) | 11(1.35) | 55(6.77) | 94(11.58) |
| 恩曲他滨 | 226(27.83) | 5(0.62) | 4(0.49) | 45(5.54) | 532(65.52) |
| 拉米夫定 | 226(27.83) | 5(0.62) | 4(0.49) | 45(5.54) | 532(65.52) |
| 替诺福韦 | 356(43.84) | 5(0.62) | 103(12.68) | 186(22.91) | 162(19.95) |
| 非核苷类反转录酶抑制剂 | |||||
| 多拉韦林a | 222(28.91) | 44(5.73) | 66(8.59) | 199(25.91) | 237(30.86) |
| 依非韦仑 | 153(18.84) | 11(1.36) | 9(1.11) | 61(7.51) | 578(71.18) |
| 奈韦拉平 | 140(17.24) | 21(2.59) | 3(0.37) | 19(2.34) | 629(77.46) |
| 利匹韦林 | 270(33.25) | 60(7.39) | 102(12.56) | 73(8.99) | 307(37.81) |
| 蛋白酶抑制剂 | |||||
| 阿扎那韦 | 771(94.95) | 5(0.61) | 2(0.25) | 10(1.23) | 24(2.96) |
| 达芦那韦 | 786(96.81) | 7(0.86) | 11(1.35) | 7(0.86) | 1(0.12) |
| 洛匹那韦/利托那韦 | 772(95.07) | 4(0.49) | 2(0.25) | 6(0.74) | 28(3.45) |
| 整合酶抑制剂b | |||||
| 比克替拉韦 | 651(98.20) | 6(0.90) | 1(0.15) | 5(0.75) | 0(0.00) |
| 卡博特韦c | 296(98.01) | 0(0.00) | 1(0.33) | 2(0.66) | 3(1.00) |
| 多替拉韦 | 651(98.20) | 6(0.90) | 1(0.15) | 5(0.75) | 0(0.00) |
| 艾维雷韦 | 622(93.82) | 23(3.47) | 7(1.06) | 6(0.90) | 5(0.75) |
| 拉替拉韦 | 622(93.82) | 23(3.47) | 10(1.51) | 3(0.45) | 5(0.75) |
注:括号外数据为例数,括号内数据为构成比(%);a缺失44例;b耐药检测663例;c缺失361例
本研究发现,2018-2021年河南省艾滋病患者ART失败的耐药率(83.25%)高于我国报道的ART失败耐药率(57.00%)[2],也高于河南省前期报道的耐药率(78.21%)[3]。ART时间<1年者的耐药率高于ART≥5年者,与河南省前期报道耐药结果不一致[4],可能与近年来河南省ART前的非核苷类药物耐药率增加有关[5],提示须加强ART前的耐药检测。在ART药物中,2个核苷类药物联合非核苷类药物方案的耐药率高于2个核苷类药物联合PIs/INSTIs方案,这与PIs/INSTIs具有强效抑制病毒和高耐药屏障有关。因此,选择高耐药屏障药物方案,有助于降低耐药发生,提高ART成功率。ART失败且CD4计数<100个/µl患者的耐药率较高,提示ART失败后,如不及时干预,在病毒学突破基础上,容易继发出现CD4计数下降,导致更多基因突变的积累,引起更广泛的耐药[6, 7]。为避免更多的耐药,建议加强ART后的病毒载量检测,尽早发现病毒学失败和及时更换用药方案。
河南省ART失败患者的HIV-1基因亚型以B亚型为主,与河南省早期报道的结果一致[8],但国内其他省份报道以CRF01_AE和CRF07_BC亚型为主[9, 10]。不同的HIV-1基因亚型,对ART药物的反应和敏感性存在一定差异,会带来不同的耐药风险[11]。本研究发现,A亚型虽然耐药率最高,但该亚型在河南省占比较少。CRF01_AE和CRF55_01B亚型在河南省占有一定比例,耐药率均高于B和CRF07_BC亚型,与姚之莹等[12]报道的CRF01_AE耐药率高于其他亚型和Lan等[13]报道CRF55_01B耐药率达79.01%的结果基本一致。
核苷类耐药中,M184V/I突变率最高,其次为K65R,与国内外的研究结果一致[9,14]。本结果显示:由于有多个核苷类药物耐药突变并存的情况,如M184V/I且K65R突变、M184V/I且TAMs突变,可能导致更多核苷类药物产生更高程度的耐药[15]。其中拉米夫定以高度耐药为主,阿巴卡韦、替诺福韦的中、高度耐药占50%左右。
非核苷类耐药中,突变率较高的是K103N/S、G190A/S、V106M/I、Y181C/I,这与国内及河南省前期报道结果一致[3,16],这些突变一旦出现会导致对依非韦仑和奈韦拉平的高度耐药。由于非核苷类药物之间易出现交叉耐药,还会造成其他非核苷类药物的高度耐药[17, 18]。因此,本结果中不仅依非韦仑和奈韦拉平以高度耐药为主,还有新一代非核苷类药物利匹韦林和多拉韦林出现相当比例的中、高度耐药,极大地限制了新药的使用。
PIs和INSTIs突变发生较少。PIs突变率位居前3位的主要突变分别是M46I、V82A/F和I54V/MV。由于PIs的耐药屏障较高,产生耐药一般需要多个主要突变同时发生,在本研究中仅发现13例患者因M46I、V82A和I54V同时发生突变,造成洛匹那韦/利托那韦高度耐药。但由于河南省使用洛匹那韦/利托那韦患者较多[1],仍要警惕PIs耐药问题。在INSTIs中,以次要突变E157Q/EQ的突变率最高,主要突变Q148R/OH、N155H、R263K突变率低。在一代INSTIs中,拉替拉韦、艾维雷韦耐药屏障相对较低,1个主要突变Q148H/R或N155H/S可引起拉替拉韦高度耐药,且拉替拉韦和艾维雷韦存在交叉耐药[19];在二代INSTIs中,多替拉韦和比克替拉韦耐药至少需要≥2个主要突变,耐药屏障较高。虽然INSTIs在临床上应用时间较短,但本研究发现,有6例艾滋病患者对所有INSTIs全部耐药,造成后续方案选择困难。随着INSTIs进入医疗保险报销政策,艾滋病患者更多选择使用,临床上根据患者耐药结果合理规范使用,加强依从性教育,避免或减少INSTIs耐药的发生。
综上所述,河南省艾滋病患者ART失败的耐药率高,主要表现在NNRTIs和NRTIs耐药率高,耐药突变复杂多样。虽然目前INSTIs和PIs耐药相对较少,但耐药风险仍需警惕。建议有条件的情况下,对ART前的患者开展耐药检测,选择高耐药屏障药物治疗,在ART之后要及时进行病毒载量检测,评估疗效,一旦发现ART失败,尽快进行耐药检测和更换ART方案。对病毒载量50~1 000拷贝数/ml之间的患者开展耐药检测,也是及早发现耐药、应对HIV-1耐药的举措之一。
杨萱, 孙燕, 霍玉奇, 等. 河南省抗病毒治疗失败的艾滋病患者耐药特征[J]. 中华流行病学杂志, 2023, 44(11): 1795-1801. DOI: 10.3760/cma.j.cn112338-20230505-00279.
Yang X, Sun Y Huo YQ, et al. Characteristics of drug resistance in HIV/AIDS patients with antiretroviral treatment failure in Henan Province[J]. Chin J Epidemiol, 2023, 44(11):1795-1801. DOI: 10.3760/cma.j.cn112338-20230505-00279.
所有作者声明无利益冲突



























