
观察咯血患者的临床特征,评估选择性动脉栓塞术(SAE)治疗咯血的预后。
回顾性选取2017年7月至2020年7月在江汉大学附属医院呼吸与危重症医学科因咯血接受SAE治疗的住院患者,术后随访2年,分析咯血的病因,血管造影表现,供血血管、手术并发症及术后咯血复发情况。
共有1 211例患者行数字减影血管造影(DSA)及SAE治疗。咯血的主要病因为支气管扩张并感染654例(54.0%),肺结核144例(11.9%),肺恶性肿瘤128例(10.6%),肺部感染116例(9.6%)。血管增粗、迂曲,末梢分支增多紊乱、体动脉-肺循环异常交通、动脉瘤或瘤样扩张为DSA下靶血管的主要病理特征。1 211例患者共栓塞6 540支责任血管,例均栓塞的血管支数为(5.4±3.7)支,其中栓塞支气管动脉(BA)(2.5±1.0)支,非支气管性体动脉(NBSA)(3.5±2.0)支。SAE总有效率为94.0%(1 138/1 211)。1 026例患者完成随访,208例2年内咯血复发(20.3%)。复发组栓塞的责任血管支数、NBSA支数及其比例均高于未复发组,肺血管介入联合呼吸内镜介入治疗比例低于未复发组(均P<0.05)。481例(39.72%)出现术中及术后并发症,以术后胸背痛385例(31.79%)和发热142例(11.73%)为多见。
成人咯血的主要病因是支气管扩张合并感染。BA和NBSA均为咯血的主要责任血管。靶血管越复杂,NBSA数量及比例越高,越容易出现咯血复发,SAE是治疗咯血的一种安全有效的方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
咯血是指喉以下呼吸道任何部位出血经口腔排出,咯血不同于其他部位的出血,少量的咯血即可能堵塞气道,从而损害通气和氧合,甚至导致窒息而危及生命,是需要紧急干预的临床急症,尤其是大咯血的病死率高达75%[1]。外科手术风险高、创伤大。内科治疗主要通过促凝、收缩血管或抗纤溶作用达到止血目的,对于咯血量较大或反复咯血的患者效果较差。选择性动脉栓塞术(selective arterial embolization,SAE)是一种安全、微创、可反复进行的治疗技术,即刻止血率达70%~99%,可将大咯血的死亡率降至13%~17.8%,已成为内科止血治疗无效的咯血、大咯血、复发性咯血的一线微创治疗手段[2, 3]。本研究分析了SAE治疗的咯血患者资料,观察咯血的病因分布、血管造影特点及责任血管分布,探讨SAE对咯血的疗效和安全性。
回顾性选择2017年7月至2020年7月在江汉大学附属医院呼吸与危重症医学科因咯血接受SAE治疗的住院患者。纳入标准:(1)经内科保守治疗无效的大咯血患者;(2)内科治疗后仍反复发作的中、小量咯血。咯血量的判定标准:少量咯血:痰中带血或24 h咯血量<100 ml,中量咯血:24 h咯血100~500 ml,大量咯血:24 h咯血量>500 ml或1次咯血量超过100 ml[4]。所有患者术前均常规行药物止血治疗,术前均签署手术知情同意书。本研究符合赫尔辛基宣言对伦理的相关要求。
通过电子病历系统收集患者资料,包括性别、年龄、既往史、咯血病因、咯血次数、咯血量、抗凝药物使用情况等临床资料。
SAE术前完善血常规、血型、肝肾功能、电解质、心肌酶学、血气分析、脑钠肽、心电图等一般检查,所有患者均行CT支气管动脉造影(computed tomography bronchial arteriography,CTBA)检查初步筛查病变血管,明确是否存在血管畸形等。
患者仰卧位,消毒铺巾,予1%利多卡因注射液局部浸润麻醉后,采用改良Seldinger技术或其改良术穿刺右侧股动脉或桡动脉,置入5 F血管鞘(日本泰尔茂公司),结合CTBA初步确定异常血管并置入5 F造影导管(C3、MIK、RLG、H1等)(美国COOK公司),手推对比剂(碘克沙醇320 mg/ml)寻找靶血管并进行血管造影(荷兰飞利浦公司UNIQ FD20 DSA操作系统),确认靶血管后,将1.98 F~2.6 F微导管(美国麦瑞通公司)沿造影导管超选至血管远端进行栓塞。据病理血管直径选择粒径300~1 000 μm聚乙烯醇颗粒(polyvinyl alcohol,PVA,美国Cook公司)栓塞末梢血管床,运用150~1 400 μm明胶海绵颗粒(gelatin sponge particle embolic agent,GS,杭州艾迪康公司)栓塞责任血管主干,如造影有动-静脉瘘、支气管动脉瘤、支气管动脉-肺循环瘘或需保护重要血管分支,则可能使用弹簧圈(美国COOK公司)栓塞。如有肺动脉假性动脉瘤(pulmonary arterial pseudoaneurysm,PAPA),则同时采用改良Seldinger技术穿刺股静脉,根据CTA及体动脉造影确定PAPA位置及供血,超选造影病变肺动脉,对PAPA进行旷置栓塞(弹簧圈栓塞入瘤动脉和出瘤动脉,或金属覆膜支架隔绝瘤体)。术后使用局部加压包扎止血,术肢保持制动12~18 h。大咯血及复发性咯血患者在SAE时同台行支气管镜检查及治疗,即双介入治疗[5]。
1. 直接出血征象:造影剂溢出。
2. 间接出血征象:病变血管增粗、迂曲,末梢分支增多紊乱,病灶区域血管呈网状或丛状分布;病变体动脉-肺循环异常交通;动脉瘤或瘤样扩张形成[6, 7]。
1. SAE效果评价:SAE效果评价包括栓塞成功,治疗有效和治疗无效。SAE 栓塞成功指栓塞后复查造影病变分支末梢闭塞,主干血流停滞,假性动脉瘤不再显示。治疗有效指术后 24 h 内临床观察咯血终止,或咯血量较术前明显减少至痰中带血;治疗无效指术后至出院时咯血量较术前无减少甚至咯血症状加重。
2. 随访:出院后通过住院、门诊、电话或微信随访,随访时间为出院1、3、6、12、18及24个月。随访内容包括术后咯血有无复发、咯血复发时间、咯血量、是否再次接受SAE。若患者在随访期间出现任何需要住院、药物治疗甚至手术干预的咯血即为咯血复发。少量咯血采取保守治疗。中量或大量反复咯血SAE手术的适应证与第1次SAE相似。咯血复发分为早发型(1个月内再次出现咯血)和晚发型(1个月后再发咯血)[8]。
采用 SPSS 24.0软件进行统计学分析,计数资料以例数(%)表示,组间比较采用χ2检验。计量资料首先进行正态性检验,符合正态分布资料的以表示,组间比较采用独立样本t检验。双侧检验,检验水准α=0.05。
共纳入1 211例因咯血接受SAE治疗的住院患者,年龄(69±15)岁,男782例(64.6%),女429例(35.4%)。少量咯血628例(51.9%),中量咯血339例(28.0%),大量咯血244例(20.1%)。288例(23.8%)患者行肺血管介入联合呼吸内镜介入治疗,115例(9.6%)患者因大咯血窒息术前行气管插管。咯血的病因如表1所示,位于前三位的分别是支气管扩张并感染654例(54.0%),肺结核144例(11.9%),肺恶性肿瘤128例(10.6%)。咯血患者胸部CT影像学表现见图1。
1 211例咯血患者病因分布[例(%)]
1 211例咯血患者病因分布[例(%)]
| 项目 | 结果 |
|---|---|
| 支气管扩张并感染 | 654(54.0) |
| 肺结核 | 144(11.9) |
| 肺恶性肿瘤 | 128(10.6) |
| 肺炎 | 116(9.6) |
| 隐源性咯血 | 64(5.3) |
| 肺曲霉菌感染 | 45(3.7) |
| 医源性咯血 | 29(2.4) |
| 抗凝药物引起 | 21(1.7) |
| 手术及操作引起 | 8(0.7) |
| 非结核分枝杆菌肺病 | 16(1.3) |
| 弥漫性肺泡出血 | 5(0.4) |
| 肺血管畸形 | 4(0.3) |
| 肺动脉高压 | 4(0.3) |
| 白塞病 | 2(0.2) |
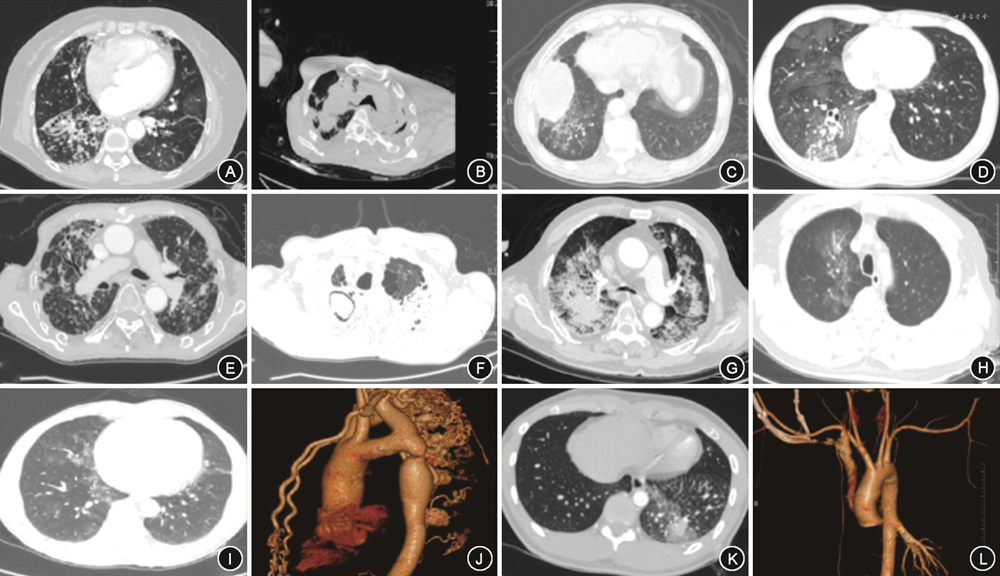

所有患者术中DSA均发现支气管动脉(bronchial artery,BA)血管增粗、迂曲,末梢分支增多紊乱,病灶区域血管呈网状或丛状分布(图2A),其中,29.6%为异位起源BA(图2B)。774例(63.9%)患者存在非支气管性体动脉(non-bronchial systemic artery,NBSA)异常并参与病灶部位供血(图2C)。1 092例(90.2%)患者存在体动脉-肺循环异常交通。包括肋间动脉-肺动脉瘘(图2C),食管固有动脉-肺动脉瘘(图2D);BA-肺静脉瘘(图2E);肺动-静脉瘘(图2F);143例(11.8%)有动脉瘤或瘤样扩张。包括支气管动脉瘤(图2G);非支气管性胸廓内动脉瘤(图2H);肺动脉假性动脉瘤(图2I)。单纯肺动脉高压引起的咯血,以第一大类先天性心脏病引起的肺动脉高压为常见,责任血管可涉及锁骨下动脉分支、胸、腹主动脉分支(支气管动脉、肋间后动脉、膈下动脉、食管固有动脉),主干迂曲增粗、末梢紊乱,责任血管床大多沿肺门周围分布(图3)。白塞病的靶血管分布在以肺动脉灌注较差位置的周围体动脉的迂曲、扩张及末梢紊乱,多发的体-肺动脉瘘形成,责任血管末梢网血管丰富(图4)。
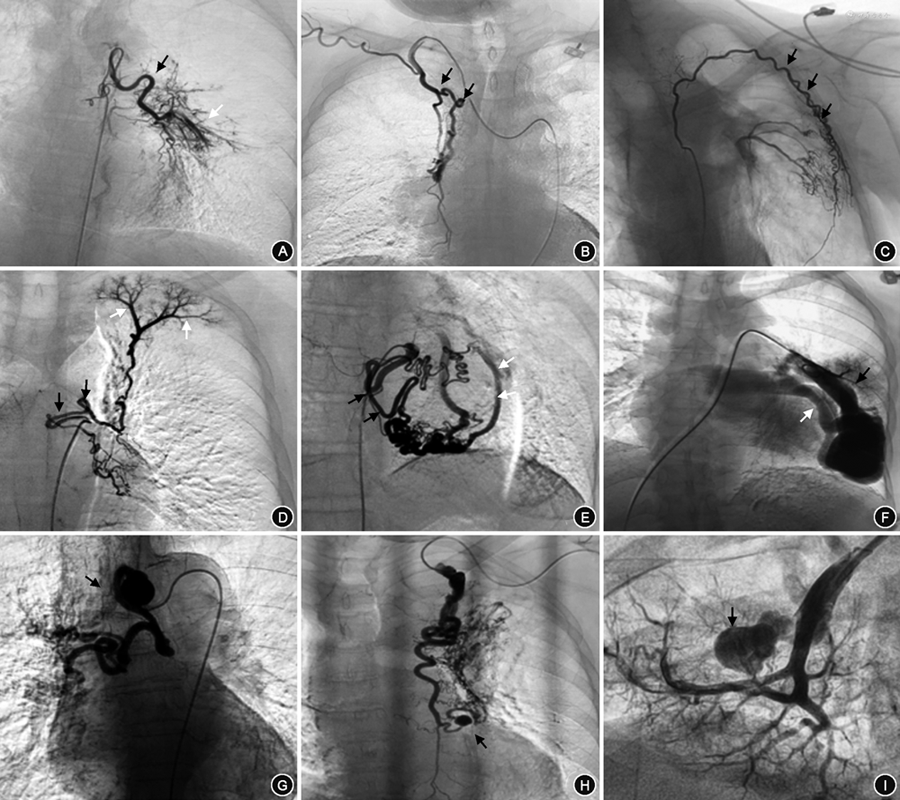

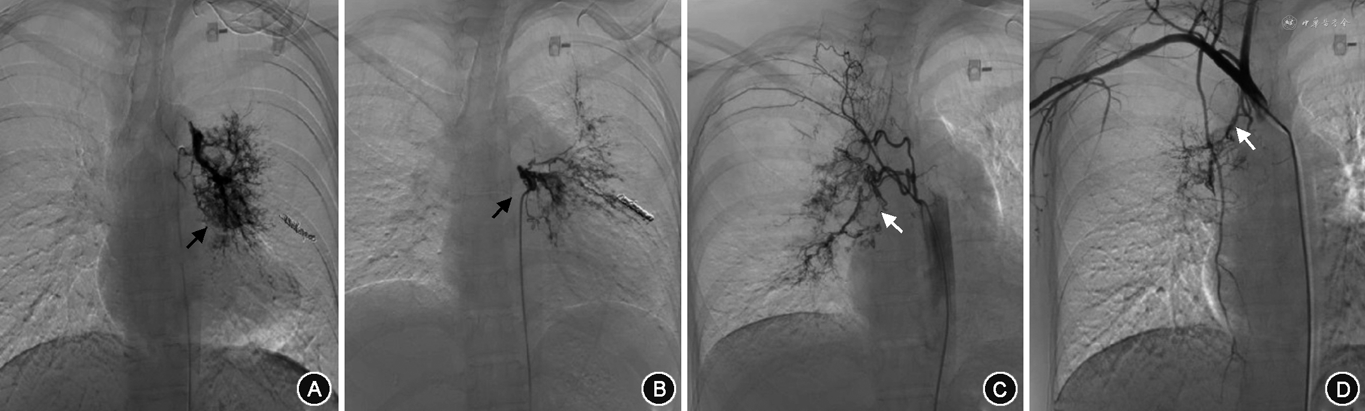

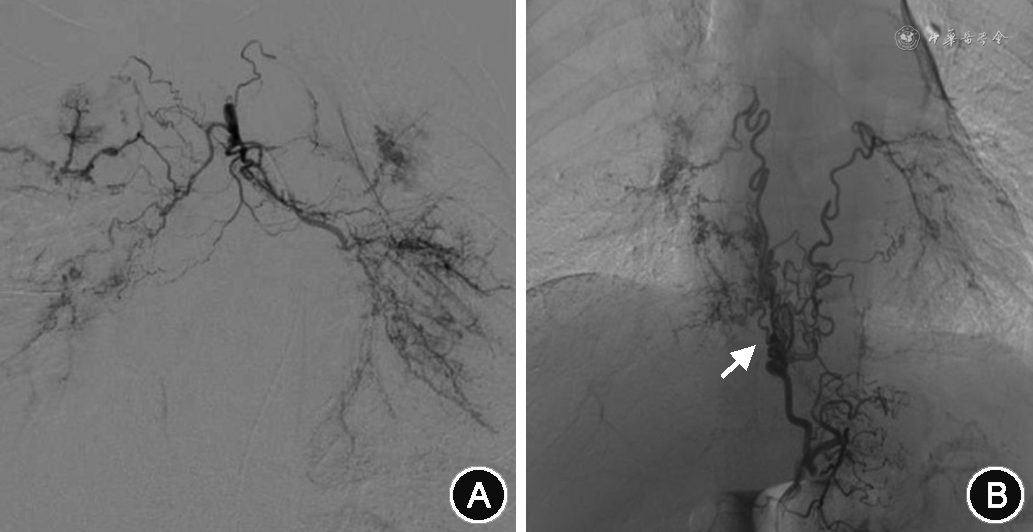

纳入的1 211例咯血患者,术中探及的责任血管大部分完成栓塞,5例11支血管因栓塞禁忌未予以栓塞。单用PVA颗粒栓塞59例,PVA和GS颗粒联合栓塞1 009例(83.3%)。143例(11.8%)动脉瘤或瘤样扩张均使用弹簧圈进行栓塞。共栓塞引起咯血责任血管6 540支;其中最少者栓塞1支血管,最多者栓塞31支血管。例均栓塞的血管支数为(5.4±3.7)支。所有患者均有来自BA的咯血,共栓塞BA 3 027支,栓塞BA(2.5±1.0)支,其中29.6%为异位起源BA,以主动脉弓(35.8%)、锁骨下动脉(30%)和胸廓内动脉(27.9%)起源多见。正常起源BA中,栓塞左侧BA、右侧BA、左右共干BA和支肋共干BA分别为30.6%、10.4%、25.9%、33.1%。774例(63.9%)患者存在来自NBSA的咯血,栓塞NBSA(3.5±2.0)支,其中以胸廓内动脉(24.5%)、膈下动脉(24.4%)多见(图5)。其中,4例肺动脉高压患者共栓塞责任血管24支,正常起源BA 10支,异位起源BA 8支,NBSA 6支(包括胸廓内动脉、肋间后动脉)。2例白塞病患者共栓塞责任血管 21支,正常起源BA 6支,异位起源BA 2支,NBSA 13支(包括胸廓内动脉、甲状颈干、肋间后动脉、胸上动脉、膈下动脉、食管固有动脉)。


所有患者均成功完成SAE,即刻止血率达94.0%(1 138/1 211),5例弥漫性肺泡出血治疗无效,住院期间死亡。共1 026例患者完成随访,随访时间153(61,264)d,失访率15.3%。208例患者在2年间咯血复发,复发率为20.3%。其中,早发型18例(1.8%),迟发型190例(18.5%)。6个月内累积复发116例(11.3%),1年内累积复发172例(16.8%)。复发性咯血患者中,167例(80.3%)经内科药物止血治疗后好转。31例(14.9%)行第2次SAE,6例(2.9%)行第3次SAE,2例(0.96%)行第4次SAE,2例(0.96%)因咯血控制不佳行外科手术治疗。咯血复发患者中,支气管扩张合并感染96例,肺结核49例,肺恶性肿瘤44例,肺真菌病19例。复发组栓塞的责任血管支数、NBSA支数及其比例高于未复发组,双介入治疗比例低于未复发组(均P<0.05)。详见表2。
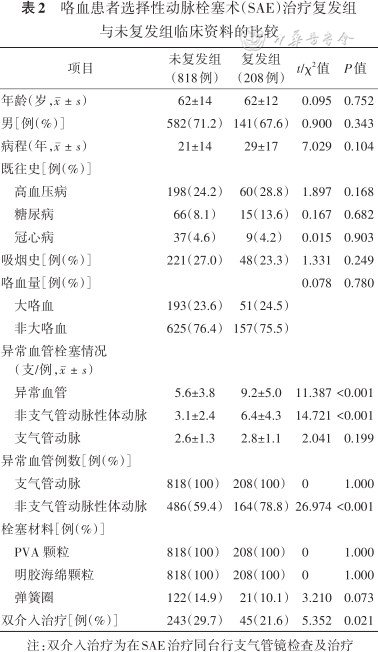
咯血患者选择性动脉栓塞术(SAE)治疗复发组与未复发组临床资料的比较
咯血患者选择性动脉栓塞术(SAE)治疗复发组与未复发组临床资料的比较
| 项目 | 未复发组(818例) | 复发组(208例) | t/χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 62±14 | 62±12 | 0.095 | 0.752 |
| 男[例(%)] | 582(71.2) | 141(67.6) | 0.900 | 0.343 |
| 病程(年,) | 21±14 | 29±17 | 7.029 | 0.104 |
| 既往史[例(%)] | ||||
| 高血压病 | 198(24.2) | 60(28.8) | 1.897 | 0.168 |
| 糖尿病 | 66(8.1) | 15(13.6) | 0.167 | 0.682 |
| 冠心病 | 37(4.6) | 9(4.2) | 0.015 | 0.903 |
| 吸烟史[例(%)] | 221(27.0) | 48(23.3) | 1.331 | 0.249 |
| 咯血量[例(%)] | 0.078 | 0.780 | ||
| 大咯血 | 193(23.6) | 51(24.5) | ||
| 非大咯血 | 625(76.4) | 157(75.5) | ||
| 异常血管栓塞情况(支/例,) | ||||
| 异常血管 | 5.6±3.8 | 9.2±5.0 | 11.387 | <0.001 |
| 非支气管动脉性体动脉 | 3.1±2.4 | 6.4±4.3 | 14.721 | <0.001 |
| 支气管动脉 | 2.6±1.3 | 2.8±1.1 | 2.041 | 0.199 |
| 异常血管例数[例(%)] | ||||
| 支气管动脉 | 818(100) | 208(100) | 0 | 1.000 |
| 非支气管动脉性体动脉 | 486(59.4) | 164(78.8) | 26.974 | <0.001 |
| 栓塞材料[例(%)] | ||||
| PVA 颗粒 | 818(100) | 208(100) | 0 | 1.000 |
| 明胶海绵颗粒 | 818(100) | 208(100) | 0 | 1.000 |
| 弹簧圈 | 122(14.9) | 21(10.1) | 3.210 | 0.073 |
| 双介入治疗[例(%)] | 243(29.7) | 45(21.6) | 5.352 | 0.021 |
注:双介入治疗为在SAE治疗同台行支气管镜检查及治疗
481例(39.72%)出现SAE术中及术后并发症(表3)。术中73例(6.02%)出现应激性血压升高,行降压药物治疗后好转;36例(2.97%)在超选过程中出现血管痉挛,停止操作后自行缓解;21例(1.73%)出现血管内膜损伤或夹层,可自行缓解;11例(0.91%)在导管经过心脏进入肺动脉时出现心律失常,停止操作后自行缓解。9例(0.70%)靶血管主干破裂导致相应部位血肿形成,行明胶或弹簧圈栓塞后可缓解。术后主要并发症为胸骨后灼烧感及胸背痛385例(31.79%),该症状可自行缓解;142例(11.73%)出现低热,该症状可自行缓解;126例(10.40%)穿刺部位瘀青,其中27例(2.23%)形成血肿,该症状在2周左右可自行缓解。其他术后并发症包括26例(2.15%)出现腹痛、腹胀不适,该症状行护胃治疗后可缓解,制动后8例(0.66%)出现肌间静脉血栓形成,可自行缓解;4例(0.33%)并发肺栓塞,行抗凝或肺动脉取栓治疗后好转;2例(0.17%)出现脑梗死;1例(0.08%)造影剂脑病,行脱水及营养神经治疗后好转。术中及术后未出现截瘫、支气管-食管瘘、膈肌麻痹等影响患者日后生活质量的严重手术相关并发症及死亡事件。
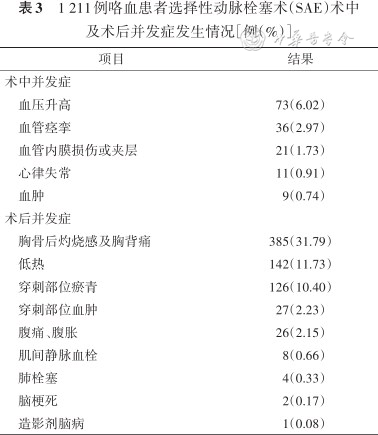
1 211例咯血患者选择性动脉栓塞术(SAE)术中及术后并发症发生情况[例(%)]
1 211例咯血患者选择性动脉栓塞术(SAE)术中及术后并发症发生情况[例(%)]
| 项目 | 结果 |
|---|---|
| 术中并发症 | |
| 血压升高 | 73(6.02) |
| 血管痉挛 | 36(2.97) |
| 血管内膜损伤或夹层 | 21(1.73) |
| 心律失常 | 11(0.91) |
| 血肿 | 9(0.74) |
| 术后并发症 | |
| 胸骨后灼烧感及胸背痛 | 385(31.79) |
| 低热 | 142(11.73) |
| 穿刺部位瘀青 | 126(10.40) |
| 穿刺部位血肿 | 27(2.23) |
| 腹痛、腹胀 | 26(2.15) |
| 肌间静脉血栓 | 8(0.66) |
| 肺栓塞 | 4(0.33) |
| 脑梗死 | 2(0.17) |
| 造影剂脑病 | 1(0.08) |
咯血的病因较多,法国一项全国回顾性多中心流行病学研究发现50%为隐源性咯血[9];在发展中国家肺结核是最常见的咯血原因(65%)[10]。本研究中,支气管扩张所占比例明显高于其他疾病:一方面在于综合医院肺结核患者相对较少,另一方面大部分继发于陈旧性肺结核的支气管扩张患者的咯血均归因于支气管扩张。
90%的咯血是由于BA增生扩张继而破裂所致[11]。Keshmiri等[12]研究指出92%的咯血来自BA系统,3%源于NBSA,5%同时存在BA和NBSA供血。此外,有文献报道5%的咯血归因于肺动脉出血,极少的罕见病例的咯血来自肺静脉和支气管静脉[13, 14]。近年来NBSA作为责任血管,尤其在咯血复发的患者中越来越受到关注。一项关于SAE术后咯血早期和晚期复发的危险因素分析指出NBSA参与血供越多,不完全栓塞概率越高,复发可能性越大,漏栓NBSA是患者术后短期复发的危险因素[8]。既往研究报道指出仅40%~62%的患者在首次SAE中成功栓塞NBSA[15]。Zhang等[16]研究指出545例患者中,93例患者存在NBSA源性咯血,共栓塞NBSA 151支,其中以肋间后动脉和胸廓内动脉为主。本研究中63.9%的患者存在来自NBSA的咯血,例均栓塞NBSA(3.5±2.0)支,明显多于其他研究。由于NBSA起源的广泛性和多样性,导致术中的显示和处理均存在一定的技术困难,在进行选择性血管造影时,经验不足的放射科医师可能容易忽略NBSA,这可能是以往研究中报道的NBSA作为责任血管发生率较低的原因之一。
与单纯保守治疗相比,SAE能提高持续或反复发作的非大咯血患者的生活质量,降低复发率[17]。本研究中SAE的有效率达94.0%,5例弥漫性肺泡大咯血的患者经栓塞支气管动脉后仍有反复出血,均在住院期间死亡,提示弥漫肺泡出血可能无法从手术中获益,可能是由于此类患者的BA无明显迂曲、扩张等病理表现。荟萃分析结果显示,SAE术后咯血的复发率为10%~57%,体动脉-肺循环瘘以及漏栓NBSA是咯血早期复发的危险因素,中晚期复发的影响因素包括栓塞血管再通、新的侧支循环形成以及原发病灶的进展[6,18, 19]。本研究中SAE术后2年复发率为20.3%,低于既往大部分研究,其原因可能与以下因素相关:(1)本中心所有患者术前均完善CTBA,术前CTBA能有效避免NBSA和异位BA的漏栓,增加术中体动脉-肺循环瘘的检出率,从而提高咯血患者无复发生存率。(2)29.7%的咯血患者行SAE联合支气管镜的双介入治疗。(3)本研究中83.3%的患者采用PVA颗粒栓塞末梢血管,联合GS颗粒栓塞血管主干。长效和短效栓塞的联合使用在一定程度上减少了单纯GS栓塞所引起病变部位血管再通的风险。(4)例均栓塞病理血管的支数多于既往研究。由此推测在血管造影术中发现的所有病理血管尤其是与肺部病灶相关的异常血管均可能增加未来咯血复发的风险,预防性栓塞相关的病理血管可能进一步降低咯血复发率,但仍需多中心前瞻性研究进一步证实。
本研究中39.7%的患者出现SAE术中及术后并发症,栓塞后综合征发生率稍高,可能与栓塞总血管数和NBSA栓塞支数明显增多有关。另外,既往研究中由于误栓起源于支肋共干BA或肋间后动脉根部的脊髓动脉导致脊髓缺血而出现短暂或永久性截瘫的发生率为0.6%~4.4%[20]。而本研究中1 211例患者术后均未出现截瘫,与本中心确认责任血管后,选择不同直径微导管超选至血管远端予以精准栓塞有关,提示术中超选择性栓塞可进一步提高手术的安全性。
由于本研究为单中心回顾性研究,存在数据缺失及选择偏倚等问题,尚需多中心前瞻性观察研究进一步验证。同时,未比较内科药物与SAE治疗,以及先药物保守治疗后予以SAE治疗等不同亚组的治疗效果。
李发久, 朱紫阳, 陈实, 等. 咯血的临床特征及选择性动脉栓塞术治疗咯血效果观察[J]. 中华医学杂志, 2023, 103(44): 3567-3574. DOI: 10.3760/cma.j.cn112137-20230721-00062.
所有作者声明不存在利益冲突



























