
探讨内镜黏膜下剥离术(ESD)联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的效果及安全性。
回顾性分析2015年1月至2019年12月东南大学附属中大医院收治的T1a-MM/T1b-SM期食管鳞癌71例患者,根据治疗方式将其分为两组:ESD组(单纯ESD治疗)和ESD-放疗组(ESD联合放疗),术后随访时间为(44±17)个月。采用生存分析比较两组患者无病生存率、总生存率的差异,并比较并发症的发生情况。对比两组患者基线资料,采用Cox比例风险回归模型分析无病生存率的影响因素。
ESD-放疗组44例[男28例,女16例,年龄(65±7)岁],ESD组27例[男18例,女9例,年龄(67±9)岁]。生存分析结果显示,ESD-放疗组1、3和5年的无病生存率分别为95.5%、92.9%和77.4%,均高于ESD组的85.2%、73.2%和62.7%(均P<0.05)。ESD-放疗组1、3和5年总生存率分别为100%、94.7%和94.7%,ESD组分别为96.3%、96.3%和79.4%,差异均无统计学意义(均P>0.05)。Cox比例风险回归模型分析显示,ESD联合放疗(HR=0.19,95%CI:0.04~0.90,P=0.037)、肿瘤完全切除(HR=0.25,95%CI:0.07~0.86,P=0.027)以及脉管侵犯(HR=12.06,95%CI:1.61~90.26,P=0.015)是无病生存率的影响因素。ESD最常见的并发症是食管狭窄,联合放疗后未出现3级及以上放疗不良反应。
ESD联合放疗是T1a-MM/T1b-SM期食管鳞癌患者一种有效且安全的治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
食管癌严重威胁全球人类健康[1]。在中国,食管癌的发病率和死亡率分别列全部恶性肿瘤的第六和第四位,其中食管鳞癌约占90%[2]。对于侵犯上皮层和固有层的食管鳞癌,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗的5年总生存率超过90%[3, 4]。近年来越来越多的T1a-MM/T1b-SM期食管鳞癌患者接受ESD治疗[5, 6, 7],肿瘤浸润深度的增加意味着淋巴结转移风险更高[8, 9, 10, 11],因此ESD术后有必要联合其他治疗,以减少肿瘤的复发和转移。日本食道协会发布的“食管癌实践指南(2022版)”中指出,目前尚无充足的证据推荐最合适的联合治疗方案[12]。国内外关于ESD联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的研究有限,这种联合治疗的必要性仍不明确。一项随机对照研究报道了ESD联合放疗可以提高患者的3年累积无复发生存率,但研究仅纳入了T1a期患者[13]。另一项研究显示ESD联合放疗不能提高T1a期患者生存率,且可能导致不良预后[14],研究结论与多数文献相矛盾[15, 16]。大部分研究纳入了接受内镜下黏膜切除术(endoscopic mucosal resection,EMR)患者,评估ESD联合放、化疗的疗效,或者是排除了病变超过食管环周3/4的患者[17, 18],这些情况都会对研究结果产生影响。本研究回顾性分析ESD联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的疗效及安全性,以期为改善患者预后提供参考。
本研究为回顾性队列研究,已获得东南大学附属中大医院伦理委员会批准(批号:2021ZDSYLL064-P01);治疗方案是根据患者的病理诊断、临床状况和个人意愿进行个体化决策,所有患者治疗前均签署知情同意书。选取2015年1月至2019年12月在东南大学附属中大医院消化内科接受食管癌ESD治疗的95例患者。根据国际抗癌联盟/美国癌症联合会第8版[19]TNM分期,均为Ⅰ期(cTNM)食管癌患者。
1.纳入标准:(1)接受食管ESD治疗;(2)术后病理证实为T1a-MM/T1b-SM期食管鳞癌。
2.排除标准:(1)既往接受过食管鳞癌ESD、放疗、化疗或外科手术;(2)ESD术后追加外科手术、化疗;(3)食管多发病变;(4)曾患或目前合并其他恶性肿瘤;(5)失访。
3.分组:排除11例ESD术后立即行外科手术、6例食管多发病变、2例既往行食管ESD、2例既往行食管放疗、1例既往行食管鳞癌外科手术以及2例失访患者后,共有71例患者纳入分析。根据治疗方案不同将其分为ESD组(单纯ESD治疗)27例和ESD-放疗组(ESD联合放疗)44例。
1.ESD及相关定义:患者在ESD前接受放大内镜和超声内镜检查,以评估肿瘤浸润深度(参考日本食道协会AB分型[20])。患者接受胸腹部联合增强CT或正电子发射计算机断层显像(positron emission computed tomography,PET/CT)检查,以评估淋巴结和远处转移情况。所有ESD治疗由1名该院消化内科主任医师完成,采用标准化操作,术中使用单通道上消化道内镜(日本东京奥林巴斯公司GIF-Q260J型)、电外科工作站(德国图宾根爱尔博公司VIO 300D型)和高频电刀(日本东京奥林巴斯公司)[21, 22]。ESD切除标本的组织学类型、浸润深度、水平垂直切缘、分化程度以及脉管侵犯至少由2名病理专家共同评估。对于内镜下切除的标本的分期,黏膜下浸润深度≤200 μm定义为pT1b-SM1,黏膜下浸润深度>200 μm定义为pT1b-SM2。完整切除指病变在内镜下被整块切除并获得单块标本;完全切除指病变被完整切除,且标本的水平和垂直切缘均为阴性。
2.放疗及放疗相关的不良反应:ESD-放疗组所有患者在ESD结束后25~84 d开始接受三维适形放疗,采用6 MV直线加速器(德国西门子公司)。放疗前在内镜下使用钛夹标记病变上、下缘,以精准辅助放疗定位。放疗方案根据术后病理、患者一般状况和放疗反应进行设计和调整。ESD-放疗组患者初始阶段的放疗总剂量为46~54 Gy(1.8~2.0 Gy/次,1次/d,5次/周),其中部分患者还接受了序贯瘤床加量,最终ESD-放疗组患者的总放疗剂量范围为46~60 Gy。本研究根据美国肿瘤放射治疗协作组/欧洲肿瘤治疗研究协作组诊断分级标准来评估放疗不良反应:白细胞损伤、血小板损伤、食管损伤、肺损伤、皮肤损伤,根据损伤的程度的不同,均分别分为0、1、2、3和4级。
3.随访:所有患者均接受随访以监测局部复发和远处转移。随访始于ESD手术日期,止于患者死亡日期或2021年6月。ESD术后3、6和12个月各复查一次内镜,此后每年复查一次。ESD术后每6~12个月复查一次胸腹部联合CT。研究团队从电子病历中获取患者的随访数据,必要时通过电话与患者或家属沟通。
4.评估:局部复发是指通过内镜或CT发现复发的原发肿瘤或局部淋巴结[15]。无病生存期定义为自ESD手术日起至出现局部复发、远处转移或死亡的时间间隔,对于存活的患者,日期截尾点为末次随访日期。总生存期定义为自ESD手术日起至出现死亡的时间间隔,对于存活的患者,日期截尾点为末次随访日期[23]。ESD相关并发症包括术后出血、穿孔和食管狭窄,其中食管狭窄是指使用标准内镜无法通过狭窄段[24]。
采用SPSS 18.0软件进行数据处理和统计学分析。符合正态分布的连续变量的数据用表示,两组间比较采用独立样本t检验。分类变量的数据用例(%)表示,两组间比较采用χ2检验或Fisher确切概率法。无病生存率和总生存率的生存分析采用Kaplan-Meier法,并利用log-rank进行检验。采用Cox比例风险回归模型分析无病生存率的影响因素。双侧检验,检验水准α=0.05。
共纳入71例T1a-MM/T1b-SM期食管鳞癌患者,男46例,女25例,年龄(66±8)岁,ESD-放疗组44例[男28例,女16例,年龄(65±7)岁],ESD组27例[男18例,女9例,年龄(67±9)岁],患者的基线临床特征见表1。两组患者性别、年龄、随访时间、肿瘤部位、标本长径、浸润深度、分化程度、病变环周、完全切除和脉管侵犯间的差异均无统计学意义(均P>0.05)。
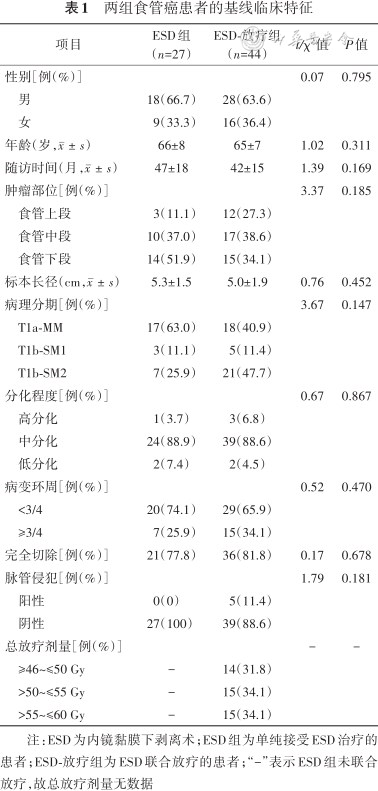
两组食管癌患者的基线临床特征
两组食管癌患者的基线临床特征
| 项目 | ESD组(n=27) | ESD-放疗组(n=44) | t/χ2值 | P值 |
|---|---|---|---|---|
| 性别[例(%)] | 0.07 | 0.795 | ||
| 男 | 18(66.7) | 28(63.6) | ||
| 女 | 9(33.3) | 16(36.4) | ||
| 年龄(岁,) | 66±8 | 65±7 | 1.02 | 0.311 |
| 随访时间(月,) | 47±18 | 42±15 | 1.39 | 0.169 |
| 肿瘤部位[例(%)] | 3.37 | 0.185 | ||
| 食管上段 | 3(11.1) | 12(27.3) | ||
| 食管中段 | 10(37.0) | 17(38.6) | ||
| 食管下段 | 14(51.9) | 15(34.1) | ||
| 标本长径(cm,) | 5.3±1.5 | 5.0±1.9 | 0.76 | 0.452 |
| 病理分期[例(%)] | 3.67 | 0.147 | ||
| T1a-MM | 17(63.0) | 18(40.9) | ||
| T1b-SM1 | 3(11.1) | 5(11.4) | ||
| T1b-SM2 | 7(25.9) | 21(47.7) | ||
| 分化程度[例(%)] | 0.67 | 0.867 | ||
| 高分化 | 1(3.7) | 3(6.8) | ||
| 中分化 | 24(88.9) | 39(88.6) | ||
| 低分化 | 2(7.4) | 2(4.5) | ||
| 病变环周[例(%)] | 0.52 | 0.470 | ||
| <3/4 | 20(74.1) | 29(65.9) | ||
| ≥3/4 | 7(25.9) | 15(34.1) | ||
| 完全切除[例(%)] | 21(77.8) | 36(81.8) | 0.17 | 0.678 |
| 脉管侵犯[例(%)] | 1.79 | 0.181 | ||
| 阳性 | 0(0) | 5(11.4) | ||
| 阴性 | 27(100) | 39(88.6) | ||
| 总放疗剂量[例(%)] | - | - | ||
| ≥46~≤50 Gy | - | 14(31.8) | ||
| >50~≤55 Gy | - | 15(34.1) | ||
| >55~≤60 Gy | - | 15(34.1) |
注:ESD为内镜黏膜下剥离术;ESD组为单纯接受ESD治疗的患者;ESD-放疗组为ESD联合放疗的患者;“-”表示ESD组未联合放疗,故总放疗剂量无数据
ESD组有6例(22.2%)患者出现局部复发,其中原发肿瘤复发有6例,无局部淋巴结复发的病例。6例局部复发患者中,3例再次接受ESD治疗,2例接受氩离子凝固术(argon plasma coagulation,APC),1例因高龄和身体状况差仅选择对症支持治疗。前5例患者最终获得治愈,最后1例患者在第51个月因食管癌死亡。ESD组随访期间无远处转移,但有2例患者死亡,死因与食管癌无关(死于胆道感染、肺炎),随访期间也未出现局部复发和远处转移。
ESD-放疗组有2例(4.5%)患者出现局部复发伴远处转移,另有2例(4.5%)患者出现远处肺转移。2例局部复发伴远处转移患者中,1例先出现原发肿瘤复发,随后出现气管和胸椎转移,随访第21个月因食管癌死亡;另1例先出现食管周围淋巴结复发,随后出现肺转移和肝转移,患者接受了化疗,随访第28个月最终因食管癌死亡。2例远处肺转移患者中,1例因个人原因仅接受对症支持治疗,另1例接受了化疗,2例患者在末次随访时仍然存活,生存期分别为62和26个月。
生存分析结果显示,ESD-放疗组1、3和5年的无病生存率分别为95.5%、92.9%和77.4%,均高于ESD组的85.2%、73.2%和62.7%(均P<0.05,图1A)。ESD-放疗组1、3和5年总生存率分别为100%、94.7%和94.7%,ESD组分别为96.3%、96.3%和79.4%,差异均无统计学意义(均P>0.05,图1B)。
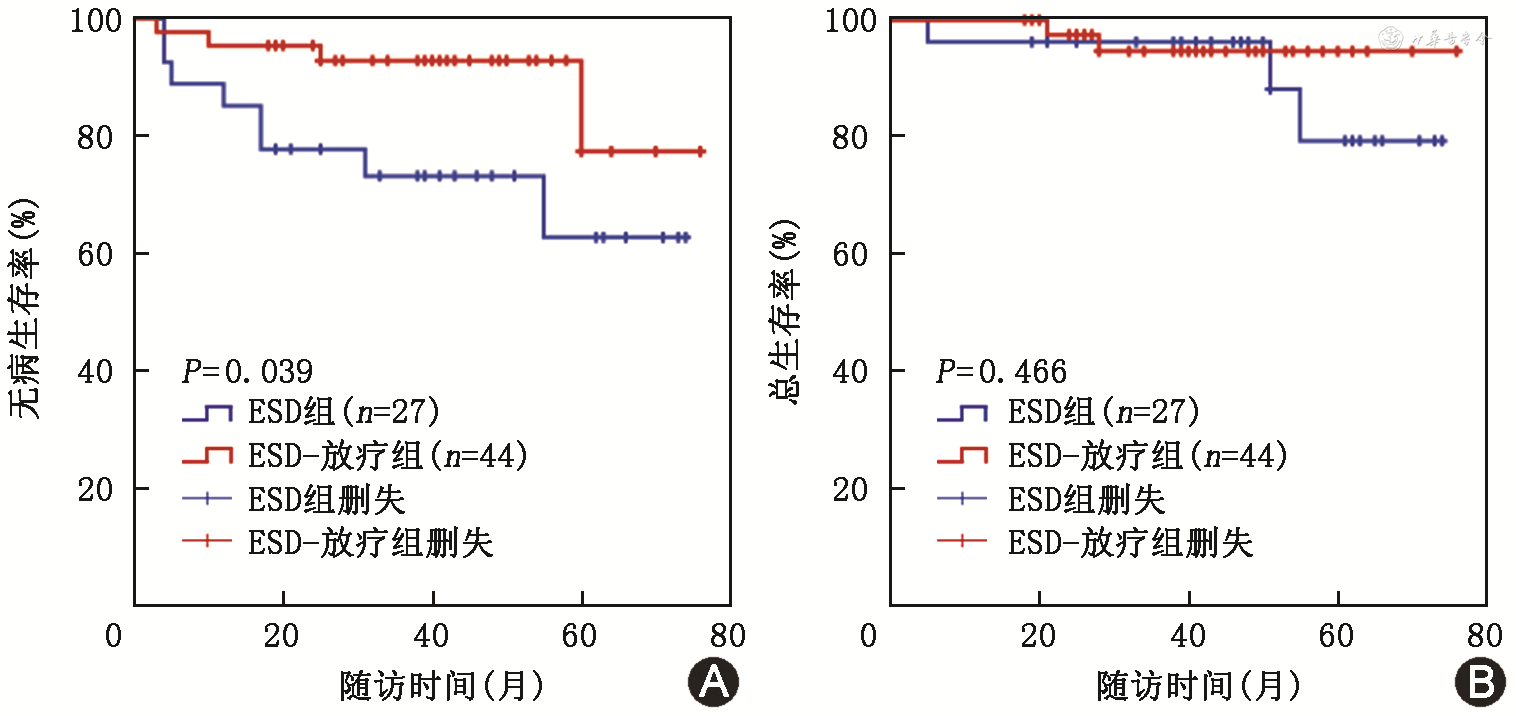

注:ESD为内镜黏膜下剥离术;ESD组为单纯接受ESD治疗的患者;ESD-放疗组为ESD联合放疗的患者
根据单因素分析结果(表2),将年龄(P=0.129)、肿瘤完全切除(P=0.027)、脉管侵犯(P=0.144)、ESD联合放疗(P=0.039)纳入多因素分析,结果显示:ESD联合放疗(HR=0.19,95%CI:0.04~0.90,P=0.037)、肿瘤完全切除(HR=0.25,95%CI:0.07~0.86,P=0.027)以及脉管侵犯(HR=12.06,95%CI:1.61~90.26,P=0.015)是无病生存率的影响因素。
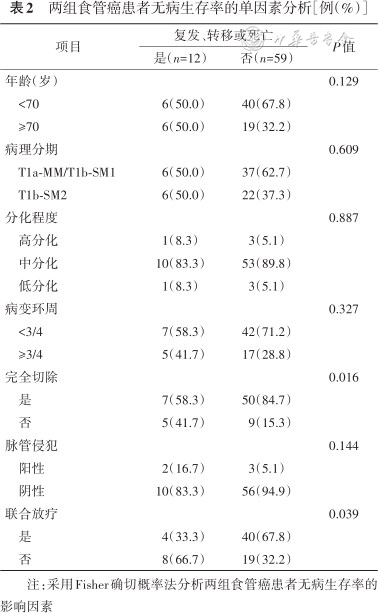
两组食管癌患者无病生存率的单因素分析[例(%)]
两组食管癌患者无病生存率的单因素分析[例(%)]
| 项目 | 复发、转移或死亡 | P值 | |
|---|---|---|---|
| 是(n=12) | 否(n=59) | ||
| 年龄(岁) | 0.129 | ||
| <70 | 6(50.0) | 40(67.8) | |
| ≥70 | 6(50.0) | 19(32.2) | |
| 病理分期 | 0.609 | ||
| T1a-MM/T1b-SM1 | 6(50.0) | 37(62.7) | |
| T1b-SM2 | 6(50.0) | 22(37.3) | |
| 分化程度 | 0.887 | ||
| 高分化 | 1(8.3) | 3(5.1) | |
| 中分化 | 10(83.3) | 53(89.8) | |
| 低分化 | 1(8.3) | 3(5.1) | |
| 病变环周 | 0.327 | ||
| <3/4 | 7(58.3) | 42(71.2) | |
| ≥3/4 | 5(41.7) | 17(28.8) | |
| 完全切除 | 0.016 | ||
| 是 | 7(58.3) | 50(84.7) | |
| 否 | 5(41.7) | 9(15.3) | |
| 脉管侵犯 | 0.144 | ||
| 阳性 | 2(16.7) | 3(5.1) | |
| 阴性 | 10(83.3) | 56(94.9) | |
| 联合放疗 | 0.039 | ||
| 是 | 4(33.3) | 40(67.8) | |
| 否 | 8(66.7) | 19(32.2) | |
注:采用Fisher确切概率法分析两组食管癌患者无病生存率的影响因素
结果提示,年龄<70岁的患者,ESD-放疗组的无病生存率高于ESD组;T1a-MM/T1b-SM1期患者,ESD-放疗组的无病生存率高于ESD组;食管上段和食管中段患者,ESD-放疗组的无病生存率高于ESD组(均P<0.05)。年龄≥70岁、T1b-SM2期和食管下段患者,两组间无病生存率的差异无统计学意义(均P>0.05,表3)。

不同临床特征食管癌患者无病生存率的比较[例(%)]
不同临床特征食管癌患者无病生存率的比较[例(%)]
| 项目 | ESD组(n=27) | ESD-放疗组(n=44) | χ2值 | P值 |
|---|---|---|---|---|
| 年龄(岁) | ||||
| <70 | 10(71.4) | 30(93.8) | 4.34 | 0.037 |
| ≥70 | 9(69.2) | 10(83.3) | 2.06 | 0.152 |
| 病理分期 | ||||
| T1a-MM/T1b-SM1 | 15(75.0) | 22(95.7) | 3.89 | 0.049 |
| T1b-SM2 | 4(57.1) | 18(85.7) | 2.05 | 0.153 |
| 肿瘤部位 | ||||
| 食管上段 | 1(33.3) | 11(91.7) | 5.48 | 0.019 |
| 食管中段 | 6(60.0) | 16(94.1) | 4.54 | 0.033 |
| 食管下段 | 12(85.7) | 13(86.7) | 0.31 | 0.577 |
注:ESD为内镜黏膜下剥离术;ESD组为单纯接受ESD治疗的患者;ESD-放疗组为ESD联合放疗的患者
随访期间,两组患者均无术后出血。两组患者食管狭窄发生率差异无统计学意义(P=0.893);食管狭窄患者接受食管探条扩张和(或)放置食管支架后均获得有效缓解。两组患者穿孔发生率的差异无统计学意义(P=1.000);其中3例穿孔在ESD术中发现,均通过单枚钛夹夹闭处理,另1例穿孔在ESD术后被及时发现,保守治疗后好转。ESD-放疗组放疗相关的不良反应均为1或2级,未出现3级及以上不良反应,且保守治疗后均得到改善,没有因放疗的不良反应而死亡的患者(表4)。
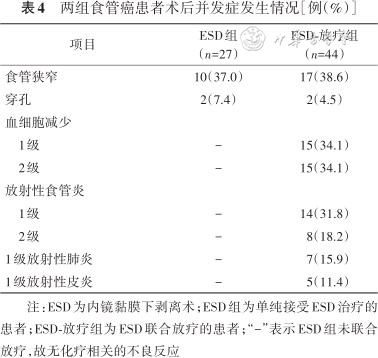
两组食管癌患者术后并发症发生情况[例(%)]
两组食管癌患者术后并发症发生情况[例(%)]
| 项目 | ESD组(n=27) | ESD-放疗组(n=44) |
|---|---|---|
| 食管狭窄 | 10(37.0) | 17(38.6) |
| 穿孔 | 2(7.4) | 2(4.5) |
| 血细胞减少 | ||
| 1级 | - | 15(34.1) |
| 2级 | - | 15(34.1) |
| 放射性食管炎 | ||
| 1级 | - | 14(31.8) |
| 2级 | - | 8(18.2) |
| 1级放射性肺炎 | - | 7(15.9) |
| 1级放射性皮炎 | - | 5(11.4) |
注:ESD为内镜黏膜下剥离术;ESD组为单纯接受ESD治疗的患者;ESD-放疗组为ESD联合放疗的患者;“-”表示ESD组未联合放疗,故无化疗相关的不良反应
本研究比较了ESD联合放疗与单纯ESD治疗的临床结局。结果显示,联合放疗有利于延长患者的无病生存期,但总生存期并未延长。ESD联合放疗、肿瘤完全切除及脉管侵犯是无病生存期的影响因素。对于年龄<70岁、T1a-MM/T1b-SM1期、食管上段和食管中段的患者,ESD-放疗组的无病生存期长于ESD组。食管狭窄是ESD最常见的并发症,联合放疗后未出现3级及以上放疗不良反应。
对于T1a-MM/T1b-SM期食管癌患者,有证据表明食管切除术或放、化疗可作为内镜手术后的联合治疗手段[12],但ESD仅联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的疗效尚需进一步证实。Nishibuchi等[25]在一项回顾性研究中证实,非治愈性ESD或EMR术后联合放疗,可有效减少食管癌的复发和转移,其5年无进展生存率和总生存率分别为64%和78%。因此ESD联合放疗可有效减少随访期间的补救治疗,如果ESD术后出现原发肿瘤复发,选择ESD、EMR或APC等内镜下补救治疗可以获得良好的长期预后[26];若出现局部淋巴结复发或远处转移,则需要选择放、化疗或外科手术作为补救治疗以期获得治愈性结局。
本研究显示ESD联合放疗、肿瘤完全切除以及脉管侵犯是T1a-MM/T1b-SM期食管鳞癌患者无病生存期的影响因素。有研究表明T1b-SM2期患者的无病生存率更低,但浸润深度未被证实为影响因素。不同临床特征食管癌患者无病生存率比较结果显示,ESD联合放疗并未改善年龄≥70岁、T1b-SM2期和食管下段的患者的无病生存期,不同患者产生不同的治疗结局可能与放疗作用的两面性有关。基于这些发现,本研究推荐年龄<70岁、T1a-MM/T1b-SM1期以及食管上段/中段的患者可接受ESD联合放疗,这为食管鳞癌患者的治疗提供了新的证据支持。
本研究未发生ESD术后出血。尽管有27例患者出现食管狭窄,4例患者出现穿孔,但两组间狭窄和穿孔的差异均无统计学意义,这表明联合放疗不会增加食管狭窄和穿孔的发生率。本研究的食管狭窄发生率高于既往研究,可能有以下两个原因:本研究纳入了T1b-SM期、全周ESD以及较大病灶的患者;此外,2019年之前的患者并未给予有效措施以预防食管狭窄的发生,现在则可以通过使用激素[27, 28, 29]或ESD术中放置食管支架进行预防。
一般而言,ESD/EMR联合放疗中采用的放疗剂量要低于根治性放疗[30, 31],目前尚无相关指南或共识指导T1a-MM/T1b-SM期食管鳞癌患者进行ESD术后放疗。本研究采用46~60 Gy总放疗剂量以期获得预防复发和转移的最佳效果,随访期间ESD-放疗组未出现3级及以上放疗不良反应。低剂量放疗有助于降低周围正常组织的辐射暴露、减轻患者身体负担、减少放疗的不良反应;此外,对于未来因其他癌症需再次接受放疗的患者也将是有益的。
本研究结果显示联合放疗并未延长患者的总生存期,与既往文献中的报道不一致[23],可能与下面两个原因相关:本研究纳入的部分患者在既往研究中多作为排除病例,包括不耐受外科手术、T1b-SM2期以及病变超过食管环周3/4的患者;本研究中ESD仅联合放疗,并未同时接受化疗。
本研究存在以下局限性:这是一项非随机、回顾性的单中心研究;此外,平均44个月的随访时间不足以评估长期结局,有待大样本、前瞻性、多中心的研究以明确ESD联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的疗效及安全性。
综上,ESD联合放疗有助于延长T1a-MM/T1b-SM期食管鳞癌患者的无病生存期,减少单纯ESD治疗后出现的复发和转移,是一种有效且安全的治疗策略,尤其适用于年龄<70岁、T1a-MM/T1b-SM1期以及食管上段/中段的患者。
陈延方, 刘仕倩, 李明月, 等. 内镜黏膜下剥离术联合放疗治疗T1a-MM/T1b-SM期食管鳞癌的效果及安全性[J]. 中华医学杂志, 2023, 103(45): 3676-3682. DOI: 10.3760/cma.j.cn112137-20230814-00222.
所有作者声明不存在利益冲突



























