
探索人源化和鼠源CD19嵌合抗原受体T细胞(CAR-T细胞)治疗复发/难治急性B淋巴细胞白血病(B-ALL)安全性、短期及长期随访的疗效差异。
分析2016年5月至2023年3月于华中科技大学同济医学院附属协和医院接受CD19 CAR-T细胞治疗的80例R/R B-ALL患者的有效性和安全性,其中接受鼠源CAR-T治疗31例,人源化CAR-T治疗49例。
鼠源和人源化组患者发生细胞因子释放综合征(CRS)的比例分别为61.3%和65.3%,其中接受鼠源CAR-T的患者发生重症CRS的比例高于人源化CAR-T(19.4%对8.2%,P=0.174),两组中分别有1例患者死于严重CRS。1~2级免疫效应细胞相关神经毒性综合征(ICANS)的发生率为12.9%和6.1%,无患者发生高级别ICANS。鼠源组和人源化组中白血病患者的总体反应率分别为74.2%和87.8%。在中位时间为10.5个月的随访期中,两组患者中位无复发生存(RFS)期均为12个月,中位总生存(OS)期均未达到。在45例基线骨髓白血病细胞负荷>20%的患者中,接受人源化CAR-T治疗的患者1年PFS率显著高于鼠源组(43.25%对33.33%,P=0.027)。桥接移植是改善B-ALL患者OS(χ2=8.017,P=0.005)及RFS(χ2=6.584,P=0.010)的独立影响因素。常见高危因素(年龄、骨髓高肿瘤负荷、BCR-ABL融合基因)对长期随访结果无显著影响。3例人源化组患者多次回输后仍达完全缓解,1例鼠源组患者复发后二次回输鼠源CAR-T细胞RFS期仅1个月。
与接受鼠源CAR-T疗法治疗的患者相比,人源化CAR-T在不影响安全性的前提下,在高肿瘤负荷患者中显示出更持久的疗效,并有效克服免疫原性导致的CAR-T耐药,为多次复发患者提供治疗选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
靶向CD19嵌合抗原受体T细胞(CAR-T细胞)疗法的出现,为复发/难治急性B淋巴细胞白血病(B-ALL)患者提供了新的治疗策略。多项临床研究显示,靶向CD19鼠源CAR-T细胞治疗B-ALL患者完全缓解(CR)率可达70%~90%[1,2],但其在安全性和长期疗效方面仍然存在许多问题。首先是与治疗相关的不良反应,包括细胞因子释放综合征(CRS)、神经毒性、血液毒性等[3],其中CRS是最常见的不良反应[4]。Tisagenlecleucel是首个在美国食品药品管理局获批的鼠源CAR-T产品,在治疗复发/难治B-ALL时,高达44.3%的患者发生3~4级CRS[5]。此外,尽管鼠源CAR-T细胞疗效显著,仍有30%~50%的患者在1年内复发[6]。不良反应和复发限制了鼠源CAR-T产品的广泛应用,研究人员将鼠源靶头进行人源化改造,以期提高患者的临床获益。
鼠源CAR-T的单链可变区(scFv)具有天然的免疫排斥作用,机体可通过细胞免疫和体液免疫排斥和清除CAR-T细胞。因此,CAR的免疫原性是影响CAR-T细胞长期存续或能否重复输注的重要因素[7]。配体受体结构域的人源化改造等策略可有效降低CAR的免疫原性,临床前研究证实具有完全人源化scFv的CAR能够通过逃避潜在的宿主抗CAR免疫反应获得持续的抗肿瘤活性[8]。然而,目前国内尚无对比鼠源和人源化CD19 CAR-T细胞治疗复发/难治B-ALL差异的大样本临床研究。本研究纳入接受鼠源和人源化CD19 CAR-T治疗的复发难治B-ALL患者,探究两组之间安全性、短期及长期随访的疗效差异。
本研究为回顾性队列研究,2016年5月至2023年3月,85例复发/难治B-ALL患者接受CD19 CAR-T治疗,5例患者因缺少关键临床数据予以排除,80例患者纳入临床试验。患者的诊断分型依据WHO 2016标准,疗效评估参考《中国成人急性淋巴细胞白血病诊断与治疗指南(2021版)》[9]。CR:①外周血无原始细胞,无髓外白血病;②骨髓三系造血恢复,原始细胞<5%;③中性粒细胞绝对计数(ANC)>1.0×109/L;④PLT>100×109/L;⑤4周内无复发。CRi:PLT≤100×109/L和(或)ANC≤1.0×109/L。其他应满足CR的标准。总体反应率(ORR)=CR率+CRi率。难治定义为诱导治疗结束(一般指4周方案或Hyper-CVAD方案)未能取得CR/CRi;复发定义为已取得CR的患者外周血或骨髓又出现原始细胞(比例>5%),或影像学、活检出现髓外疾病。本研究定义CAR-T治疗高危因素包括基线时高肿瘤负荷(细胞形态学提示骨髓白血病细胞>20%)、高危基因(BCR-ABL、BCR-ABL1样、MLL、TP53、KMT2A、TCF3-HLF、IKZF1)阳性、染色体异常(低二倍体、≥5种染色体异常、21号染色体内部扩增)、中枢/睾丸浸润[9,10]。本研究经华中科技大学同济医学院附属协和医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
鼠源CD19 CAR结构中的scFv来源于鼠FMC63单抗。人源化scFv在保留鼠源CAR的互补决定区前提下,将骨架部分用人源相似序列替代,再与共刺激域等其他序列连接,构建人源化CD19 CAR结构,经慢病毒包装、转染制备人源化CAR-T细胞(专利号ZL 2019 1 0621505.2)。采集供者或患者外周血T淋巴细胞在体外通过慢病毒载体将CAR结构片段转染进入T细胞,进行体外分离、纯化和扩增制备出转染率30%~70%的CAR-T细胞产品。预处理方案:环磷酰胺300 mg·m-2·d-1,-5~-3 d;氟达拉滨30 mg·m-2·d-1,-5~-3 d。患者在第0天回输CD19 CAR-T细胞,鼠源CAR-T细胞的中位输注量为6.5(1.5~10)×106/kg,人源化CAR-T细胞的中位输注量为4(2~6)×106/kg。
不良反应评估标准:CRS、免疫效应细胞相关神经毒性综合征(ICANS)诊断及分级参照ASTCT共识[11];血液毒性参照美国常见不良事件评价标准(CTCAE)5.0版;CAR-T细胞治疗相关凝血病(CARAC)参照CARAC管理中国专家共识[12];CAR相关噬血细胞综合征(CAR-HLH)参考CAR-T毒性评估及管理[13]。通过门诊或住院复查、电话随访、检索病历的方式对患者进行随访。随访时间截至2023年6月1日,中位随访时间为10.5(95% CI 6~15)个月。总生存(OS)期为CAR-T细胞输注至任何原因死亡或随访终点。无复发生存(RFS)期为CAR-T治疗后获得CR至疾病复发、死亡或随访终点。
应用Graphpad Prism 9.0进行统计学分析。分类变量以例数(百分比)描述,采用卡方检验或Fisher精确概率法进行组间比较;连续变量以中位数(范围)描述,组间比较采用秩和检验(不符合正态分布)。采用Reverse Kaplan-Meier法计算所有患者及亚组的中位随访时间;采用Kaplan-Meier法绘制生存曲线,Log-rank检验进行组间比较。双侧P<0.05为差异有统计学意义。
共纳入80例复发/难治B-ALL患者,其中女38例,男42例,中位年龄28.5(13~67)岁。76例患者在CAR-T细胞输注前骨髓内存在肿瘤负荷,中位原始细胞比例为23.45%(0.02%~97.85%),4例患者骨髓微小残留未见原始细胞,但尚可检测到高危基因突变拷贝数。22例患者存在高危基因突变,其中16例伴BCR-ABL融合基因,3例伴MLL-AF4融合基因,2例伴TP53突变,1例同时伴MLL-AF4融合基因和TP53突变。52.5%的患者在接受CAR-T治疗前出现疾病复发,既往接受的中位治疗线数为3(1~10)线,26.3%的患者接受过造血干细胞移植,8.8%的患者接受过CAR-T治疗。31例患者回输鼠源CAR-T细胞,49例患者回输人源化CAR-T细胞,人源化组患者骨髓白血病细胞>20%比例显著高于鼠源组(P<0.001),而回输总细胞量则低于鼠源CAR-T细胞(P<0.001)(表1)。
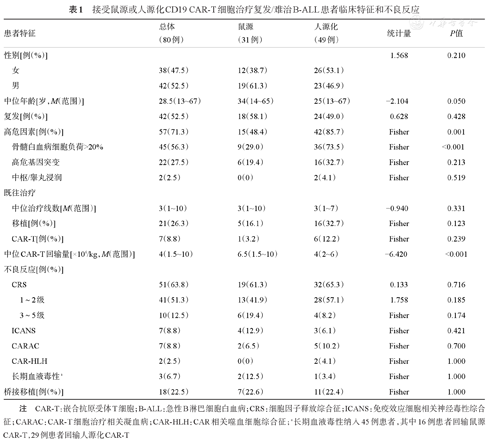
接受鼠源或人源化CD19 CAR-T细胞治疗复发/难治B-ALL患者临床特征和不良反应
接受鼠源或人源化CD19 CAR-T细胞治疗复发/难治B-ALL患者临床特征和不良反应
| 患者特征 | 总体(80例) | 鼠源(31例) | 人源化(49例) | 统计量 | P值 |
|---|---|---|---|---|---|
| 性别[例(%)] | 1.568 | 0.210 | |||
| 女 | 38(47.5) | 12(38.7) | 26(53.1) | ||
| 男 | 42(52.5) | 19(61.3) | 23(46.9) | ||
| 中位年龄[岁,M(范围)] | 28.5(13~67) | 34(14~65) | 25(13~67) | -2.104 | 0.050 |
| 复发[例(%)] | 42(52.5) | 18(58.1) | 24(49.0) | 0.628 | 0.428 |
| 高危因素[例(%)] | 57(71.3) | 15(48.4) | 42(85.7) | Fisher | 0.001 |
| 骨髓白血病细胞负荷>20% | 45(56.3) | 9(29.0) | 36(73.5) | Fisher | <0.001 |
| 高危基因突变 | 22(27.5) | 6(19.4) | 16(32.7) | Fisher | 0.213 |
| 中枢/睾丸浸润 | 2(2.5) | 0(0) | 2(4.1) | Fisher | 0.519 |
| 既往治疗 | |||||
| 中位治疗线数[M(范围)] | 3(1~10) | 3(1~10) | 3(1~7) | -0.940 | 0.331 |
| 移植[例(%)] | 21(26.3) | 5(16.1) | 16(32.7) | Fisher | 0.123 |
| CAR-T[例(%)] | 7(8.8) | 1(3.2) | 6(12.2) | Fisher | 0.239 |
| 中位CAR-T回输量[×106/kg,M(范围)] | 4(1.5~10) | 6.5(1.5~10) | 4(2~6) | -6.420 | <0.001 |
| 不良反应[例(%)] | |||||
| CRS | 51(63.8) | 19(61.3) | 32(65.3) | 0.133 | 0.716 |
| 1~2级 | 41(51.3) | 13(41.9) | 28(57.1) | 1.758 | 0.185 |
| 3~5级 | 10(12.5) | 6(19.4) | 4(8.2) | Fisher | 0.174 |
| ICANS | 7(8.8) | 4(12.9) | 3(6.1) | Fisher | 0.421 |
| CARAC | 7(8.8) | 2(6.5) | 5(10.2) | Fisher | 0.700 |
| CAR-HLH | 2(2.5) | 0(0) | 2(4.1) | Fisher | 1.000 |
| 长期血液毒性a | 3(6.7) | 2(12.5) | 1(3.4) | Fisher | 1.000 |
| 桥接移植[例(%)] | 18(22.5) | 7(22.6) | 11(22.4) | Fisher | 1.000 |
注 CAR-T:嵌合抗原受体T细胞;B-ALL:急性B淋巴细胞白血病;CRS:细胞因子释放综合征;ICANS:免疫效应细胞相关神经毒性综合征;CARAC:CAR-T细胞治疗相关凝血病;CAR-HLH:CAR相关噬血细胞综合征;a长期血液毒性纳入45例患者,其中16例患者回输鼠源CAR-T,29例患者回输人源化CAR-T
共有51例患者发生CRS,51.3%(41/80)的患者为1~2级,8.8%(7/80)为3级,1例患者发生4级CRS,2例患者因5级CRS死亡。鼠源组和人源化组的CRS发生率分别61.3%和65.3%,其中接受鼠源CAR-T治疗的患者发生重症CRS的比例高于人源化CAR-T,但差异无统计学意义(19.4%对8.2%,Fisher,P=0.174)。ICANS的发生率分别为12.9%和6.1%(Fisher,P=0.421),均为1~2级,未观察到高级别ICANS发生,经激素和对症治疗后症状均好转。7例患者被诊断为CARAC,表现为血小板减少、弥散性血管内凝血(DIC)相关指标异常以及细胞因子升高,4例发生在1~2级CRS后,3例发生在3~5级CRS后。2例患者符合CAR-HLH的诊断标准,出现CRS后铁蛋白升高、三系减少伴胆红素升高、肺水肿等器官毒性,糖皮质激素、静脉注射免疫球蛋白及对症支持治疗后恢复正常。35例患者未能评估长期血液毒性,其中18例B-ALL患者在回输后3个月内行造血干细胞移植,17例患者存在未缓解、疾病进展、失访或随访时间未及等问题。其余45例患者中,6.7%(3/45)在回输后3个月仍有CTCAE 3级及以上的血液毒性。
80例复发/难治B-ALL患者中,ORR为82.5%,CR率为76.3%。其中鼠源组OR率为74.2%;人源化组ORR为87.8%。截至2023年6月1日,中位随访10.5(95% CI 6~15)个月,鼠源和人源化组患者的中位RFS期均为12个月,中位OS期均未达到。人源化组患者1年OS率高于鼠源组,但差异尚无统计学意义[(82.4±6.1)%对(78.3±8.8)%,χ2=0.082,P=0.774,图1]。在回输前骨髓白血病细胞负荷>20%的45例患者中,人源化组患者的1年OS和RFS率均高于鼠源组[(86.7±6.3)%对(59.3±25.2)%;(43.2±10.9)%对(33.3±27.2)%,两组间RFS差异有统计学意义(P=0.027,图2)。
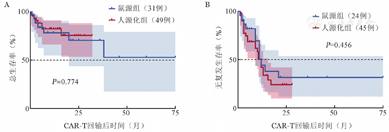

CAR-T:嵌合抗原受体T细胞;B-ALL:急性B淋巴细胞白血病
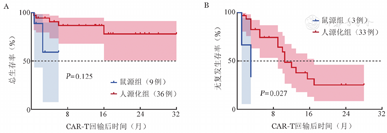

CAR-T:嵌合抗原受体T细胞;B-ALL:急性B淋巴细胞白血病
对影响白血病患者OS和PFS的因素进行单因素分析。桥接移植是改善患者1年OS(χ2=8.017,P=0.005)及1年RFS(χ2=6.584,P=0.010)的独立影响因素。而常见高危因素(年龄、回输前骨髓高白血病细胞负荷、BCR-ABL融合基因)对患者的OS和RFS无显著影响(表2)。
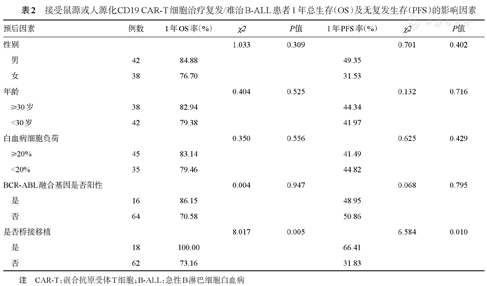
接受鼠源或人源化CD19 CAR-T细胞治疗复发/难治B-ALL患者1年总生存(OS)及无复发生存(PFS)的影响因素
接受鼠源或人源化CD19 CAR-T细胞治疗复发/难治B-ALL患者1年总生存(OS)及无复发生存(PFS)的影响因素
| 预后因素 | 例数 | 1年OS率(%) | χ2 | P值 | 1年PFS率(%) | χ2 | P值 |
|---|---|---|---|---|---|---|---|
| 性别 | 1.033 | 0.309 | 0.701 | 0.402 | |||
| 男 | 42 | 84.88 | 49.35 | ||||
| 女 | 38 | 76.70 | 31.53 | ||||
| 年龄 | 0.404 | 0.525 | 0.132 | 0.716 | |||
| ≥30岁 | 38 | 82.94 | 44.34 | ||||
| <30岁 | 42 | 79.38 | 41.97 | ||||
| 白血病细胞负荷 | 0.350 | 0.556 | 0.625 | 0.429 | |||
| ≥20% | 45 | 83.14 | 41.49 | ||||
| <20% | 35 | 79.46 | 44.82 | ||||
| BCR-ABL融合基因是否阳性 | 0.004 | 0.947 | 0.068 | 0.795 | |||
| 是 | 16 | 86.15 | 48.95 | ||||
| 否 | 64 | 70.58 | 50.86 | ||||
| 是否桥接移植 | 8.017 | 0.005 | 6.584 | 0.010 | |||
| 是 | 18 | 100.00 | 66.41 | ||||
| 否 | 62 | 73.16 | 31.83 |
注 CAR-T:嵌合抗原受体T细胞;B-ALL:急性B淋巴细胞白血病
7例患者既往在本院接受过CD19 CAR-T细胞治疗。1例鼠源组患者复发后二次回输鼠源CAR-T细胞后于第14天达到CR,然而其在回输后1个月内因疾病进展死亡,体内未能检测到持续存在的CAR-T细胞。4例人源化患者二次回输后仍达CR,中位RFS期为3(1~9)个月。其中1例在接受CAR-T治疗前基线骨髓微小残留为72.4%,回输人源化CAR-T后3周内达到CR,于回输后9个月髓外复发,病理检查示CD19阳性,经二次回输后仍达CR,并实现4个月无病生存。后又因复发分别行第三和第四次CAR-T回输,最终因阴性复发退组。
本研究结果仍支持鼠源CD19 CAR-T细胞疗法对复发/难治B-ALL患者有效。然而,高级别CRS发生率和CAR-T存续性不足已成为CAR-T细胞治疗后长期生存的主要挑战。研究表明,鼠源CAR结构中的单链可变片段中的抗原表位可以引起HLA限制性T细胞介导的免疫反应[14]。而通过改变CAR的框架或非互补决定区域使用人源化抗体片段可减低其免疫原性,从而使CAR-T细胞治疗过程中细胞因子的释放减少并且抗肿瘤活性增强[15]。因此,人源化CAR-T细胞有可能成为高肿瘤负荷、预后不良和CAR-T回输后复发患者的治疗选择[16]。特别是对于鼠源CAR-T治疗达到CR后复发的患者,仍可获益于人源化CAR-T细胞[17]。在多发性骨髓瘤患者中,全人源BCMA靶向CAR-T 1/2期注册临床研究(NCT05066646)结果显示,纳入103例患者中,12例既往接受过CAR-T治疗,ORR仍高达96%。这表明人源化或全人源细胞可以作为鼠源CAR-T细胞治疗无效或缓解后复发的有效治疗手段。本研究中,人源化CAR-T组患者的ORR优于鼠源组,但差异无统计学意义;其在骨髓高白血病细胞负荷患者的长期缓解方面显著优于鼠源组,可能与抗CAR反应降低、CAR-T长期续存相关。
CRS是CAR-T细胞回输后最常见的不良反应,是由全身免疫细胞过度激活和增殖引起的全身炎症反应综合征[4]。研究表明CRS等级与患者基线肿瘤负荷相关,本研究中接受人源化CAR-T细胞的患者白血病细胞负荷显著高于鼠源组,尽管差异无统计学意义,但人源化CAR-T细胞在高白血病细胞负荷患者中引发3~5级CRS反应的比例低于鼠源组,可能与人源化CAR结构亲和力更强、免疫原性较低相关。此外,因鼠源CAR-T临床研究开展较早,细胞制备工艺尚不完善,CAR转染率较低,所以鼠源组的高回输剂量未导致两组间CRS发生率的差异。人源化CAR-T细胞在提升安全性的同时,通过减少CRS相关治疗避免对长期生存的影响。早期常规剂量使用糖皮质激素治疗CRS不会影响临床疗效,但长时间或大剂量使用可能会抑制患者体内CAR-T细胞的扩增及存续[18],甚至缩短患者的PFS和OS期[19]。鼠源组患者高危CRS治疗过程中激素的使用与鼠源CAR-T细胞天然的免疫原性共同作用,可能进一步阻碍患者实现长期缓解。其他常见不良反应,如神经毒性、血液毒性和HLH在本研究中的发生比例均较低,对患者预后未造成显著影响。
接受CD19 CAR-T治疗患者的1年复发率为30%~50%[20],CAR-T细胞在体内不能长时间存续是导致阳性复发的主要原因。人源化抗体修饰通过降低免疫原性来延长CAR-T细胞的持久性,可以在一定程度上提高治疗效果。美国费城儿童医院的临床研究中,74例接受人源化CAR-T治疗的复发/难治B-ALL患者两年的无复发率高达74%[16]。CAR-T回输有效患者可通过巩固治疗进一步延长获益。本研究中18例B-ALL患者缓解后行巩固性造血干细胞移植,患者1年的OS率达到100%,RFS率达到66%,明显优于未桥接移植组,与本中心已发表研究结论一致[21]。国内一项探究人源化靶向CD19 CAR-T细胞有效性及安全性的研究中,共纳入41例患者,5例达CR患者未接受巩固性治疗,均出现阴性复发[22]。CAR-T治疗后复发患者可再次回输人源化CAR-T细胞,获得一定时间的持续缓解[23]。随着越来越多CAR-T产品上市,如何通过产品优化和方案选择最大限度地延长患者的OS期,需要在更大的样本量、更长随访时间的前瞻性临床试验中加以探索。
当然,本研究具有一定局限性:由于鼠源CAR-T临床研究开展较早,存在患者回输剂量差异较大、未规范化CRS等不良反应后治疗方案等问题,导致队列内及队列间存在异质性。
本研究结果表明人源化CD19 CAR-T疗法在治疗复发/难治B-ALL中具有更好的长期疗效,并为CAR-T回输后复发患者提供新的治疗选择。
ClinicalTrial,NCT02965092、NCT04008251
ClinicalTrial, NCT02965092、NCT04008251
所有作者声明无利益冲突



























