
随着人们生活方式的改变和肥胖患病率的增加,儿童青少年2型糖尿病(T2DM)的发病率也在不断增高,严重影响儿童及青少年身心健康,增加疾病防控负担。儿童青少年T2DM的流行病学、病理生理学、生长发育和对治疗的反应不同于成人T2DM及1型糖尿病(T1DM),如何准确诊断及治疗,且尽量在儿童青少年β细胞功能发生显著恶化之前保留其功能是关键。该文结合《国际儿童和青少年糖尿病学会临床实践共识指南2022:儿童和青少年2型糖尿病》及《美国糖尿病学会儿童和青少年糖尿病护理标准2023》相关要点和最新临床试验对儿童青少年T2DM的流行病学现状、病理生理机制、危险因素、合并症、并发症以及其管理的循证证据等进行多层面梳理,以期为儿童青少年T2DM临床诊疗提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全球对于儿童及青少年2型糖尿病(type 2 diabetes mellitus,T2DM)日益关注,但大型队列随访研究表明,其共病和并发症的发病率和流行率仍在急剧增加,严重影响儿童及青少年的身心健康,增加疾病防控负担。我国自发布《中国2型糖尿病防治指南(2020版)》(第17章第四节:儿童和青少年2型糖尿病)后,暂无新的指南共识更新。本文梳理《国际儿童和青少年糖尿病学会(International Society for Pediatric and Adolescent Diabetes,ISPAD)临床实践共识指南2022:儿童和青少年2型糖尿病》[1](简称ISPAD 2022)及《美国糖尿病学会(American Diabetes Association,ADA)儿童和青少年糖尿病护理标准2023》[2](简称ADA 2023)相关要点,结合近年关于儿童及青少年T2DM诊治的临床试验数据,以期为儿童及青少年T2DM的诊治及研究提供参考。
在过去的20年中,青少年T2DM的患病率持续增加。全球发病率为(0~330)/10万人年,患病率为(0~5 300)/10万。在儿童糖尿病的构成比中,由20年前的3%上升至45%,呈现不同的时间、地理分布及人口学特征:美洲印第安人年发病率为49.4/10万,亚洲和太平洋地区为22.7/10万,非裔美国人为19.4/10万,非西班牙裔白人仅为5.6/10万,英国为0.54/10万,中国台湾地区6.5/10万[3]。日本新发儿童和青少年糖尿病中T2DM占80%,美国青少年T2DM的患病率从2001年的34/10万增长到2017年的76/10万,相对增加了95.3%[4]。我国也呈明显上升趋势[5],患病率也由1995年的4.1/10万上升至2010年的10.0/10万;年龄≥10岁患者占82.2%,男孩占57.9%;患病率存在地域差异,西南地区(广州、武汉、郑州、重庆)最低为2.52/10万,东部地区(上海、浙江、南京、苏州、江西)次之为3.77/10万,北部地区(北京、哈尔滨、天津、沈阳)最高为15.64/10万;经济发达地区与欠发达地区的患病率分别为15.16/10万、1.64/10万[6]。
种族,性别,家族史,宫内暴露情况,超重、肥胖,青春期生长激素、雄性激素、雌性激素分泌和体重增加,均被证实与儿童及青少年T2DM密切相关。
非白色欧洲血统的人如非洲人、本土的北美洲人、西班牙(尤其是墨西哥裔)美国人、亚洲人、南亚人(印度半岛)、本土的太平洋岛民等儿童及青少年T2DM发病率较高;女性约占65%~75%(我国女孩占42.1%[6]);60%的患者其父母患有糖尿病,30%的患者祖父母患有糖尿病[7]。暴露于糖尿病母亲的宫内环境使子代患T2DM的风险较对照组(非糖尿病)增加了7.3倍,超重或肥胖母亲的宫内环境使子代患T2DM的风险增加1.4~3.5倍[8]。母体过量的脂质水平会增加子代肥胖及代谢风险[9]。青春期胰岛素敏感性较青春期前大约下降30%,青春期结束后,部分糖耐量减低可以在3~5年后恢复正常[10]。
我国儿童和青少年的肥胖患病率从2006—2010年的7.5%上升到2009—2014年的10.4%,与儿童和青少年T2DM患病趋势平行。儿童T2DM人群存在严重的脂质代谢紊乱,甘油三酯、总胆固醇和低密度脂蛋白胆固醇水平较高[11]。与成人T2DM不同,肥胖、糖尿病前期和T2DM的儿童青少年患者中,出现糖尿病症状的儿童胰岛素耗竭的比例达到85%,且胰岛β细胞功能衰减的速度更快,更早出现糖尿病并发症[12]。
高血糖症状+符合以下4项之一+胰岛自身抗体阴性,可诊断儿童及青少年T2DM:(1)空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L;(2)口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L;(3)随机血浆葡萄糖≥11.1 mmol/L;(4)糖化血红蛋白(glycated hemoglobin A1c,HbA1c)≥6.5%。HbA1c要求为美国国家糖化血红蛋白标准化计划认证的设备、标准化的糖尿病控制与并发症试验检测,用于不被血红蛋白病干扰的儿童T2DM[1]。在青春期开始后或10岁后,对于体重指数(body mass index,BMI)≥第85百分位同年龄、同性别的青少年及具有T2DM危险因素的儿童及青少年,应进行靶向筛查以确定T2DM病例。筛查时应对其他肥胖相关共病(高血压、血脂异常、非酒精性脂肪性肝病、多囊卵巢综合征、阻塞性睡眠呼吸暂停)进行临床评估。超重或肥胖的儿童和青少年应该进行胰腺自身抗体测试,以排除自身免疫性1型糖尿病(type 1 diabetes mellitus,T1DM)。
区分儿童的T1DM和T2DM存在困难:T1DM儿童中超重和肥胖常见,仅少数以糖尿病酮症酸中毒起病[5];糖尿病相关的自身抗体和酮症也可存在于具有T2DM临床特征的10岁以下青春期前儿童个体中(包括肥胖和黑棘皮病)[13]。准确的分型对儿童及青少年糖尿病诊断来说至关重要。随着基因诊断技术的发展,对精准诊断及临床上个体化治疗方案的制定有重要价值[14]。
儿童和青少年的T2DM管理主要包括生活方式干预和药物、代谢手术治疗。
我国指南建议饮食控制以维持标准体重、纠正已发生的代谢紊乱和减轻胰岛β细胞的负担为原则[5]:6~12岁儿童能量摄入为900~1 200 kcal/d,13~18岁则在1 200 kcal/d以上。碳水化合物供能占50%~55%,脂肪占25%~35%(其中饱和脂肪酸<10%),蛋白质占15%~20%。膳食纤维摄入量为10~14 g/1 000 kcal。减少久坐,每天至少参加60 min的中至高强度体育活动,每周至少进行3 d肌肉和骨骼力量的训练[1]。根据年龄保证每晚8~11 h的足够高质量睡眠(5~13岁儿童9~11 h,14~17岁青少年8~10 h)[1]。超重/肥胖的青少年建议减少7%~10%体重[1]。还包括自我血糖监测、家庭和学校支持以及心理方面管理[1]。
到目前为止,美国食品和药物监督管理局(Food and Drug Administration,FDA)已经批准了4种治疗儿童和青少年T2DM的药物:二甲双胍、胰岛素、利拉鲁肽和艾塞那肽,不推荐未经过FDA批准的其他药物用于儿童和青少年T2DM治疗。
对于临床怀疑为T2DM的青少年超重或肥胖新发糖尿病患者,启动生活方式管理和糖尿病教育血糖或HbA1c控制不达标,药物治疗流程推荐见图1[2]。
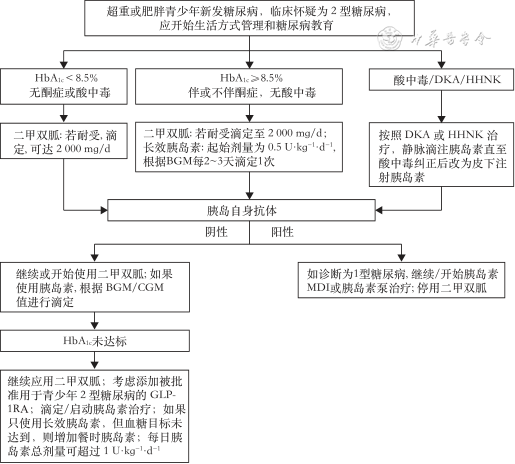

注:HbA1c为糖化血红蛋白;BGM为血液葡萄糖监测;CGM为持续葡萄糖监测;GLP-1RA为胰高糖素样肽-1受体激动剂;DKA为糖尿病酮症酸中毒;HHNK为高血糖高渗性非酮症综合征;MDI为每日多次注射
1.二甲双胍:对于偶然诊断或代谢稳定(HbA1c<8.5%和无症状)的儿童青少年T2DM患者,肾功能正常情况下,首选二甲双胍。指南推荐[15],初始剂量500 mg/d连用7 d,接下的3~4周内每周增加500 mg/d,最大剂量不超过2 000 mg/d。
注意事项:可有胃肠道不良反应,包括一过性的腹痛、腹泻、恶心等。在肝肾功能不全,如肝酶升高3倍以上,严重感染,重大手术,或放射检查使用碘化造影剂时禁用。长期使用二甲双胍可能引起维生素B12缺乏。
2.胰岛素:可快速改善代谢异常并能保护胰岛β细胞功能。有典型糖尿病症状[多尿、多饮、夜尿和(或)体重减轻],血糖≥13.9 mmol/L,HbA1c≥8.5%,无酸中毒症状,则应首先使用长效胰岛素治疗,同时使用二甲双胍。对于酮症/糖尿病酮症酸中毒患者,应开始皮下或静脉注射胰岛素治疗。待酸中毒纠正后,应胰岛素联合二甲双胍治疗。对于严重高血糖(血糖≥33.3 mmol/L)者,还需评估有无合并高血糖高渗性非酮症综合征。
指南推荐[15],中性鱼精蛋白锌胰岛素或基础胰岛素(0.25~0.50 U/kg)1次/d注射。如果二甲双胍和基础量胰岛素(最高至1.2 U/kg)联用仍不能达标,需加用餐前胰岛素直至血糖正常。病情稳定后胰岛素每次减量30%~50%,逐渐过渡到单用二甲双胍,过渡期往往需要2~6周。各种胰岛素作用特点见表1。
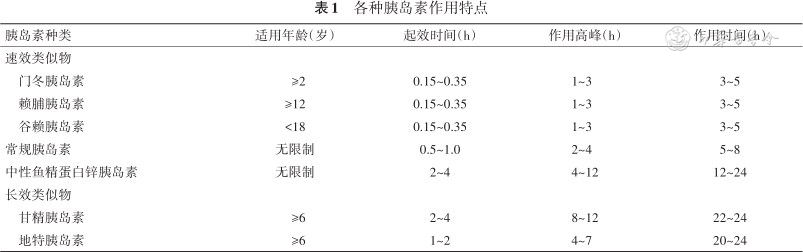
各种胰岛素作用特点
各种胰岛素作用特点
| 胰岛素种类 | 适用年龄(岁) | 起效时间(h) | 作用高峰(h) | 作用时间(h) |
|---|---|---|---|---|
| 速效类似物 | ||||
| 门冬胰岛素 | ≥2 | 0.15~0.35 | 1~3 | 3~5 |
| 赖脯胰岛素 | ≥12 | 0.15~0.35 | 1~3 | 3~5 |
| 谷赖胰岛素 | <18 | 0.15~0.35 | 1~3 | 3~5 |
| 常规胰岛素 | 无限制 | 0.5~1.0 | 2~4 | 5~8 |
| 中性鱼精蛋白锌胰岛素 | 无限制 | 2~4 | 4~12 | 12~24 |
| 长效类似物 | ||||
| 甘精胰岛素 | ≥6 | 2~4 | 8~12 | 22~24 |
| 地特胰岛素 | ≥6 | 1~2 | 4~7 | 20~24 |
注意事项:胰岛素的不良反应主要是低血糖及体重增加。高胰岛素血症和高血糖各自独立地与全因死亡及心血管死亡相关联[16],胰岛素治疗可能会增加高胰岛素血症的不良影响。
3.胰高糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA):指南推荐[2],如二甲双胍联合或不联合胰岛素治疗血糖无法控制达标,对≥10岁、没有甲状腺髓样癌或多发性内分泌腺瘤病史及家族史的青少年T2DM患者应考虑使用GLP-1RA。主要不良反应为胃肠道症状(恶心、腹泻、呕吐、便秘、腹痛、消化不良、厌食等)。
(1)利拉鲁肽(Liraglutide):2019年先后在美国和欧洲获批可用于10岁以上的T2DM患者。研究显示,利拉鲁肽(≤1.8 mg/d)+二甲双胍组26周平均HbA1c较基线水平降低0.64%、52周降低0.50%,而安慰剂+二甲双胍组26周HbA1c较基线增加0.42%,52周时增加0.80%。利拉鲁肽组降低FPG的效果优于安慰剂组,HbA1c达标(<7.0%)的比例几乎2倍于安慰剂组[17]。利拉鲁肽(3.0 mg)联合生活方式干预治疗56周时BMI标准差评分较基线的变化优于安慰剂组,估计差异-0.22(95%CI -0.37~-0.08;P=0.002)。利拉鲁肽组(113例)中有51例(43.3%)、安慰剂组(105例)中20例(18.7%)BMI降低≥5%;利拉鲁肽组33例(26.1%)、安慰剂组9例(8.1%)BMI降低≥10%。但胃肠道不良事件发生率较安慰剂组更高(分别为64.8%和36.5%)[18]。
(2)艾塞那肽(Exenatide)周制剂:2021年获美国FDA批准用于儿童T2DM(10~17岁)的治疗。在接受/未接受胰岛素/磺脲类药物治疗的10~18岁的T2DM青少年患者中,艾塞那肽2 mg组(59例)24周时在降低HbA1c方面优于安慰剂组(24例)(最小二乘均值变化分别为-0.36%和0.49%),组间差异为-0.85%(95%CI -1.51~-0.19;P=0.012);但受试者的上腹痛、腹胀、腹泻、消化不良、恶心和呕吐发生率更高,大多数属于轻度或中度,并在研究期间得到缓解[19]。
(3)度拉糖肽(Dulaglutide):美国FDA于2022年11月17日批准度拉糖肽注射液说明书修订用于辅助饮食和运动改善T2DM成人和10岁及以上儿童患者的血糖控制。推荐起始剂量为0.75 mg、1次/周皮下注射,若需额外血糖控制,在0.75 mg剂量至少4周后可增至推荐最大剂量1.5 mg、1次/周。
(4)司美格鲁肽(Semaglutide):2023年3月30日,欧洲药品管理局网站显示,司美格鲁肽用于12岁及以上青少年体重管理的上市申请获人用药品委员会推荐批准。推荐可用于≥12岁的肥胖和体重>60 kg的儿童青少年的体重管理,如果青少年患者在使用2.4 mg或最大耐受剂量12周后BMI没有降低>5%,则应停止治疗并重新评估。
4.其他药物在儿童青少年人群的研究进展:DINAMO研究表明,恩格列净能够在临床上显著降低青少年T2DM患者HbA1c水平,利格列汀适度降低HbA1c但差异未达到统计学意义,药物总体安全性良好[20]。另有研究显示,在标准治疗方案中加入达格列净,与安慰剂组比较,HbA1c水平与基线的变化差异并不显著,但严重低血糖的风险很低[21]。
2019美国儿科学会《儿科代谢和减重手术:证据、障碍和最佳实践》指南有以下变化:(1)增加了重度肥胖的儿科定义,使用超过第95百分位的百分比;(2)考虑Ⅱ级重度肥胖时,放宽了合并症标准;(3)若存在Ⅲ级重度肥胖,不再有特定适应证;(4)不再建议等到青少年线性生长完成后再手术。青少年减重手术的选择标准:(1)BMI 35~39 kg/m2或超过第95百分位者20%以上,同时有明显临床并发症,如合并T2DM、阻塞性睡眠呼吸暂停(阻塞性睡眠呼吸暂停低通气指数>5)、晚期非酒精性脂肪性肝炎、假性脑瘤、布朗特病、股骨头骨骺滑脱、胃食管反流病、高血压等;(2)BMI>40 kg/m2或超过第95百分位者40%以上,无合并症管理需求且无禁忌证[22]。
ADA 2023推荐对于有严重肥胖(BMI>35 kg/m2)且有HbA1c升高和(或)严重的共病的青少年,可由经验丰富的外科医师进行手术治疗,多学科团队包括外科医师、内分泌医师、注册营养师、行为健康专家和护士。
青少年减重手术纵向评估研究和青少年病态肥胖手术研究随访发现,总队列平均减重27%,Roux-en-Y胃旁路术(Roux-en Y gastric bypass,RYGB)组减重28%,袖状胃切除术组减重26%。RYGB对青少年T2DM及高血压缓解率显著高于成人(T2DM缓解率分别为86%和53%,P=0.03;高血压缓解率分别为68%和41%,P<0.001),还可改善甘油三酯、高密度脂蛋白胆固醇、尿白蛋白排泄率。但与袖状胃切除术组相比,RYGB组青少年术后铁元素缺乏的发生率亦较高(分别为48%和29%,P=0.004),维生素D缺乏常见,且有降低骨密度风险[21]。
儿童及青少年T2DM较T1DM易更早出现糖尿病并发症,指南推荐管理见表2[2]。
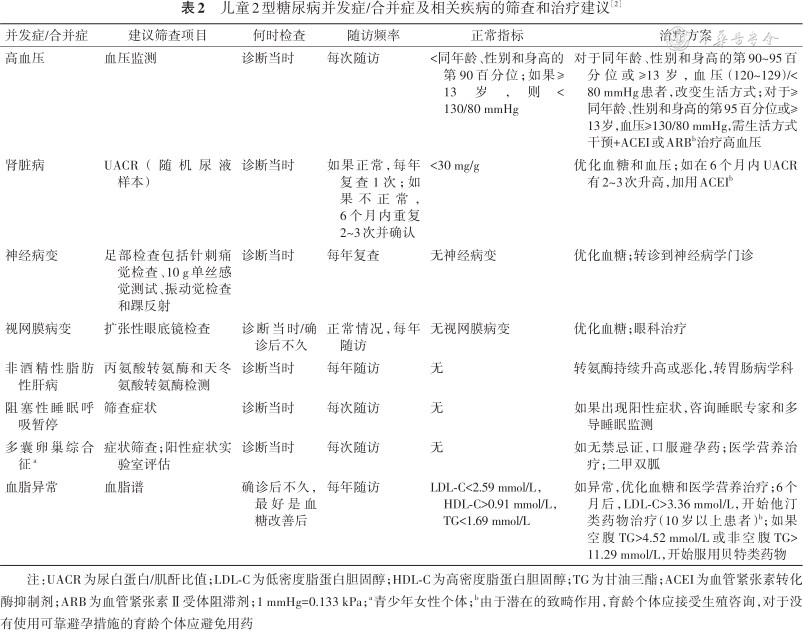
儿童2型糖尿病并发症/合并症及相关疾病的筛查和治疗建议[2]
儿童2型糖尿病并发症/合并症及相关疾病的筛查和治疗建议[2]
| 并发症/合并症 | 建议筛查项目 | 何时检查 | 随访频率 | 正常指标 | 治疗方案 |
|---|---|---|---|---|---|
| 高血压 | 血压监测 | 诊断当时 | 每次随访 | <同年龄、性别和身高的第90百分位;如果≥13岁,则<130/80 mmHg | 对于同年龄、性别和身高的第90~95百分位或≥13岁,血压(120~129)/<80 mmHg患者,改变生活方式;对于≥同年龄、性别和身高的第95百分位或≥13岁,血压≥130/80 mmHg,需生活方式干预+ACEI或ARBb治疗高血压 |
| 肾脏病 | UACR(随机尿液样本) | 诊断当时 | 如果正常,每年复查1次;如果不正常,6个月内重复2~3次并确认 | <30 mg/g | 优化血糖和血压;如在6个月内UACR有2~3次升高,加用ACEIb |
| 神经病变 | 足部检查包括针刺痛觉检查、10 g单丝感觉测试、振动觉检查和踝反射 | 诊断当时 | 每年复查 | 无神经病变 | 优化血糖;转诊到神经病学门诊 |
| 视网膜病变 | 扩张性眼底镜检查 | 诊断当时/确诊后不久 | 正常情况,每年随访 | 无视网膜病变 | 优化血糖;眼科治疗 |
| 非酒精性脂肪性肝病 | 丙氨酸转氨酶和天冬氨酸转氨酶检测 | 诊断当时 | 每年随访 | 无 | 转氨酶持续升高或恶化,转胃肠病学科 |
| 阻塞性睡眠呼吸暂停 | 筛查症状 | 诊断当时 | 每次随访 | 无 | 如果出现阳性症状,咨询睡眠专家和多导睡眠监测 |
| 多囊卵巢综合征a | 症状筛查;阳性症状实验室评估 | 诊断当时 | 每次随访 | 无 | 如无禁忌证,口服避孕药;医学营养治疗;二甲双胍 |
| 血脂异常 | 血脂谱 | 确诊后不久,最好是血糖改善后 | 每年随访 | LDL-C<2.59 mmol/L,HDL-C>0.91 mmol/L,TG<1.69 mmol/L | 如异常,优化血糖和医学营养治疗;6个月后,LDL-C>3.36 mmol/L,开始他汀类药物治疗(10岁以上患者)b;如果空腹TG>4.52 mmol/L或非空腹TG>11.29 mmol/L,开始服用贝特类药物 |
注:UACR为尿白蛋白/肌酐比值;LDL-C为低密度脂蛋白胆固醇;HDL-C为高密度脂蛋白胆固醇;TG为甘油三酯;ACEI为血管紧张素转化酶抑制剂;ARB为血管紧张素Ⅱ受体阻滞剂;1 mmHg=0.133 kPa;a青少年女性个体;b由于潜在的致畸作用,育龄个体应接受生殖咨询,对于没有使用可靠避孕措施的育龄个体应避免用药
建议每3个月评估1次血糖及HbA1c,结合患者使用药物的特点个体化监测血糖。对于胰岛素MDI或使用胰岛素泵的青少年T2DM患者,应提供实时持续葡萄糖监测或间歇扫描持续葡萄糖监测。
大多数T2DM儿童和青少年,合理的目标是HbA1c<7%。更严格的目标(HbA1c<6.5%)适合低血糖风险低或没有其他治疗不良反应的个体,包括短期的糖尿病和β细胞功能障碍较小和仅用生活方式或二甲双胍就能显著改善体重的患者。如果存在低血糖风险增加,HbA1c目标可放宽至<7.5%。
T2DM儿童及青少年患抑郁症风险高,严重影响儿童对糖尿病管理的依从性。ADA 2023建议:使用适合年龄的标准化和验证工具来筛查T2DM青年的糖尿病痛苦、抑郁症状和心理/行为健康,注意抑郁症和饮食紊乱的症状,必要时咨询心理健康专业人员;选择转食代糖或其他药物时,应考虑服药行为和药物对体重的影响;从青春期开始,孕前咨询应纳入常规糖尿病门诊就诊;在诊断时和诊断之后定期进行烟草、电子烟和酒精使用情况的筛查。
儿童及青少年T2DM是由胰岛素抵抗与β细胞功能减退共同导致的,胰岛β细胞功能衰减的速度比成人T2DM更快,药物治疗血糖控制失败率比成人高3~4倍,且易更早出现糖尿病并发症。许多患儿起病时即合并血脂异常、高血压、白蛋白尿、多囊卵巢综合征等[7]其他代谢异常。因此,精准诊断及治疗,努力在青少年β细胞功能发生显著恶化之前保留其功能是关键。随着基因诊断技术的发展,新型降糖药物如利拉鲁肽、艾塞那肽等的出现以及代谢手术的完善成熟,让我们有了更多治疗儿童青少年糖尿病的武器。健康的生活方式引导,合理地选择药物及代谢手术治疗,有效控制血糖的同时积极控制体重,治疗高血压、高血脂、非酒精性脂肪性肝病、多囊卵巢综合征等共病,预防糖尿病急、慢性并发症,关注高血糖和胰岛素抵抗/高胰岛素血症的不良影响,提高治疗达标率,是未来还需努力的方向。
闫孝永, 张林, 丁玲, 等. 从最新临床实践共识指南及临床研究看儿童和青少年2型糖尿病诊治进展[J]. 中华糖尿病杂志, 2023, 15(12): 1190-1195. DOI: 10.3760/cma.j.cn115791-20230628-00288.
所有作者声明无利益冲突



























