支气管哮喘(哮喘)是一种常见的慢性呼吸道疾病,其中5%~10%的患者为重度哮喘。重度哮喘给患者造成了沉重的生理、心理负担,随着不同种类生物制剂的问世,生物制剂治疗重度哮喘初步显示出一定的临床疗效。本文明确了重度哮喘的诊断标准、重度哮喘的分子表型,分析了生物制剂治疗重度哮喘的靶点和生物制剂能否治愈重度哮喘,并分析了长期使用生物制剂的安全性及风险。总之,生物制剂为重度哮喘患者带来了更为精准、更为个体化的治疗选择。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(哮喘)是一种常见的慢性呼吸道疾病,全球有超过3.5亿人患有哮喘,其中5%~10%的患者为重度哮喘[1,2]。重度哮喘不仅给患者造成了沉重的生理、心理负担,同时也给社会造成了巨大的经济负担。近年来,随着不同种类生物制剂的问世,生物制剂治疗重度哮喘初步显示出一定的临床疗效,丰富了重度哮喘的治疗管理模式,也为重度哮喘的有效治疗展现出曙光。为此,本文拟就生物制剂治疗重度哮喘方面,提出一些个人的观点,期望合理有效地使用生物制剂,逐步迈向哮喘精准化与个体化治疗。
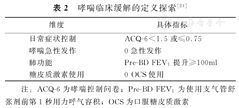
目前国内外对于重度哮喘的定义不尽相同。2020年ATS/ERS指南和2023年全球哮喘防治创议(Global Initiative for Asthma,GINA)指南中[1,2],重度哮喘的定义是需要用高剂量吸入性糖皮质激素联合长效β2受体激动剂(inhaled glucocorticoids combined/long-acting beta-2 receptor agonists,ICS/LABA)才能维持"控制",或尽管采用了这种疗法仍表现为"未控制"的哮喘。我国2020年的哮喘防治指南中,重度哮喘的定义是指在过去的1年中,需要使用GINA 2020建议的第4级或第5级哮喘药物治疗,才能够维持控制或即使在上述治疗下仍表现为"未控制"的哮喘[3]。
依据上述不同的定义判断重度哮喘,可能会导致重度哮喘的过早诊断或延迟诊断,2023年GINA指南强调诊断重度哮喘必须先进行高剂量ICS/LABA治疗;而2020年我国哮喘防治指南强调的第4级或第5级哮喘药物治疗,其中包括中剂量ICS/LABA治疗,这样就会给临床医生造成困惑,如果中剂量ICS/LABA勉强控制甚至不能控制,究竟是增加吸入ICS/LABA剂量还是诊断为重度哮喘,进而寻求其他治疗方式。
有研究表明,哮喘的控制效果与吸入ICS/LABA的剂量呈正相关,一项纳入人群包括轻度、中度和重度哮喘的青少年和成人meta分析表明ICS剂量的增加可以增加哮喘患者的获益,并且建议如果患者哮喘控制不充分,应加用大剂量的ICS[4]。但也有人认为,虽然ICS的量效呈正相关,中重度哮喘患者可能需要更高剂量的ICS,但是中高剂量的ICS又处于量效曲线的平坦部分,即对于已使用中剂量以上哮喘患者增加ICS剂量后获益增加较少,而长期使用导致的全身性不良反应会增加,因此对中剂量ICS/LABA治疗不佳时,该如何合理地升级治疗仍是一个问题。考虑到目前阶段生物制剂价格普遍昂贵,个人或医保难以完全承受,且临床疗效和安全性尚未得到普遍公认,笔者认为此时重度哮喘应依据2023年GINA指南较为合适,即已经使用了高剂量ICS/LABA仍表现为勉强控制甚至为"未控制"的哮喘,当然对此也可以进行讨论,重度哮喘的识别和诊断未来还应结合我国的临床实际。
哮喘是一种异质性疾病,哮喘表型可作为识别哮喘患者群体的一种方式,为患者提供更为个体化更精准的治疗与管理。根据哮喘的分子通路,哮喘表型可分为T2型哮喘和非T2型哮喘。大多数重症哮喘患者都有T2型炎症,一方面通常是由适应性免疫系统在识别过敏原时产生的IL-4、IL-5和IL-13等细胞因子为特征,另一方面也可以由固有免疫系统被病毒、细菌或刺激物激活并产生IL-33、IL-25和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)等为特征。T2型炎症通常以嗜酸粒细胞(eosinophilic granulocyte,EOS)升高或呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)升高为主要特征,并可能伴有IgE升高,而非T2型炎症通常以中性粒细胞升高为特征[5]。
研究表明,EOS是哮喘发生、发展过程中的关键效应细胞,在哮喘的气道高反应性与气道重塑病理过程中发挥重要作用[6,7]。EOS表型是重度哮喘中最为常见的表型。全球重度哮喘专家共识提出,临床上可以根据外周血EOS计数≥300/μl或外周血EOS计数≥150/μl并结合一些临床特征(如鼻息肉,FeNO≥25 ppb,成年发病等)判定EOS表型的重度哮喘[8]。此外数项研究表明,诱导痰EOS比例可以作为EOS表型重度哮喘识别标准,不同界值(2%、2.5%或3%)均有临床研究报道[9]。
需要注意的是,虽然重度哮喘多表现为T2型炎症,但也有部分为非T2型炎症,该类型哮喘患者EOS比例正常或增高不明显,缺乏2型炎症的体征和标志物,表现为中性粒细胞或寡粒细胞炎症,并且这类患者本身就对ICS治疗的反应较差[10],因此临床医生很容易根据重度哮喘定义而判断为重度哮喘。过分强调T2型炎症,可能会导致临床医生认知偏差,造成对其他非T2型炎症哮喘认识不充分、不深入,也会影响对疾病的判断和诊断。对于非T2型重度哮喘治疗,目前已有一些探索性研究,比如低剂量大环内酯类药物的使用、一些针对中性粒细胞的生物制剂的开发(MG-ZG122)等,可能有望于提高非T2型炎症的疗效[11]。
自2003年奥马珠单抗治疗中重度过敏性哮喘在美国FDA获批上市,众多生物制剂陆续在国际上获批用于治疗重度哮喘。目前国际上获批的生物制剂有抗IgE单克隆抗体(Omalizumab,奥马珠单抗),抗IL-4R单克隆抗体(Dupilumab,度普利尤单抗),抗IL-5单克隆抗体(Mepolizumab,美泊利单抗),抗IL-5R单克隆抗体(Benralizumab,本瑞利珠单抗)和抗TSLP单克隆抗体(Tezepelumab)。
奥马珠单抗是重组人源化单克隆抗体,奥马珠单抗靶向拮抗IgE,降低血浆游离IgE水平,影响变态反应的启动和发生,能有效减少ICS及急救药物使用量,降低住院率,适用于过敏性哮喘的治疗。Tezepelumab靶向针对TSLP,可阻断诱导T2型炎症的关键上皮细胞因子TSLP,TSLP可触发下游促炎通路的复杂级联反应,可以为所有重度哮喘患者带来获益,不受EOS表型影响。IL-4与IL-4Ra受体亚链相互作用并刺激IgE和气道重塑介质的产生。度普利尤单抗与IL-4Rα结合,抑制IL-4与IL-13介导的炎症反应。IL-5在EOS的产生、增殖及活化方面起重要作用。美泊利珠单抗与EOS表面表达的IL-5受体复合物结合,阻断IL-5的生理效应。本瑞利珠单抗直接与IL-5Rα结合,通过抗体依赖细胞介导的细胞毒性作用减少EOS。IL-13是辅助性T细胞2型炎症的中心环节,与IgE产生、黏液生成、气道高反应、支气管纤维化等有关。Tralokinumab是IgG4人源化单克隆抗体,能阻断IL-13与其受体结合。上述这些单抗均可不同程度降低EOS的比例,改善哮喘患者症状[12,13,14]。
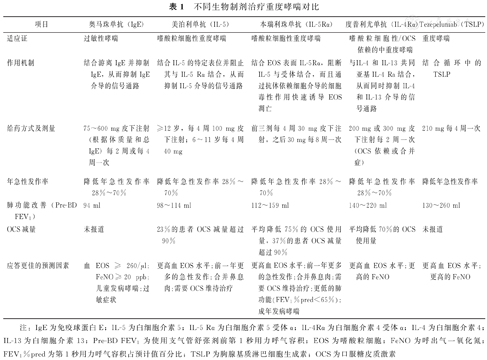
在使用生物制剂治疗哮喘之前,临床医生应充分了解生物制剂发挥作用的细节,究竟是改善症状、恢复肺功能?还是减少急性发作?亦或是降低全身糖皮质激素的用量?从患者的感受来讲,可能改善症状和肺功能更为重要,但是目前相关的研究结果虽然令人鼓舞,但并非能解决所有值得关注的问题。有关临床研究证据显示生物制剂治疗重度哮喘有较好的疗效和安全性,但与临床医生的关注和患者的需求还有一定的距离[15,16,17,18,19,20,21,22,23]。总之,生物制剂都可以有效降低重度哮喘患者的急性发作率,一定程度改善患者的肺功能,降低患者的住院率,减少患者口服激素的使用,同时改善患者的生活质量(表1)。
不同生物制剂治疗重度哮喘对比
不同生物制剂治疗重度哮喘对比
| 项目 | 奥马珠单抗(IgE) | 美泊利单抗(IL-5) | 本瑞利珠单抗(IL-5Rα) | 度普利尤单抗(IL-4Rα) | Tezepelumab(TSLP) |
|---|---|---|---|---|---|
| 适应证 | 过敏性哮喘 | 嗜酸粒细胞性重度哮喘 | 嗜酸粒细胞性重度哮喘 | 嗜酸粒细胞性/OCS依赖的中重度哮喘 | 重度哮喘 |
| 作用机制 | 结合游离IgE并抑制IgE,从而抑制IgE介导的信号通路 | 结合IL-5的特定表位并阻止其与IL-5 Rα结合,从而抑制IL-5介导的信号通路 | 结合EOS表面IL-5Rα,阻断IL-5与受体结合,而且通过抗体依赖细胞介导的细胞毒性作用快速诱导EOS凋亡 | 与IL-4和IL-13共同亚基IL-4 Ra结合,从而同时抑制IL-4和IL-13介导的信号通路 | 结合循环中的TSLP |
| 给药方式及剂量 | 75~600 mg皮下注射(根据体质量和总IgE)每2周或每4周一次 | ≥12岁,每4周100 mg皮下注射;6~11岁每4周40 mg | 前三剂每4周30 mg皮下注射,之后30 mg每8周一次 | 200 mg或300 mg皮下注射每2周一次(OCS依赖或合并症) | 210 mg每4周一次 |
| 年急性发作率 | 降低年急性发作率28%~70% | 降低年急性发作率28%~70% | 降低年急性发作率28%~70% | 降低年急性发作率28%~70% | 降低年急性发作率 |
| 肺功能改善(Pre-BD FEV1) | 94 ml | 98~114 ml | 112~159 ml | 140~220 ml | 130~260 ml |
| OCS减量 | 未报道 | 23%的患者OCS减量超过90% | 平均降低75%的OCS使用量,37%的患者OCS减量超过90% | 平均降低70%的OCS使用量 | 未报道 |
| 应答更佳的预测因素 | 血EOS≥260/μl;FeNO≥20 ppb;儿童发病哮喘;过敏症状 | 更高血EOS水平;前一年更多的急性发作;合并鼻息肉;需要OCS维持治疗 | 更高血EOS水平;前一年更多的急性发作;合并鼻息肉;需要OCS维持治疗;更低的肺功能(FEV1%pred<65%);成年发病哮喘 | 更高血EOS水平;更高的FeNO | 更高血EOS水平;更高的FeNO |
注:IgE为免疫球蛋白E;IL-5为白细胞介素5;IL-5 Rα为白细胞介素5受体α;IL-4Rα为白细胞介素4受体α;IL-4为白细胞介素4;IL-13为白细胞介素13;Pre-BD FEV1为使用支气管舒张剂前第1秒用力呼气容积;EOS为嗜酸粒细胞;FeNO为呼出气一氧化氮;FEV1%pred为第1秒用力呼气容积占预计值百分比;TSLP为胸腺基质淋巴细胞生成素;OCS为口服糖皮质激素
各生物制剂的临床研究显示,本瑞利珠单抗降低重度哮喘患者的年急性发作率高达28%~70%,美泊利单抗、度普利尤单抗、奥马珠单抗和Tezepelumab分别降低年急性发作率达32%~53%,48%~59%,26%和39%~58%[20,21,24,25,26,27,28,29,30]。
生物制剂可显著改善重度哮喘患者的肺功能情况。奥马珠单抗可以提升肺功能94 ml,而美泊利单抗、度普利尤单抗、本瑞利珠单抗和Tezepelumab可分别提升肺功能达98~114 ml,140~220 ml,112~159 ml和130~260 ml,度普利尤单抗及Tezepelumab在肺功能改善方面相比其他生物制剂具有一定优势。
生物制剂可以显著降低重度哮喘的口服激素使用量,降低因口服激素带来的不良反应。一项系统综述及荟萃分析显示,本瑞利珠单抗可以降低患者75%的口服激素使用量,37%的患者口服激素能减量超过90%;度普利尤单抗可以降低患者70%的口服激素使用量;美泊利单抗治疗,23%的患者口服激素减量超过90%。
在降低急性发作方面,本瑞利珠单抗、度普利尤单抗、美泊利单抗及Tezepelumab相比奥马珠单抗在降低年急性发作率上具有一定优势。值得关注的是,本瑞利珠单抗是一种可以同时降低重度哮喘患者的口服糖皮质激素(oral contraceptive steroid,OCS)和其他背景控制药物的生物制剂,同时用药间隔较其他生物制剂更长,可显著提高患者的生活质量和依从性[20]。
目前尚未有证据显示生物制剂能够治愈重度哮喘,因此学者提出,"哮喘控制"未来应以临床缓解作为治疗目标。针对哮喘患者,临床缓解的定义应兼顾患者症状控制、肺功能、急性发作以及口服激素使用四大方面[24](表2)。近年来生物制剂治疗重度哮喘是否可以达到临床缓解,即广义上的治愈成为了一大研究热点。在一项意大利学者的回顾性研究中,其对使用奥马珠单抗、美泊利单抗、本瑞利珠单抗以及度普利尤单抗治疗的重度哮喘患者治疗至少12个月后是否达到临床缓解进行了分析[31]。研究表明,本瑞利珠单抗治疗后,35.8%的患者达到了临床缓解。其他3种生物制剂治疗后,也分别有21.8%~23.6%的患者达到了临床缓解。
已报道的生物制剂注册临床研究与真实世界数据显示,生物制剂治疗重度哮喘的总体安全性良好。例如,在本瑞利珠单抗长达5年的随访中,本瑞利珠单抗长期不良事件发生率为28.5~32.4次/100人年,严重不良事件发生率为6.3~8.4次/100人年,与安慰剂组相似[20]。最常见的不良反应包括鼻窦炎、上呼吸道感染、过敏性鼻炎等,未发现新报告的蠕虫与寄生虫感染。肿瘤发生率较低,仅为0.5~0.7次/100人年。在长达4.5年的长期随访后,美泊利单抗的安全性数据显示不良事件发生率为3 688次/1 000人年[32]。在长达96周的随访过后,度普利尤单抗的安全性数据显示与治疗相关的不良事件发生率为130次/100人年[19]。值得一提的是,度普利尤单抗的多项临床研究表明,4%~25%的患者外周血EOS在度普利尤单抗治疗4~12周之间会短暂升高[33]。这种一过性EOS数升高可能增加患者结膜炎、面部红斑等不良反应的风险[34]。
由于生物制剂治疗哮喘的时间不长,有些针对IgE的生物制剂可能会造成IgE下降。比如,奥马珠单抗作为一种重组人源化抗IgE单克隆抗体,可有效降低IgE水平,这有可能导致寄生虫感染的发病率或严重程度的增加。还需要注意的是,奥马珠单抗治疗后可能会发生罕见的急性全身过敏反应,但是其机制尚不清楚。此外,因为生物制剂导致的血液中EOS数量的降低,也会导致寄生虫或者其他感染甚至恶性肿瘤的发生。在SIROCCO和CALIMA哮喘加重研究中,有报道在使用贝那利珠单抗期间有些患者出现了新生恶性肿瘤,但是大多先前也接受过安慰剂治疗,并且整体评估其恶性肿瘤急性加重的总体发生率较低(<1%)。进一步对约1 600例哮喘患者(其中约1 000例持续暴露于贝那利珠单抗长达2年)和约2 700例COPD患者(暴露约1年)的综合分析表明,贝那利珠单抗治疗导致的EOS耗竭不会增加感染或恶性肿瘤的风险[35]。
总而言之,尽管目前生物制剂在哮喘及其他炎症性疾病中都有着很大程度的安全性,但是由于生物制剂治疗哮喘的时间不长,例数相对有限,其近期及远期安全性还有待进一步地证实,如何在哮喘中抓住"主要矛盾",通过使用生物制剂控制哮喘患者症状,又能同时减少不良安全事件的发生,仍需要更多病例及更长随访时间的观察。
生物制剂为重度哮喘患者带来了更为精准、更为个体化的治疗选择。未来随着更多生物制剂的上市,需要更多临床队列研究来帮助临床医生更好的选择合适的治疗药物。
作者声明无利益冲突