
近年来随着免疫缺陷人群的不断扩大,真菌感染成为威胁人类健康的重要因素。同样,儿童中由于血液病、恶性肿瘤使用免疫抑制剂和广谱抗菌药物等而处于免疫抑制状态的患儿数量增多,使得儿童真菌感染总体死亡率仍较高,且显示出非白念珠菌和曲霉菌感染高发的趋势,真菌感染是导致危重症儿童死亡的重要原因之一。现介绍总结儿童侵袭性真菌感染的流行病学特征、诊断和治疗策略,以期使儿童真菌感染得到临床更多的重视,减少儿童侵袭性真菌感染的发生及改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
真菌感染性疾病根据感染部位的不同可以分为侵袭性真菌感染(invasive fungal infections,IFI)和浅表真菌感染,全球每年真菌感染人数达亿次以上[1],仍是免疫抑制患者和住院患者最严重的并发症之一,极大地影响了患者的预后。而近年来随着医疗干预手段的不断增加、广谱抗菌药物和糖皮质激素的广泛应用以及器官移植和深部置管技术的发展,真菌机会感染风险显著增加,其中儿童也占有相当的比例,尤其是新生儿本属于免疫低下人群。儿童真菌感染现状与成人相比具有差异,治疗也有所不同,现主要对儿童IFI的流行病学、诊断方法及治疗方案进行介绍总结,以提高临床医师对儿童真菌感染的认识,减少真菌感染对儿童健康造成的威胁。
近年来具有真菌感染风险的患者显著增加,面临真菌感染风险的人群广泛,使得了解其流行病学特征具有重要意义。儿童侵袭性肺部真菌感染临床实践专家共识(2022版)[2]指出,应高度警惕IFI发生的高风险儿童,主要包含:(1)原发性免疫缺陷病(primary immunodeficiency,PID);(2)接受造血干细胞移植(hematopoietic stem cell transplantation,HSCT);(3)血液恶性肿瘤;(4)发生移植物抗宿主病;(5)中性粒细胞绝对计数≤0.5×109/L,持续时间≥10 d;(6)原发病使用糖皮质激素的儿童患者;(7)长期侵入性置管;(8)其他重症病毒感染的儿童患者。
IFI的流行病学数据根据不同的地区、人群、基础疾病等有较大差异[3]。不同国家地区各自针对不同类型基础疾病的儿童患者进行了IFI发生率和死亡率的具体研究,现对近5年的相关研究数据进行整理,见表1[4,5,6,7,8,9,10,11,12,13,14]。
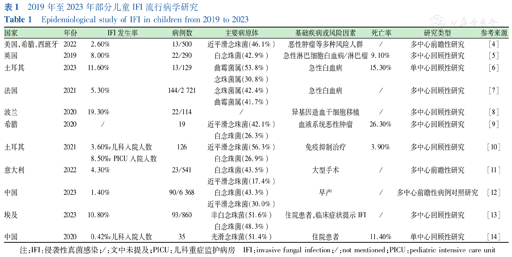
2019年至2023年部分儿童IFI流行病学研究
Epidemiological study of IFI in children from 2019 to 2023
2019年至2023年部分儿童IFI流行病学研究
Epidemiological study of IFI in children from 2019 to 2023
| 国家 | 年份 | IFI发生率 | 病例数 | 主要病原体 | 基础疾病或风险因素 | 死亡率 | 研究类型 | 参考来源 |
|---|---|---|---|---|---|---|---|---|
| 美国,希腊,西班牙 | 2022 | 2.60% | 13/500 | 近平滑念珠菌(46.1%) | 恶性肿瘤等多种风险人群 | / | 多中心前瞻性研究 | [4] |
| 英国 | 2019 | 8.00% | 22/290 | 白念珠菌(42.9%) | 急性淋巴细胞白血病/淋巴瘤 | 9.10% | 多中心回顾性研究 | [5] |
| 土耳其 | 2023 | 11.60% | 13/129 | 曲霉菌属(53.8%) | 急性白血病 | 15.30% | 单中心回顾性研究 | [6] |
| 念珠菌属(30.8%) | ||||||||
| 法国 | 2021 | 5.30% | 144/2 721 | 念珠菌属(42.4%) | 急性白血病 | / | 多中心回顾性研究 | [7] |
| 曲霉菌属(41.7%) | ||||||||
| 波兰 | 2020 | 19.30% | 22/114 | / | 异基因造血干细胞移植 | / | 多中心回顾性研究 | [8] |
| 希腊 | 2020 | / | 19 | 近平滑念珠菌(42.1%) | 血液系统恶性肿瘤 | 26.30% | 多中心回顾性研究 | [9] |
| 白念珠菌(26.3%) | ||||||||
| 土耳其 | 2021 | 3.60‰儿科入院人数 | 126 | 近平滑念珠菌(56.3%) | 免疫抑制治疗 | 3.90% | 多中心回顾性研究 | [10] |
| 8.50‰ PICU入院人数 | 白念珠菌(26.9%) | |||||||
| 意大利 | 2022 | 4.30% | 23/541 | 白念珠菌(43.5%) | 大型手术 | / | 多中心前瞻性研究 | [11] |
| 近平滑念珠菌(17.4%) | ||||||||
| 中国 | 2023 | 1.40% | 90/6 368 | 白念珠菌(43.3%) | 早产 | / | 多中心前瞻性病例对照研究 | [12] |
| 近平滑念珠菌(30.0%) | ||||||||
| 埃及 | 2023 | 10.80% | 93/860 | 非白念珠菌(51.6%) | 住院患者,临床症状提示IFI | / | 多中心回顾性研究 | [13] |
| 白念珠菌(48.3%) | ||||||||
| 中国 | 2020 | 0.42‰儿科入院人数 | 35 | 光滑念珠菌(51.4%) | 住院患者 | 11.40% | 单中心回顾性研究 | [14] |
注:IFI:侵袭性真菌感染;/:文中未提及;PICU:儿科重症监护病房 IFI:invasive fungal infection;/:not mentioned;PICU:pediatric intensive care unit
在高风险儿童中,IFI发病率根据疾病类型和治疗方案不同存在差异,使相关研究的数据难以进行直接比较,但总体来说血液性疾病、接受肿瘤化疗或HSCT的儿童IFI发生率较高。患者死亡率也很大程度取决于感染情况和基础疾病的复杂程度,且随着治疗手段的进步,儿童IFI患者死亡率呈现明显下降的趋势[15],但这一改善主要体现在念珠菌血症的患儿中。侵袭性霉菌病(invasive mycosis disease,IMD)的儿童死亡率仍较高,可达到50%左右[16]。
引起儿童IFI的主要病原体近年来有所变化。念珠菌属是美国和欧洲儿童及新生儿医院获得性血流感染中最常见的真菌病原体[17],对所有儿科住院患者的多中心前瞻性研究显示白念珠菌仍是导致儿童IFI最常见的病原体,但非白念珠菌(包括近平滑念珠菌、光滑念珠菌等)的分离率已达到半数以上[18],其中近平滑念珠菌占比可以达到所有念珠菌血症的14%~30%,克柔念珠菌、热带念珠菌等在儿童中则相对少见[17]。IMD中曲霉菌属是主要的病原体,欧洲临床微生物学与感染病学会的研究数据显示,烟曲霉和黄曲霉是造成新生儿和儿童侵袭性曲霉病(invasive aspergillosis,IA)最主要的病原体,约占所有儿童IA病例的19.8%和5.3%[19]。
儿童真菌感染的早期诊断具有一定难度,尤其是具有高死亡率的IFI感染,临床表现特异性较低,可能只有发热症状,并与其他基础疾病(如白血病、恶性肿瘤等)同样具有的发热症状以及治疗导致的应激性发热难以区分。IFI分为真菌血症、器官真菌病、播散性真菌感染等,在易感儿童中以呼吸道和黏膜感染多见[20]。根据《儿童侵袭性肺部真菌感染临床实践专家共识(2022)》[2]的诊断标准,IFI诊断包括确诊、临床诊断及拟诊3个层次:(1)确诊:宿主因素+临床证据+组织病理学和/或真菌微生物学证据;(2)临床诊断:宿主因素+临床证据+临床诊断意义微生物学证据;(3)拟诊:宿主因素+临床证据。
传统的检测手段如直接镜检和真菌培养仍是诊断真菌感染的金标准,但阳性率较低,阴性结果不能排除真菌感染。无菌部位如脑脊液镜检发现酵母或菌丝具有重要的临床意义,呼吸道分泌物中出现分隔菌丝也高度提示侵袭性霉菌感染。血培养是诊断念珠菌血症的金标准,其灵敏度为21.0%~71.0%[21],但同样存在阳性率低、耗时长等问题,不利于真菌感染的早期诊断。
血清学诊断作为传统诊断方法的补充,主要包括抗原和抗体检测两部分,对早期感染的诊断意义较大,主要包括用于检测侵袭性曲霉感染的半乳甘露聚糖(galactomannan,GM)试验和用于检测泛真菌感染的G试验。GM是曲霉菌属菌丝顶端释放的多糖细胞壁成分,且其释放量与感染的严重程度呈正相关,可用于侵袭性曲霉感染的早期诊断[22]。其检测样本可以是血清、血浆、支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和脑脊液,上述样本GM试验阳性被视为IFI的病原学诊断标准之一,且儿童与成人适用同样的GM阈值[22]。Meta分析显示,儿童患者中GM试验的合并灵敏度为81%,特异度为88%,与成人中的数据相当[23];且已有研究验证了儿童患者BALF或脑脊液GM试验阳性较血清具有更好的灵敏性和特异性[24]。《第8届欧洲白血病感染会议:2020癌症或HSCT后儿童患者侵袭性真菌疾病的诊断、预防和治疗指南》中,推荐对感染高风险儿童进行每周2次的血清学GM检测[23]。但GM试验也存在一定的假阳性和假阴性率,应当与发热、免疫功能缺陷等临床特征相结合。G试验检测的目标分子是1,3-β-D-葡聚糖,该成分广泛存在于除毛霉菌和隐球菌以外的其他所有真菌中。G试验检测仅适用于血清样本,可用于IFI的早期诊断,对真菌感染的高危患者每周2次动态监测可以提高其特异性,且可以协助诊断突破性IA。与GM试验相比G试验干扰因素更多,且有文献报道称,健康儿童的1,3-β-D-葡聚糖高于健康成人[25],儿童G试验临界值尚无统一的专家共识,不应作为儿童IFI的诊断依据[23],但其动态监测仍有辅助诊断的意义。血清学检测方法简便且灵敏度高,但无法明确菌种及药敏特征,对于易感人群应当进行血清标志物的连续监测,以尽早采取抗真菌治疗。
随着分子生物诊断学的发展,基质辅助激光解吸电离飞行时间质谱、等温扩增技术、全基因组测序等为真菌诊断提供了更多的选择。2020年欧洲指南再次明确了聚合酶链反应(polymerase chain reaction,PCR)检测和DNA测序在IFI确诊中的价值[26]。特别是曲霉PCR在诊断IA中具有重要意义,对于严重免疫功能低下患者疑似存在IA时,建议应用血液、血清或BALF进行曲霉PCR检测作为评估及诊断的一部分。对于其他IFI,有研究验证了基于PCR方法在血清/血浆中检测多重真菌核酸的新技术,其特异度为43%~85%,敏感度为11%~80%[27],《第8届欧洲白血病感染会议:2020癌症或HSCT术后儿童患者侵袭性真菌疾病的诊断、预防和治疗指南》中将血清真菌核酸检测作为诊断B级推荐,BALF和组织标本中的真菌核酸检测为诊断A级推荐[23]。
宏基因组二代测序技术(metagenomic next generation sequencing,mNGS)是基于下一代基因测序技术的一种应用,在IFI病原学诊断中的临床应用范围包括免疫功能低下或重症IFI、疑难IFI和经验治疗无效的IFI。mNGS在罕见及新发病原体诊断中已经发挥出了明显的优势,是病原诊断的重要补充手段,且在儿童感染性疾病中的应用价值已得到验证[28]。mNGS的优势在于不需要培养,节省时间,在某些类型真菌的检测敏感性高于传统方法,且覆盖罕见真菌和其他类型病原体。但其不足在于对采样要求较高,真菌基因组数据库不全,需要区分定植和感染等。目前已有mNGS运用于临床的具体指南和报告解读流程,根据报告结果应给出相应的解读[29]:(1)高致病性真菌:如曲霉、马尔尼菲篮状菌、新生隐球菌,在大部分样本中均可视为病原体。(2)条件致病菌:如念珠菌属,在外周血、脑脊液等无菌体液样本中可能是病原体,但在痰液、BALF、尿液中可能是共生菌。(3)对于免疫缺陷患者,常见定植菌也可能是造成感染的病原体,应结合测序质量和临床症状综合分析。若mNGS结果符合患者的临床表现和其他实验室检查,推荐根据mNGS结果指导临床决策。若患者mNGS结果阳性且符合临床表现,但缺乏除mNGS结果外的其他实验室支持证据,应进一步完善其他实验室检查加以验证,不能仅根据mNGS结果进行诊断[30]。
对于真菌感染高危人群,预防是首要任务。IFI高风险的儿童患者(通常指发病率≥10%)均应采取一定的预防治疗措施,且患病概率越高,预防性治疗获益程度越大[19]。IFI高风险的儿童主要包括上文所述疾病类型患者,且年龄>10岁,低中性粒细胞计数,以及同时进行抗病毒治疗均为儿童患者发生IFI的高风险因素,应及时进行预防性抗真菌措施[31]。《2012欧洲临床微生物与感染病学会(ESCMID)儿童念珠菌病诊断和管理指南:新生儿及儿童因念珠菌引起的侵袭性感染的预防与处理》中推荐儿童预防念珠菌血症比较适合的药物是米卡芬净和伏立康唑(A-Ⅰ),氟康唑也被推荐用于预防性治疗(A-Ⅰ),但仅适用于发生IMD概率较低的患者[32]。对于IA,ESCMID和欧洲医学真菌学联盟(European Confederation of Medical Mycology,ECMM)联合制定的临床指南:《ESCMID-ECMM指南:新生儿与儿童IA诊断和管理指南(2019)》推荐使用泊沙康唑和伏立康唑(A-Ⅱ)进行预防治疗[19]。一项纳入了560例HSCT儿童的随机对照试验结果表明,卡泊芬净与三唑类药物在用于预防IFI发生时差异无统计学意义[33],具体用药可以根据院内真菌流行及药敏情况而定,预防治疗的疗程长短也应视患者情况是否改善而定,如患者临床指标改善且免疫功能重建则可终止预防治疗[34]。
经验治疗针对尚未确定诊断者,主要包括出现不明原因发热等临床IFI症状的高危患儿。由于真菌感染的诊断具有一定难度,而延误治疗又将大大提高患者死亡概率,因此经验治疗显得更为重要。指南指出,在高危人群中出现不明原因发热,广谱抗生素治疗7 d无效或出现再发热的患者,应当开展经验性抗真菌治疗。经验性治疗通常选取抗菌谱较广的药物,临床研究证实两性霉素B脂质体(liposomal amphotericin B,L-AmB)可安全有效用于治疗新生儿与儿童念珠菌血症,且L-AmB可穿过血脑屏障,在中枢神经系统中具有抗真菌活性,L-AmB在儿童中肾毒性风险低于成人,因此2012 ESCMID新生儿/儿童念珠菌病指南推荐级别较高[32]。此外对于儿童患者的A-Ⅰ推荐药物还包括卡泊芬净和米卡芬净,指南中氟康唑虽然也被推荐用于治疗新生儿念珠菌,但其相对较窄的抗真菌谱可能会造成潜在限制,若患儿IA风险较低,则可应用氟康唑(B-Ⅱ)[32]。对于IA风险较高的患儿,ESCMID-ECMM指南表明卡泊芬净与L-AmB用于儿童血液肿瘤患者的IA经验性/抢先治疗疗效相当,推荐二者用于患儿IA经验性治疗(A-Ⅰ),特别是使用唑类药物预防的儿童,卡泊芬净与L-AmB应为其一线治疗方案[19]。
诊断驱动治疗是指针对临床确诊IFI患者的治疗,其药物主要根据推测的可能致病菌进行选择。与预防治疗和经验治疗相比,既能使患者尽早接受治疗,又减少了抗菌药物的过度使用,用药更为精确,是未来抗真菌治疗的趋势。其疗程应当涵盖血清学指标和/或影像学指标的改善。而目标治疗是指明确病原菌后,根据其种类和药敏特征以及患者具体情况,选择有针对性的药物,以控制临床症状,彻底清除病原体。目标性治疗是儿童深部真菌感染治疗的重点,真菌培养对寻找病原体、药敏检测和目标治疗意义重大,即使经验治疗和诊断驱动治疗取得较好疗效,在患者感染症状未完全缓解前,仍需反复查找真菌病原,以实现精准的针对性治疗。
儿童真菌感染的流行病学、诊断和治疗都取得了相当大的进展,从全球数据来看,过去近20年新生儿和儿童IFI的发病率总体呈下降趋势[15],但由于免疫缺陷等易感儿童的数量不断增加,以及真菌感染导致的高死亡率和沉重的医疗负担,使得儿童真菌感染依然是一个不容忽视的重要话题。诊断技术的发展和预防治疗的推广在很大程度上改善了儿童真菌感染的现状,但IFI的总体死亡率仍较高,且病原体呈现出非白念珠菌和曲霉菌高发的趋势,未来仍需进一步提高临床真菌感染的诊断能力,以更早地开展合适的治疗措施,从而进一步改善真菌感染儿童的生存率和预后。
所有作者均声明不存在利益冲突



























