
探讨双侧视盘肿胀(ODS)患者的病因构成及临床特征。
回顾性检索2017年1月至2021年6月北京同仁医院神经内科病房收治的所有初诊为双侧ODS患者的医疗记录,进行病因分类并获得人口统计学和临床信息,比较临床特征的差异。
共纳入双侧ODS 131例,男56例,女75例,年龄15~73(39±14)岁。双侧ODS最常见的病因是颅内压增高(56/131,42.7%),其次是视神经炎(ON)(40/131,30.5%),其他的病因包括血管性视神经病变(13/131,9.9%)、假性视乳头水肿(9/131,6.9%)、葡萄膜炎(6/131,4.6%)、中毒性视神经病(3/131,2.3%),不明原因占4/131(3.1%)。特发性颅高压(IIH)(43/56,76.8%)是视乳头水肿最常见的病因。在ODS两种主要病因颅内压增高和ON临床特征的比较中,发病年龄、性别、眼痛或头痛以及眼底盘周出血的发生率差异无统计学意义(均P>0.05),视敏度异常及低视力在ON组较颅内压增高组更常见[36/40(90%)比 33/56(58.9%),P=0.001;35/80(43.8%)比22/112(19.6%),P<0.001],重度视乳头水肿在颅内压增高组更常见[38/112(33.9%)比9/80(11.3%),P<0.001]。
虽然双侧ODS最常见的病因是颅内压增高,但也可由其他多种病因引发。在对中国患者的研究中,ON是需要重点鉴别的病因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
视盘肿胀(optic disc swelling,ODS)是眼眶或眼内疾病、颅内病变及全身性疾病的特征性表现。某些病变相对良性,但某些严重损害视力甚至危及生命[1]。术语“视盘肿胀”可用于任何原因引起的ODS。肿胀视盘、视盘水肿、视乳头水肿(papilledema,PE)、视乳头炎(optic neuritis,ON)及视盘隆起是经常用来描述ODS的术语。尽管“视乳头水肿”是指ODS,但它是特指由于颅内压增高引起的视盘水肿。一般认为双侧ODS多数为颅内压增高所致,但还有一部分常常与浸润性视神经病、中毒性视神经病以及恶性高血压等疾病相关[2]。识别双侧ODS的原因对于后续诊断及治疗至关重要。尽管在临床中经常遇到双侧ODS的病例,然而关于双侧ODS常见病因的回顾性研究很少,尤其国内尚罕见此方面的研究,本研究旨在分析北京同仁医院神经内科住院患者双侧ODS的病因构成及相应的临床特征。
回顾性检索首都医科大学附属北京同仁医院神经内科2017年1月至2021年6月的住院病历,确定在此期间发生双侧ODS的所有新患者(年龄≥14岁),并检索他们的医疗记录。本研究符合《赫尔辛基宣言》对伦理的要求,患者知情同意豁免。
1.资料收集:回顾性分析双侧ODS患者病因构成和临床特征。收集有关年龄、性别、视功能及ODS病因的数据。检查内容包括眼部及神经系统查体,眼科检查包括最佳矫正视力(best corrected visual acuity,BCVA)、瞳孔反应、彩色眼底相、视野检查(Humphrey视野分析仪)、视觉诱发电位(visual evoked potentials,VEP)、光学相干断层成像(optical coherence tomography,OCT)、部分完善了眼部B超及眼底荧光造影(fundus fluorescein angiography,FFA)等。实验室检查包括血常规、生化、红细胞沉降率、C-反应蛋白、感染指标筛查(梅毒、HIV、肝炎、结核等病原学)及免疫指标的筛查,包括抗核抗体(antinuclear antibody,ANA)、抗双链DNA(antidouble stranded-DNA,dsDNA)抗体、抗可溶性抗原(antiextractable nuclear antigen antibody,ENA)抗体,抗中性粒细胞包质抗体(antineutrophil cytoplasmic autoantibody,ANCA)、抗心磷脂(anticardiolipin,ACL)抗体,部分查了水通道蛋白4(aquaporin protein-4,AQP4)抗体、髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体、自身免疫胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体。腰椎穿刺检查包括脑脊液压力及脑脊液常规、生化、IgG合成率、寡克隆带(oligoclonal band,OB)、革兰染色、细胞学等检查,影像学检查包括头及视神经磁共振成像(MRI)、磁共振静脉造影(MRV),部分完善了全脑血管造影(DSA)检查。
2.病因分类:根据双侧ODS的诊断流程(图1)进行病因分类如下:颅内压增高引起PE[包括特发性颅高压(idiopathic intracranial hypertention,IIH)及继发性颅高压]、ON(根据病因分为特发性、感染性、自身免疫性视神经病;根据受累部位分为视神经乳头炎、视神经网膜炎)、血管性视神经病变(非动脉炎性前部缺血性视神经病、糖尿病视乳头水肿、视盘血管炎)、假性视乳头水肿[pesudopapilloedema,PPE,Leber遗传性视神经病(Leber′s hereditary optic neuropathy,LHON)、视盘玻璃疣、倾斜拥挤视盘]、葡萄膜炎[包括Vogt-小柳原田综合征(Vogt-Koyanagi-Harada syndrome,VKH综合征)]、药物及中毒代谢性视神经病(甲醇中毒、乙胺丁醇、胺碘酮中毒等)以及未知病因。分析各类病因的分布。
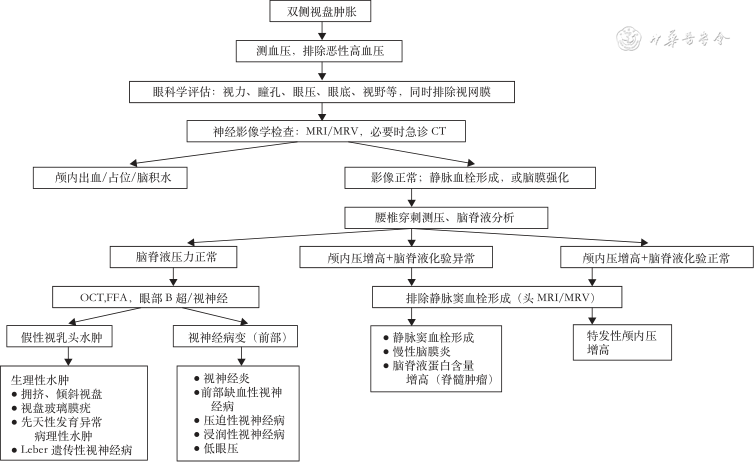

注:MRI为磁共振成像;MRV为磁共振静脉造影;OCT为光学相干断层成像;FFA为眼底荧光造影
3.主要疾病诊断方法:按照目前公认的相关诊断标准、指南、专家共识进行诊断,难以明确病因的双侧ODE,归为不明原因。(1)PE:诊断基于颅内压增高,而颅内压升高需通过存在颅内占位性病变或脑积水的神经影像学证实,神经影像学检查正常者随后腰椎穿刺检查脑脊液压力升高为颅内压升高[3]。(2)ON的临床诊断依据是急性视力下降(可能伴眼痛)、视野异常,存在相对性传入性瞳孔功能障碍(relative afferent pupillary disorder,RAPD)或VEP异常,除外其他视神经疾病及视觉中枢病变,排除其他眼科疾病[4, 5]。(3)PPE:诊断基于视盘的异常先天性抬高、小视杯,或通过B超,OCT或FFA检测到视盘玻璃疣的存在[6]。(4)LHON:可表现为视盘假性水肿,诊断基于外周血mtDNA致病性突变。(5)非动脉炎性前部缺血性视神经病变(non-arteritic anterior ischemic optic neuropathy,NA-AION):诊断需符合急性无痛性视力下降、典型的视野缺损、眼底视盘水肿常伴盘周出血、存在RAPD和(或)VEP异常,有全身及眼局部危险因素,除外其他视神经病变[7, 8]。(6)糖尿病性视乳头病变(diabetic papillopathy,DP):诊断需要同时存在糖尿病和视盘水肿以及排除其他可能疾病[6]。(7)葡萄膜炎:诊断需符合葡萄膜炎的眼部特征,如睫状充血、角质沉淀物、前房细胞、前房闪辉、虹膜改变及视盘水肿,并除外视盘水肿的其他病因[9]。葡萄膜炎常常是VKH综合征的部分表现。(8)VKH综合征:诊断标准需符合双眼受累、有神经或听觉体征、皮肤表现、无外伤或眼内手术史,无其他眼部疾病的临床或实验室证据[10]。(9)中毒代谢性视神经病的诊断需要有药物或毒素的暴露史,排除其他可引起双侧视神经病变的疾病。
4.视功能评估:BCVA检查采用标准对数视力表进行,参考我国低视力及盲的标准,根据BCVA测量结果分为≥0.8,≥0.3~<0.8,0.1~<0.3,0.05~<0.1,0.02~<0.05,无光感~<0.02(<0.3属低视力)。视野缺损是指在视野范围内,除生理盲点外出现的任何暗点,包括生理盲点扩大、中心暗点、弓形缺损、鼻侧阶梯、颞侧缺损、向心性视野缩小、弥漫性视野缺损等。评价PE的程度基于Frisen分级标准[11]分为0~5级。
采用Microsoft Office Excel 2013及SPSS 22.0 统计软件进行数据汇总和分析。正态分布计量资料用表示,组间比较采用t检验;计数资料的统计描述用例(%)表示,组间比较采用χ²检验。双侧检验,检验水准α=0.05。
共纳入双侧ODS患者131例,男56例,女75例,男女比例1∶1.34,年龄15~73(39±14)岁。20岁及以下10例(7.6%),21~50岁92例(70.2%),50岁以上29例(22.2%)。
1. 颅内压增高:双侧ODS最常见的病因是颅内压增高(56/131,42.7%),其中IIH(43/56,76.8%)是PE最常见的病因。继发性颅高压(13例)的病因包括静脉窦血栓形成(cerebral venous sinus thrombosis,CVST)(7例)、上矢状窦旁脑膜瘤(1例)、脑囊虫病(1例)、硬脑膜动静脉瘘(1例)、中毒性脑白质病(1例)、结缔组织病(1例)、脑膜炎(1例)。
43例IIH患者中有32例女性、11例男性。仅有肥胖一项危险因素者13例,仅贫血者10例,仅静脉窦狭窄者7例,肥胖合并贫血者1例,肥胖合并静脉窦狭窄1例,无明确危险因素者11例。1例CVST患者为梅毒感染及心磷脂抗体阳性,其余患者未找到危险因素。
2. ON:共40例(40/131,30.5%)。(1)根据病因分类:特发性ON 38例、感染性ON 1例、自身免疫性视神经病1例。特发性ON根据发病机制分型:MOG抗体相关疾病(myelin oligodendrocyte glycoproteinantibody-associated disease,MOG-AD)8例,AQP4阳性视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)3例,自身免疫胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)星型细胞病1例,其余26例为抗体阴性的非典型ON。感染性ON 1例的感染病原体为梅毒螺旋体。自身免疫性视神经病1例的原发自身免疫病为白塞病。(2)根据受累部位分类:视神经乳头炎36例、视神经网膜炎4例。
3. 血管性视神经病变:共13例(13/131,9.9%)。导致血管性视神经病变的疾病包括NA-AION 7例,视盘血管炎4例,DP 2例。7例NA-AION中男女比例6∶1,3例有贫血、2例有高原地区旅居史、1例高危视盘合并高热呕吐前驱史。4例视盘血管炎患者中有3例病因为系统性疾病,包括梅毒、肺结核、变应性肉芽肿性血管炎(Churg Strauss综合征,CSS)。
4. PPE:共9例(9/131,6.9%),导致PPE的疾病包括LHON 4例,视盘玻璃疣3例,倾斜拥挤视盘2例。4例LHON中,3例为线粒体DNA m.11778G>A位点突变,1例为m.14484T>C突变。
5. 其他:葡萄膜炎6例(6/131,4.6%),其中VKH综合征5例,仅眼部受累的葡萄膜炎1例。中毒代谢性视神经病3例(3/131,2.3%),包括乙胺丁醇中毒1例、胺碘酮1例,甲醇中毒1例。未知病因的4例(4/131,3.1%)。
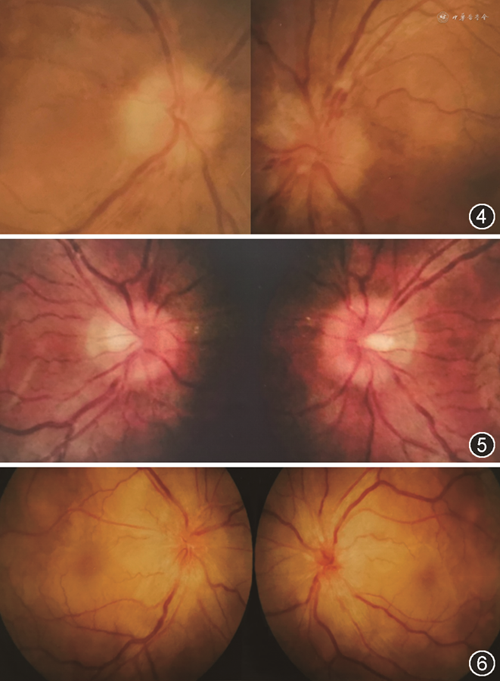
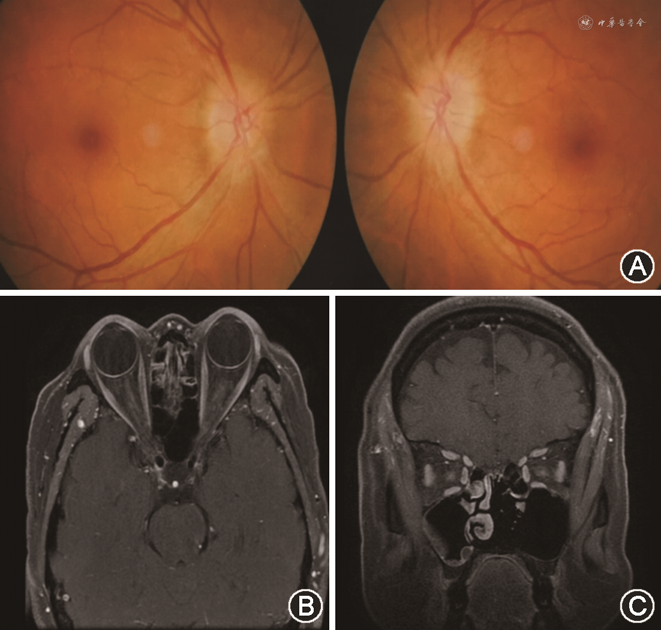
双侧ODS的主要病因的临床特征见表1,典型病例眼底及影像学表现见图2, 3, 4, 5, 6。
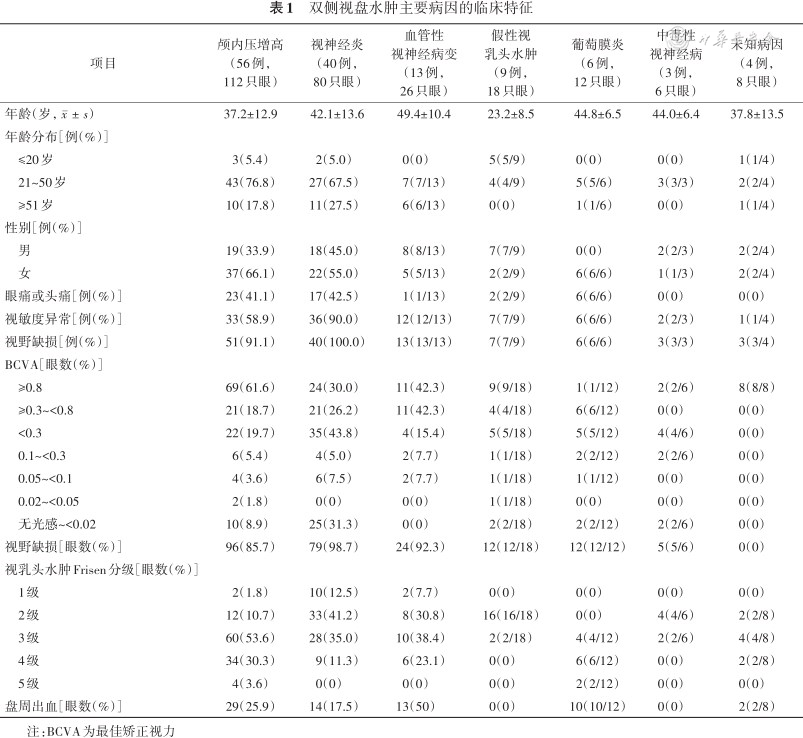
双侧视盘水肿主要病因的临床特征
双侧视盘水肿主要病因的临床特征
| 项目 | 颅内压增高(56例,112只眼) | 视神经炎(40例,80只眼) | 血管性视神经病变(13例,26只眼) | 假性视乳头水肿(9例,18只眼) | 葡萄膜炎(6例,12只眼) | 中毒性视神经病(3例,6只眼) | 未知病因(4例,8只眼) | |
|---|---|---|---|---|---|---|---|---|
| 年龄(岁,) | 37.2±12.9 | 42.1±13.6 | 49.4±10.4 | 23.2±8.5 | 44.8±6.5 | 44.0±6.4 | 37.8±13.5 | |
| 年龄分布[例(%)] | ||||||||
| ≤20岁 | 3(5.4) | 2(5.0) | 0(0) | 5(5/9) | 0(0) | 0(0) | 1(1/4) | |
| 21~50岁 | 43(76.8) | 27(67.5) | 7(7/13) | 4(4/9) | 5(5/6) | 3(3/3) | 2(2/4) | |
| ≥51岁 | 10(17.8) | 11(27.5) | 6(6/13) | 0(0) | 1(1/6) | 0(0) | 1(1/4) | |
| 性别[例(%)] | ||||||||
| 男 | 19(33.9) | 18(45.0) | 8(8/13) | 7(7/9) | 0(0) | 2(2/3) | 2(2/4) | |
| 女 | 37(66.1) | 22(55.0) | 5(5/13) | 2(2/9) | 6(6/6) | 1(1/3) | 2(2/4) | |
| 眼痛或头痛[例(%)] | 23(41.1) | 17(42.5) | 1(1/13) | 2(2/9) | 6(6/6) | 0(0) | 0(0) | |
| 视敏度异常[例(%)] | 33(58.9) | 36(90.0) | 12(12/13) | 7(7/9) | 6(6/6) | 2(2/3) | 1(1/4) | |
| 视野缺损[例(%)] | 51(91.1) | 40(100.0) | 13(13/13) | 7(7/9) | 6(6/6) | 3(3/3) | 3(3/4) | |
| BCVA[眼数(%)] | ||||||||
| ≥0.8 | 69(61.6) | 24(30.0) | 11(42.3) | 9(9/18) | 1(1/12) | 2(2/6) | 8(8/8) | |
| ≥0.3~<0.8 | 21(18.7) | 21(26.2) | 11(42.3) | 4(4/18) | 6(6/12) | 0(0) | 0(0) | |
| <0.3 | 22(19.7) | 35(43.8) | 4(15.4) | 5(5/18) | 5(5/12) | 4(4/6) | 0(0) | |
| 0.1~<0.3 | 6(5.4) | 4(5.0) | 2(7.7) | 1(1/18) | 2(2/12) | 2(2/6) | 0(0) | |
| 0.05~<0.1 | 4(3.6) | 6(7.5) | 2(7.7) | 1(1/18) | 1(1/12) | 0(0) | 0(0) | |
| 0.02~<0.05 | 2(1.8) | 0(0) | 0(0) | 1(1/18) | 0(0) | 0(0) | 0(0) | |
| 无光感~<0.02 | 10(8.9) | 25(31.3) | 0(0) | 2(2/18) | 2(2/12) | 2(2/6) | 0(0) | |
| 视野缺损[眼数(%)] | 96(85.7) | 79(98.7) | 24(92.3) | 12(12/18) | 12(12/12) | 5(5/6) | 0(0) | |
| 视乳头水肿Frisen分级[眼数(%)] | ||||||||
| 1级 | 2(1.8) | 10(12.5) | 2(7.7) | 0(0) | 0(0) | 0(0) | 0(0) | |
| 2级 | 12(10.7) | 33(41.2) | 8(30.8) | 16(16/18) | 0(0) | 4(4/6) | 2(2/8) | |
| 3级 | 60(53.6) | 28(35.0) | 10(38.4) | 2(2/18) | 4(4/12) | 2(2/6) | 4(4/8) | |
| 4级 | 34(30.3) | 9(11.3) | 6(23.1) | 0(0) | 6(6/12) | 0(0) | 2(2/8) | |
| 5级 | 4(3.6) | 0(0) | 0(0) | 0(0) | 2(2/12) | 0(0) | 0(0) | |
| 盘周出血[眼数(%)] | 29(25.9) | 14(17.5) | 13(50) | 0(0) | 10(10/12) | 0(0) | 2(2/8) | |
注:BCVA为最佳矫正视力




在ODS两种主要病因颅内压增高和ON患者临床特征的比较中,发病年龄、性别、眼痛或头痛以及眼底盘周出血的发生率差异无统计学意义(均P>0.05)(表2)。视敏度异常在ON组较颅内压增高组更常见(90.0% 比 58.9%,P=0.001),低视力(BCVA<0.3)在ON组更常见(43.8% 比 19.6%,P<0.001),Frisen分级4~5级的重度PE在颅内压增高组更常见(33.9% 比 11.3%,P<0.001)。
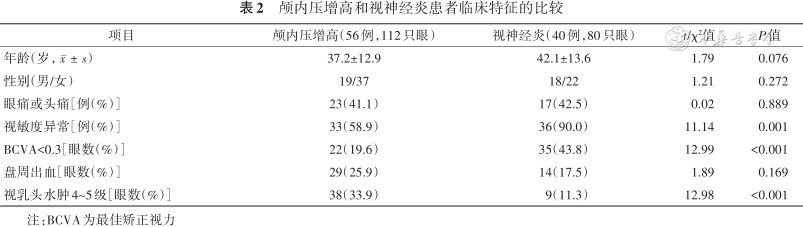
颅内压增高和视神经炎患者临床特征的比较
颅内压增高和视神经炎患者临床特征的比较
| 项目 | 颅内压增高(56例,112只眼) | 视神经炎(40例,80只眼) | t/χ²值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 37.2±12.9 | 42.1±13.6 | 1.79 | 0.076 |
| 性别(男/女) | 19/37 | 18/22 | 1.21 | 0.272 |
| 眼痛或头痛[例(%)] | 23(41.1) | 17(42.5) | 0.02 | 0.889 |
| 视敏度异常[例(%)] | 33(58.9) | 36(90.0) | 11.14 | 0.001 |
| BCVA<0.3[眼数(%)] | 22(19.6) | 35(43.8) | 12.99 | <0.001 |
| 盘周出血[眼数(%)] | 29(25.9) | 14(17.5) | 1.89 | 0.169 |
| 视乳头水肿4~5级[眼数(%)] | 38(33.9) | 9(11.3) | 12.98 | <0.001 |
注:BCVA为最佳矫正视力
虽然有医学文献列出了双侧ODS的病因[12, 13],但各病因临床特征的比较尚不全面,且国内罕见此方面的研究,因此本研究探讨了双侧ODS的病因构成,同时比较了各病因的临床特征。和以往研究相比,恶性高血压、白血病、甲状腺相关眼病、急性播散性脑脊髓炎(ADEM)等引起双侧ODS没有在本研究中观察到,可能与上述部分疾病多首诊于急诊科及内科相关,故本研究可能存在选择偏倚。
正如预期,双侧ODS最常见的病因是颅内压增高导致的PE(42.7%)。在日本双侧ODS病因的研究中,PE最常见的病因为脑肿瘤,其次为脑出血,以及慢性硬膜下血肿、CVST、IIH等[13]。本研究中颅内压增高最常见的原因是IIH(76.8%),其次为CVST(12.5%),没有发现脑出血及硬膜下血肿引起PE的病例,可能与此类患者若无视力下降主诉很少常规做视功能检查相关。IIH病因不明,研究显示,女性和肥胖是IIH的主要危险因素,其他可能的危险因素包括贫血、艾迪森病、甲状旁腺功能减退、儿童使用生长激素、维生素A中毒、服用四环素及NASIDS药物等[14, 15]。静脉窦狭窄可导致局部静脉高压和脑脊液经蛛网膜颗粒引流继发性减少,对颅内压增高的形成产生一定作用。本研究中IIH患者的患病危险因素包括女性、肥胖、贫血、静脉窦狭窄。
双侧ODS第二常见的病因为ON(30.5%)。以往双侧ODS病因研究中均未提及ON的分型,本研究对ON做了病因分类。典型性ON,也称特发性脱髓鞘性ON,常和多发性硬化相关,1/3患者伴视盘水肿,但多为单眼发病。本研究中双侧ON均为非典型性ON。以往研究表明,MOG抗体阳性的ON患者多双眼受累(约60%)[16],常累及视神经前段,出现视盘水肿者多见(约80%)[16, 17]。而AQP4抗体阳性ON多累及视神经后段、视交叉及视束部位,视盘水肿相对少见(约1/3)。GFAP星形细胞病最常见的表现类型为脑膜脑炎或脑膜脑脊髓炎,双侧ODS在GFAP星形细胞病中发生率为32%,病因更倾向于炎性血管病变导致的视神经乳头炎,而并不是常见的颅内压增高[18, 19]。本研究中,抗体阴性的非典型ON占大多数(65%),ON的未知抗体仍需不断探索和研究。
在日本京都大学医学院Hata和Miyamoto[12]的研究中,AION是单侧ODS最常见的病因,但在双侧ODS中并不常见(9%,其中NA-AION占6%),和本研究NA-AION占双侧ODS的比例类似(5.3%)。存在高危视盘的NA-AION患者对侧眼在5年内受累的概率为15%[20]。双眼同时或相继受累的AION要警惕巨细胞动脉炎(giant cell arteritis,GCA)导致的动脉炎性前部缺血性视神经病(arteritic anterior ischemic optic neuropathy,A-AION)。本研究尚未检索到GCA导致A-AION的病例,但检索到了感染及CSS导致视盘血管炎的病例。分析原因可能与亚洲人GCA患病率较低相关;另外GCA存在“隐匿性”,视力丧失可为GCA的唯一症状,在临床上容易漏诊,本研究为回顾性研究,存在一定的局限性。
正确的识别真性还是PPE可使患者免去很多不必要的检查。PPE有视盘抬高但抬高区不超过视盘边缘,可伴有视网膜分支血管异常、无盘周出血、荧光造影无渗漏。PPE分为病理性水肿(LHON)及生理性水肿(各种先天视盘解剖变异)。LHON急性期视盘充血、毛细血管扩张,盘周神经纤维层水肿,眼底呈现“视盘水肿”,但FFA中视盘或盘周的血管无荧光渗漏,故为假性水肿[21, 22]。本研究中,LHON的患者在假性水肿中占比最高,但在国外几个视盘水肿病因研究中,并没有提及LHON[12, 13,23]。
虽然双侧ODS最常见的病因是颅内压增高,但也可由其他多种原因引发。在对中国患者的研究中,双侧ON是需要重点鉴别的病因。详细的病史采集、系统的检查从而明确潜在的病因对于后续诊断和治疗至关重要。
汪晓楠, 王佳伟. 双侧视盘肿胀的病因构成及临床特征分析[J]. 中华医学杂志, 2024, 104(1): 31-37. DOI: 10.3760/cma.j.cn112137-20231005-00636.
所有作者声明不存在利益冲突



























