
探讨早发型坏死性小肠结肠炎(NEC)肠造瘘患儿的临床特征,并分析术后并发症的危险因素。
回顾性分析2016年5月至2023年5月首都医科大学附属北京儿童医院收治的因NEC行肠造瘘患儿的临床资料(围产期情况、临床特征、临床结局等)。根据发病日龄不同分为早发型肠造瘘组(<14日龄)和晚发型肠造瘘组(≥14日龄);根据NEC患儿肠造瘘术后是否合并并发症,分为并发症组和无并发症组,分析各组患儿临床资料的差异,总结早发型NEC肠造瘘患儿临床特征;采用多因素logistic回归模型分析NEC肠造瘘患儿术后并发症的危险因素。
共纳入68例患儿,其中早发型肠造瘘组43例[男26例,女17例,日龄(6.5±3.0)d],晚发型肠造瘘组25例[男15例,女10例,日龄(21.0±3.0)d];NEC患儿肠造瘘术后并发症组有28例(男17例,女11例),日龄[M(Q1,Q3)]为9(5,14)d,无并发症组有33例(男22例,女11例),日龄14(6,21)d。与晚发型肠造瘘组相比,早发型肠造瘘组患儿生后合并脑室内出血[30.2%(13/43)比8.0%(2/25)]、血流动力学意义的动脉导管未闭[37.2%(16/43)比12.0%(3/25)]、生后机械通气≥72 h[39.5%(17/43)比16.0%(4/25)]、Ⅲ期NEC[69.8%(30/43)比40.0%(10/25)]及广泛型NEC[27.9%(12/43)比8.0%(2/25)]、短期术后并发症[56.8%(21/37)比29.2%(7/24)]的发生率更高,差异均有统计学意义(均P<0.05)。多因素logistic回归模型分析结果显示,造瘘近端小肠剩余长度是NEC患儿肠造瘘术后并发症的保护因素(OR=0.764,95%CI:0.648~0.901,P=0.001);而Ⅲ期NEC是其危险因素(OR=1.042,95%CI:1.004~5.585,P=0.017)。
早发型NEC肠造瘘患儿术后并发症发生率高,预后差;造瘘近端小肠剩余长度是NEC肠造瘘术后并发症的保护因素,而Ⅲ期NEC是其危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿期最常见的严重胃肠道急症之一,活产婴儿中其发生率为1‰~5‰。NEC发病机制是多因素的,其确切病因尚不清楚,但肠道黏膜和免疫系统发育不成熟已被确定为重要原因之一[1]。尽管在过去几十年里医疗技术迅速发展,但NEC相关并发症的死亡率高达20%~30%,需手术治疗的患儿死亡率更高[2]。NEC通常发生在生后2周内,考虑与肠内喂养的启动有关,也可发生在肠内营养完全建立后[3]。在荷兰进行的一项多中心研究中,NEC发病中位日龄是12 d[4]。既往研究表明不同发病日龄NEC患儿临床特点存在一定差异,如与晚发型NEC(late-onset necrotizing enterocolitis,LO-NEC)相比,早发型NEC(early-onset necrotizing enterocolitis,EO-NEC)患儿需要手术干预的比例更高[5],但目前关于NEC肠造瘘患儿临床特点及结局的研究较少。本研究回顾性分析NEC合并肠造瘘患儿的临床资料,比较EO-NEC与LO-NEC行肠造瘘患儿的临床特点,并探讨NEC手术后发生并发症的危险因素,为优化NEC肠造瘘患儿的诊治措施并改善预后提供参考。
1. 本研究为回顾性队列研究。回顾性分析2016年5月至2023年5月在首都医科大学附属北京儿童医院新生儿中心因NEC行肠造瘘术患儿的临床资料。本研究经首都医科大学附属北京儿童医院医学伦理委员会批准,审批号:[2023]-E-132-R;本研究符合赫尔辛基宣言,所有入组对象均豁免知情同意。
2. 纳入标准:(1)足月儿生后28 d内、或早产儿校正胎龄为44周内;(2)符合第5版《实用新生儿学》的NEC诊断标准并且Bell分期为Ⅱ期及以上[6];(3)因NEC行肠道(小肠或结肠)双腔或单腔造瘘术及二期关瘘术。
3. 排除标准:(1)行肠造瘘手术的原发病与NEC无关;(2)合并先天性疾病(如消化道畸形、严重先天性心脏病、遗传代谢病、染色体异常等)。
4. 分组:根据发病日龄不同分为早发型肠造瘘组(<14日龄)和晚发型肠造瘘组(≥14日龄);根据NEC患儿肠造瘘术后是否合并并发症,分为并发症组和无并发症组。
1. 资料收集:从首都医科大学附属北京儿童医院电子病历系统中收集患儿如下信息:(1)围产期资料:包括患儿性别、胎龄、出生体重、分娩方式、生后窒息抢救史、喂养方式、是否合并脑室内出血(intraventricular hemorrhage,IVH)、是否有血流动力学意义的动脉导管未闭(hemodynamically significant patent ductus arteriosus,hs-PDA)、是否给予有创呼吸支持,母孕期情况等;(2)临床特点:患儿起病日龄、临床表现、NEC分期及分型、出现症状至造瘘的时间、术后临床特征、并发症发生率等。
2. 相关定义:(1)EO-NEC:发病日龄<14 d,LO-NEC:发病日龄≥14 d[7]。(2)NEC分期及分型:参考改良Bell分期诊断标准,所有入组病例的NEC分期均为Ⅱ期及以上[6];根据病变范围,将NEC分为局灶型、多病灶型及广泛病变型3种类型[8]。(3)造口高流量腹泻:指造瘘口排稀水样大便,量超过40 ml·kg-1·d-1,且伴有中度以上脱水需急诊留观超过24 h或需要入院治疗者[9]。(4)IVH、hs-PDA、败血症等新生儿疾病的诊断标准均参考第5版《实用新生儿学》[6]。(5)造瘘近端小肠剩余长度:指从屈氏韧带到造口近端肠管的测量长度,以cm为单位。
应用SPSS 25.0统计软件进行数据分析。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法;符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。采用多因素logistic回归模型分析影响NEC肠造瘘术后并发症危险因素。双侧检验,检验水准α=0.05。
共有73例患儿行肠造瘘术,5例术中明确为其他肠道疾病(十二指肠膜性狭窄1例,中肠扭转1例,阑尾炎穿孔3例),最终共68例因NEC行肠造瘘术的患儿纳入研究;术后因病情恶化,家属放弃治疗者7例(EO-NEC 6例,LO-NEC 1例),随访结局均为死亡。68例患儿中,早发型肠造瘘组43例[男26例,女17例,日龄(6.5±3.0)d],晚发型肠造瘘组25例[男15例,女10例,日龄(21.0±3.0)d];NEC患儿肠造瘘术后并发症组有28例[男17例,女11例,日龄为9(5,14)d],无并发症组有33例[男22例,女11例,日龄14(6,21)d](注:因7例患儿术后即放弃治疗,缺少术后临床资料,故未包含该分组内)。
1. 围产期特点:早发型肠造瘘组患儿出生体重、合并hs-PDA和IVH、需有创呼吸支持的比例均高于晚发型肠造瘘组(均P<0.05);两组患儿生后喂养方式间的差异有统计学意义(P<0.05),其他基本特征间的差异均无统计学意义(均P>0.05,表1)。
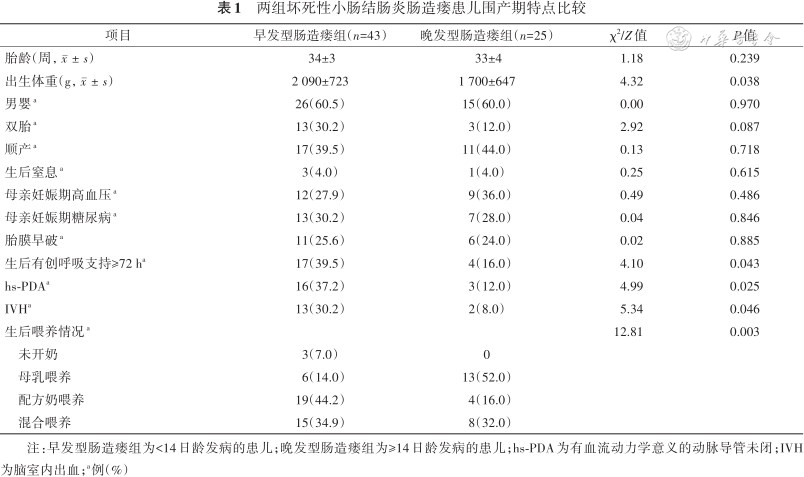
两组坏死性小肠结肠炎肠造瘘患儿围产期特点比较
两组坏死性小肠结肠炎肠造瘘患儿围产期特点比较
| 项目 | 早发型肠造瘘组(n=43) | 晚发型肠造瘘组(n=25) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 胎龄(周,) | 34±3 | 33±4 | 1.18 | 0.239 |
| 出生体重(g,) | 2 090±723 | 1 700±647 | 4.32 | 0.038 |
| 男婴a | 26(60.5) | 15(60.0) | 0.00 | 0.970 |
| 双胎a | 13(30.2) | 3(12.0) | 2.92 | 0.087 |
| 顺产a | 17(39.5) | 11(44.0) | 0.13 | 0.718 |
| 生后窒息a | 3(4.0) | 1(4.0) | 0.25 | 0.615 |
| 母亲妊娠期高血压a | 12(27.9) | 9(36.0) | 0.49 | 0.486 |
| 母亲妊娠期糖尿病a | 13(30.2) | 7(28.0) | 0.04 | 0.846 |
| 胎膜早破a | 11(25.6) | 6(24.0) | 0.02 | 0.885 |
| 生后有创呼吸支持≥72 ha | 17(39.5) | 4(16.0) | 4.10 | 0.043 |
| hs-PDAa | 16(37.2) | 3(12.0) | 4.99 | 0.025 |
| IVHa | 13(30.2) | 2(8.0) | 5.34 | 0.046 |
| 生后喂养情况a | 12.81 | 0.003 | ||
| 未开奶 | 3(7.0) | 0 | ||
| 母乳喂养 | 6(14.0) | 13(52.0) | ||
| 配方奶喂养 | 19(44.2) | 4(16.0) | ||
| 混合喂养 | 15(34.9) | 8(32.0) |
注:早发型肠造瘘组为<14日龄发病的患儿;晚发型肠造瘘组为≥14日龄发病的患儿;hs-PDA为有血流动力学意义的动脉导管未闭;IVH为脑室内出血;a例(%)
2. 手术相关特征:在起病症状上,呼吸暂停多见于早发型肠造瘘组,差异有统计学意义(P<0.05)。早发型肠造瘘组患儿Ⅲ期NEC、广泛型NEC发生率高于晚发型肠造瘘组,差异均有统计学意义(均P<0.05);晚发型肠造瘘组患儿造瘘近端小肠剩余长度长于早发型肠造瘘组,差异有统计学意义(P<0.05)。两组患儿手术指征的确定、出现症状至手术的时间、造瘘口位置、死亡率间的差异均无统计学意义(均P>0.05,表2)。
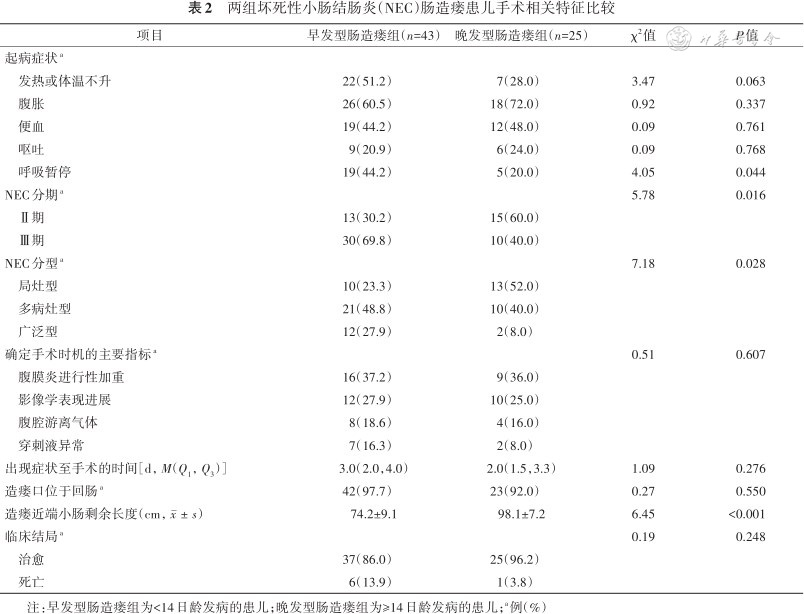
两组坏死性小肠结肠炎(NEC)肠造瘘患儿手术相关特征比较
两组坏死性小肠结肠炎(NEC)肠造瘘患儿手术相关特征比较
| 项目 | 早发型肠造瘘组(n=43) | 晚发型肠造瘘组(n=25) | χ2值 | P值 |
|---|---|---|---|---|
| 起病症状a | ||||
| 发热或体温不升 | 22(51.2) | 7(28.0) | 3.47 | 0.063 |
| 腹胀 | 26(60.5) | 18(72.0) | 0.92 | 0.337 |
| 便血 | 19(44.2) | 12(48.0) | 0.09 | 0.761 |
| 呕吐 | 9(20.9) | 6(24.0) | 0.09 | 0.768 |
| 呼吸暂停 | 19(44.2) | 5(20.0) | 4.05 | 0.044 |
| NEC分期a | 5.78 | 0.016 | ||
| Ⅱ期 | 13(30.2) | 15(60.0) | ||
| Ⅲ期 | 30(69.8) | 10(40.0) | ||
| NEC分型a | 7.18 | 0.028 | ||
| 局灶型 | 10(23.3) | 13(52.0) | ||
| 多病灶型 | 21(48.8) | 10(40.0) | ||
| 广泛型 | 12(27.9) | 2(8.0) | ||
| 确定手术时机的主要指标a | 0.51 | 0.607 | ||
| 腹膜炎进行性加重 | 16(37.2) | 9(36.0) | ||
| 影像学表现进展 | 12(27.9) | 10(25.0) | ||
| 腹腔游离气体 | 8(18.6) | 4(16.0) | ||
| 穿刺液异常 | 7(16.3) | 2(8.0) | ||
| 出现症状至手术的时间[d,M(Q1,Q3)] | 3.0(2.0,4.0) | 2.0(1.5,3.3) | 1.09 | 0.276 |
| 造瘘口位于回肠a | 42(97.7) | 23(92.0) | 0.27 | 0.550 |
| 造瘘近端小肠剩余长度(cm,) | 74.2±9.1 | 98.1±7.2 | 6.45 | <0.001 |
| 临床结局a | 0.19 | 0.248 | ||
| 治愈 | 37(86.0) | 25(96.2) | ||
| 死亡 | 6(13.9) | 1(3.8) |
注:早发型肠造瘘组为<14日龄发病的患儿;晚发型肠造瘘组为≥14日龄发病的患儿;a例(%)
3. 术后临床特点及并发症:早发型肠造瘘组患儿术后需要有创呼吸支持比例、术后静脉营养时间、达到全肠道内喂养的时间、术后相关并发症比例均高于晚发型肠造瘘组,差异均有统计学意义(均P<0.05)。两组患儿住院时间、术后抗生素使用时间的差异均无统计学意义(均P>0.05)。在术后相关并发症中,术后肠梗阻(完全性/非完全性)、脓毒性休克、急性肾衰竭、胆汁淤积性肝病多见于早发型肠造瘘组,差异均有统计学意义(均P<0.05),其余并发症间差异均无统计学意义(均P>0.05,表3)。
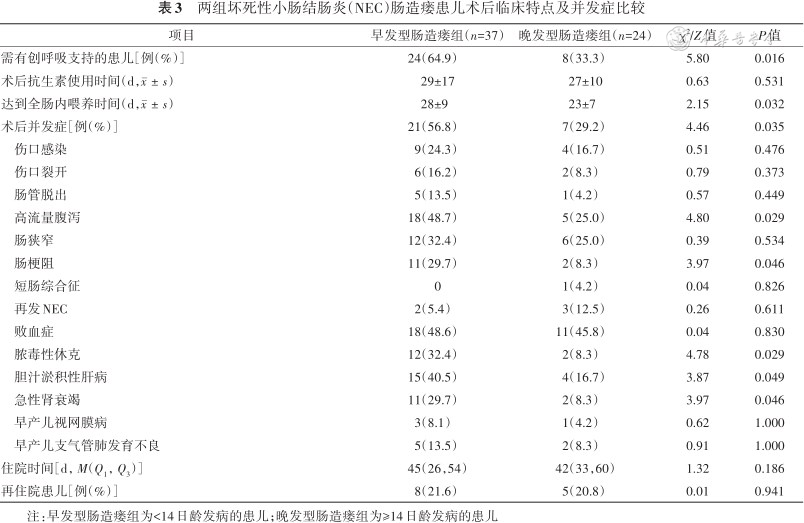
两组坏死性小肠结肠炎(NEC)肠造瘘患儿术后临床特点及并发症比较
两组坏死性小肠结肠炎(NEC)肠造瘘患儿术后临床特点及并发症比较
| 项目 | 早发型肠造瘘组(n=37) | 晚发型肠造瘘组(n=24) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 需有创呼吸支持的患儿[例(%)] | 24(64.9) | 8(33.3) | 5.80 | 0.016 |
| 术后抗生素使用时间(d,) | 29±17 | 27±10 | 0.63 | 0.531 |
| 达到全肠内喂养时间(d,) | 28±9 | 23±7 | 2.15 | 0.032 |
| 术后并发症[例(%)] | 21(56.8) | 7(29.2) | 4.46 | 0.035 |
| 伤口感染 | 9(24.3) | 4(16.7) | 0.51 | 0.476 |
| 伤口裂开 | 6(16.2) | 2(8.3) | 0.79 | 0.373 |
| 肠管脱出 | 5(13.5) | 1(4.2) | 0.57 | 0.449 |
| 高流量腹泻 | 18(48.7) | 5(25.0) | 4.80 | 0.029 |
| 肠狭窄 | 12(32.4) | 6(25.0) | 0.39 | 0.534 |
| 肠梗阻 | 11(29.7) | 2(8.3) | 3.97 | 0.046 |
| 短肠综合征 | 0 | 1(4.2) | 0.04 | 0.826 |
| 再发NEC | 2(5.4) | 3(12.5) | 0.26 | 0.611 |
| 败血症 | 18(48.6) | 11(45.8) | 0.04 | 0.830 |
| 脓毒性休克 | 12(32.4) | 2(8.3) | 4.78 | 0.029 |
| 胆汁淤积性肝病 | 15(40.5) | 4(16.7) | 3.87 | 0.049 |
| 急性肾衰竭 | 11(29.7) | 2(8.3) | 3.97 | 0.046 |
| 早产儿视网膜病 | 3(8.1) | 1(4.2) | 0.62 | 1.000 |
| 早产儿支气管肺发育不良 | 5(13.5) | 2(8.3) | 0.91 | 1.000 |
| 住院时间[d,M(Q1,Q3)] | 45(26,54) | 42(33,60) | 1.32 | 0.186 |
| 再住院患儿[例(%)] | 8(21.6) | 5(20.8) | 0.01 | 0.941 |
注:早发型肠造瘘组为<14日龄发病的患儿;晚发型肠造瘘组为≥14日龄发病的患儿
4. 影响并发症组和无并发症组患儿结局的单因素分析:与无并发症组患儿相比,并发症组起病日龄、Ⅲ期NEC、广泛型NEC、造瘘近端小肠剩余长度间的差异均有统计学意义(均P<0.05)。两组患儿胎龄、出生体重、性别、是否合并脓毒性休克、是否需要有创呼吸支持、住院时长、关瘘时间等差异均无统计学意义(均P>0.05,表4)。
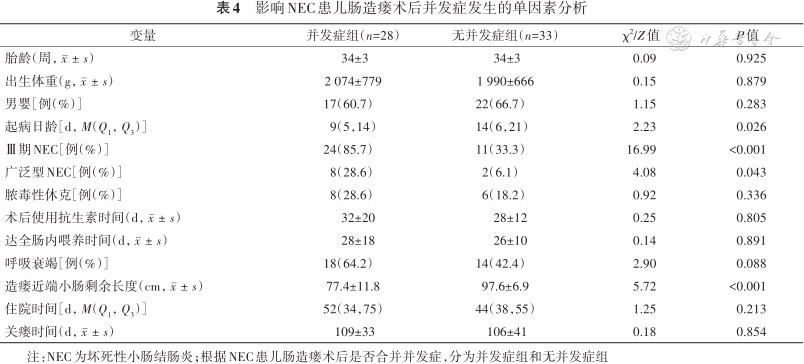
影响NEC患儿肠造瘘术后并发症发生的单因素分析
影响NEC患儿肠造瘘术后并发症发生的单因素分析
| 变量 | 并发症组(n=28) | 无并发症组(n=33) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 胎龄(周,) | 34±3 | 34±3 | 0.09 | 0.925 |
| 出生体重(g,) | 2 074±779 | 1 990±666 | 0.15 | 0.879 |
| 男婴[例(%)] | 17(60.7) | 22(66.7) | 1.15 | 0.283 |
| 起病日龄[d,M(Q1,Q3)] | 9(5,14) | 14(6,21) | 2.23 | 0.026 |
| Ⅲ期NEC[例(%)] | 24(85.7) | 11(33.3) | 16.99 | <0.001 |
| 广泛型NEC[例(%)] | 8(28.6) | 2(6.1) | 4.08 | 0.043 |
| 脓毒性休克[例(%)] | 8(28.6) | 6(18.2) | 0.92 | 0.336 |
| 术后使用抗生素时间(d,) | 32±20 | 28±12 | 0.25 | 0.805 |
| 达全肠内喂养时间(d,) | 28±18 | 26±10 | 0.14 | 0.891 |
| 呼吸衰竭[例(%)] | 18(64.2) | 14(42.4) | 2.90 | 0.088 |
| 造瘘近端小肠剩余长度(cm,) | 77.4±11.8 | 97.6±6.9 | 5.72 | <0.001 |
| 住院时间[d,M(Q1,Q3)] | 52(34,75) | 44(38,55) | 1.25 | 0.213 |
| 关瘘时间(d,) | 109±33 | 106±41 | 0.18 | 0.854 |
注:NEC为坏死性小肠结肠炎;根据NEC患儿肠造瘘术后是否合并并发症,分为并发症组和无并发症组
5. 影响并发症组和无并发症组患儿结局的多因素logistic回归模型分析:以NEC患儿肠造瘘术后有并发症为因变量,上述单因素分析中有统计学意义的指标作为自变量,多因素分析结果表明,造瘘近端小肠剩余长度(OR=0.764,95%CI:0.648~0.901,P=0.001)是NEC术后发生并发症的保护因素,近端剩余小肠长度每增加1 cm,发生术后并发症的风险减少0.764倍;Ⅲ期NEC是其危险因素(OR=1.042,95%CI:1.004~5.585,P=0.017),Ⅲ期NEC发生术后并发症的风险是Ⅱ期NEC的1.042倍。
对于严重的NEC患者,尤其是早产儿,伴或不伴坏死肠管切除的暂时性肠造瘘是较为安全的手术方式[10],但术后发生的电解质紊乱、体重不增等问题严重影响术后的生活质量,关瘘前甚至需多次手术治疗[11]。总结肠造瘘患儿的临床特点,对于临床更好的诊治该类患儿具有重要意义,本研究结果表明不同发病日龄NEC肠造瘘患儿临床特点及术后并发症间的差异有统计学意义。
NEC发病的确切病因尚不清楚,宫内生长迟缓、窒息、先天性心脏病、机械通气等均是NEC发生的危险因素[12, 13]。本研究中,EO-NEC肠造瘘组hs-PDA、生后长时间机械通气的比例均高于LO-NEC肠造瘘组,且该组患儿胎龄、出生体重均较大,这与既往研究结果相同[14]。Yoffe Deri等[7]通过多中心研究表明NEC发病日龄与胎龄、出生体重间存在负相关,考虑与该类新生儿胃肠道功能相对更加成熟,可以更早地接受肠内营养和加奶速度快,从而导致生后2周内胃肠道负担较重等因素相关[15]。生后1周内纯母乳喂养可以减少EO-NEC的发生[16],在本研究中两组患儿生后喂养方式存在差异。此外,IVH可引起血流动力学不稳定,从而导致需手术干预的NEC[17, 18],本研究肠造瘘患儿IVH总体发生率为16.4%,多见于EO-NEC肠造瘘组,但仍需深入研究其相关机制,制定针对严重IVH并发NEC的多学科管理的临床管理指南。
NEC手术原则主要是早期干预以减少败血症的发生,并减少对无肠道缺血坏死的患儿进行不必要的手术[19],但在临床工作中难以准确把握手术时机。而及时进行手术干预可减少并发症,缩短住院时长,改善临床预后[20, 21]。此外,诸多危险因素包括败血症、Ⅲ期NEC、呼吸衰竭等,也与预后不良有关[22]。本研究中,EO-NEC肠造瘘组患儿NEC分期及分型均较差,多合并脓毒性休克,需及时采取手术治疗控制病情进展。该组患儿术后开始肠道内喂养时,易发生喂养不耐受,以及造瘘口高流量腹泻,考虑与造瘘口近端小肠长度较短有关[23]。对于NEC患儿应根据疾病进展情况,及时采取手术干预,术后应给予严格且个性化的肠道管理,包括密切监测炎性指标、体重增加情况、造瘘口的量及性质的改变,及时调整喂养方式等,从而改善术后生存质量。
NEC肠造瘘术后并发症的发生率较高[10,23],本研究肠造瘘患儿术后并发症发生率为45.9%,多发于EO-NEC肠造瘘组,与其肠道受累程度重、范围广,从而导致肠道切除长度增加有关。由于病例数较少,两组患儿死亡率差异无统计学意义。Short等[24]的研究结果与本研究不同,考虑与纳入人群不同、样本量较小有关,但均表明不同发病日龄的NEC患儿临床特点存在差异。此外,本研究肠造瘘患儿再入院率为21.3%,其中76.9%为术后不完全性肠梗阻所致,两组差异无统计学意义。分析影响肠造瘘患儿术后发生并发症的结果表明,造瘘近端小肠剩余长度是肠造瘘患儿术后并发症的保护因素,而Ⅲ期NEC是其危险因素。造瘘近端小肠剩余长度越短,发生术后并发症的风险越高,而对于NEC分型,统计学结果尚未显示显著效应。由于本研究病例数较少,存在一定的局限性,仍需多中心研究探讨其影响因素,指导临床治疗。
综上,EO-NEC肠造瘘患儿的临床特点与LO-NEC肠造瘘患儿存在差异,其病情重、术后并发症发生率较高。造瘘近端小肠剩余长度是肠造瘘术后并发症的保护因素,而Ⅲ期NEC是其危险因素。临床工作中应当遵循NEC外科管理的循证医学证据,积极合理治疗Bell Ⅱ期及进展期NEC,及时手术介入,在一定程度上有助于改善患儿预后。
李继承, 杜娟, 杨子馨, 等. 早发型坏死性小肠结肠炎肠造瘘患儿临床特征及术后并发症危险因素分析[J]. 中华医学杂志, 2024, 104(1): 38-44. DOI: 10.3760/cma.j.cn112137-20230926-00577.
所有作者声明不存在利益冲突



























