
探讨18F-脱氧葡萄糖(18F-FDG)正电子发射体层摄影(PET)/CT在肺癌骨转移、前列腺癌骨转移与多发性骨髓瘤(MM)鉴别诊断中的应用价值。
横断面研究。纳入2020年11月—2022年11月西安交通大学第一附属医院均行18F-FDG PET/CT检查的42例肺癌骨转移患者、30例前列腺癌骨转移患者和36例MM患者的临床资料,其中男78例、女30例,年龄33~87岁,分别纳入肺癌组、前列腺癌组和MM组。分析3组患者骨骼病灶的位置分布、骨质破坏类型和最大标准摄取值(SUVmax)的差异。
3组患者年龄、性别比较,差异均有统计学意义(F=9.63、χ2=17.17,P值均<0.001)。3组患者骨骼病灶部位70%以上累及肋骨、脊柱及骨盆,其次好发于四肢;3组患者骨骼病灶位于肋骨、骨盆、四肢、颅骨的差异均有统计学意义(P值均<0.05),位于脊柱和胸骨的差异均无统计学意义(P值均>0.05)。病灶分布位置组间比较显示:前列腺癌组骨转移灶分布于骨盆、四肢者分别为96.7%(29/30)、53.3%(16/30),均多于肺癌组的71.4%(30/42)、19.0%(8/42),差异均有统计学意义(P值均<0.05);MM组病灶位于肋骨者[100%(36/36)]多于前列腺癌组[70%(21/30)],位于骨盆者[72.2%(26/36)]少于前列腺癌组[96.7%(29/30)]、位于颅骨者[55.6%(20/36)]多于前列腺癌组和肺癌组[6.7%(2/30)和4.8%(2/42)],差异均有统计学意义(P值均<0.05)。3组患者骨质破坏类型总体比较的差异有统计学意义(χ2=82.94,P<0.001):肺癌组和MM组患者骨骼病灶的骨质破坏均以溶骨性病变为主[81.0%(34/42)和94.4%(34/36)],成骨性病变较少[7.1%(3/42)和2.8%(1/36)],还有部分混合性病变[11.9%(5/42)和2.8%(1/36)];前列腺癌组患者则以成骨性病变为主[90.0%(27/30)]。在代谢特征方面,肺癌组、前列腺癌组和MM组的SUVmax水平依次由高到低(F=54.66,P<0.001)。
18F-FDG PET/CT有助于综合评价肺癌骨转移、前列腺癌骨转移和MM病灶的骨质结构和代谢特征,对它们具有较高的鉴别诊断价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple myeloma,MM)是一种起源于骨髓浆细胞的淋巴造血系统恶性肿瘤,也是常见的骨原发性恶性肿瘤,表现为全身骨髓的多发骨质破坏和晚期广泛的髓外侵犯,严重影响患者的生命健康和生活质量[1]。骨转移瘤是指原发于骨外的恶性肿瘤,常常发生于肺癌和前列腺癌等恶性肿瘤的晚期,由肿瘤细胞通过血液、淋巴系统转移至骨骼系统所致[2]。骨转移瘤与MM均能侵犯全身骨骼系统,尽管其侵犯机制并不相同,但两者骨骼病变部位、临床表现及影像学特点相近[3, 4],尤其是对于不同来源的多发性骨转移瘤与MM,利用常规影像学检查对其鉴别仍存在较大的困难,容易导致误诊和漏诊,从而影响患者的治疗。18F-脱氧葡萄糖(fluorodeoxyglucose,18F-FDG)PET/CT显像技术实现了影像解剖图像与功能代谢图像的融合,可评价全身骨质的密度改变和代谢变化,为不同来源骨骼病变的鉴别诊断提供更多的参考[5, 6, 7, 8]。本研究回顾性分析了42例肺癌骨转移患者、30例前列腺癌骨转移患者和36例MM瘤患者的临床资料,通过比较三者18F-FDG PET/CT检查结果的差异,探讨18F-FDG PET/CT在三者鉴别诊断中的应用价值,为临床提供参考。
纳入标准:(1)经病理学检查确诊为前列腺癌、肺癌或多发性骨髓瘤;(2)前列腺癌、肺癌患者经诊断标准明确为骨转移;(3)均行18F-FDG PET/CT检查,相关影像学和实验室检查清晰完整。排除标准:(1)进行18F-FDG PET/CT检查前患者已接受放化疗等抗肿瘤治疗;(2)合并其他恶性肿瘤。
横断面研究。纳入2020年11月—2022年11月在西安交通大学第一附属医院行18F-FDG PET/CT检查的42例肺癌骨转移患者、30例前列腺癌骨转移患者和36例MM患者,分别列为肺癌组、前列腺癌组和MM组。本研究符合《赫尔辛基宣言》要求,所有患者签署临床研究知情同意书。
符合下列情况之一,即诊断为恶性肿瘤骨转移:(1)穿刺或手术病理证实为恶性肿瘤骨转移;(2)排除骨折、感染、关节炎及退行性病变等因素后,18F-PET/CT显示全身骨有≥5处异常放射性浓聚灶;(3)有2种以上的影像学检查认为是恶性肿瘤骨转移病灶,并经至少6个月随访证实;(4)临床出现骨痛症状,局部抗肿瘤治疗后疼痛缓解。
采用荷兰飞利浦Gemini TF 64型PET/CT仪,在美国GE公司MINItrace小型回旋加速器及多功能合成模块上合成18F-FDG,放射化学纯度均>95%。患者检查前禁食至少6 h,控制血糖水平≤7.5 mmol/L,安静休息15 min后通过肘静脉注射18F-FDG,剂量为4.5~5.5 mBq/kg,休息1 h后进行全身PET/CT检查。患者平卧,上肢自然下垂于身体两侧,扫描范围从颅顶至双侧下肢,保证骨骼均在此范围内。首先进行螺旋CT扫描(管电流50 mA,管电压为120 kV,层厚5 mm,层间距5 mm);然后进行PET扫描(每床位1.5 min,共采集8~10个床位)。采用核医学图像重建快速迭代算法进行图像重建,利用CT图像对PET图像进行衰减校正,将2个图像融合后传入工作站进行分析。
18F-FDG PET/CT图像分别由2位有5年以上核医学诊断经验的医师和1位高年资放射科医师进行分析。意见有分歧时,经过讨论达成一致结果。观察CT检查中的影像学特点,包括骨骼受侵犯的部位和骨质破坏形态(溶骨性病变、成骨性病变、混合性病变3种类型),并分析PET图像中18F-FDG的分布规律。所有骨转移灶和MM病灶沿病灶周边勾画ROI,通过软件自动计算骨骼病灶的最大标准摄取值(maximum standard uptake value,SUVmax);多处骨病灶的患者,SUVmax取其中18F-FDG代谢最高的3处病灶摄取值的平均值。根据图像分析系统自动设定的SUVmax临界值,将SUVmax≥6.0视为18F-FDG高摄取[9]。
比较3组患者骨骼病灶的位置分布、骨质破坏类型,以及18F-FDG代谢特征。
应用SPSS 26.0统计学软件进行数据分析。分类资料以频数(%)表达,采用χ2检验或Fisher确切概率法;服从正态分布的计量资料以±s表示,3组间比较采用方差分析及SNK-q检验。以P<0.05为差异有统计学意义。
肺癌组男28例、女14例,年龄34~87(61.8±13.2)岁;前列腺癌组30例,年龄54~85(70.4±8.4)岁;MM组男20例、女16例,年龄33~76(58.9±10.2)岁。3组患者的年龄、性别比较,差异均有统计学意义(F=9.49、χ2=17.17,P值均<0.001)。
3组患者骨骼病灶分布于肋骨、脊柱及骨盆者均占70%以上。3组总体比较,骨病灶位于肋骨、骨盆、四肢、颅骨的患者比例差异均有统计学意义(P值均<0.05),骨病灶位于脊柱和胸骨的患者比例差异均无统计学意义(P值均>0.05)。进一步两两比较显示,前列腺癌组骨病灶位于骨盆、四肢的患者多于肺癌组,MM组发生肋骨病灶的患者比例多于前列腺癌组、发生骨盆病灶的患者比例少于前列腺癌组、发生颅骨病灶的患者比例多于前列腺癌组和肺癌组,差异均有统计学意义(P值均<0.05)。见表1。
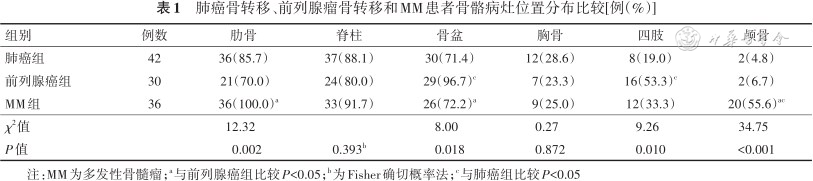
肺癌骨转移、前列腺瘤骨转移和MM患者骨骼病灶位置分布比较[例(%)]
肺癌骨转移、前列腺瘤骨转移和MM患者骨骼病灶位置分布比较[例(%)]
| 组别 | 例数 | 肋骨 | 脊柱 | 骨盆 | 胸骨 | 四肢 | 颅骨 |
|---|---|---|---|---|---|---|---|
| 肺癌组 | 42 | 36(85.7) | 37(88.1) | 30(71.4) | 12(28.6) | 8(19.0) | 2(4.8) |
| 前列腺癌组 | 30 | 21(70.0) | 24(80.0) | 29(96.7)c | 7(23.3) | 16(53.3)c | 2(6.7) |
| MM组 | 36 | 36(100.0)a | 33(91.7) | 26(72.2)a | 9(25.0) | 12(33.3) | 20(55.6)ac |
| χ2值 | 12.32 | 8.00 | 0.27 | 9.26 | 34.75 | ||
| P值 | 0.002 | 0.393b | 0.018 | 0.872 | 0.010 | <0.001 |
注:MM为多发性骨髓瘤;a与前列腺癌组比较P<0.05;b为Fisher确切概率法;c与肺癌组比较P<0.05
肺癌组和MM组患者骨骼病灶的骨质破坏均以溶骨性病变为主,成骨性病变较少,还有部分未出现骨质破坏;前列腺癌组患者以成骨性病变为主。3组患者骨质破坏类型比较,差异有统计学意义(P<0.001)。见表2。
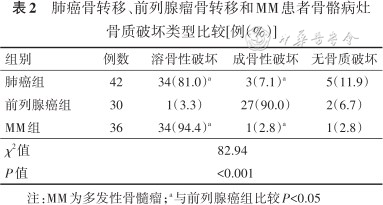
肺癌骨转移、前列腺瘤骨转移和MM患者骨骼病灶骨质破坏类型比较[例(%)]
肺癌骨转移、前列腺瘤骨转移和MM患者骨骼病灶骨质破坏类型比较[例(%)]
| 组别 | 例数 | 溶骨性破坏 | 成骨性破坏 | 无骨质破坏 |
|---|---|---|---|---|
| 肺癌组 | 42 | 34(81.0)a | 3(7.1)a | 5(11.9) |
| 前列腺癌组 | 30 | 1(3.3) | 27(90.0) | 2(6.7) |
| MM组 | 36 | 34(94.4)a | 1(2.8)a | 1(2.8) |
| χ2值 | 82.94 | |||
| P值 | <0.001 | |||
注:MM为多发性骨髓瘤;a与前列腺癌组比较P<0.05
肺癌骨转移和前列腺癌骨转移病灶以高代谢为主,SUVmax较高,分别为5.70~29.10(15.51±5.60)和4.30~15.10(9.41±3.47)。在42例肺癌骨转移病例中,有41例(97.6%)显示SUVmax≥6.0;而在30例前列腺癌骨转移病例中,有24例(80.0%)显示SUVmax≥6.0。MM病灶以弥漫性轻中度代谢为主,SUVmax较低,为0.80~12.00(5.39±2.84)。在36例MM病灶中,有12例(33.3%)显示SUVmax≥6.0。3组间SUVmax比较差异有统计学意义(F=54.66,P<0.001),组间两两比较差异均有统计学意义(P值均<0.05)。
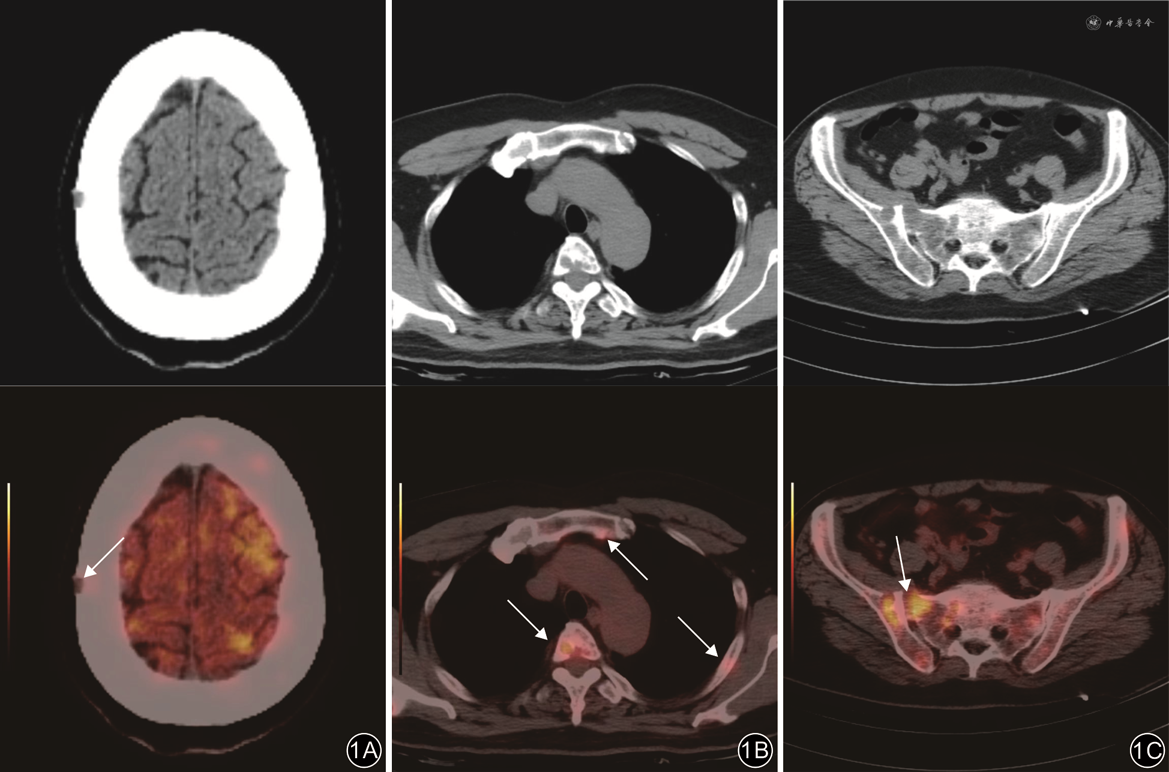

注:上排为CT图像;下排为对应位置的正电子发射体层摄影(PET)/CT融合图像
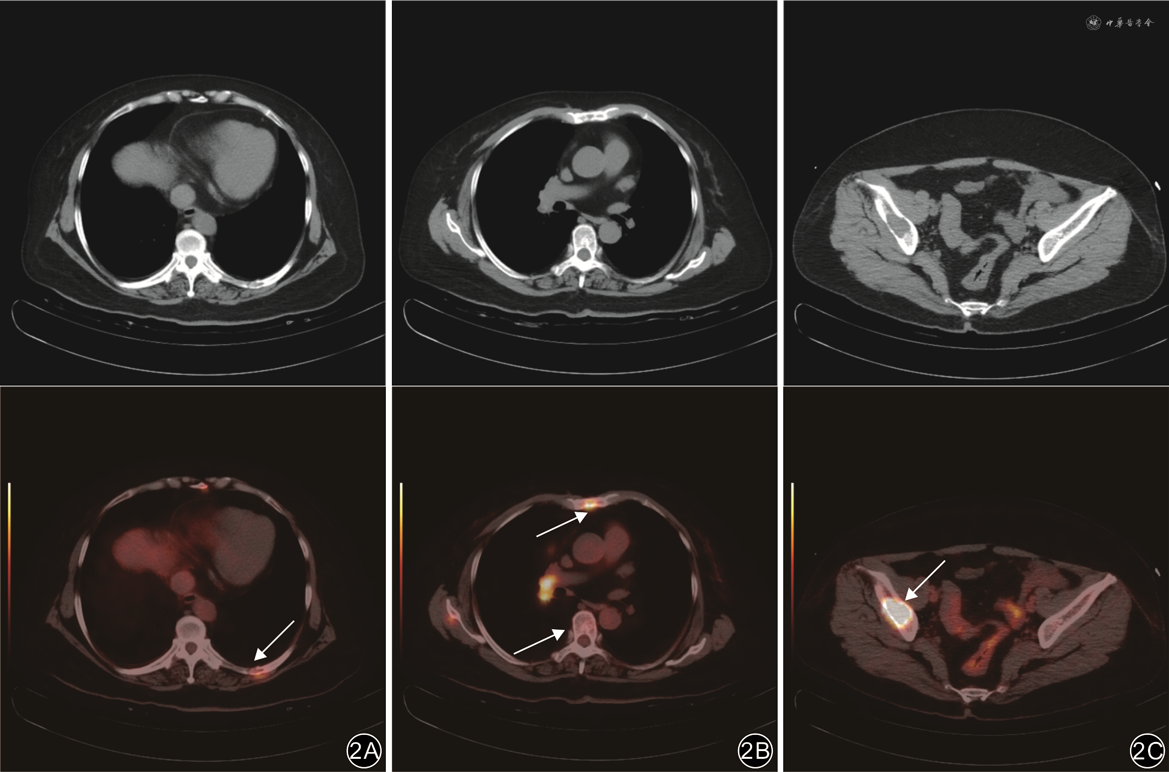

注:上排为CT图像;下排为对应位置的正电子发射体层摄影(PET)/CT融合图像
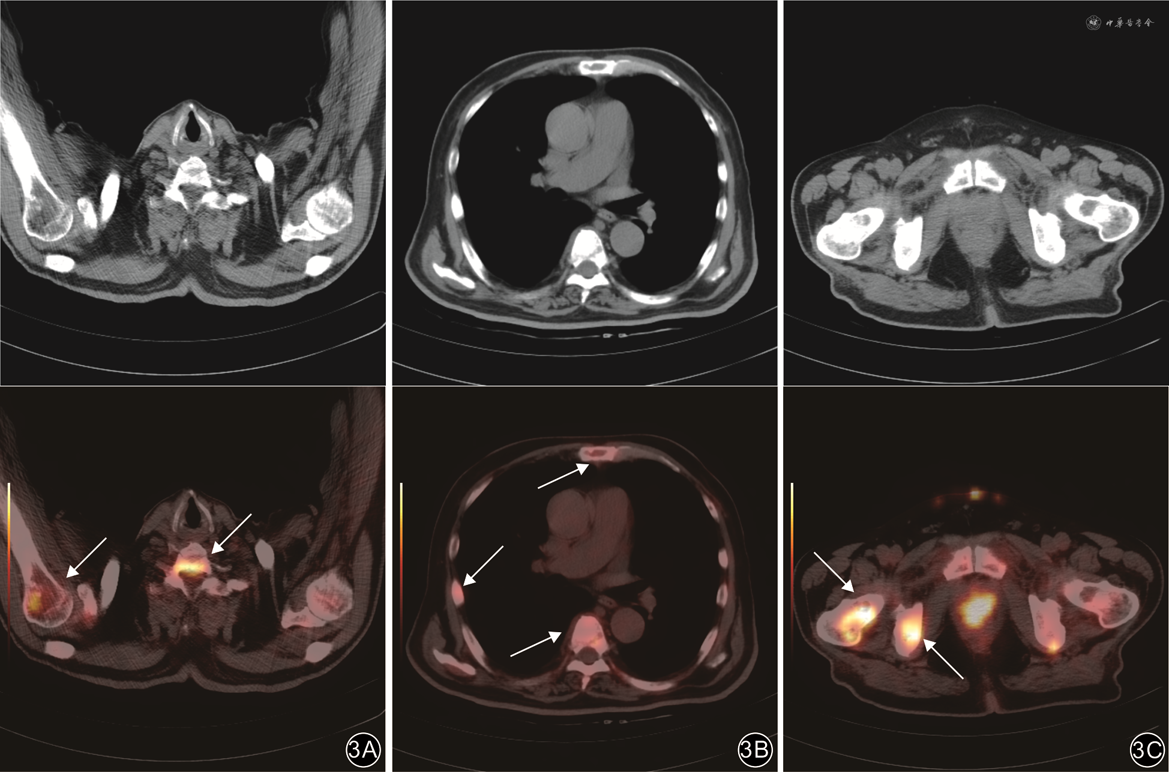

注:上排为CT图像;下排为对应位置的正电子发射体层摄影(PET)/CT融合图像
肺癌和前列腺癌均极易发生骨转移[10, 11]。在肿瘤早期阶段转移灶就可能开始或已经播散到骨骼上,预示着病情恶化和生存期的缩短,但由于患者常无明显临床症状而不易被发现,使得肿瘤的进展被疏忽[12, 13]。因此,早期发现并明确恶性肿瘤有无骨转移,有助于患者的临床诊断与分期,对制定针对性的治疗方案及改善患者预后具有重要意义[14, 15]。MM与肿瘤骨转移的病因不同,但两者的临床表现和常规影像特点相似,常累及全身的骨骼系统,均易造成全身多发性骨质代谢异常,两者的鉴别诊断一直是临床上的难题之一。
X线、CT、MRI、骨扫描和PET/CT等是临床诊断骨病变常用的影像学方法[16, 17]。18F-FDG为葡萄糖类似物,是临床最常用的PET示踪剂。研究表明,骨发生病变时往往存在局部代谢异常,骨病灶对18F-FDG摄取量是正常骨的3~10倍[18],对于CT无明显骨质密度改变的早期骨病变,PET表现为18F-FDG高摄取灶,在探测早期隐匿性骨病灶方面较单纯的形态学检查更准确[19]。此外,肿瘤的转移灶具有和原发灶相似的代谢特性,一次注射18F-FDG进行常规的全身显像,可以提供包括骨骼在内的全身脏器组织的病变信息,其低剂量CT同时可以清晰显示病灶的范围及特征。总之,18F-FDG PET/CT显像将PET与CT有机融合,能同时显示组织的解剖结构和代谢状况,可对患者的病灶分布状态、骨质变化和代谢活性等进行全面评价,对MM和骨转移瘤的鉴别诊断较X线、CT、MRI等常规影像学检查方法更有优势[6,20, 21]。
本研究回顾性分析了42例肺癌骨转移、30例前列腺癌骨转移和36例MM患者的临床资料,发现3组患者的性别和年龄差异均有统计学意义(P值均<0.001),这与不同疾病本身存在的流行病学差异有关[22, 23, 24]。18F-FDG PET/CT基于骨转移灶对18F-FDG的摄取程度显像,而研究显示绝大部分器官的FDG摄取与年龄、性别之间未见明显相关性[25]。因此,性别和年龄间的差异并不影响本研究的结果。
本研究结果显示,这3种疾病均能累及全身多处骨骼,且均好发于富含红骨髓的骨骼部位(脊柱、肋骨和骨盆),而较少在含黄骨髓的四肢骨生长,但具体分布有所差异:MM患者骨病灶分布于肋骨及颅骨者比前列腺癌骨转移患者多见,前列腺癌骨转移病灶分布于骨盆及四肢(主要为股骨)者多于肺癌骨转移患者,差异均有统计学意义(P值均<0.001),与既往研究一致[26, 27]。分析3种疾病的骨病变分布特点,均与其靠近原发病灶且局部血供较丰富、表面积较大有关;但这3种疾病均能累及全身多处,单纯根据发病部位进行鉴别的意义较小。
MM有别于骨转移瘤的CT图像特征之一是骨骼内多个病灶弥漫分布且呈蜂窝样改变。本研究中,MM患者与肺癌骨转移患者均以溶骨性骨质破坏居多、成骨性病变较少,还有一部分未出现骨质破坏。两者可能存在共同的调节机制,主要是因为成骨细胞的活性减弱,而破骨细胞导致的骨吸收增强,同时也基于肿瘤自身的独特通路,MM的溶骨性破坏可能与CD166等细胞因子对破骨细胞的激活有关,而趋化因子CXCL12的高表达可能在肺癌骨转移中发挥着重要的作用[28, 29]。与肺癌骨转移及MM患者不同的是,前列腺癌骨转移患者以成骨性骨质破坏为主,其成骨性病变患者占比明显高于前两者(P值均<0.001),提示根据骨质破坏的类型可以辅助判断病变的性质。
SUVmax是重要的PET征象之一,可反映病灶中最高的局部FDG代谢活性。有研究报道,MM病灶的SUVmax明显低于前列腺癌骨转移灶(P<0.001),SUVmax值分别为5.01±2.13和10.03±3.83[9]。本研究结果显示:MM病灶以轻中度代谢为主,SUVmax较低;前列腺癌骨转移病灶的SUVmax高于MM组,与既往报道类似[9,30];肺癌骨转移瘤病灶以高代谢为主,SUVmax最高,绝大多数在6.0以上,甚至达到29.1,高于文献报道[31, 32],这可能是因为我们采用的是基于病例而非病灶的分析方法,以具有多个(≥5个)PET/CT异常放射性浓聚灶的病例为主,且考虑到临床应用的简便性,选取的是多个骨病灶中的18F-FDG高代谢病灶。由此可见,溶骨性骨转移瘤对18F-FDG的摄取高于成骨性骨转移瘤,而MM对18F-FDG的摄取最低,可据此区别骨转移瘤与MM。研究表明,骨转移瘤形成机制与骨髓瘤不一样[33, 34],其骨转移灶的形成需要大量的能量供应,造成局部糖代谢明显增高。对于肺癌骨转移,其溶骨性骨转移灶内主要是肿瘤细胞,且病灶进展迅速导致无氧糖酵解增加,从而使代谢高于周围正常组织;而前列腺癌的成骨性转移灶内肿瘤细胞较少,18F-FDG代谢增高并不明显。此外,临床常联合尿本周蛋白这项特殊检测指标来鉴别MM与肿瘤骨转移[35],该指标在MM患者中的阳性率为50%左右,而在骨转移瘤患者中的阳性率极低。故笔者认为,临床医生应全面分析骨骼多发肿瘤性病变患者的临床特征,在条件允许情况下推荐行18F-FDG PET/CT检查,根据病灶的骨质结构与代谢活性变化,结合尿本周蛋白水平等生化指标鉴别诊断MM与骨转移瘤。
需要注意的是,18F-FDG PET/CT显像中病灶分布、骨质破坏和SUVmax等指标并不是鉴别多发性骨髓瘤与骨转移瘤的首要鉴别点,对于原发灶不明、实验室检查阴性或其他影像学检查仍难以诊断的病例,可利用18F-FDG PET/CT显像进行辅助鉴别。对于PET示18F-FDG摄取增高但CT未见明显骨质密度改变的病灶,不能轻易排除骨肿瘤的可能性。SUVmax值的高低对MM与骨转移瘤的鉴别具有一定的提示作用,除了运用SUVmax值作为鉴别诊断的条件之一以外,还需要结合同机CT上的骨形态特征进行综合判断。此外,18F-FDG PET/CT全身检查可同时探查骨肿瘤的原发灶,进而提供重要的鉴别诊断信息:若18F-FDG PET/CT显示全身多发溶骨性骨质破坏,且未探测到明确的原发灶,提示有多发性骨髓瘤的可能;相反,若在肺部探测到明确的原发灶,则肺癌骨转移诊断较为明确;若18F-FDG PET/CT显示前列腺代谢不均匀增高,且伴有全身多发成骨性骨质破坏,则可提示前列腺癌并多发骨转移[36]。
综上所述,对于CT上显示多发溶骨性骨破坏的患者,应结合PET图像上18F-FDG的高摄取区域及其SUVmax值以鉴别MM与肺癌骨转移,而多发成骨性骨质破坏患者则首先考虑前列腺癌骨转移的可能。18F-FDG PET/CT兼备PET与CT的优点,有助于综合评价病灶的骨质结构和代谢特征,对肺癌骨转移、前列腺癌骨转移和MM的鉴别诊断具有较高的临床应用价值。本研究为单中心、回顾性研究,样本量较小,研究结果存在一定的偏倚。后续研究可加大样本量,对每例患者的所有骨病灶进行分析,并比较PET/CT显像与其他检查方法对于MM与肿瘤骨转移的鉴别价值,为临床诊断提供更多的信息。
高俊刚, 尚宇, 刘翔, 等. 18F-FDG PET/CT显像对肺癌骨转移、前列腺癌骨转移与多发性骨髓瘤的鉴别诊断[J]. 中华解剖与临床杂志, 2024, 29(1): 1-8. DOI: 10.3760.cma.j.cn101202-20230425-00115.
所有作者声明不存在利益冲突



























