
探讨磁共振成像技术动脉自旋标记(ASL)评估肾移植术后移植肾纤维化程度的可行性及其应用价值。
横断面研究。纳入2021年12月至2022年12月于苏州大学附属第一医院就诊的移植肾受者,所有受试者均行ASL磁共振检查,通过后处理软件获得移植肾血流参数,即肾皮质肾血流量(RBF)。根据患者移植肾Banff纤维化评分进行分组比较。采用单因素方差分析比较各组间移植肾皮质RBF的差异;采用Spearman相关分析肾皮质RBF与移植肾纤维化评分的相关性。采用受试者工作特征(ROC)曲线分析肾皮质RBF及实验室指标鉴别不同纤维化程度移植肾的能力,使用Delong检验比较曲线下面积(AUC)。
共纳入60例患者,男42例,女18例,年龄(44.6±10.8)岁。患者根据Banff纤维化评分分为4组:ci0组(纤维化评分0分,11例)、ci1组(纤维化评分1分,21例)、ci2组(纤维化评分2分,20例)、ci3组(纤维化评分3分,8例)。随着移植肾纤维化程度加重,肾皮质RBF趋于减小,ci0~3组肾皮质RBF分别为(214.9±28.5)、(181.7±29.3)、(158.8±39.2)、(123.1±27.2)ml·(100 g)-1·min-1,差异有统计学意义(F=14.02,P<0.001)。移植肾皮质RBF与Banff纤维化评分呈中度负相关(r=-0.644,P<0.001)。移植肾皮质RBF和24 h尿蛋白区分ci0和ci1~3的AUC分别为0.881(95%CI:0.772~0.950)和0.680(95%CI:0.547~0.795),肾皮质RBF的AUC高于24 h尿蛋白(P=0.047)。肾皮质RBF区分ci0~1和ci2~3、ci0~2和ci3的AUC分别为0.796(95%CI:0.673~0.889)和0.900(95%CI:0.795~0.963)。
ASL能够定量评估移植肾血流灌注,对于区分不同纤维化程度的移植肾均有较高的效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是终末期肾病患者最理想的治疗方案,但各种术后常见并发症如移植肾排斥、慢性移植肾损伤等,均可能会影响移植肾的存活[1, 2]。慢性移植肾损伤在肾移植术后不可避免,限制了移植肾的寿命,常常导致移植肾功能障碍甚至移植肾失功[3]。移植肾间质纤维化是一种常见、不可逆、进行性的慢性移植肾损伤,是移植肾预后的重要预测因子[4, 5]。移植肾间质纤维化以细胞外基质成分的过量沉积为特点,伴有间质炎性细胞浸润和组织微结构紊乱[6]。移植肾穿刺活检是目前评价移植肾纤维化程度的金标准,但受限于操作的有创性和活检样本量的局限性。此外,纤维化在移植肾内分布并不均匀,活检得到的样本量无法准确地反映整个肾脏纤维化程度[7]。
近年来,功能磁共振成像(magnetic resonance imaging,MRI)在移植肾中的应用愈加成熟,为解剖成像与多参数功能信息的结合开辟了新的可能性[8, 9]。动脉自旋标记(arterial spin labeling,ASL)使用血液作为内源性造影剂,无需引入外源性造影剂即可进行组织灌注测量。既往研究表明,ASL测得的肾皮质肾血流量(renal blood flow,RBF)与金标准所测值相当,慢性肾脏病与移植肾功能障碍患者的肾血流灌注显著减少[10, 11, 12, 13]。由于间质纤维化与毛细血管减少和微血管灌注受损有关,因此推测ASL测得的RBF可以反映纤维化的程度[14]。本研究旨在探究ASL在评估移植肾间质纤维化程度的可行性及其应用价值。
横断面研究。纳入2021年12月至2022年12月于苏州大学附属第一医院就诊的移植肾受者。纳入标准:(1)有移植肾穿刺活检指征:血清肌酐升高、尿检异常等;(2)术后接受骁悉/米芙+泼尼松+他克莫司/环孢素A三联抗排异治疗;(3)年龄≥18周岁。排除标准:(1)有MRI检查禁忌证(如幽闭恐惧症、子宫金属节育环等);(2)MRI检查时发现移植肾巨大囊肿、血肿、梗死、肿瘤、动静脉严重狭窄等异常情况。本研究经苏州大学附属第一医院伦理委员会批准(伦理审批号:2022-412),所有患者均知情同意。
1. 资料收集:(1)所有受试者的基线人口学特征、实验室指标、病理穿刺结果,包括性别、年龄、移植术后时间、血清肌酐、胱抑素C、血红蛋白量、24 h蛋白尿、Banff纤维化评分。(2)记录所有受试者MRI检查当日血清肌酐,根据慢性肾脏病流行病学合作公式计算估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)。MRI检查时间与移植肾穿刺时间间隔在48 h内。
2. 分组方法:移植肾病变的诊断和半定量评估参照2019年Banff移植病理学诊断标准[15],Banff病变为涉及肾小管、血管或肾小球的病变,包括肾小球炎、间质纤维化、肾小管萎缩等,病变评分0~3分,严重程度逐渐上升。根据Banff纤维化评分结果,将所有受试者分为4组:ci0组(纤维化评分0分,皮质纤维化<5%)、ci1组(纤维化评分1分,皮质纤维化5%~25%)、ci2组(纤维化评分2分,皮质纤维化>25%~50%)、ci3组(纤维化评分3分,皮质纤维化>50%)。
MRI扫描采用Philips 1.5T MRI(荷兰飞利浦公司),采用28相控阵体部线圈。扫描序列包括T1加权像(T1WI)、T2加权像(T2WI)、ASL。扫描范围为肋弓下缘至耻骨联合下缘。ASL的扫描参数如下:重复时间:3 963 ms,回波时间:15 ms,体素大小:3.75 mm×3.75 mm×8.00 mm,视野:240 mm×240 mm×88 mm,快速自旋回波因子:20,平面回波因子:15,8个动态。
应用飞利浦后处理工作站处理得到所有移植肾的RBF图。以横断位T1WI为参考,选取靠近肾脏横轴最大径层面的图像,避开肾脏边缘、血管及集合系统,在移植肾RBF图上手动勾画移植肾皮质轮廓,得到相应区域的RBF。由2名高年资放射科医师采用盲法在移植肾RBF图上进行勾画测量,记录2名医师所测RBF,去掉明显偏倚值,取平均值。
采用SPSS 25.0统计学软件进行数据分析。采用组内相关系数(intraclass correlation coefficient,ICC)比较2名测量者所测RBF的一致性,ICC>0.75 表示一致性良好。对计量资料进行正态性检验,符合正态分布的计量资料以表示,组间比较采用单因素方差分析,进一步两两比较采用SNK法;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Kruskal-Wallis H检验。分类变量比较采用χ2检验或Fisher确切概率法。采用Spearman相关分析肾皮质RBF和eGFR与移植肾间质纤维化评分的相关性;采用Pearson相关分析肾皮质RBF与eGFR之间的相关性,r<0.3为弱相关,0.3≤r<0.7为中度相关,0.7≤r<1.0为强相关。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析肾皮质RBF及实验室指标对不同纤维化程度移植肾的鉴别诊断价值,使用Delong检验比较ROC曲线下面积(area under the curve,AUC)。均为双侧检验,检验水准α=0.05。
纳入60例患者,男42例(70.0%),女18例(30.0%),年龄(44.6±10.8)岁。根据患者移植肾Banff纤维化评分分为4组:ci0组11例,ci1组21例,ci2组20例,ci3组8例。4组患者间年龄、性别构成、24 h尿蛋白差异均无统计学意义(均P>0.05);4组患者间移植术后时间、血清肌酐、eGFR、胱抑素C和血红蛋白差异有统计学意义(均P<0.05);进一步两两比较结果显示,ci0组移植术后时间短于ci2组;ci0、ci1、ci2组血清肌酐均低于ci3组;ci0、ci1、ci2组eGFR均高于ci3组;ci0、ci1、ci2组胱抑素C均低于ci3组,ci1组胱抑素C低于ci2组;ci1和ci2组的血红蛋白均高于ci3组(均P<0.05)(表1)。
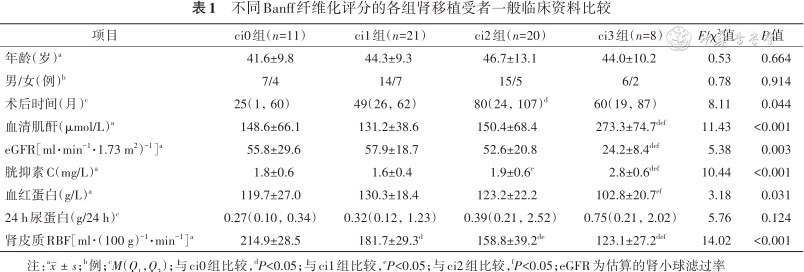
不同Banff纤维化评分的各组肾移植受者一般临床资料比较
不同Banff纤维化评分的各组肾移植受者一般临床资料比较
| 项目 | ci0组(n=11) | ci1组(n=21) | ci2组(n=20) | ci3组(n=8) | F/χ2值 | P值 |
|---|---|---|---|---|---|---|
| 年龄(岁)a | 41.6±9.8 | 44.3±9.3 | 46.7±13.1 | 44.0±10.2 | 0.53 | 0.664 |
| 男/女(例)b | 7/4 | 14/7 | 15/5 | 6/2 | 0.78 | 0.914 |
| 术后时间(月)c | 25(1,60) | 49(26,62) | 80(24,107)d | 60(19,87) | 8.11 | 0.044 |
| 血清肌酐(μmol/L)a | 148.6±66.1 | 131.2±38.6 | 150.4±68.4 | 273.3±74.7def | 11.43 | <0.001 |
| eGFR[ml·min-1·1.73 m2)-1]a | 55.8±29.6 | 57.9±18.7 | 52.6±20.8 | 24.2±8.4def | 5.38 | 0.003 |
| 胱抑素C(mg/L)a | 1.8±0.6 | 1.6±0.4 | 1.9±0.6e | 2.8±0.6def | 10.44 | <0.001 |
| 血红蛋白(g/L)a | 119.7±27.0 | 130.3±18.4 | 123.2±22.2 | 102.8±20.7ef | 3.18 | 0.031 |
| 24 h尿蛋白(g/24 h)c | 0.27(0.10,0.34) | 0.32(0.12,1.23) | 0.39(0.21,2.52) | 0.75(0.21,2.02) | 5.76 | 0.124 |
| 肾皮质RBF[ml·(100 g)-1·min-1]a | 214.9±28.5 | 181.7±29.3d | 158.8±39.2de | 123.1±27.2def | 14.02 | <0.001 |
注:a;b例;cM(Q1,Q3);与ci0组比较,dP<0.05;与ci1组比较,eP<0.05;与ci2组比较,fP<0.05;eGFR为估算的肾小球滤过率
2名测量者对肾皮质RBF的测量一致性较好,ICC为0.865,95%CI:0.785~0.917,P<0.001。ci0组[(214.9±28.5)ml·(100 g)-1·min-1]的肾皮质RBF高于ci1组[(181.7±29.3)ml·(100 g)-1·min-1]、ci2组[(158.8±39.2)ml·(100 g)-1·min-1]和ci3组[(123.1±27.2)ml·(100 g)-1·min-1],组间差异有统计学意义(F=14.02,P<0.001)。事后两两比较,各组间差异均有统计学意义(均P<0.05)(图1)。
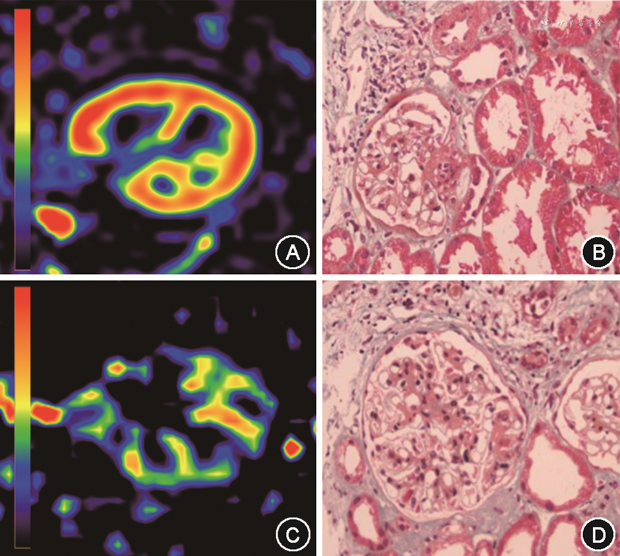

相关性分析结果显示,移植肾皮质RBF和Banff纤维化评分呈负相关(r=-0.644,P<0.001),eGFR与Banff纤维化评分ci呈负相关(r=-0.331,P=0.010),移植肾皮质RBF和eGFR呈正相关(r=0.352,P=0.006)。
肾皮质RBF和24 h尿蛋白区分ci0和ci1~3组的AUC分别为0.881(95%CI:0.772~0.950)和0.680(95%CI:0.547~0.795),RBF的AUC高于24 h尿蛋白,差异有统计学意义(Z=1.985,P=0.047)。
肾皮质RBF、血清肌酐、eGFR和胱抑素C可区分ci0~1和ci2~3组。肾皮质RBF的AUC为0.796(95%CI:0.673~0.889),当阈值为167.0 ml·(100 g)-1·min-1时,灵敏度为67.9%,特异度为81.2%;血清肌酐的AUC为0.658(95%CI:0.525~0.776),eGFR的AUC为0.661(95%CI:0.527~0.778),胱抑素C的AUC为0.720(95%CI:0.590~0.829),差异均无统计学意义(均P>0.05)。
肾皮质RBF、血清肌酐、eGFR、胱抑素C和血红蛋白均能区分ci0~2和ci3组,血清肌酐和eGFR具有较高的诊断效能(AUC均为0.935);RBF的AUC为0.900(95%CI:0.795~0.963),当阈值为142.0 ml·(100 g)-1·min-1时,灵敏度为87.5%,特异度为88.5%(表2)。
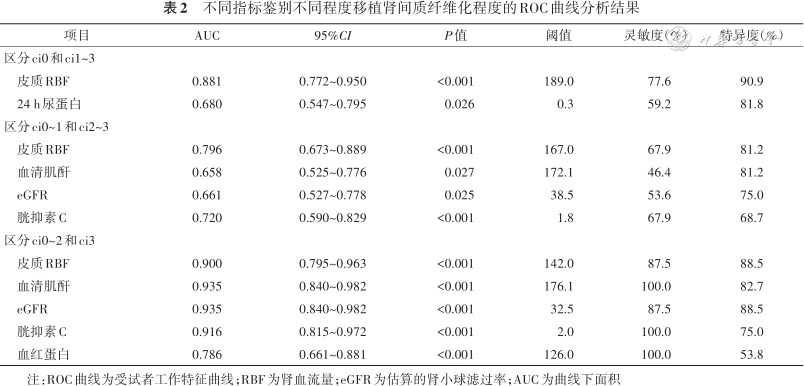
不同指标鉴别不同程度移植肾间质纤维化程度的ROC曲线分析结果
不同指标鉴别不同程度移植肾间质纤维化程度的ROC曲线分析结果
| 项目 | AUC | 95%CI | P值 | 阈值 | 灵敏度(%) | 特异度(%) |
|---|---|---|---|---|---|---|
| 区分ci0和ci1~3 | ||||||
| 皮质RBF | 0.881 | 0.772~0.950 | <0.001 | 189.0 | 77.6 | 90.9 |
| 24 h尿蛋白 | 0.680 | 0.547~0.795 | 0.026 | 0.3 | 59.2 | 81.8 |
| 区分ci0~1和ci2~3 | ||||||
| 皮质RBF | 0.796 | 0.673~0.889 | <0.001 | 167.0 | 67.9 | 81.2 |
| 血清肌酐 | 0.658 | 0.525~0.776 | 0.027 | 172.1 | 46.4 | 81.2 |
| eGFR | 0.661 | 0.527~0.778 | 0.025 | 38.5 | 53.6 | 75.0 |
| 胱抑素C | 0.720 | 0.590~0.829 | <0.001 | 1.8 | 67.9 | 68.7 |
| 区分ci0~2和ci3 | ||||||
| 皮质RBF | 0.900 | 0.795~0.963 | <0.001 | 142.0 | 87.5 | 88.5 |
| 血清肌酐 | 0.935 | 0.840~0.982 | <0.001 | 176.1 | 100.0 | 82.7 |
| eGFR | 0.935 | 0.840~0.982 | <0.001 | 32.5 | 87.5 | 88.5 |
| 胱抑素C | 0.916 | 0.815~0.972 | <0.001 | 2.0 | 100.0 | 75.0 |
| 血红蛋白 | 0.786 | 0.661~0.881 | <0.001 | 126.0 | 100.0 | 53.8 |
注:ROC曲线为受试者工作特征曲线;RBF为肾血流量;eGFR为估算的肾小球滤过率;AUC为曲线下面积
移植肾间质纤维化是一种慢性病理改变,以细胞外基质的广泛沉积为主要特征,与肾小管损伤相关的修复机制和慢性损伤刺激之间的不平衡有关[16]。纤维化进程中通常不伴有明显的临床表现,当发现肾功能损伤时,往往纤维化程度已较重[16]。评估移植肾纤维化负荷有助于识别移植肾功能障碍高危患者,从而给予适当的临床干预[4]。目前临床评估移植肾间质纤维化的金标准为穿刺活检,但其为有创检查[17]。近年来,功能MRI已成为移植肾疾病早期诊断的研究热点[9],但关于无创评估移植肾间质纤维化的研究尚处于初步探索阶段。
本研究探讨了ASL评估移植肾间质纤维化程度的可行性,结果发现肾皮质RBF随着移植肾间质纤维化程度加深而减低,提示在纤维化进程中,存在毛细血管减少和微血管灌注受损,使得肾皮质血流灌注减少。此外,本研究发现ASL测得的移植肾皮质RBF与移植肾Banff纤维化评分呈中度负相关,且能区分不同纤维化程度的移植肾。这些结果证明ASL有望成为无创评估移植肾间质纤维化的可靠辅助工具。
目前,多数研究应用了扩散张量成像、体素内不相干运动成像(intravoxel incoherent motion,IVIM)、T1 mapping等相对成熟的成像技术来评估移植肾纤维化[14,18, 19],但将ASL应用于移植肾纤维化评估的研究还相对较少。本研究发现移植肾皮质RBF随着纤维化进展呈下降趋势,这与既往研究结果一致[14]。此外,Yu等[16]比较了ASL和IVIM在评估移植肾纤维化程度中的价值,发现相较于IVIM,ASL对于纤维化变化更为敏感。这也证明了在纤维化进程中,比起由于纤维基质沉积导致的水分子弥散受限,血流灌注的变化更为显著。
间质纤维化是肾移植术后不可避免的病理改变,且往往伴随肾功能损伤,直观表现为eGFR减低,但也有研究发现部分移植肾虽然存在间质纤维化改变,而其eGFR仍在正常范围内[20]。另外,Wang等[21]的研究发现ASL测得的肾皮质RBF有助于检出处于亚临床病变的移植肾,该研究比较了组织学正常和存在亚临床病变的移植肾,发现后者的肾皮质RBF显著减少,而两组间的eGFR无明显差异。本研究结果也显示肾皮质RBF与间质纤维化有更强的相关性,这表明了相较于eGFR,肾皮质RBF能够更敏感地提示移植肾功能障碍。因此,对于移植肾纤维化和肾功能的评估,肾皮质RBF可能更优于eGFR。
本研究测得的肾皮质RBF稍高于Yu等[16]研究中所测的值,推测是因为肾皮质RBF会受多种因素的影响,如移植肾的组织病理改变,部分移植肾纤维化程度虽然较轻,但可能同时伴随其他病理改变,如炎症等,这同样会引起移植肾血流灌注的减低[22]。此外,由于ASL成像是基于标记流入血液作为内源性示踪剂,因此当患者处于贫血状态时会导致测得的肾皮质RBF减低[21,23]。因此,未来需纳入更多的病例来进一步研究肾皮质RBF能否作为预测移植肾间质纤维化的独立因素。
本研究存在以下局限性:第一,研究样本量有限,尤其是ci0组和ci3组的入组患者较少,可能会影响ASL鉴别肾移植纤维化程度的诊断效能;第二,本研究为横断面研究,未能探讨功能MRI预测移植肾纤维化进展的应用价值;第三,本研究为单中心研究,研究结果是否能推至其他中心,仍需要进行多中心研究验证。
综上所述,ASL能够定量评估移植肾血流灌注,对于移植肾纤维化的鉴别具有一定价值,有望成为临床上无创评估移植肾纤维化的一种手段。
蒋彬, 万嘉毅, 田洋洋, 等. 动脉自旋标记在评估移植肾间质纤维化中的应用价值[J]. 中华医学杂志, 2024, 104(4): 276-281. DOI: 10.3760/cma.j.cn112137-20230726-00095.
所有作者声明不存在利益冲突



























