
探讨国产免疫检查点抑制剂(ICI)与帕博利珠单抗治疗驱动基因阴性晚期非小细胞肺癌的疗效和安全性差异。
回顾性分析2017年1月1日至2022年10月1日间在湖南省肿瘤医院就诊的1 241例驱动基因阴性不可手术的ⅢB~Ⅳ期非小细胞肺癌患者资料,所有患者均接受免疫单药或免疫联合化疗治疗,1 241例患者中,男1 066例,女175例;年龄14~84岁,中位年龄62岁。67例患者接受国产ICI单药治疗,695例患者接受国产ICI联合化疗治疗;102例患者接受帕博利珠单药治疗,377例患者接受帕博利珠单抗联合化疗治疗。比较国产ICI和帕博利珠单抗单药或联合化疗的疗效和安全性。
在ICI单药组中,使用国产ICI和帕博利珠单抗的客观缓解率(ORR)分别为43.3%(29/67)和44.1%(45/102),疾病控制率(DCR)分别为79.1%(53/67)和84.3%(86/102),差异均无统计学意义(均P>0.05)。在免疫联合化疗组中,使用国产ICI和帕博利珠单抗的ORR分别为60.9%(423/695)和62.9%(237/377),DCR分别为92.9%(646/695)和91.0%(343/377),差异均无统计学意义(均P>0.05)。在ICI单药组中,使用国产ICI和帕博利珠单抗的中位无进展生存时间(PFS)分别为9.0(95%CI:3.0~15.0)个月和7.4(95%CI:4.8~9.8)个月,差异无统计学意义(P=0.660);中位总生存时间(OS)分别为27.0(95%CI:25.0~29.0)个月和22.0(95%CI:17.1~26.9)个月,差异无统计学意义(P=0.673)。在免疫联合化疗组中,使用国产ICI和帕博利珠单抗的中位PFS分别为9.0(95%CI:8.2~9.8)和10.5(95%CI:9.0~12.0)个月,差异无统计学意义(P=0.186);中位OS分别为24.0(95%CI:19.1~28.9)和26.0(95%CI:21.3~30.7)个月,差异均无统计学意义(P=0.359)。国产ICI组和帕博利珠单抗组1~2级反应性皮肤毛细血管增生症的发生率分别为14.0%(107/762)和0,≥3级反应性皮肤毛细血管增生症的发生率分别为1.0%(7/762)和0,差异均有统计学意义(均P<0.05);其他不良反应发生率差异均无统计学意义(均P>0.05)。
国产ICI与帕博利珠单抗治疗驱动基因阴性晚期非小细胞肺癌的疗效相近;除国产ICI可能会出现特异性的毛细血管增生症外,其他不良反应发生率差异不大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是中国发病率和死亡率最高的恶性肿瘤,每年新发病例约82.8万,占新发恶性肿瘤总数的24.6%;每年死亡病例约65.7万,占所有恶性肿瘤死亡人数的29.7%[1]。而非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌患者的80%以上[2]。近年来,以免疫检查点抑制剂(immune checkpoint inhibitor,ICI)细胞程序性细胞死亡受体1/程序性细胞死亡配体1(programmed cell death protein 1/programmed death ligand 1,PD-1/PD-L1)为代表的免疫治疗药物在多种肿瘤治疗中取得了令人瞩目的效果,其中帕博利珠单抗和纳武利尤单抗写入了多个国家恶性肿瘤临床治疗指南[3, 4]。但由于治疗费用昂贵,可及性差,其在临床上的应用受到限制。近年来,我国自主研发的PD-1抑制剂,如特瑞普利单抗[5]、信迪利单抗[6]、卡瑞利珠单抗[7]取得了不错的抗肿瘤疗效。目前,在随机对照试验中,鲜有国产ICI与进口ICI帕博利珠单抗头对头临床试验的比较。本研究中探讨了国产ICI与帕博利珠单抗单药或联合化疗治疗NSCLC的疗效,为临床治疗方案的选择提供更可靠的指导和决策依据。
1. 对象:回顾性纳入2017年1月1日至2022年10月1日间于湖南省肿瘤医院就诊的1 908例接受免疫治疗的NSCLC患者临床资料。纳入和排除标准:纳入标准:(1)不可手术的ⅢB~Ⅳ期肺癌,并经细胞学或组织学明确诊断为NSCLC;(2)肿瘤组织或血标本行基因检测,提示表皮生长因子受体/酪氨酸激酶(epidermal growth factor receptor/
anaplastic lymphoma kinase,EGFR/ALK)野生型;(3)有化疗、免疫治疗的适应证;(4)预计生存时间>3个月;(5)有可测量的病灶;(6)患者接受4个周期以上的治疗,有疗效评估。排除标准:(1)依从性差;(2)有化疗或免疫治疗禁忌证;(3)一般情况差,肝肾功能不全,严重心脑血管疾病;(4)接受非一线治疗和免疫巩固治疗。按照以上纳入和排除标准,1 241例接受免疫治疗联合化疗或接受免疫单药治疗的NSCLC患者进入本研究,1 241例患者中,男1 066例,女175例;年龄14~84岁,中位年龄62岁。有吸烟史992例(79.9%),美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分1 149例(92.6%),鳞癌患者715例(57.6%),Ⅳ期893例(72.0%),基线无脑转移1 101例(88.7%),基线无肝转移1 133例(91.3%),PD-L1表达已知636例(51.2%),无局部治疗1 096例(88.3%)。67例接受国产ICI单药治疗(信迪利单抗51例,卡瑞利珠单抗9例,特瑞普利单抗7例),695例接受国产ICI联合化疗治疗(信迪利单抗371例,卡瑞利珠单抗146例,替雷利珠单抗93例,特瑞普利单抗85例);102例接受帕博利珠单药治疗,377例接受帕博利珠单抗联合化疗治疗。本研究符合《赫尔辛基宣言》相关伦理要求,并经湖南省肿瘤医院伦理委员会批准(批文:CXSL1900125),所有患者均签署了知情同意书。
2. 治疗方法:病理类型为肺腺癌的患者,给予培美曲塞联合卡铂方案化疗,培美曲塞500 mg/m2,第1天,卡铂药物浓度-时间曲线下面积(area under the plasma concentration time curve,AUC)=5~6,第1天,每21 d为1个治疗周期。病理类型为肺鳞癌患者,给予结合型白蛋白紫杉醇联合卡铂方案化疗,白蛋白紫杉醇260 mg/m2,第1天,卡铂AUC=5~6,第1天,每21 d为1个治疗周期。免疫治疗:帕博利珠单抗200 mg,第1天;或替雷利珠单抗200 mg,第1天;或卡瑞利珠单抗200 mg,第1天;或信迪利单抗200 mg,第1天;或特瑞普利单抗240 mg,第1天,每21 d为1个治疗周期。
3. 随访与观察指标:免疫治疗联合化疗和免疫单药治疗每行2个周期治疗后,复查胸腹部增强CT,头部MRI等检查评估,并行血常规、肝肾功能检查评估药物安全性,直到患者疾病进展或不能耐受。随访截至2022年10月1日,随访率为90.1%(1 241/1 378)。全组患者随访时间为1.4~58个月,中位随访时间为24个月。参照实体瘤的疗效评级标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1 版进行疗效评价,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病进展(progressive disease,PD)、疾病稳定(stable disease,SD)。客观缓解率(objective response rate,ORR)的定义为(CR+PR)例数/总例数×100%。疾病控制率(disease control rate,DCR)的定义为(CR+PR+SD)例数/总例数×100%。无进展生存时间(progression free survival,PFS)的定义为第1次用药到疾病进展、死亡的时间或末次随访时间。总生存时间(overall survival,OS)的定义为从诊断日期开始至任何原因所致死亡的日期或末次随访日期。不良反应评价参照常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版,分为5级。
4. 统计学方法:采用SPSS 26.0统计学软件进行统计学分析。计数资料采用例数和百分数描述,组间比较采用χ2检验。以Kaplan-Meier法绘制生存曲线,并行log-rank非参数检验比较组间差异。双侧检验,检验水准为α=0.05。
1. ICI单药和免疫联合化疗组中国产ICI与帕博利珠单抗患者的临床特征比较:由表1可见,无论是免疫单药组,还是免疫联合化疗组,国产ICI与帕博利珠单抗患者的年龄、性别、吸烟史、ECOG评分、TNM分期、基线脑转移、基线肝转移以及局部治疗的差异均无统计学意义(均P>0.05),而PD-L1的表达率差异均有统计学意义(均P<0.05);其中免疫联合化疗组中国产ICI与帕博利珠单抗患者的病理类型差异亦有统计学意义(P<0.01,表1)。
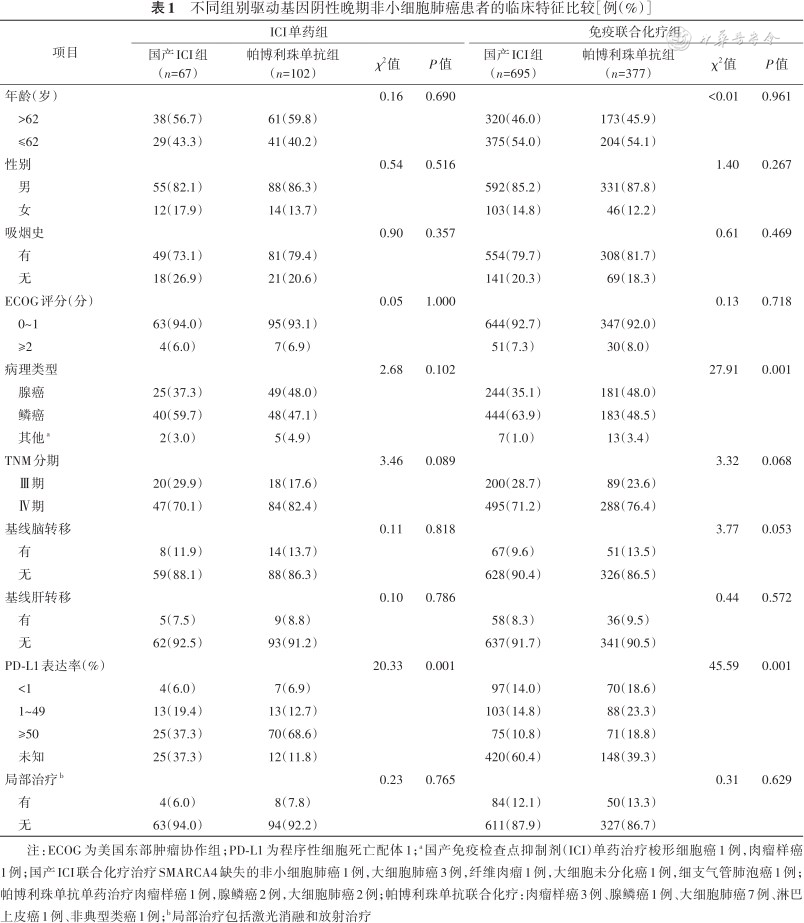
不同组别驱动基因阴性晚期非小细胞肺癌患者的临床特征比较[例(%)]
不同组别驱动基因阴性晚期非小细胞肺癌患者的临床特征比较[例(%)]
| 项目 | ICI单药组 | 免疫联合化疗组 | ||||||
|---|---|---|---|---|---|---|---|---|
| 国产ICI组(n=67) | 帕博利珠单抗组(n=102) | χ2值 | P值 | 国产ICI组(n=695) | 帕博利珠单抗组(n=377) | χ2值 | P值 | |
| 年龄(岁) | 0.16 | 0.690 | <0.01 | 0.961 | ||||
| >62 | 38(56.7) | 61(59.8) | 320(46.0) | 173(45.9) | ||||
| ≤62 | 29(43.3) | 41(40.2) | 375(54.0) | 204(54.1) | ||||
| 性别 | 0.54 | 0.516 | 1.40 | 0.267 | ||||
| 男 | 55(82.1) | 88(86.3) | 592(85.2) | 331(87.8) | ||||
| 女 | 12(17.9) | 14(13.7) | 103(14.8) | 46(12.2) | ||||
| 吸烟史 | 0.90 | 0.357 | 0.61 | 0.469 | ||||
| 有 | 49(73.1) | 81(79.4) | 554(79.7) | 308(81.7) | ||||
| 无 | 18(26.9) | 21(20.6) | 141(20.3) | 69(18.3) | ||||
| ECOG评分(分) | 0.05 | 1.000 | 0.13 | 0.718 | ||||
| 0~1 | 63(94.0) | 95(93.1) | 644(92.7) | 347(92.0) | ||||
| ≥2 | 4(6.0) | 7(6.9) | 51(7.3) | 30(8.0) | ||||
| 病理类型 | 2.68 | 0.102 | 27.91 | 0.001 | ||||
| 腺癌 | 25(37.3) | 49(48.0) | 244(35.1) | 181(48.0) | ||||
| 鳞癌 | 40(59.7) | 48(47.1) | 444(63.9) | 183(48.5) | ||||
| 其他a | 2(3.0) | 5(4.9) | 7(1.0) | 13(3.4) | ||||
| TNM分期 | 3.46 | 0.089 | 3.32 | 0.068 | ||||
| Ⅲ期 | 20(29.9) | 18(17.6) | 200(28.7) | 89(23.6) | ||||
| Ⅳ期 | 47(70.1) | 84(82.4) | 495(71.2) | 288(76.4) | ||||
| 基线脑转移 | 0.11 | 0.818 | 3.77 | 0.053 | ||||
| 有 | 8(11.9) | 14(13.7) | 67(9.6) | 51(13.5) | ||||
| 无 | 59(88.1) | 88(86.3) | 628(90.4) | 326(86.5) | ||||
| 基线肝转移 | 0.10 | 0.786 | 0.44 | 0.572 | ||||
| 有 | 5(7.5) | 9(8.8) | 58(8.3) | 36(9.5) | ||||
| 无 | 62(92.5) | 93(91.2) | 637(91.7) | 341(90.5) | ||||
| PD-L1表达率(%) | 20.33 | 0.001 | 45.59 | 0.001 | ||||
| <1 | 4(6.0) | 7(6.9) | 97(14.0) | 70(18.6) | ||||
| 1~49 | 13(19.4) | 13(12.7) | 103(14.8) | 88(23.3) | ||||
| ≥50 | 25(37.3) | 70(68.6) | 75(10.8) | 71(18.8) | ||||
| 未知 | 25(37.3) | 12(11.8) | 420(60.4) | 148(39.3) | ||||
| 局部治疗b | 0.23 | 0.765 | 0.31 | 0.629 | ||||
| 有 | 4(6.0) | 8(7.8) | 84(12.1) | 50(13.3) | ||||
| 无 | 63(94.0) | 94(92.2) | 611(87.9) | 327(86.7) | ||||
注:ECOG为美国东部肿瘤协作组;PD-L1为程序性细胞死亡配体1;a国产免疫检查点抑制剂(ICI)单药治疗梭形细胞癌1例,肉瘤样癌1例;国产ICI联合化疗治疗SMARCA4缺失的非小细胞肺癌1例,大细胞肺癌3例,纤维肉瘤1例,大细胞未分化癌1例,细支气管肺泡癌1例;帕博利珠单抗单药治疗肉瘤样癌1例,腺鳞癌2例,大细胞肺癌2例;帕博利珠单抗联合化疗:肉瘤样癌3例、腺鳞癌1例、大细胞肺癌7例、淋巴上皮癌1例、非典型类癌1例;b局部治疗包括激光消融和放射治疗
2. ICI单药和免疫联合化疗组使用国产ICI与帕博利珠单抗患者的近期疗效比较:在ICI单药组中,使用国产ICI和帕博利珠单抗的ORR分别为43.3%和44.1%,差异无统计学意义(χ2=0.01,P=1.000);DCR分别为79.1%和84.3%,差异无统计学意义(χ2=0.75,P=0.415)。在免疫联合化疗组中,使用国产ICI和帕博利珠单抗的ORR分别为60.9%和63.1%,差异无统计学意义(χ2=0.41,P=0.554);DCR分别为93.0%和91.0%,差异无统计学意义(χ2=1.33,P=0.281;表2)。
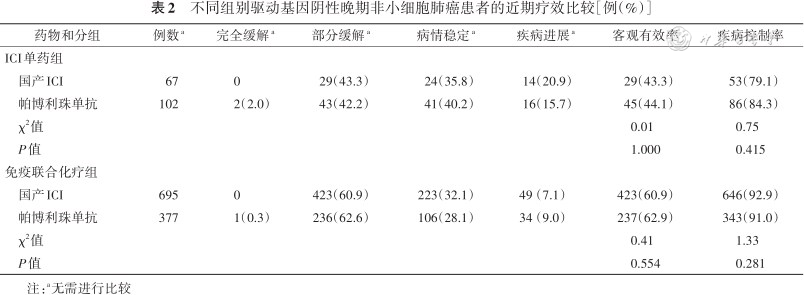
不同组别驱动基因阴性晚期非小细胞肺癌患者的近期疗效比较[例(%)]
不同组别驱动基因阴性晚期非小细胞肺癌患者的近期疗效比较[例(%)]
| 药物和分组 | 例数a | 完全缓解a | 部分缓解a | 病情稳定a | 疾病进展a | 客观有效率 | 疾病控制率 |
|---|---|---|---|---|---|---|---|
| ICI单药组 | |||||||
| 国产ICI | 67 | 0 | 29(43.3) | 24(35.8) | 14(20.9) | 29(43.3) | 53(79.1) |
| 帕博利珠单抗 | 102 | 2(2.0) | 43(42.2) | 41(40.2) | 16(15.7) | 45(44.1) | 86(84.3) |
| χ2值 | 0.01 | 0.75 | |||||
| P值 | 1.000 | 0.415 | |||||
| 免疫联合化疗组 | |||||||
| 国产ICI | 695 | 0 | 423(60.9) | 223(32.1) | 49(7.1) | 423(60.9) | 646(92.9) |
| 帕博利珠单抗 | 377 | 1(0.3) | 236(62.6) | 106(28.1) | 34(9.0) | 237(62.9) | 343(91.0) |
| χ2值 | 0.41 | 1.33 | |||||
| P值 | 0.554 | 0.281 |
注:a无需进行比较
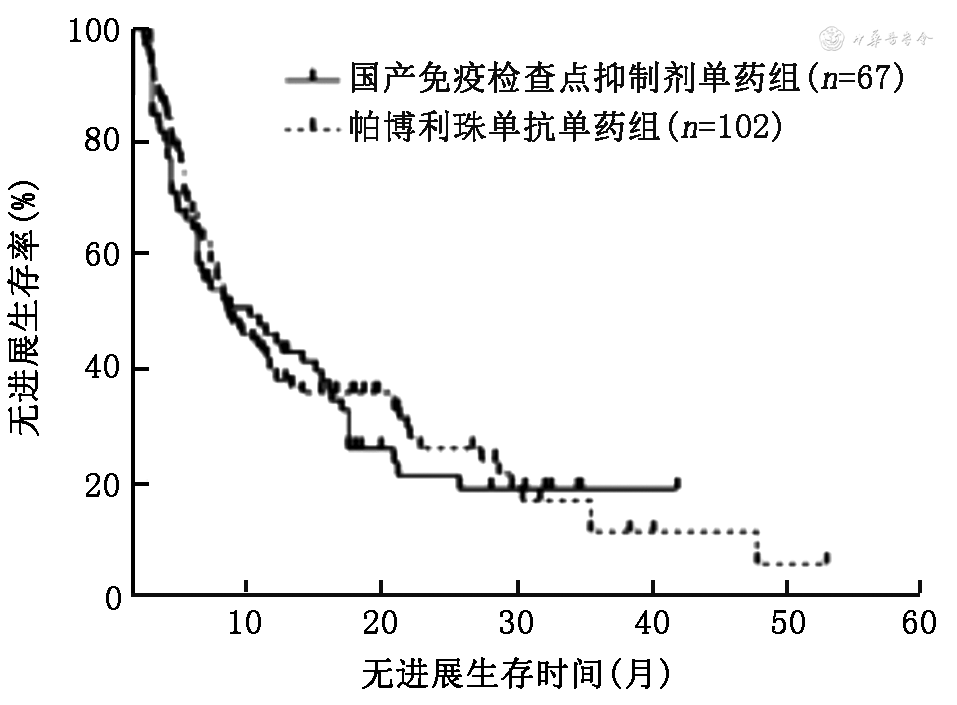
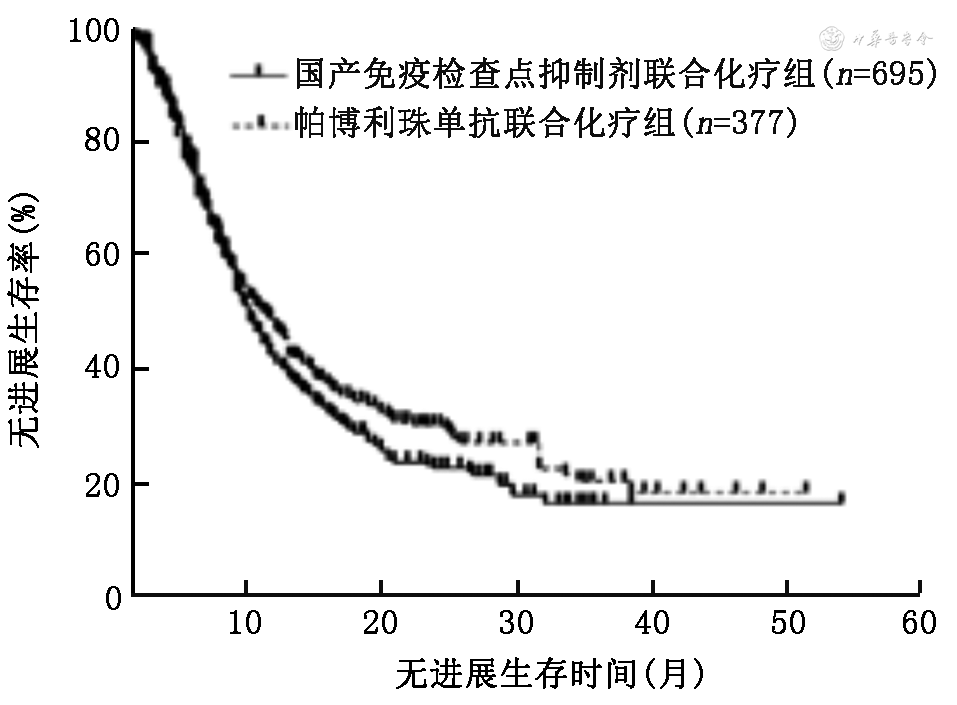
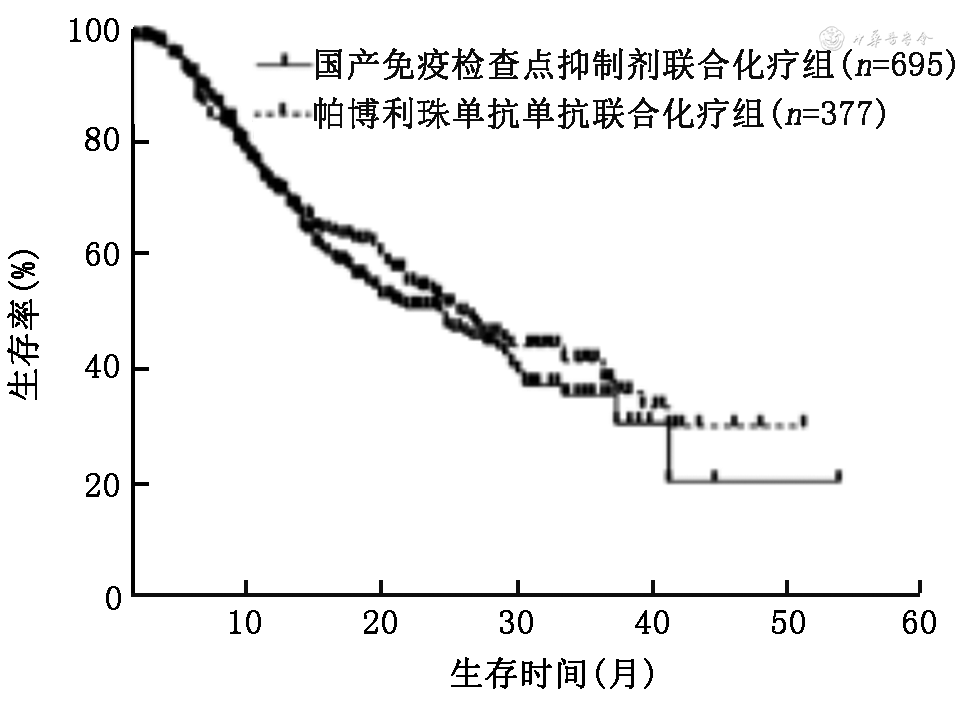
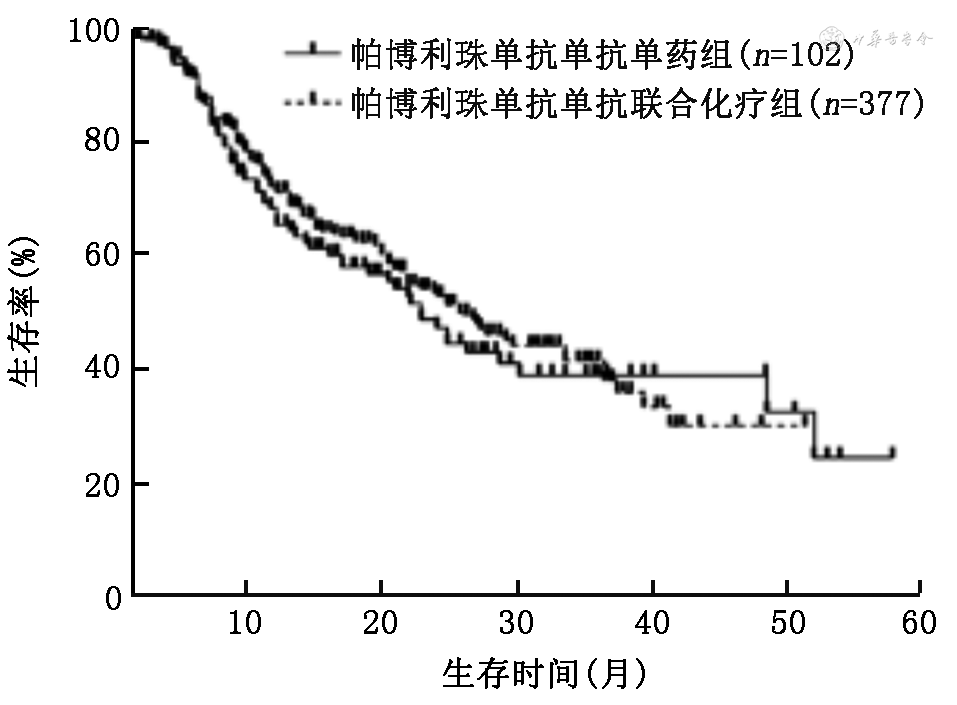
3.ICI单药和免疫联合化疗组使用国产ICI与帕博利珠单抗患者的PFS和OS的比较:在ICI单药组中,使用国产ICI和帕博利珠单抗的中位PFS分别为9.0(95%CI:3.0~15.0)个月和7.4(95%CI:4.8~9.8)个月,差异无统计学意义(χ2=0.19,P=0.660;图1);中位OS分别为27.0(95%CI:25.0~29.0)个月和22.0(95%CI:17.1~26.9)个月,差异无统计学意义(χ2=0.18,P=0.673;图2)。在免疫联合化疗组中,使用国产ICI和帕博利珠单抗的中位PFS分别为9.0(95%CI:8.2~9.8)个月和10.5(95%CI:9.0~12.0)个月,差异无统计学意义(χ2=1.75,P=0.186;图3);中位OS分别为24.0(95%CI:19.1~28.9)个月和26.0(95%CI:21.3~30.7)个月,差异无统计学意义(χ2=0.36,P=0.359;图4)。





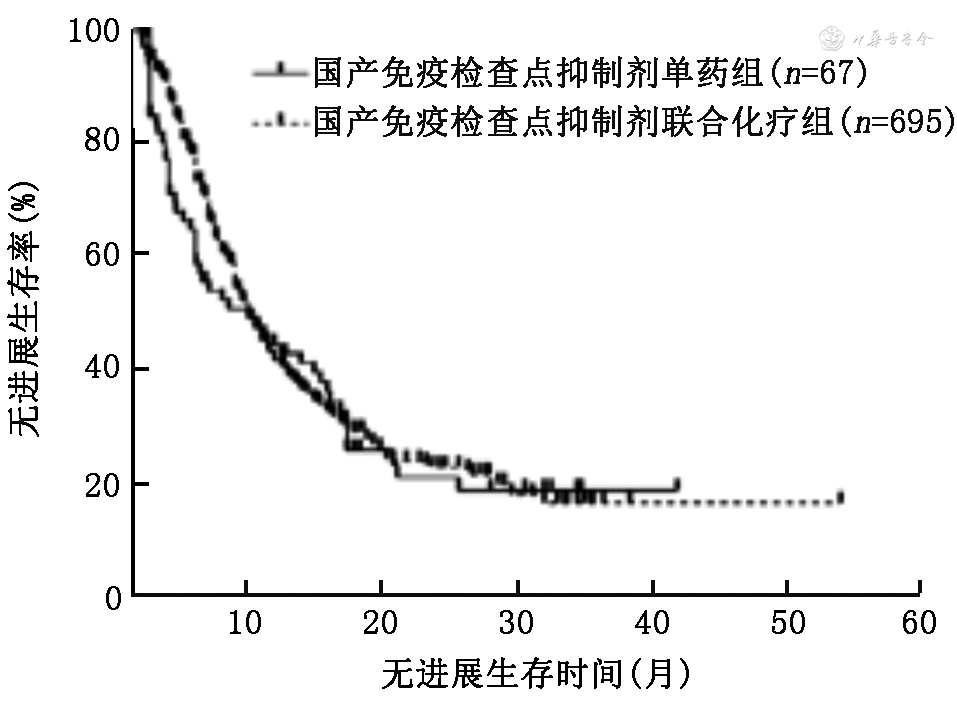
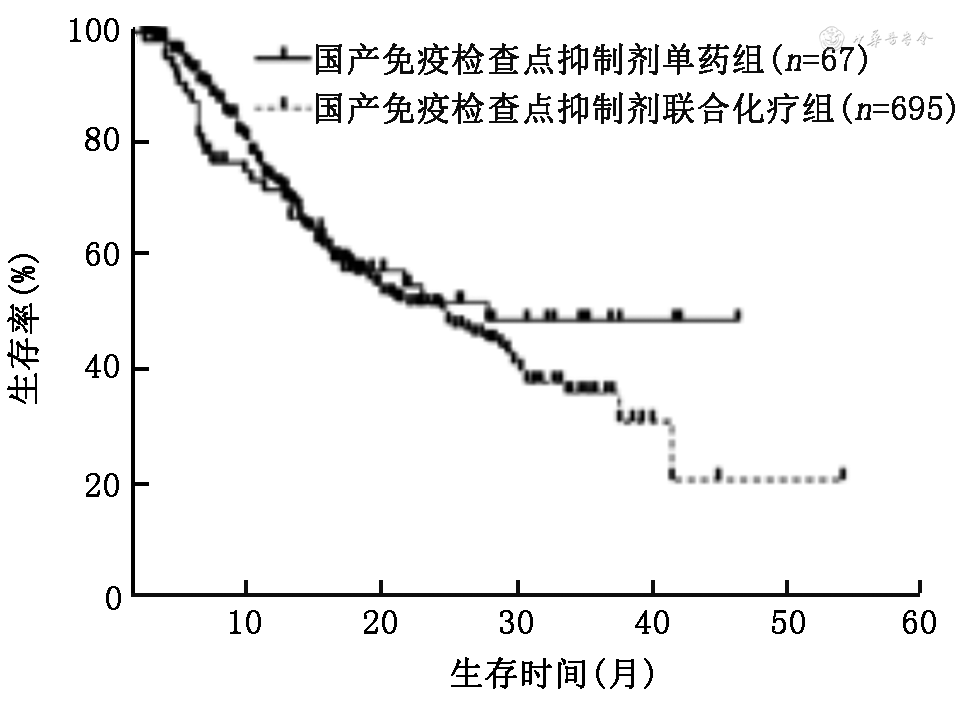
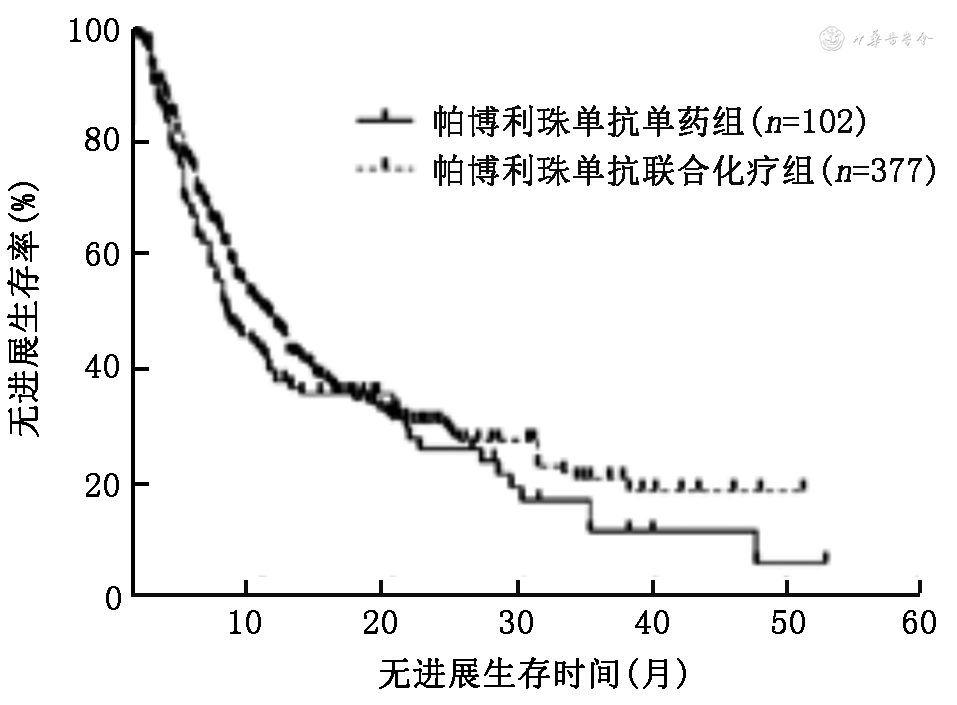
4.使用国产ICI和帕博利珠单抗单药与免疫联合化疗患者的PFS和OS比较:使用国产ICI单药组和免疫联合化疗的中位PFS分别为9.0(95%CI:3.0~15.0)个月和9.0(95%CI:8.2~9.8)个月,差异无统计学意义(χ2=0.45,P=0.502;图5);中位OS分别为27.0(95%CI:25.0~29.0)个月和24.0(95%CI:19.1~28.9)个月,差异无统计学意义(χ2=0.29,P=0.591;图6)。使用帕博利珠单抗患者单药组和免疫联合化疗的中位PFS分别为7.4(95%CI:4.8~9.8)个月和10.5(95%CI:9.0~12.0)个月,差异无统计学意义(χ2=1.92,P=0.166;图7);OS分别为22.0(95%CI:17.1~26.9)个月和26.0(95%CI:21.3~30.7)个月,差异无统计学意义(χ2=0.27,P=0.600;图8)。




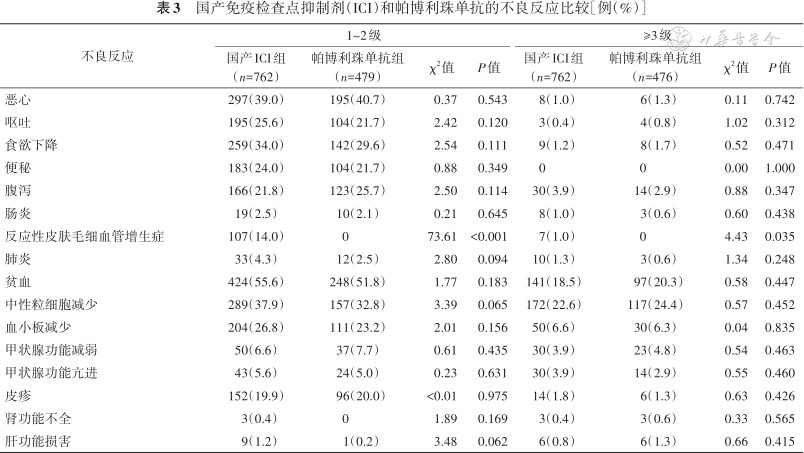
5.国产ICI和帕博利珠单抗药物不良反应的比较:由表3可见,无论是国产ICI,还是帕博利珠单抗,药物所致不良反应均以1~2级为主,≥3级不良反应少见。国产ICI组和帕博利珠单抗组1~2级反应性皮肤毛细血管增生症的发生率分别为14.0%和0,≥3级反应性皮肤毛细血管增生症的发生率分别为1.0%和0,差异均有统计学意义(P<0.01,P=0.048)。国产ICI和帕博利珠单抗均有不同程度的恶心、呕吐、食欲下降、便秘、腹泻、肠炎、肺炎、贫血、中性粒细胞减少、血小板减少、甲状腺功能减弱、甲状腺功能亢进、皮疹、肾功能不全、肝功能损害等不良反应,但发生率差异均无统计学意义(均P>0.05)。
国产免疫检查点抑制剂(ICI)和帕博利珠单抗的不良反应比较[例(%)]
国产免疫检查点抑制剂(ICI)和帕博利珠单抗的不良反应比较[例(%)]
| 不良反应 | 1~2级 | ≥3级 | ||||||
|---|---|---|---|---|---|---|---|---|
| 国产ICI组(n=762) | 帕博利珠单抗组(n=479) | χ2值 | P值 | 国产ICI组(n=762) | 帕博利珠单抗组(n=476) | χ2值 | P值 | |
| 恶心 | 297(39.0) | 195(40.7) | 0.37 | 0.543 | 8(1.0) | 6(1.3) | 0.11 | 0.742 |
| 呕吐 | 195(25.6) | 104(21.7) | 2.42 | 0.120 | 3(0.4) | 4(0.8) | 1.02 | 0.312 |
| 食欲下降 | 259(34.0) | 142(29.6) | 2.54 | 0.111 | 9(1.2) | 8(1.7) | 0.52 | 0.471 |
| 便秘 | 183(24.0) | 104(21.7) | 0.88 | 0.349 | 0 | 0 | 0.00 | 1.000 |
| 腹泻 | 166(21.8) | 123(25.7) | 2.50 | 0.114 | 30(3.9) | 14(2.9) | 0.88 | 0.347 |
| 肠炎 | 19(2.5) | 10(2.1) | 0.21 | 0.645 | 8(1.0) | 3(0.6) | 0.60 | 0.438 |
| 反应性皮肤毛细血管增生症 | 107(14.0) | 0 | 73.61 | <0.001 | 7(1.0) | 0 | 4.43 | 0.035 |
| 肺炎 | 33(4.3) | 12(2.5) | 2.80 | 0.094 | 10(1.3) | 3(0.6) | 1.34 | 0.248 |
| 贫血 | 424(55.6) | 248(51.8) | 1.77 | 0.183 | 141(18.5) | 97(20.3) | 0.58 | 0.447 |
| 中性粒细胞减少 | 289(37.9) | 157(32.8) | 3.39 | 0.065 | 172(22.6) | 117(24.4) | 0.57 | 0.452 |
| 血小板减少 | 204(26.8) | 111(23.2) | 2.01 | 0.156 | 50(6.6) | 30(6.3) | 0.04 | 0.835 |
| 甲状腺功能减弱 | 50(6.6) | 37(7.7) | 0.61 | 0.435 | 30(3.9) | 23(4.8) | 0.54 | 0.463 |
| 甲状腺功能亢进 | 43(5.6) | 24(5.0) | 0.23 | 0.631 | 30(3.9) | 14(2.9) | 0.55 | 0.460 |
| 皮疹 | 152(19.9) | 96(20.0) | <0.01 | 0.975 | 14(1.8) | 6(1.3) | 0.63 | 0.426 |
| 肾功能不全 | 3(0.4) | 0 | 1.89 | 0.169 | 3(0.4) | 3(0.6) | 0.33 | 0.565 |
| 肝功能损害 | 9(1.2) | 1(0.2) | 3.48 | 0.062 | 6(0.8) | 6(1.3) | 0.66 | 0.415 |
肺癌是全球范围内最常见的恶性肿瘤之一,其中NSCLC约占80%,以ICI为代表的肿瘤免疫治疗改写了晚期NSCLC的治疗模式。但截至目前,尚缺乏大样本采用“头对头”直接对比国产ICI与同类进口ICI疗效差异的临床研究。本研究收集了1 241例接受免疫治疗的晚期NSCLC患者的临床资料,分析国产ICI与帕博利珠单抗的疗效差异,结果显示,使用国产ICI单药与帕博利珠单抗单药的ORR分别为43.3%和 44.1%,中位PFS分别为9.0和7.4个月,差异均无统计学意义。国产ICI联合化疗与帕博利珠单抗联合化疗的ORR分别为60.9%和63.1%,中位PFS分别为9.0和10.5个月,差异均无统计学意义,提示国产ICI的疗效不逊于帕博利珠单抗。Liu等[8]的研究结果显示,国产ICI信迪利单抗单药与帕博利珠单抗单药的ORR分别为46.2%和35.7%,中位PFS分别为8.4和7.5个月;信迪利单抗联合化疗与帕博利珠单抗联合化疗组的ORR分别为57.1%和30.0%,中位PFS分别为7.0和7.2个月,与本研究结果相似。
既往研究显示,免疫单药与免疫联合化疗治疗NSCLC的疗效与安全性相似[9]。本研究结果同样提示,无论是国产ICI单药对比联合治疗,还是帕博利珠单抗单药对比联合治疗,其中位PFS和OS的差异均无统计学意义。
KEYNOTE-042和KEYNOTE-024研究结果显示,PD-L1高表达、高龄和耐受性差的NSCLC患者,可考虑帕博利珠单抗单药治疗[10, 11],目前国内尚未批准国产ICI单药作为一线NSCLC的治疗方案,部分经济有限的患者会选择国产ICI单药。另有研究表明,PD-L1高表达的NSCLC患者,免疫单药治疗的5年生存率达32%[12],而PD-L1表达≥50%的患者仅占NSCLC的29.8%[13]。联合治疗在扩大受益范围和提高免疫治疗疗效方面作用显著,在KEYNOTE-189研究[14, 15]和KEYNOTE-407研究[16, 17]中帕博利珠单抗联合化疗取得了不错的疗效;与此同时,中国自主研发的PD-1抑制剂联合化疗在CameL、CameL-sq、ORIENT-11和RATIONALE 304等临床研究中也取得了显著的疗效,但也面临着不良反应处理以及免疫持久性和疗效等方面的问题亟需解决[18, 19, 20, 21]。
本研究中免疫治疗联合化疗患者的中位PFS与OS均长于针对帕博利珠单抗联合化疗和针对信迪利单抗联合化疗治疗NSCLC的临床研究[14,16],原因可能与本研究纳入患者年龄偏小且部分患者接受过局部治疗有一定关系。
在安全性方面,本研究结果显示,除国产ICI反应性皮肤毛细血管增生症的发生率明显高于帕博利珠单抗组外,其余不良反应,包括恶心、肠炎、肺炎、贫血、皮疹、肝功能损害、甲状腺功能亢进和减退等的发生率差异均无统计学意义。免疫治疗药物相关的不良反应在促进T细胞增殖的同时,也会导致免疫系统失衡,进而引发与正常组织相关的免疫相关不良事件。
综上所述,国产ICI与帕博利珠单抗治疗NSCLC的疗效相似,除国产ICI反应性皮肤毛细血管增生症的发生率明显高于帕博利珠单抗组外,其余不良反应发生率相似。但本研究为单中心回顾性研究,存在一定的局限性,未来仍需进行大样本、前瞻性、随机对照试验加以证实。
陈阳倩, 张聿达, 言欢, 等. 国产免疫检查点抑制剂与帕博利珠单抗治疗驱动基因阴性晚期非小细胞肺癌的疗效和安全性比较[J]. 中华医学杂志, 2024, 104(4): 282-289. DOI: 10.3760/cma.j.cn112137-20230512-00775.
所有作者声明不存在利益冲突



























