
探讨造血干细胞移植(hematopoietic stem cell transplantation,HSCT)相关中枢神经系统(central nervous system,CNS)并发症的影响因素及预后。
回顾性分析华中科技大学同济医学院附属同济医院血液科2019年1月1日至2021年8月31日住院的550例HSCT受者资料,根据是否发生CNS并发症分为CNS组(24例)和非CNS组(526例),分析比较两组受者的临床资料和预后。分析CNS并发症发生的影响因素,并对差异有统计学意义的指标进行多因素logistic回归分析,对预后相关因素如年龄、性别、疾病危险度等进行Cox回归分析。
550例受者中330例为异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT),220例为自体造血干细胞移植(Autologous hematopoietic stem cell transplantation,auto-HSCT),共有24例受者(4.36%)发生CNS并发症,其中4例发生了2种CNS并发症。并发症的类型包括颅内感染8例(28.57%),移植相关血栓性微血管病(thrombotic microangiopathy,TMA)6例(21.43%),中枢肿瘤侵犯4例(14.29%),颅内出血4例(14.29%),脑白质病2例(7.14%),不明原因脑病4例(14.29%)。Logisitic回归分析CNS并发症的影响因素,结果显示:血小板植入时间(β=0.084,OR=1.088,P=0.048)、CMV感染(β=1.295,OR=3.65,P=0.008)与HSCT受者CNS并发症的发生呈正相关,年龄(β=-0.052,OR=0.949,P=0.004)与HSCT受者CNS并发症的发生呈负相关。24例发生CNS并发症的受者9例(37.50%)死亡,其中3例颅内感染,3例脑出血,2例TMA,1例不明原因脑病。血小板植入时间是HSCT受者发生CNS并发症预后不良的独立危险因素。
年龄、CMV感染、血小板植入时间均是发生HSCT后CNS并发症的相关因素。血小板植入时间是HSCT受者发生CNS并发症预后不良的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近几十年来,造血干细胞移植(hematopoietic stem cell transplantation,HSCT)已经广泛应用于各种血液系统恶性肿瘤和遗传性疾病。随着移植技术的进步,移植相关死亡率有所降低,但移植后中枢神经系统(central nervous system,CNS)并发症仍然常见,是HSCT受者死亡的重要原因。相关研究显示,HSCT后CNS并发症的发生率高达9.7%~70.3%,死亡率达10%[1,2]。本研究回顾性分析华中科技大学同济医学院附属同济医院2019年1月1日至2021年8月31日期间的550例造血干细胞移植受者的临床资料,总结分析了移植后CNS并发症的发病率、临床特征和危险因素,现在汇报如下:
回顾性分析华中科技大学同济医学院附属同济医院2019年1月1日至2021年8月31日住院的550例造血干细胞移植受者资料。入组标准:2019年1月1日至2021年8月31日期间在本院行异基因造血干细胞移植或者自体造血干细胞移植的血液疾病受者。排除标准:研究资料不齐全的受者。所有受者和家属都签署了同济医院批准的移植治疗知情同意书。
造血干细胞移植发生的CNS并发症为移植预处理化疗后发生的并发症,其诊断依据受者的症状、体征、头颅CT及MRI等影像学检查、脑脊液检查,并依据相应诊断指南:造血干细胞移植相关血栓性微血管病诊断和治疗中国专家共识(2021年版)、中国脑出血诊治指南(2019版)等相关诊治指南和共识[3,4]。其中具有临床意义的症状包括:发热、癫痫发作、视觉障碍、颅神经麻痹、言语障碍、肢体瘫痪和头痛等。病因分为6种:颅内出血、脑白质病、中枢肿瘤侵犯、颅内感染、移植相关血栓性微血管病(thrombotic microan-giopathy,TMA)[3]和原因不明的脑病。
所有白血病及高度侵袭性淋巴瘤受者均予以BU/CY(环磷酰胺联合马利兰)为基础的清髓预处理方案,其中18例受者联合全身照射(Total Body Irradiation,TBI)。再生障碍性贫血受者予以降低剂量BU/CY为基础的非清髓预处理方案或Post-CTX方案。
BU/CY方案:阿糖胞苷(Ara-C,4 g·m-2·d-1,移植前10天到移植前9天),白消安(BU,3.2 mg·kg-1·d-1,移植前8天到移植前6天),环磷酰胺(CTX,1.8 g·m-2·d-1,移植前5天到移植前4天),Me-CCNU(250 mg·m-2·d-1,移植前3天),兔抗人胸腺细胞球蛋白(ATG,2.5 mg·kg-1·d-1,移植前5天至移植前2天)。
再生障碍性贫血受者减低剂量BU/CY方案:BU(0.8 mg·kg-1·d-1,移植前7天至移植前6天),CY(50 mg·kg-1·d-1,移植前5天至移植前2天),ATG(2.5 mg·kg-1·d-1,移植前5天至移植前2天)
再生障碍性贫血Post-CTX方案:猪抗淋巴细胞球蛋白(ALG,30 mg·kg-1·d-1,移植前12天至移植前8天),CTX(4.5 mg·kg-1·d-1,移植前9天至移植前8天),氟达拉滨(30 mg·m-2·d-1,移植前5天至移植前4天),Bu(3.2 mg·kg-1·d-1,移植前4天至移植前3天),CTX(50 mg·kg-1·d-1,移植后第3天至移植后第4天)。
淋巴瘤受者予以BEAM(司莫司汀+美法仑+依托泊苷+阿糖胞苷)为基础的预处理方案:司莫司汀300(mg·m-2·d-1,移植前6天);依托泊苷(200 mg·m-2·d-1,移植前5天至移植前2天),阿糖胞苷400(mg·m-2·d-1,移植前5天至移植前2天)。
多发性骨髓瘤受者予以马法兰方案:马法兰(200 mg·m-2·d-1,移植前2天)。
所有异基因造血干细胞受者移植后均予以环孢素A或他克莫司、霉酚酸酯和短期甲氨蝶呤预防移植物抗宿主病(graft versus host disease,GVHD)。环孢素A的谷浓度150~250 μg/L,他克莫司的谷浓度5~20 μg/L。GVHD的治疗包括甲泼尼龙(1~2 mg·kg-1·d-1),口服或者静脉注射环孢素A(3~6 mg/kg·d,具体剂量据药物浓度调整)。二线治疗包括他克莫司(0.1~0.2 mg·kg-1·d-1,具体剂量据药物浓度调整)、重组Ⅱ型TNF受体-抗体融合蛋白和CD25单克隆抗体等方案[4]。
总结移植后受者发生颅内感染、TMA、中枢肿瘤侵犯、脑白质等并发症,观察可疑影响因素指标包括年龄、性别、危险度、EBV是否感染、CMV是否感染、性别匹配、治疗方案包含TBI、CD34干细胞(106/kg)、白细胞植入时间、血小板植入时间、白细胞是否植入、血小板是否植入,采用logistic回归分析、Cox生存分析探讨这些因素是否是引起HSCT后CNS并发症的危险因素。病例随访截止时间为2021年8月31日。
采用SPSS 23.0软件进行数据处理。对移植后中枢神经系统并发症行单因素和多因素分析采用95%可信区间(95%CI)。符合正态分布的计量资料采用 ±s表述,采用t检验、配对t检验、方差分析、协方差分析等方法;对不符合正态分布的资料计量资料采用M(Q1,Q3)或M(范围),采用秩和检验、配对秩和检验等。计数资料采用例(%)表示。组间比较采用χ2检验、校正χ2检验、Fisher精确检验等,若为等级资料则采用非参数秩和检验。影响因素分析采用逐步回归向前条件进入法单因素及多因素logistic回归分析,生存分析采用向前条件进入法单因素及多因素Cox回归模型。所有的统计检验均采用双侧检验,P值≤0.05为差异有统计学意义。
±s表述,采用t检验、配对t检验、方差分析、协方差分析等方法;对不符合正态分布的资料计量资料采用M(Q1,Q3)或M(范围),采用秩和检验、配对秩和检验等。计数资料采用例(%)表示。组间比较采用χ2检验、校正χ2检验、Fisher精确检验等,若为等级资料则采用非参数秩和检验。影响因素分析采用逐步回归向前条件进入法单因素及多因素logistic回归分析,生存分析采用向前条件进入法单因素及多因素Cox回归模型。所有的统计检验均采用双侧检验,P值≤0.05为差异有统计学意义。
淋巴瘤216例,白血病195例,再生障碍性贫血68例,骨髓增生异常综合征31例,多发性骨髓瘤27例和其他13例。
HSCT共330例,包括:单倍体造血干细胞移植(haploidentical hematopoietic stem cell transplantation,haplo-HSCT)247例,HLA全相合的血缘供者HSCT61例,HLA表型相合非血缘供者造血干细胞移植22例;自体造血干细胞移植(autologous hematopoietic stem cell transplantation,auto-HSCT)220例,其中联合CART治疗158例。
以BUCY为基础的方案279例(包括联合TBI 18例),BEAM为基础的方案183例,Post-CTX方案54例,马法兰方案27例,其他方案:FIU+CY+ATG,FIU+MEL(马法兰)+ATG等7例。
550例HSCT受者中的24例发生了CNS并发症,总体发生率4.36%。根据是否发生CNS并发症分为CNS组(24例)和无CNS组(526例)。CNS组年龄28岁(5~66岁),其中,<14岁有4例,≥14岁有24例;无CNS组;年龄38岁(2~71岁),其中,<14岁有36例,≥14岁有490例。CNS组男13例,女11例;无CNS组;男322例;女204例。两组在年龄、性别、疾病危险程度、中枢神经系统侵犯等临床特征比较,差异均无统计学意义(表1)。
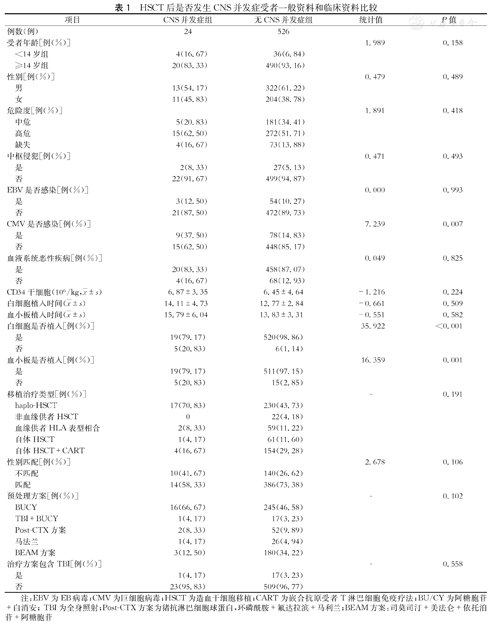
HSCT后是否发生CNS并发症受者一般资料和临床资料比较
HSCT后是否发生CNS并发症受者一般资料和临床资料比较
| 项目 | CNS并发症组 | 无CNS并发症组 | 统计值 | P值 |
|---|---|---|---|---|
| 例数(例) | 24 | 526 | ||
| 受者年龄[例(%)] | 1.989 | 0.158 | ||
| <14岁组 | 4(16.67) | 36(6.84) | ||
| ≥14岁组 | 20(83.33) | 490(93.16) | ||
| 性别[例(%)] | 0.479 | 0.489 | ||
| 男 | 13(54.17) | 322(61.22) | ||
| 女 | 11(45.83) | 204(38.78) | ||
| 危险度[例(%)] | 1.891 | 0.418 | ||
| 中危 | 5(20.83) | 181(34.41) | ||
| 高危 | 15(62.50) | 272(51.71) | ||
| 缺失 | 4(16.67) | 73(13.88) | ||
| 中枢侵犯[例(%)] | 0.471 | 0.493 | ||
| 是 | 2(8.33) | 27(5.13) | ||
| 否 | 22(91.67) | 499(94.87) | ||
| EBV是否感染[例(%)] | 0.000 | 0.993 | ||
| 是 | 3(12.50) | 54(10.27) | ||
| 否 | 21(87.50) | 472(89.73) | ||
| CMV是否感染[例(%)] | 7.239 | 0.007 | ||
| 是 | 9(37.50) | 78(14.83) | ||
| 否 | 15(62.50) | 448(85.17) | ||
| 血液系统恶性疾病[例(%)] | 0.049 | 0.825 | ||
| 是 | 20(83.33) | 458(87.07) | ||
| 否 | 4(16.67) | 68(12.93) | ||
CD34干细胞(106/kg, ±s) ±s) | 6.87±3.35 | 6.45±4.64 | -1.216 | 0.224 |
白细胞植入时间( ±s) ±s) | 14.11±4.73 | 12.77±2.84 | -0.661 | 0.509 |
血小板植入时间( ±s) ±s) | 15.79±6.04 | 13.83±3.31 | -0.551 | 0.582 |
| 白细胞是否植入[例(%)] | 35.922 | <0.001 | ||
| 是 | 19(79.17) | 520(98.86) | ||
| 否 | 5(20.83) | 6(1.14) | ||
| 血小板是否植入[例(%)] | 16.359 | 0.001 | ||
| 是 | 19(79.17) | 511(97.15) | ||
| 否 | 5(20.83) | 15(2.85) | ||
| 移植治疗类型[例(%)] | - | 0.191 | ||
| haplo-HSCT | 17(70.83) | 230(43.73) | ||
| 非血缘供者HSCT | 0 | 22(4.18) | ||
| 血缘供者HLA表型相合 | 2(8.33) | 59(11.22) | ||
| 自体HSCT | 1(4.17) | 61(11.60) | ||
| 自体HSCT+CART | 4(16.67) | 154(29.28) | ||
| 性别匹配[例(%)] | 2.678 | 0.106 | ||
| 不匹配 | 10(41.67) | 140(26.62) | ||
| 匹配 | 14(58.33) | 386(73.38) | ||
| 预处理方案[例(%)] | - | 0.102 | ||
| BUCY | 16(66.67) | 245(46.58) | ||
| TBI+BUCY | 1(4.17) | 17(3.23) | ||
| Post-CTX方案 | 2(8.33) | 52(9.89) | ||
| 马法兰 | 1(4.17) | 26(4.94) | ||
| BEAM方案 | 3(12.50) | 180(34.22) | ||
| 治疗方案包含TBI[例(%)] | - | 0.558 | ||
| 是 | 1(4.17) | 17(3.23) | ||
| 否 | 23(95.83) | 509(96.77) |
注:EBV为EB病毒;CMV为巨细胞病毒;HSCT为造血干细胞移植;CART为嵌合抗原受者T淋巴细胞免疫疗法;BU/CY为阿糖胞苷+白消安;TBI为全身照射;Post-CTX方案为猪抗淋巴细胞球蛋白,环磷酰胺+氟达拉滨+马利兰;BEAM方案:司莫司汀+美法仑+依托泊苷+阿糖胞苷
24例CNS并发症包括颅内感染8例(8.57%),TMA6例(21.43%),中枢肿瘤侵犯4例(14.29%),颅内出血4例(14.29%),脑白质病2例(7.14%),不明原因脑病4例(14.29%)。其中4例发生了2种CNS并发症:1例同时发生颅内出血和中枢肿瘤侵犯,1例同时发生颅内感染和脑白质病,1例同时发生中枢肿瘤侵犯和颅内感染,1例先后发生中枢肿瘤侵犯和颅内感染。
logistic回归结果显示:除血小板植入时间(β=0.009,OR=1.094,P=0.029)、CMV感染(β=1.237,OR=3.446,P=0.005),年龄(β=-0.036,OR=0.964,P=0.011)、白细胞是否植入(β=-3.127,OR=0.044,P<0.01)和血小板是否植入(β=-2.193,OR=0.112,P<0.01)外,其余因素与CNS并发症发生均无相关性(P>0.05)。(表2)
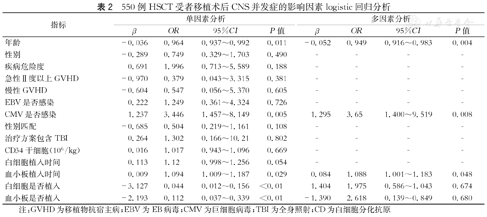
550例HSCT受者移植术后CNS并发症的影响因素logistic回归分析
550例HSCT受者移植术后CNS并发症的影响因素logistic回归分析
| 指标 | 单因素分析 | 多因素分析 | ||||||
|---|---|---|---|---|---|---|---|---|
| β | OR | 95%CI | P值 | β | OR | 95%CI | P值 | |
| 年龄 | -0.036 | 0.964 | 0.937~0.992 | 0.011 | -0.052 | 0.949 | 0.916~0.983 | 0.004 |
| 性别 | -0.289 | 0.749 | 0.329~1.703 | 0.490 | - | - | - | - |
| 疾病危险度 | 0.691 | 1.996 | 0.713~5.589 | 0.188 | - | - | - | - |
| 急性Ⅱ度以上GVHD | -0.970 | 0.379 | 0.043~3.315 | 0.381 | - | - | - | - |
| 慢性GVHD | -0.604 | 0.547 | 0.056~5.370 | 0.605 | - | - | - | - |
| EBV是否感染 | 0.222 | 1.249 | 0.361~4.324 | 0.726 | - | - | - | - |
| CMV是否感染 | 1.237 | 3.446 | 1.457~8.149 | 0.005 | 1.295 | 3.65 | 1.400~9.519 | 0.008 |
| 性别匹配 | -0.685 | 0.504 | 0.219~1.161 | 0.108 | - | - | - | - |
| 治疗方案包含TBI | 0.264 | 1.302 | 0.166~10.21 | 0.802 | - | - | - | - |
| CD34干细胞(106/kg) | 0.016 | 1.017 | 0.943~1.096 | 0.669 | - | - | - | - |
| 白细胞植入时间 | 0.113 | 1.12 | 0.998~1.256 | 0.054 | - | - | - | - |
| 血小板植入时间 | 0.009 | 1.094 | 1.009~1.187 | 0.029 | 0.084 | 1.088 | 1.001~1.183 | 0.048 |
| 白细胞是否植入 | -3.127 | 0.044 | 0.012~0.156 | <0.01 | 1.404 | 1.975 | 0.586~1.043 | 0.674 |
| 血小板是否植入 | -2.193 | 0.112 | 0.037~0.339 | <0.01 | -1.390 | 2.618 | 0.139~0.849 | 0.680 |
注:GVHD为移植物抗宿主病;EBV为EB病毒;CMV为巨细胞病毒;TBI为全身照射;CD为白细胞分化抗原
采用逐步回归向前方法进行多因素logistic回归分析,将单因素分析中有统计学意义的3个变量纳入多因素分析,结果显示:血小板植入时间(β=0.084,OR=1.088,P=0.048)、CMV感染(β=1.295,OR=3.65,P=0.008)与并发症发生正相关;年龄与并发症发生负相关(β=-0.052,OR=0.949,P=0.004)。(表2)
发生CNS并发症的24例受者中,9例死亡,病死率为37.50%,其中3例颅内感染,3例脑出血,2例TMA,1例不明原因脑病。
对预后相关因素如年龄、性别、危险度等进行单因素Cox回归分析结果显示:年龄(HR=1.058,P=0.006)、白细胞是否植入(HR=0.080,P=0.001)、白细胞植入时间(HR=1.266,P=0.030)、血小板是否植入(HR=0.080,P=0.001)和血小板植入时间(HR=1.246,P=0.019)是影响HSCT受者发生CNS并发症预后不良的危险因素。而多因素Cox分析结果显示:血小板植入时间(HR=8.399,P=0.024)是其独立危险因素。(表3)
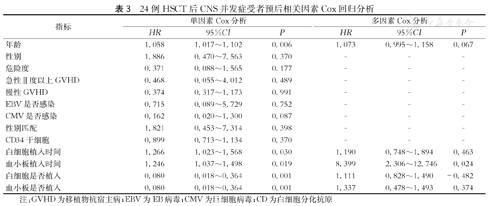
24例HSCT后CNS并发症受者预后相关因素Cox回归分析
24例HSCT后CNS并发症受者预后相关因素Cox回归分析
| 指标 | 单因素Cox分析 | 多因素Cox分析 | ||||
|---|---|---|---|---|---|---|
| HR | 95%CI | P | HR | 95%CI | P | |
| 年龄 | 1.058 | 1.017~1.102 | 0.006 | 1.073 | 0.995~1.158 | 0.067 |
| 性别 | 1.886 | 0.470~7.563 | 0.370 | - | - | - |
| 危险度 | 0.371 | 0.088~1.565 | 0.177 | - | - | - |
| 急性Ⅱ度以上GVHD | 0.468 | 0.055~4.012 | 0.489 | - | - | - |
| 慢性GVHD | 0.374 | 0.317~1.173 | 0.991 | - | - | - |
| EBV是否感染 | 0.715 | 0.089~5.729 | 0.752 | - | - | - |
| CMV是否感染 | 0.162 | 0.020~1.300 | 0.087 | - | - | - |
| 性别匹配 | 1.821 | 0.453~7.314 | 0.398 | - | - | - |
| CD34干细胞 | 0.899 | 0.713~1.134 | 0.370 | - | - | - |
| 白细胞植入时间 | 1.266 | 1.023~1.568 | 0.030 | 1.190 | 0.748~1.894 | 0.463 |
| 血小板植入时间 | 1.246 | 1.037~1.498 | 0.019 | 8.399 | 2.306~12.746 | 0.024 |
| 白细胞是否植入 | 0.080 | 0.018~0.364 | 0.001 | 1.111 | 0.828~1.490 | -0.482 |
| 血小板是否植入 | 0.080 | 0.018~0.364 | 0.001 | 1.337 | 0.478~1.493 | 0.374 |
注:GVHD为移植物抗宿主病;EBV为EB病毒;CMV为巨细胞病毒;CD为白细胞分化抗原
CNS并发症是造血干细胞移植后的常见并发症,国内外研究表明发生率5%~14%,死亡率可高达40%,是导致异基因造血干细胞移植受者死亡的独立危险因素[1,2]。本研究回顾性分析了华中科技大学同济医学院附属同济医院550例造血干细胞移植受者资料,其中24例发生了CNS并发症,发生率为4.36%,比以往报道的发生率低[5],可能与近年来移植技术持续改进后GVHD和感染等移植后并发症发生明显减少有关。
研究结果表明,造血干细胞移植后CNS并发症大多数发生在移植后早期,这与国外之前的研究类似[6,7]。最常见的CNS并发症与血管病变相关,包括TMA 6例,颅内出血4例,脑白质病2例,占所有并发症50%,这可能与移植后受者血管内皮损伤及血小板低下、凝血功能异常相关。国外一项包含351例造血干细胞移植受者的回顾性研究中,45例受者发生移植CNS并发症,其中脑梗死或短暂性脑缺血发作占24%[8]。2020年北京大学人民医院报道的6 449例HSCT受者中有8.4%出现了CNS并发症,其中2.3%(143例)受者发生脑卒中[9]。
CNS并发症中颅内感染也较常见,细菌、真菌、病毒、结核等病原体感染均可发生,这可能与移植受者免疫力低下及长期使用免疫抑制剂相关。本研究中共有8例受者发生颅内感染,已经明确的病原体包括嗜麦芽窄食单胞菌、热带念珠菌、结核杆菌、肺炎克雷伯菌和近平滑念珠菌各1例。其中1例haplo-HSCT的受者,先后发生了两次颅内感染,经过积极治疗成功治愈。该受者存在以下颅内感染的高危因素:供者年龄偏大(受者父亲),干细胞动员效果不佳(CD34+干细胞3.06×106/kg),白细胞植入延迟(移植后18 d);伴有中枢侵犯;发生严重的GVHD。意大利一项单中心研究显示,452例HSCT受者中,30例(6.6%)发生CNS并发症,其中颅内感染占30%[10]。2017年北京大学血液学研究所报道1 274例HSCT移植受者中30例(2.4%)发生病毒性脑炎,检测到呼吸道合胞病毒(43.3%)、BKV病毒(23.3%)、巨细胞病毒(CMV)等病毒[11]。国外也有移植后颅内感染相关报道[12,13]。另外,中枢肿瘤侵犯或者复发也常见,本研究中4例受者发生中枢肿瘤侵犯。北京陆道培医院曹星玉等[13]在一项640例HSCT受者的回顾性研究中发现57例发生CNS并发症,其中CNS肿瘤复发17例。在北京大学人民医院一项回顾性研究中,2 045例急性髓系白血病HSCT移植受者中,有37例在移植后发生CNS肿瘤复发,发生率为1.81%[14],其他并发症如可逆性脑病、癫痫也常见[15,16]。
目前国内外研究结果显示,移植后CNS并发症与疾病的危险度分层、供受者的匹配程度、年龄和Ⅱ度以上aGVHD等因素密切相关[7,17]。多因素logistic回归分析结果显示:血小板植入时间、CMV感染、年龄与CNS并发症发生密切相关。这些结果与国内外相关研究结果相近[9,11,13,17]。北京陆道培医院曹星玉等[13]的研究认为年龄对CNS并发症的发生率无关。
鉴于allo-HSCT与auto-HSCT的差异性,本研究将两者分别进行了单因素分析,结果显示CD34+干细胞、白细胞是否植入、血小板是否植入与allo-HSCT后CNS并发症发生负相关;CMV感染与auto-HSCT后CNS并发症发生正相关;血小板植入时间、白细胞植入时间与auto-HSCT后CNS并发症发生负相关。统计结果与整体分析类似。但多因素分析结果显示,以上影响因素与两种移植后的CNS并发症发生均不相关,这可能与研究样本量相关。另外,auto-HSCT受者CNS并发症发生较少,推测与auto-HSCT后白细胞及血小板植入较allo-HSCT早,且自体移植不需要使用免疫抑制剂相关。在auto-HSCT中,大部分CNS并发症受者曾接受CAR-T治疗,这些受者均发生不同程度的细胞因子释放综合征(cytokine release syndrome,CRS)和免疫效应细胞相关神经毒性综合征等CAR-T治疗后常见的并发症,CNS并发症的发生是否与这些因素相关有待进一步研究证实。
HSCT后CNS并发症是受者的重要死因,严重影响HSCT受者的预后,增加受者非复发死亡率,降低无进展存活率和总存活率[2,17]。一项研究发现HSCT后发生CNS并发症的受者1年存活率低于无并发症的受者(8%比72%,P<0.01)[18]。本研究结果与其相似,HSCT后CNS并发症的24例受者中,9例死亡,其中3例颅内感染,3例脑出血,2例TMA,1例不明原因脑病,死亡率达到37.50%。以往研究报道与移植后CNS并发症预后的相关因素包括感染、脑血管事件、预处理方案、病毒和真菌感染、GVHD以及无关供者等[7,19]。本研究对HSCT后CNS并发症受者预后相关因素进行单因素Cox回归分析,结果显示:年龄、白细胞植入时间和血小板植入时间是预后危险因素,白细胞是否植入和血小板是否植入是预后保护因素;多因素Cox分析结果显示:血小板植入时间是预后的独立危险因素。
本研究是单中心回顾性研究,研究结果有待进一步验证。未来可联合多中心移植单位进行多中心前瞻性研究,进一步认识HSCT后受者CNS并发症的高危因素和临床特征,更好地导临床医师进行HSCT后CNS并发症的针对性预防,并做到早发现、早治疗、精准治疗,以改善受者预后。
所有作者声明无利益冲突



























