
本文从移植心脏[冠状动脉]血管病变(cardiac graft vasculopathy,CGV)的发病机制、诊断及治疗手段的角度出发,归纳总结了现阶段对其病理学、监测与诊治的理解与认识,为科学合理地预防、诊断、治疗CGV以改善心脏移植受者生存提供思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人类首例成功心脏移植手术于1967年在南非完成,自此,同种异体心脏移植被应用于临床。如今,心脏移植已成为心脏病终末期患者首选的治疗方案,术后中位生存期超过13年[1]。
移植心脏[冠状动脉]血管病变(cardiac graft vasculopathy,CGV)是造成心脏移植后死亡的重要原因,国际心肺移植协会(International Society for Heart and Lung Transplantation,ISHLT)2019年的研究表明,CGV在移植后1年内发病率为7.7%,而10年内的发病率达到46.8%[2]。目前,CGV的发病率有所下降,但其高发病率依然是目前限制心脏移植后长期存活的关键因素。由于疾病进展缓慢,针对CGV的相关研究样本较少,不足以得出统计学结论。本文对近年来的心脏移植物血管病的发病机制、诊断和治疗最新进展进行综述。
CGV是一种进行性纤维增生性疾病,发生于冠状动脉内,临床表现为胸闷、心慌及心律失常等,症状不典型。为便于临床诊断,ISHLT提出对CGV评估的标准方法,利用血管造影技术,根据受累血管的影响程度和管腔狭窄的严重性将CGV分为4个等级,依0~3级严重程度递增[3]。由于多种因素相互作用,移植物血管内膜直接受损,继而招募更多的炎症细胞浸润,进一步破坏内膜细胞,促进血管内皮生长因子等大量释放,导致动脉平滑肌细胞增殖与迁移,管壁重塑,血管内膜增厚,管腔阻塞,形成CGV。
CGV的病理学特征为同心状的内膜增生伴纤维化,从远端微血管系统至近段主动脉弥漫分布,伴有淋巴细胞浸润,管腔狭窄,血流灌注减少,造成移植物供血供氧不足,与呈偏心状、局灶性分布的动脉粥样硬化不同[1]。
血管平滑肌细胞增殖及其基质累积是造成内膜增厚的主要原因[4]。新生内膜分为两层,一层邻近管腔,主要由疏松结缔组织组成;另一层紧邻弹性层,由平滑肌细胞组成。两层内膜交界处有T淋巴细胞浸润,多数表达CD4+;巨噬细胞和B淋巴细胞数量相对较少,与动脉粥样硬化斑块不同,后者主要由巨噬细胞组成。
由于CGV发生于移植心脏的动静脉循环系统而非受者自身血管内,免疫学因素在发病过程中较为关键。组织相容性低、急性排斥反应和慢性炎症反应是主要因素。
参与固有免疫应答的细胞包括巨噬细胞、自然杀伤细胞(natural killer cell,NK细胞)和树突状细胞(dendritic cell,DC)等。
移植物内巨噬细胞亚群的聚集与急性排斥反应直接相关。巨噬细胞通过感知微环境中的信号极化为不同表型,其中M2型通过释放转化生长因子(transforming growth factor,TGF)-β1促进血管纤维化,是形成CGV的必要条件[5]。免疫反应的调节器miRNA中,定位于巨噬细胞的miR-21表达数量相当,选择性删除miR-21或使用miR-21拮抗蛋白可以使巨噬细胞的代谢重新编程,减少M2型巨噬细胞数量,消除CGV[6]。在小鼠心脏移植模型中,巨噬细胞耗竭时CGV发病明显减少,提示巨噬细胞与CGV的相关性[7]。
NK细胞在器官移植排斥反应中发挥重要作用,通过与供者特异性抗体(donor specific antibody,DSA)结合,在不依赖T、B淋巴细胞的情况下诱导CGV[8]。在心脏移植后,NK细胞通过识别供器官表达的主要组织相容性复合体(major histocompatibility complex,MHC)-I类分子活化,表达肿瘤坏死因子(tumor necrosis factor,TNF)-α和γ干扰素等。γ干扰素参与T淋巴细胞介导的急性排斥反应,上调炎症因子,促进内皮细胞炎症反应[9]。CD16+NK细胞也在CGV中占重要地位,个性化的NK细胞靶向治疗有望成为移植后血管损伤的重要疗法[10]。
DC是专职抗原呈递细胞(antigen presenting cell,APC),由于移植过程中血管及实质组织受损,大量濒死细胞释放炎症因子迅速激活天然免疫系统,这些因子通过补体级联和Toll样受体激活DC和巨噬细胞,以招募T淋巴细胞等参与急性排斥反应[11]。也有研究提示,DC通过诱导调节性T淋巴细胞(regulatory T cell,Treg)的生成和传统T淋巴细胞的负性选择,在诱导免疫耐受中发挥重要作用[12],有望利用DC替代免疫抑制疗法,减少药物的毒副作用。
T淋巴细胞是CGV中重要的免疫细胞,可产生大量细胞因子及趋化因子。辅助性T淋巴细胞(helper T cell,Th)1通过识别APC MHCⅡ类分子提呈的抗原,激活并释放白细胞介素(interleukin,IL)-2、IL-4、IL-5、IL-6及TNF-α和γ干扰素等细胞因子,使内皮细胞活化、炎症细胞聚集,导致平滑肌细胞向内膜迁移、增殖并沉积在细胞外基质,招募更多的单核细胞和Th1细胞,使炎症过程持续进行,进一步加速CGV[13]。Th1细胞还可以直接通过凋亡相关蛋白Fas-FasL信号通路或间接促进细胞毒性CD8+T淋巴细胞和巨噬细胞介导的延迟超敏反应诱导移植损伤[14]。滤泡辅助性T淋巴细胞是诱导DSA发育的必须因素,而滤泡调节性T淋巴细胞与之相拮抗[15]。Treg识别宿主B淋巴细胞MHC-Ⅱ类分子来抑制宿主的体液免疫,但是否直接杀死B淋巴细胞或向B淋巴细胞传递抑制信号有待进一步研究[16]。
CGV与B淋巴细胞的浸润有关,大多数CGV受者的冠状动脉周围有大量B淋巴细胞群。B淋巴细胞通过产生DSA,与内皮细胞表面抗原相结合形成免疫复合物,通过补体复合物C1启动补体经典途径,形成攻膜复合物损伤内皮细胞,导致血栓形成、自身抗原暴露,引发移植物免疫反应[17]。效应B淋巴细胞还可调节CGV,通过表达Tim-4蛋白和分泌α干扰素等促炎因子加速CGV[18]。B淋巴细胞也是导致纤维化的重要因素,推测其通过产生细胞因子或间接刺激巨噬细胞和T淋巴细胞直接参与纤维化的形成[19]。
CGV发病过程由多因子参与调控,除免疫学因素以外,多种代谢风险因子均有作用。常见的风险因子包括高血压、高血脂、糖尿病、肾功能不全等等,近期研究显示心外膜脂肪量与CGV的发病程度密切相关[20]。已有研究证明巨细胞病毒和丙型肝炎病毒对CGV的影响,而近日首次报道新型冠状病毒可以加速CGV的病变[21]。此外,供者的身体条件也影响了CGV的发病率,供者的年龄、是否吸烟以及体重指数(≥25 kg/m2)与CGV有着极大的相关性。
脑死亡是移植心脏供者的主要死因,基于供者脑死亡原因的多样性,受者心脏移植术后的远期影响可出现明显差异。研究显示,创伤性脑死亡供者的心脏移植受者的存活率高于非创伤性脑死亡,其CGV的发生率也远低于非创伤性脑死亡。供者脑死亡后的儿茶酚胺分泌过多、血流动力学紊乱造成供体心脏灌注不足,移植物缺血导致的缺血再灌注损伤(ischemia reperfusion injury,IRI)使CGV的发病风险大幅增加,IRI产生大量活性氧,直接激活内皮细胞,损伤血管。长时间的冷缺血使IL-6、γ干扰素和TGF-β等增加,激活NK细胞,诱导CGV[22]。
心脏移植后,供体心脏和受者之间处于神经的离断状态,神经再形成的时间长,且功能受到一定限制。因此受者CGV多表现为无症状或非典型症状[13],难以通过临床表现对血管病变做出预测及早期干预。CGV病变不可逆,利用仪器设备进行常规监测、早期识别并干预有利于延缓该病进程,提高受者存活率。
ISHLT提供了CGV诊断分级[3,23,24,25,26],并于2023年进行了修订(表1)。
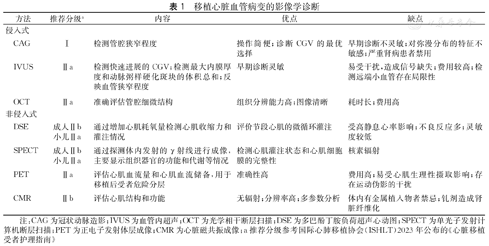
移植心脏血管病变的影像学诊断
移植心脏血管病变的影像学诊断
| 方法 | 推荐分级a | 内容 | 优点 | 缺点 |
|---|---|---|---|---|
| 侵入式 | ||||
| CAG | Ⅰ | 检测管腔狭窄程度 | 操作简便;诊断CGV的最优选择 | 早期诊断不灵敏;对弥漫分布的特征不敏感;严重肾病患者禁用 |
| IVUS | Ⅱa | 检测快速进展的CGV;检测最大内膜厚度和动脉粥样硬化斑块的体积总和;反映血管狭窄程度 | 早期诊断灵敏 | 易受干扰,造成信号缺失;费用较高;检测远端小血管存在局限性 |
| OCT | Ⅱa | 准确评估管腔细微结构 | 组织分辨能力高;图像清晰 | 耗时长;费用高 |
| 非侵入式 | ||||
| DSE | 成人Ⅱb | 通过增加心肌耗氧量检测心肌收缩力和灌注情况 | 评价节段心肌的微循环灌注 | 受高静息心率影响;不良反应多;灵敏度较低 |
| 小儿Ⅱa | ||||
| SPECT | 成人Ⅱb | 通过探测体内发射的γ射线进行成像,主要显示组织器官的功能和代谢等情况 | 检测心肌灌注状态和心肌细胞膜的完整性 | 核素辐射 |
| 小儿Ⅱa | ||||
| PET | Ⅱa | 评估心肌血流量和心肌血流储备,用于移植后受者危险分层 | 准确性高 | 费用高;易受心肌生理性摄取影响;存在运动伪影的干扰 |
| CMR | Ⅱb | 评估心肌结构和功能 | 无辐射;分辨率高;多参数分析 | 体内有金属植入物者禁忌;钆剂造成肾脏纤维化 |
注:CAG为冠状动脉造影;IVUS为血管内超声;OCT为光学相干断层扫描;DSE为多巴酚丁胺负荷超声心动图;SPECT为单光子发射计算机断层扫描;PET为正电子发射体层成像;CMR为心脏磁共振成像;a推荐分级参考国际心肺移植协会(ISHLT)2023年公布的《心脏移植受者护理指南》
冠状动脉造影(coronary angiography,CAG)是检查CGV的有效手段,ISHLT建议每年或每半年进行一次CAG评估,在儿科,考虑移植后1年同时进行CAG和血管内超声(Intravascular Ultrasound,IVUS),以排除冠状动脉疾病,监测CGV的快速发展。研究表明,利用光学相干断层扫描来评估移植后1个月纤维斑块体积可以预测心脏移植术后1年的CGV进展[27]。正电子发射体层成像通过放射性核素成像进行心肌灌注成像(myocardial perfusion imaging,MPI),获得心肌血流量和心肌流量储备等参数,有效评估微循环及心外膜,更好地反映CGV的病理生理学,在准确性方面超过了CAG和IVUS[28]。
近年来,冠状动脉CT血管成像(coronary computed tomography angiography,CCTA)技术由于其非侵入性和高灵敏度的优势逐渐应用于CGV的早期诊断[29],经CCTA可检测出冠状动脉壁体积-长度比、管壁负荷和纤维化组织等3个与CGV相关的指标[30];同时,CCTA和CT-MPI的联合使用可对CGV的冠状动脉及微血管成分进行一站式评估,有望成为早期监测手段[31],需注意碘造影剂产生的过敏反应及肾损伤风险。此外,Peyster等[32]利用计算方法,对心肌内膜活检组织的数字病理图像进行分析,针对受者提供个性化的预测,提高移植术后CGV发展预测的准确性。
CGV的发病原因复杂,目前尚无有效的治疗手段。临床更倾向于在疾病发展早期进行干预,以延缓疾病进展,提高受者存活率。
心脏移植后,须针对CGV进行一级预防,一旦确诊无改善预后的有效方案。预防应从供者选择开始,持续整个移植物的生命周期。ISHLT指出,CGV的一级预防应包括严格控制心血管病风险因子、积极参与体育锻炼、健康饮食等[24]。
CGV的发生在临床实践中不断演变,mTOR抑制剂和他汀类药物等的使用改变了它的发展进程[3]。
免疫排斥反应是CGV最主要的发病原因,而近年免疫抑制剂的使用提高了心脏移植物的存活率。规范使用免疫抑制剂是当前治疗首选方案。
最常见的免疫抑制剂包括钙调磷酸酶抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂和以霉酚酸(mycophenolic acid,MPA)为活性中心的抗增殖类药物(表2)。

免疫抑制剂简介
免疫抑制剂简介
| 药物分类 | 代表药物 | 作用机理 | 注意事项 |
|---|---|---|---|
| CNI | 环孢素A、他克莫司 | 在T淋巴细胞的活化与IL-2和γ干扰素等细胞因子的释放中发挥重要作用 | 治疗窗窄,易造成肾毒性和肝毒性,需要严格监控受者的血药浓度 |
| mTOR抑制剂 | 依维莫司、西罗莫司 | 除调节CD4+和CD8+细胞的增殖迁移,改善内皮功能与抗炎外,还具有良好的肾脏保护作用,改善受者远期预后 | 多数受者在使用mTOR后期选择停药,50%的受者出现高脂血症,部分人群出现糖尿病或蛋白尿等建议在术后早期使用mTOR,可与其他药物合用 |
| MPA类 | 吗替麦考酚酯 | 可逆性抑制NADPH氧化酶的活性组织DNA的合成,干扰淋巴细胞增殖,抑制抗体产生;减少一年内急性排斥反应的发生,减少受者死亡率 | 肾功能不全的受者适用,但会加重受者的感染风险,增加肿瘤发病风险 |
注:CNI为钙调磷酸酶抑制剂;mTOR为哺乳动物雷帕霉素靶蛋白;MPA为霉酚酸
需要注意的是,免疫抑制剂可能与受者其他用药发生相互作用,最为常见的是通过细胞色素P450功能氧化酶系(cytochrome P450,CYP450)影响代谢。环孢素A等药物与他汀类药物同时服用时,由于环孢素A抑制CYP3A4酶活性,经过该酶代谢的他汀类药物分布变广、毒性增加;MPA类药物的代谢通过肠肝循环,与影响肠肝循环的药物联合服用时可改变其生物利用度。
他汀类药物的主要作用是降脂,通过改善受者体内脂质代谢平衡,延缓CGV的进程。他汀类药物除调节脂质外,还有其他生物学效应,包括抑制促炎因子分泌、多效性抗炎、抑制T淋巴细胞和巨噬细胞的募集、降低NK细胞杀伤力、促进一氧化氮的合成等,且这些效应在治疗CGV的贡献中大于其对脂类的调节作用[33]。他汀类药物还可以治疗mTOR类药物导致的高脂血症与伤口迁延不愈,在联合用药时应当考虑。
血管重建技术分为冠状动脉旁路移植术(coronary artery bypass grafting,CABG)和经皮冠状动脉介入(percutaneous coronary intervention,PCI)。对于CGV受者来说,选择合适的重建技术较为重要。由于心脏移植受者冠状动脉再狭窄率高,建议在PCI治疗后6个月随访时行冠状动脉造影[3]。尽管CABG被认为是治疗CGV受者的可行方案,但由于CABG的相关文献较少,而临床上使用更多的PCI受非局灶性分布的影响,二者目前均只能作为姑息治疗的手段[38]。
由于器官短缺,再移植技术在伦理上受到质疑。尽管再移植是针对CGV最有效的治疗方案,但再次心脏移植的CGV受者存活率低,且预后更差,死亡率上升,临床应用范围局限。
CGV是心脏移植后慢性移植物失功的主要原因,尚无有效的解决方案。CGV的病程发展由免疫学因素和非免疫学因素共同介导,其发病机制仍未完全清楚,比如抗体介导的CGV是否依赖先天性免疫细胞的作用,以及巨噬细胞和NK细胞等是否联合作用等,有待研究者进一步探索[39]。临床上,对于CGV的诊断仍以侵入性检查方法为主,血管造影仍是首选方案;非侵入性诊断方法具有无创的优势,但仍需进一步研究改进以替代有创检测方式。药物治疗改变了CGV的发展史,mTOR抑制剂和他汀类等药物在减缓CGV进展方面有较大成就,但副作用多,需多种药物联合使用,且缺少随机前瞻性临床试验证据,等待进一步的随机试验证明。目前临床上针对CGV仍应以预防为主,需进一步提高医务人员、受者及其家属的认知,针对CGV早发现、早诊断、早治疗,提高心脏移植术后存活率,延长生存时间。
所有作者声明无利益冲突



























