
迟发性运动障碍(tardive dyskinesia,TD)是药物诱发的多动性运动障碍,一般表现为舌、下面部和下颌以及四肢不自主痉挛或舞蹈样运动(至少持续数周),发生在使用神经阻滞剂类药物至少数月后,对神经系统的损伤不可逆,显著影响患者的功能预后。本文综述了近年来关于TD相关危险因素和可能的发病机制、临床特征、评估识别及治疗管理等最新研究进展,以期提高专业人员对TD的认识,实现早期预防和识别,规范治疗,改善患者的预后和生活质量。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
迟发性运动障碍(tardive dyskinesia,TD)是使用多巴胺受体阻滞剂(dopamine receptor blocking agent,DRBA)相关药物引起的多动性运动障碍,临床表现为一系列异常的不自主运动,症状常在停用致病药物后仍然持续,严重影响患者的心理健康和生存质量。TD为临床诊断,其导致神经系统不可逆损害,症状终生存在。因此,须对所有接受DRBA患者都保持警惕和定期筛查,早期识别和积极干预可以让患者有最好的预后。本文将总结TD的临床特征、识别、诊断、治疗和预防等,旨在提高相关专业人员对TD预防及规范诊疗的理念及规范诊疗行为。
1.迟发性综合征(tardive syndromes,TS):长期应用DRBA治疗或者在DRBA减量或停药时,容易发生一种持久、刻板和重复的不自主运动,根据其发生时间,分为急性综合征(DRBA暴露3个月以内发生,包括药物诱发的帕金森综合征、急性肌张力障碍和急性静坐不能)和TS(DRBA暴露3个月或以上所导致的持续的、身体不同部位和不同形式的多动、少动和感觉异常现象,并且停药后持续存在)[1]。TS的主要分类及临床表现见表1。

迟发性综合征主要分类及临床表现[2]
迟发性综合征主要分类及临床表现[2]
| 分类 | 主要临床表现 |
|---|---|
| 迟发性运动障碍 | 复杂的、有节奏的、重复的咀嚼运动,舔唇、撅嘴、反复张/闭口和伸舌。其他术语:口-颊-舌运动障碍,颊舌-咀嚼运动障碍,可伴有四肢/躯干和膈肌运动 |
| 迟发性刻板症 | 与典型迟发性运动障碍相关;有目的、重复、有节奏和协调性的运动,常见于颅-颈、四肢躯干及骨盆 |
| 迟发性肌张力障碍 | 局灶性、节段性或全身性肌张力障碍,可能与特发性肌张力障碍相同;颈/轴性肌张力障碍最常见,表现为:颈后肌、躯干过伸(角弓反张);也可见有:颅型(眼睑痉挛、口-下颌肌张力障碍、舌肌张力障碍) |
| 迟发性静坐不能 | 感觉特征:紧张烦躁,运动冲动;行为特征:坐立不安、无法坐/站立或静卧;起搏、原位行走、腿部摩擦、身体摇摆、腿部摆动或交叉、脚趾敲击和无法在1个位置停留(运动不能)、反复触摸 |
| 迟发性抽动 | 成人发病,短暂的不自主运动,运动冲动,感觉现象,可控制的典型的抽动障碍(简单/复杂运动或发声):眨眼,颈部运动,肢体运动,发声 |
| 迟发性舞蹈症 | 随机不自主的流畅性全身运动,存在呼吸运动障碍 |
| 迟发性肌阵挛 | 短暂、快速的抖动性运动,全身性或局灶性,自发性或具有刺激敏感性 |
| 迟发性震颤 | 低频节律性震颤,姿势性和(或)运动性诱发性多见于静止性震颤 |
| 迟发性步态 | 多样表现取决于潜在的运动障碍:奇异步态,舞蹈样旋转,双脚分开较宽,不稳定,洗牌样动作,伴持续性肌张力障碍 |
| 迟发性疼痛敏感 | 口腔、生殖器区域的烧灼性疼痛 |
| 迟发性发声 | 抽动,呼噜声、呻吟、磨牙症 |
| 迟发性斜眼 | 共轭眼向上偏斜,无疼痛的眼球震颤 |
| 迟发性复合征(混合) | 上述临床症状表现多种共存,混合形式 |
2.迟发性运动障碍:迟发性运动障碍是最常见的TS表现类型之一。早在20世纪50年代,Schonecker[3]就曾描述了使用抗精神病药后出现异常运动的症状。1964年研究者使用“tardive dyskinesia”这一术语,强调了运动障碍症状出现与抗精神病药使用存在时间延迟性,之后TD的概念被广泛使用[4]。
TD的发生率因不同研究中样本来源和评估工具不同而有所差异。首先,所有的DRBA都有导致TD的可能,最常见的是抗精神病药及止吐药,也有少数心境稳定剂、抗抑郁剂等引起TD的案例报道。其次,DRBA所致TD的发生与其暴露时间和累积剂量相关。1项关于362例长期精神科门诊就诊且无TD患者的前瞻性队列研究提示,服用抗精神病药5年后发生TD的风险为32%,15年后为57%,25年后为68%。对于既往有10年抗精神病药用药史的患者,再用药5年后TD的风险为15%,15年后风险为38%[5]。对41项关于第1代抗精神病药和第2代抗精神病药荟萃分析发现,抗精神病药暴露患者的平均TD年发生率为25.3%,亚洲(17.3%)人群发生率低于欧洲(22.3%)、美国(31.3%)及其他国家和地区如澳大利亚、非洲、中东等(31.8%)[6]。我国目前尚缺乏关于TD发生的全国性流行病学研究数据,2021年针对北京市及河北省长期住院慢性精神分裂症患者的调查数据显示,TD的发生率为41.4%[7]。
1.TD发生的危险因素:TD发生的危险因素包括患者个体素质、疾病及治疗相关危险因素。为了促进临床实践中对TD发生的有效预防、早期识别和有效管理,国际上将TD发生的危险因素分为不可改变的危险因素和可改变的危险因素[8, 9],详见表2。2021年国内1项纳入901例精神分裂症患者的研究显示,中国人群TD发病的危险因素包括男性、高龄、低文化程度、吸烟史、高住院频率和长病程[10]。
| 分类 | 危险因素 |
|---|---|
| 不可改变的危险因素 | |
| 患者相关 | (1)高龄(年龄>55岁);(2)女性;(3)人种:非洲裔>高加索人>亚洲人;(4)多巴胺功能的基因多态性;(5)抗精神病药代谢的基因多态性等 |
| 疾病相关 | (1)精神分裂症病情严重、病程较长;(2)精神分裂症阴性症状突出;(3)智力残疾或脑损伤史;(4)心境障碍;(5)心境障碍伴认知症状等 |
| 可改变的危险因素 | |
| 共病相关 | (1)吸烟;(2)酒精和(或)其他精神活性物质滥用/依赖;(3)糖尿病;(4)人免疫缺陷病毒阳性等 |
| 治疗相关 | (1)抗精神病药治疗;(2)急性运动综合征史(急性肌张力障碍、帕金森病、静坐不能等);(3)抗精神病药剂量或血药浓度较高;(4)间断抗精神病药治疗;(5)联合抗胆碱能药;(6)锂盐治疗等 |
2.TD发生的病理机制:目前TD的发病机制尚不明确,主要有多巴胺受体超敏学说、氧化应激学说、突触可塑性失调学说、免疫异常和遗传等因素。TD的发生系多种因素共同作用所致,上述危险因素对发病机制发挥着重要的触发或调节作用。
(1)多巴胺受体超敏假说:多巴胺受体超敏反应仍然是目前最为广泛接受的发病机制假说,该假说认为DRBA的长期使用导致黑质纹状体通路中突触后膜的多巴胺D2受体超敏,D2受体数量上调,进一步引起苍白球内核、丘脑下核等神经元去抑制,最终导致各种运动过度的表现[11]。该假说可解释TD的部分特征,如增加DRBA剂量可能减轻TD的症状,突然停用DRBA导致TD症状加重,以及囊泡单胺转运体2(vesicular monoamine transporter 2,VMAT-2)抑制剂对TD有效等表现[12]。但该假说不能解释TD的全部临床特征,如部分患者症状仅局限于口-面-颊区、发病及疗效存在个体差异等,提示其他机制参与了TD的发病。
(2)氧化应激与神经毒性假说:DRBA使用过程中产生的氧化应激反应,可能导致神经元损伤和退行性变。该假说较好解释了TD的持续性和不可逆性,长期使用DRBA会诱导多巴胺神经递质的合成增加和代谢加快,进而导致自由基产生增加及脂质过氧化,后者与纹状体内源性抗氧化防御系统功能受损,其协同作用最终导致神经元凋亡、胶质细胞增生等[13]。研究发现在接受DRBA治疗的患者中,多巴胺神经元每10年损失15%,明显高于自然状态下的5%,提示DRBA可加速多巴胺神经元损失[14]。
(3)突触可塑性改变假说:突触可塑性是指突触通过某些机制调节神经递质传递的能力,由胆碱能、γ-氨基丁酸和多巴胺能系统共同调节,被认为是许多运动障碍疾病的基础[12]。长期使用DRBA可导致突触可塑性失调,可引起基底节向感觉运动皮质的传出投射以及皮质的传入投射出现异常,最终导致异常不自主运动的发生[12]。
(4)神经保护-损伤因素失衡假说:神经营养因子是一类对中枢和周围神经系统均有营养活性的小分子多肽或蛋白质,能维持神经细胞存活,促进其生长、发育和分化,维持其功能。而一些伤害性因素,如自由基、S100B 蛋白和炎症反应等,可能损伤神经细胞的正常存活、生长、发育和分化。两者的失衡状态影响神经元的功能状态,继而导致TD的发生。
(5)免疫异常:诸多研究显示TD患者存在中枢神经系统的免疫学异常。有证据表明中枢神经系统和免疫系统之间存在着复杂的网络调控机制,先天性及适应性免疫异常,及其与细胞因子、激素和神经递质在该网络中的动态交互发生改变,可能在TD的发生、发展过程中起关键作用。国内相关研究表明,TLR4[15]等先天性免疫通路及NMDA受体抗体[16]、TNF-α[17]、IL-1β[17]等细胞因子表达异常在TD的病理生理过程中发挥重要作用。
(6)遗传因素:研究发现遗传易感性、环境及两者间的交互作用在TD的病理机制中起着重要作用。目前研究发现与TD发生风险相关的单核苷酸多态性,其表达产物主要参与抗精神病药代谢、多巴胺能神经调控、神经可塑性、免疫验证及氧化应激调节等,主要分为下述几类[18]:(1)抗精神病药代谢酶细胞色素P450基因多态性如CYP2D6、CYP1A2等;(2)多巴胺受体及转运体基因多态性如DRD2Taq1A、DRD3 Ser9Gly、COMT、VMAT2;(3)5-羟色胺受体基因多态性如HTR2A、HTR2C;(4)γ-氨基丁酸受体基因多态性如GABRA3、GABRA4、GABRB2和SLC6A1;(5)氧化应激相关基因如MnSOD、GSTM1、NQO、NOS3;(6)突触可塑性相关基因如GRIN2B、BDN等。近年来表观遗传学改变如DNA甲基化等参与了TD的病理过程[19]。
(7)其他可能假说:研究发现,TD通常以口面部为主可能与高级皮质-纹状体-丘脑-皮质网络结构损伤易感性相关[20],该假说尚需更多研究证据进一步证实。
1.TD的临床特征:TD患者可表现为面部或躯干部位肌肉的运动异常。(1)面部特征:表现为不自主、有节律的重复刻板运动。最早期的表现可能是舌震颤或流口水,老年人以口部运动最具特征性:不说话时口唇轻微地抖动或者舌在微张的口中来回抽动或左右运动。最常见的临床特征为口-舌-颊三联征,表现为口唇及舌重复、不可控制地运动,如吸吮、转舌、舔舌、咀嚼、噘嘴、鼓腮和转颈等,有时舌头不自主地突然伸出口外,此征被称为捕蝇舌征,严重时出现构音不清和吞咽障碍等。(2)肢体特征:早期症状中,年轻患者多表现为肢体肌肉受累。TD患者可表现出四肢或躯干等肢体症状,如躯干或四肢的不自主摆动、无目的抽动、舞蹈指划样动作、手部搓丸性动作,坐位时下肢轻微抖动,足徐动或四肢躯干的扭转性运动等。(3)TD患者也可表现出其他部位肌肉的运动异常,偶有胃肠道型TD,在突然停药后出现胃部不适,恶心和呕吐等。TD患者的主要临床特点见表3。

迟发性运动障碍主要临床特征[21]
迟发性运动障碍主要临床特征[21]
| 类型 | 主要临床特点 |
|---|---|
| 眼肌运动异常 | 眨眼、眼睑痉挛 |
| 面部肌肉运动异常 | 面肌痉挛、抽搐、愁眉苦脸 |
| 口部肌肉运动异常 | 噘嘴、咂嘴、咀嚼、吸、下颌横向运动 |
| 舌肌运动异常 | 伸舌、缩舌、蠕动、舔唇 |
| 咽部肌肉运动异常 | 咽部异常运动影响发音及吞咽 |
| 颈部运动异常 | 斜颈、颈后仰 |
| 躯干运动异常 | 全身躯干运动不协调,呈古怪的姿势,如耸肩缩背、角弓反张、扭转痉挛,膈肌运动及痉挛产生呼噜声和呼吸困难∶有时表现为全身左右摇摆、躯干反复地屈曲与伸展、前后扭动或前倾后仰,称为身体摇晃征 |
| 四肢运动异常 | 肢体远端显现连续不断的屈伸动作,称为弹钢琴指(耻)征,而近端很少交累,少数可表现为舞蹈样指划动作、投掷运动(如上肢抛球样动作)、手足徐动样动作、双手反复高举或两腿不停地跳跃 |
| 肌张力低下-麻痹型运动障碍 | 可累及头、颈和腰部,如颈软不能抬头、腰软不能直起、凸腹,行走时迈不出步、提不起腿、足跟拖地而行 |
2.TD的评估[22]:TD的识别评估需要综合病史采集、精神及神经系统检查和量表评估。TD量表的评估不仅仅是评估TD症状的严重程度(轻、中或重度),而且已成TD诊断的重要依据。常用的TD评估量表包括异常不自主运动量表(Abnormal Involuntary Movement Scale,AIMS)[23]、锥体外系症状评定量表[24]、迟发性运动障碍评定量表[25]和TD影响量表[26]等。目前使用较广泛的为AIMS量表,但该量表仅评估了异常不自主运动,不能对其他不良症状(震颤、静坐不能)等进行评估。既往有文献关于锥体外系症状评定量表与AIMS进行了比较,发现运动障碍评分量表之间高度一致,锥体外系症状评定量表评分可以作为识别AIMS定义TD的简化标准,与AIMS不同,锥体外系症状评定量表测量症状的严重程度和频率。TD影响量表为专门设计用来评估TD对患者日常生活影响的标准化临床评分工具,可以更好地根据患者的功能能力和生活质量来更全面地理解和评估TD的严重程度。需要强调的是,量表评估结果的一致性取决于评估者的经验,对评估者进行培训能够提高评估结果的一致性。
3.TD的诊断及鉴别诊断[21]:TD是一种临床诊断,依据为存在典型的运动障碍性或肌张力障碍性不自主运动,至少1个月的当前或既往多巴胺受体阻滞剂用药史,并排除异常运动的其他病因。TD尚无确诊性试验或生物标志物。
诊断标准:(1)目前临床使用较多的TD诊断标准仍然是DSM-5标准:①不自主的手足徐动或舞蹈样运动持续至少几个星期;②通常发生在舌头、面部、下颚以及上下肢;③使用抗精神病药或多巴胺受体阻滞剂至少持续几个月。(2)还有2项基于AIMS评估的诊断标准:①抗精神病药治疗总时间≥3个月,既可连续使用,也可间断使用;②≥2个身体部位(如面、唇、舌、上肢、下肢、躯干)出现轻度运动障碍(评分≥2分),或1个部位出现中度运动障碍(评分≥3分)(Schooler-Kane标准[27]);或AIMS总分最低为3分,并至少有1个身体部位评分≥2分(Glazer & Morgenstern标准[28]);③排除其他可能导致不自主运动的疾病。
鉴别诊断:早期识别和积极干预可以让患者有最好的治愈机会,诊断TD还需要排除其他的运动障碍。需要鉴别的疾病汇总于表4。

迟发性运动障碍的鉴别诊断[21]
迟发性运动障碍的鉴别诊断[21]
| 疾病 | 典型发病时间a | 运动现象学 | 其他临床表现 |
|---|---|---|---|
| 迟发性运动障碍 | 数周至数年b | 舞蹈手足徐动症(不规则、舞蹈样症状)、手足徐动症(缓慢、扭动症状)和(或)口部、颌部、舌部和面部的刻板性运动(口/颌咀嚼、舌头突出、做鬼脸、咂嘴或咀嚼、眼睑痉挛)、舞蹈手足徐动症和(或)颈部、躯干和四肢的刻板性运动(弹钢琴样手指/手部运动、脚趾敲击、躯干摆动或蹬伸) | 语言障碍、饮食困难或步行困难;感到困窘、社交孤立感 |
| 肌张力障碍 | |||
| 急性 | 数小时至数天 | 多由局灶性起病,涉及头、颈、眼、口、下巴、舌和面部的牵拉、扭转、持续性和重复的动作或姿势(斜颈、牙口紧闭、下颌张开、眼睑痉挛或动眼危象、舌头突出、打转或咬舌头) | 肌肉疼痛或痉挛、痛苦、焦虑、构音障碍、吞咽障碍、呼吸喘鸣 |
| 迟发性 | 数周至数年 | ||
| 静坐不能 | |||
| 急性 | 数天至数月 | 坐立不安;可能与刻板性运动相关,如脚趾敲击、足部拖拽、重心转移或身体摆动 | - |
| 迟发性 | 数周至数年 | ||
| 帕金森综合征 | 数天(周)至数年 | 震颤和(或)运动迟缓;颈部、躯干和四肢僵直、表情匮乏、眨眼减少、手臂摆动减少、姿势异常及足部拖拽或冻结步态;兔唇综合征(具有下颌震颤症状的帕金森变异型) | 说话无力、吞咽障碍、疲劳 |
| 神经阻滞剂恶性综合征 | 数小时至数周 | 伴有震颤的“铅管样强直(较少出现各种运动障碍、肌张力障碍或肌阵挛) | 高热、意识改变、自主神经不稳定,构音障碍,吞咽困难(极端情况:高代谢危机) |
注:a为在使用多巴胺受体阻滞剂或调整多巴胺受体阻滞剂剂量后,发病时间可能早于或晚于所列举的典型发病时间;b为迟发性运动障碍可能被多巴胺受体阻滞剂治疗所掩盖,并在多巴胺受体阻滞剂撤退后首次出现;-为无相关内容
TD常被认为是不可逆的,治疗手段和技术缺乏特异性,涉及到药物和非药物等多种手段,近年来随着对TD病理机制的深入研究,逐渐开发出有针对性的治疗药物,积累了更多的研究证据,国际指南也相应地修订完善。
1. 国际指南对TD的药物治疗推荐:2013年美国神经学学会(American Academy of Neurology,AAN)发布了全球首个TD实践的治疗循证指南[29],2018年以系统综述形式对该指南进行了更新[30]。在药物治疗方面,氘丁苯那嗪(duetetrabenazine,DBZ)及缬苯那嗪(valbenazine,VBZ)为A级推荐(Ⅰ类证据);银杏叶提取物和氯硝西泮为B级推荐(Ⅰ类证据),且氯硝西泮仅限短期(约3个月内)治疗使用;金刚烷胺和丁苯那嗪(tetrabenazine,TBZ)为C级推荐。此外该指南还总结了TD的临床诊疗路径,以帮助医生早期识别和规范诊疗TD,见图1。此外,2020年美国精神病学会(American Psychiatric Association,APA)修订了《精神分裂症治疗实践指南》,其中推荐:与抗精神病治疗相关的中度至重度或出现功能损害的TD患者,应使用可逆性单胺囊泡转运体2(vesicular monoamine transporter 2,VMAT-2)抑制剂进行治疗(1B级推荐)[24]。
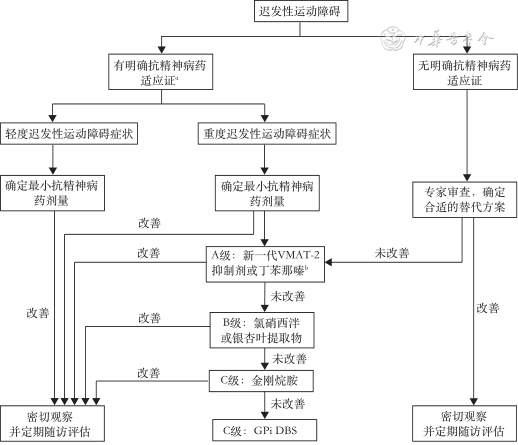

VMAT2为囊泡单胺转运体2;GPi DBS为脑苍白球深部电刺激;a精神分裂症、精神病性障碍、双相障碍、多动、严重行为问题、广泛性非精神病性焦虑和Tourette综合征;b如果新一代VMAT-2抑制剂无法获得时,考虑使用丁苯那嗪
2.TD的药物治疗
(1)VMAT2抑制剂:基于TD的多巴胺受体超敏假说,VMAT-2抑制剂可干扰多巴胺在突触前囊泡中的摄取和存储,导致突触中可释放的多巴胺减少,发挥改善TD症状的作用。目前临床常用的VMAT-2抑制剂包括TBZ、DBZ和VBZ。①TBZ:合成于1950年,用于治疗精神病性障碍和精神分裂症[31]。2008年TBZ被FDA批准用于治疗亨廷顿舞蹈病。因TBZ治疗TD相关临床研究样本量较小及上市后药物不良反应报告(如诱发抑郁情绪、帕金森样症状及嗜睡)等原因,2008年丁苯那嗪仅在FDA获批用于治疗亨廷顿舞蹈症,并未获批治疗TD的适应证。②DBZ:是一种新型的高选择性VMAT-2抑制剂,是TBZ的异构体。TBZ两个甲氧基上的6个氢原子被氘原子取代后成为DBZ,这种分子修饰使DBZ比TBZ的药代动力学特征显著改善。与TBZ相比,DBZ的药物结构延缓了药物或活性代谢产物的代谢,药物的有效药物成分血浆浓度更稳定,峰谷浓度波动更小;同时减少有害代谢产物产生,可减少不良反应的发生风险。另外,DBZ较TBZ具有更长的消除半衰期,可以增加体内药物暴露,降低给药频率,有助于提高治疗依从性[32]。DBZ于2017年由美国FDA获批,2020经中国CFDA批准适用于治疗成人亨廷顿舞蹈病和成人TD。关于DBZ相关临床研究总结见表5。③VBZ:对单胺类受体或转运体的影响极小也降低了类似“靶点外”相关不良反应的风险[33, 34]。VBZ主要通过水解和单氧化作用形成2种主要活性代谢产物+-α-HTBZ和NBI-136110,消除半衰期为15~22 h,可以每天1次给药[35]。基于2项关键3期研究结果,FDA于2017年批准VBZ用于治疗成人TD,目前该药在中国尚未获批上市。
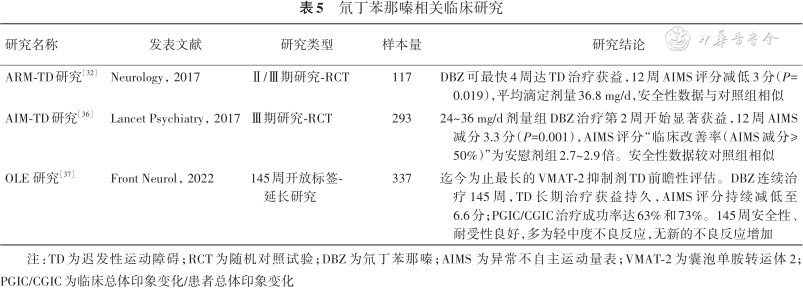
氘丁苯那嗪相关临床研究
氘丁苯那嗪相关临床研究
| 研究名称 | 发表文献 | 研究类型 | 样本量 | 研究结论 |
|---|---|---|---|---|
| ARM-TD研究[32] | Neurology,2017 | Ⅱ/Ⅲ期研究-RCT | 117 | DBZ可最快4周达TD治疗获益,12周AIMS评分减低3分(P=0.019),平均滴定剂量36.8 mg/d,安全性数据与对照组相似 |
| AIM-TD研究[36] | Lancet Psychiatry,2017 | Ⅲ期研究-RCT | 293 | 24~36 mg/d剂量组DBZ治疗第2周开始显著获益,12周AIMS减分3.3分(P=0.001),AIMS评分“临床改善率(AIMS减分≥50%)”为安慰剂组2.7~2.9倍。安全性数据较对照组相似 |
| OLE 研究[37] | Front Neurol,2022 | 145周开放标签-延长研究 | 337 | 迄今为止最长的VMAT-2抑制剂TD前瞻性评估。DBZ连续治疗145周,TD长期治疗获益持久,AIMS评分持续减低至6.6分;PGIC/CGIC治疗成功率达63%和73%。145周安全性、耐受性良好,多为轻中度不良反应,无新的不良反应增加 |
注:TD为迟发性运动障碍;RCT为随机对照试验;DBZ为氘丁苯那嗪;AIMS 为异常不自主运动量表;VMAT-2为囊泡单胺转运体2;PGIC/CGIC为临床总体印象变化/患者总体印象变化
(2)氯硝西泮:既往研究提示基底节区GABA水平的降低与TD发生相关,GABA激动剂可能是治疗TD的有效药物。一项随机、双盲、安慰剂对照交叉试验中,使用氯硝西泮的患者TD症状评分降低39%;不良反应方面19例患者中6例出现镇静,3例出现共济失调;在5例长期随访的受试者中,5~8个月均显示出对药物的耐受性问题[38]。因此,目前研究证据提示氯硝西泮可能缓解TD的临床症状和伴随的焦虑症状,对于VMAT2抑制剂耐受或无效的患者,可考虑短期使用氯硝西泮治疗,较严重的TD患者常不能从氯硝西泮的治疗中获益,且需警惕其镇静、药物依赖等不良反应[29]。
(3)抗氧化剂:既往研究提示自由基及氧化应激参与了TD的发病,故抗氧化剂可用于TD的治疗。国内1项随机双盲安慰剂对照研究共纳入157例合并TD的精神分裂症患者,应用银杏叶提取物组12周治疗后51%的患者实现了AIMS评分降低≥30%,而安慰剂组中为5.1%,且未出现不良反应,而安慰剂组仅为 5%[39]。2013年美国AAN指南推荐银杏叶提取物可考虑作为TD的治疗药物[29]。其他抗氧化剂包括维生素E、维生素B6、褪黑素等对于TD治疗的疗效及安全性尚无充分证据。
(4)金刚烷胺:金刚烷胺作为NMDA受体拮抗剂,现有证据提示该药可能减轻TD症状,具体作用机制尚不明确,推测可能通过增加多巴胺分泌及抑制多巴胺突触前再摄取改善多巴胺能传递。2013年美国AAN指南推荐金刚烷胺用于TD短期治疗[29]。1项为期18周的交叉试验将16例患者随机分入金刚烷胺(300 mg/d)组或安慰剂组,发现使用金刚烷胺不会加重精神病性症状[40]。2018年加拿大推荐意见认为使用金刚烷胺的证据有限,如果更成熟的治疗方法不能适应或无效,可以考虑使用金刚烷胺治疗TD[41]。
(5)其他药物:2016年1项回顾性研究表明,低剂量普萘洛尔治疗TD具有较好的疗效和耐受性[42]。有学者认为胆碱受体激动剂可以改善TD,但无论是临床试验或是系统综述都没有充分证据证明可将其作为治疗TD的有效药物。
3.TD的非药物治疗:TD的非药物治疗是药物治疗的有益补充。首先,肉毒素局部注射对局灶性肌张力障碍具有较好的治疗效果,肉毒毒素可以选择性地作用于胆碱能神经末梢,抑制乙酰胆碱释放,从而引起注射部位肌肉松弛,改善局部运动症状。其次,脑苍白球深部电刺激(globus pallidus interna-deep brain stimulation,GPi-DBS)手术治疗。目前有2项随机试验证实了GPi-DBS 的治疗效果,患者症状改善范围 41.5%~71.0%[43, 44]。2013年AAN指南认为DBS临床数据不足,尚不能支持或拒绝这种治疗方式。2018年加拿大推荐意见认为目前可获得的证据表明,在TD症状严重、患者感受痛苦且对药物治疗无效以及精神病性症状稳定的特定病例中,可以考虑使用GPi-DBS[41]。
非药物治疗往往是药物治疗无效的选择,目前关于药物与非药物联合治疗的研究未见报道,也是未来治疗TD主要研究方向之一。
4.TD康复管理和预防:目前尚无专门针对TD患者的康复训练课程,但考虑到TD患者出现的非自主运动增加、肌张力障碍、骨骼肌关节受损和精细运动减弱等特征,对于精神病性症状稳定的TD患者,或有较高康复治疗需求的患者,精神科医师可与神经康复科医师及照料者根据患者病情,共同制定个体化的康复训练或物理治疗方案。
鉴于TD的发生常具不可逆性,疾病的预防至关重要[41]。使用抗精神病药或其他有可能导致或加重TD的药物之前,须告知患者发生或加重TD的风险,并进行相关疾病知识普及,加强TD患者及家属或照料者对TD症状的早期识别、了解TD的疾病特征及治疗手段。
2017年APA实践指南推荐应用第1代抗精神病药的患者应每6个月评估1次,应用第2代抗精神病药的患者应每12个月评估1次;而高危TD患者应进行更频繁的监测,评估频率分别缩短至3个月和6个月[45]。2018年TD更新版综述给出了TD临床诊疗路径,同时也建议当患者明确TD诊断后,应密切观察症状,定期随访和评估[30]。
综上所述,TD是药物引起的多动性运动障碍,所有多巴胺受体阻滞剂均可能引起TD,年龄较大和接受多巴胺受体阻滞剂的持续时间是TD的最重要危险因素,其主要的发生机制可能是长期使用多巴胺受体阻滞剂引起的基底节中多巴胺受体超敏。TD的特征包括各种不自主运动和姿势,口、面和舌运动障碍是最常见表现,经常伴有其他身体部位的运动障碍。TD是一种临床诊断,诊断依据为存在典型的运动障碍性或肌张力障碍性不自主运动,并排除异常运动的其他病因。目前VMAT2抑制剂是TD主要的对症治疗药物,可与抗精神病药联用或单独使用,苯二氮䓬类药物短期使用可缓解轻度症状,少数证据显示迟发性肌张力障碍患者局部注射肉毒毒素可能有效;经对症治疗无效的难治性TD患者可考虑行DBS手术治疗。TD的预防和早期发现十分重要。
虽然目前关于TD的研究日益增多,但TD临床表现异质性大,病因和发病机制尚不明确,特别是国内关于TD危险因素、治疗及预后的研究证据较少,临床医生尚缺少对TD的认识及治疗经验,期望未来能有更多关于我国TD患者临床特征、危险因素的流行病学研究,能建立我国TD患者的大规模前瞻性队列,更重要的是能在国内进行更多发病机制及治疗相关的基础及临床研究,为TD的规范化管理和新药研发提供理论依据。
袁俊亮, 谭云龙, 王强, 等. 迟发性运动障碍的诊疗研究进展[J]. 中华精神科杂志, 2024, 57(2): 121-128. DOI: 10.3760/cma.j.cn113661-20230915-00065.
所有作者声明无利益冲突




























