
采用肺炎克雷伯菌耐药靶标KPC-2为抗原制备重组蛋白疫苗,在小鼠肺炎模型中评价疫苗的免疫原性、保护效果和保护机制。
利用大肠埃希菌原核表达系统表达肺炎克雷伯菌KPC-2蛋白,经GST亲和层析对目的蛋白进行纯化;采用KPC-2蛋白制备疫苗,经皮下注射免疫新西兰兔,心脏采血分离血清,用Protein G亲和层析纯化多克隆抗体,同时运用调理吞噬杀菌试验检测抗体的体外杀菌活性。采用KPC-2疫苗免疫雌性BALB/c小鼠3次,间接ELISA检测血清中特异性IgG抗体滴度。末次免疫后7 d,通过气管插管构建小鼠肺炎克雷伯菌肺部感染模型,感染1 h后尾静脉给予0.1 mg美罗培南治疗,通过比较免疫组与佐剂组的生存率、细菌定植量和组织病理学差异,以及给药组与生理盐水组生存率的差异评价疫苗的保护效果。采用KPC-2多克隆抗体被动免疫评价抗体的保护效果。
KPC-2免疫组小鼠血清特异性IgG水平显著高于对照组(t=4.325, P<0.05),免疫组生存率显著高于对照组[70% (7/10) vs 10% (1/10),P<0.05];免疫组小鼠肺组织炎性程度及细菌定植量显著低于对照组(t=3.127, P<0.05);疫苗主动免疫与被动免疫均具有良好的保护效果,且对抗生素治疗有明显的增效性;KPC-2多克隆抗体在体外表现出明显的吞噬杀菌活性(t=5.427, P<0.05)。
KPC-2疫苗具有良好的免疫原性和保护效果,体液免疫应答在其保护中发挥了重要作用,证明采用耐药靶标作为抗原制备疫苗具有可行性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2017年,世界卫生组织首次发布了严重危害人类健康的12种超级耐药细菌清单,其中,以肺炎克雷伯菌(Klebsiella pneumoniae, Kpn)为代表的肠杆菌科细菌位居前列[1]。Kpn是一种临床常见的耐药致病菌,可引起肺炎、尿路感染、脑膜炎、败血症等局部或全身感染[2],Kpn感染后还可以抑制巨噬细胞成熟[3],从而导致更多的合并感染[4]。当前Kpn耐药形势严峻,根据中国耐药监测网的数据,碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumoniae, CRKP)检出率从2005年的不到5%一直增长到2020年的25%左右,重症监护室CRKP的检出率已经超过60%,2021年已检出的9 879株CRKP菌株对亚胺培南和美罗胺培南的耐药率高达96.5%和97.3%[5],CRKP感染引起的病死率高达40%~50%[6]。因其超强的耐药性和致病性,CRKP被称为"超级细菌之王",严重威胁人类健康。
抗生素仍是目前治疗细菌感染的首选手段,但由于碳青霉烯酶(carbapenemase,KPC)的出现和广泛传播,使被称为最后一道防线的碳青霉烯类抗生素破防。产KPC被认为是引起Kpn耐药的主要因素[7],KPC由质粒上携带的blaKPC基因编码,可通过基因转座子等快速传播[8],传播同时也在不断突变,目前已检测出100多种亚型,我国以KPC-2为主[9]。作为潜在的药物靶点,已有多种靶向KPC-2的小分子抑制剂处于研发阶段,并表现出一定的体内外活性,但均未进入临床应用[10,11,12]。除了抗生素之外,疫苗被认为是预防感染性疾病最为科学、经济和有效的手段。KPC-2为细菌的表面蛋白,不同亚型之间序列高度保守,并可通过质粒在不同菌种之间水平传播,是制备疫苗的理想抗原。本研究拟以原核表达的KPC-2作为抗原制备疫苗,通过Kpn肺部感染模型评价疫苗的免疫原性和保护效果,以及对抗生素治疗的增效性,为基于耐药靶标的疫苗研发提供数据支撑。
Kpn临床株SRT由陆军军医大学国家免疫生物制品工程技术研究中心-80℃保存;BL21(DE3)感受态细菌、KPC-2鉴定引物购自上海生工生物工程有限公司;pGEX-6P-1-KPC-2质粒由武汉金开瑞生物工程有限公司合成;氢氧化铝佐剂购自法国Invivo Gen;羊抗鼠IgG-HRP、IPTG、TMB显色液、TMB显色终止液购自上海碧云天生物技术股份有限公司;氨苄青霉素钠购自英国BBI Solutions;质粒提取试剂盒购自美国Omega;快速蛋白凝胶试剂盒购自深圳市达科为生物技术股份有限公司;蛋白质Marker、IL-1β、IL-6、TNF-α检测试剂盒购自美国Thermo Fisher Scientific;XhoⅠ、BamHⅠ购自日本TaKaRa;胎兔补体购自美国Pel-freez Biological;二甲基甲酰胺(DMF)购自美国Sigma Aldrich。
从-80℃冰箱取出BL21(DE3)感受态细菌,放置冰上融化;吸取1 μl pGEX-6P-1-KPC-2质粒,加入感受态细菌中混匀;冰浴30 min,42℃热激90 s,冰浴3 min;加入1 ml LB培养基,37℃,150 r/min培养1 h;取50 μl菌液涂布于氨苄抗性的LB固体培养基上,37℃培养过夜。挑取平板上的单菌落于10 ml含氨苄LB培养基中,37℃,150 r/min培养过夜;利用OMEGA质粒提取试剂盒,按说明书进行质粒提取,并将提取的质粒采用BamHⅠ与XhoⅠ进行双酶切鉴定。
将Kpn临床菌株SRT划板培养过夜,挑取单菌落于37℃,150 r/min培养过夜;吸取2 ml菌液25℃,13 314×g离心2 min弃上清,沉淀加50 μl TE缓冲液重悬,100℃加热5 min,-20℃冷冻5 min,重复2次;25℃,13 314×g离心2 min收集上清,并用TE缓冲液稀释20倍,以此作为PCR模板。通过PCR扩增及核酸电泳结果判断是否为KPC-2阳性菌。根据文献设计KPC-2鉴定引物序列[13]:F1: 5′-GACAACAGGCATGACGGTGG-3′,R1: 5′-GTCCAGACGGAACGTGGTATC-3′;F2: 5′-GTATCGCCGTCTAGTTCTGC638-3′,R2: 5′-GGTCGTGTTTCCCTTTAGCC-3′。
挑取转化平板上的单菌落,37℃,150 r/min培养过夜,转入2 L LB培养基内,37℃,220 r/min培养4.5 h;将摇床温度设置为16℃,待温度降至设定值后向培养瓶内加入IPTG至终浓度为0.1 mmol/L,220 r/min培养过夜。10℃,4 000×g离心15 min收集菌体沉淀,PBS悬浮后超声破碎,4℃,20 929×g离心20 min,分离上清与GST填料常温结合4 h,分别用PBST与PBS清洗填料后用适量PreScission Protease酶4℃酶切过夜。收集酶切液进行SDS-PAGE验证。
选取体重2.5 kg左右的新西兰兔(重庆腾鑫生物技术有限公司),KPC-2首次免疫剂量为2 mg,与完全弗氏佐剂1∶1乳化,经皮下注射;第2、3次免疫抗原剂量为0.5 mg,与不完全弗氏佐剂1∶1乳化。末次免疫7 d后,采集心脏血37℃静置30 min,4℃,1 707×g离心10 min分离血清,血清过滤后经Protein G亲和层析纯化得KPC-2多克隆抗体,采用SDS-PAGE与BCA检测抗体纯度与浓度。
多克隆抗体置于56℃水浴30 min灭活补体。Kpn临床株SRT二次活化后用OBB(76%的无菌水,9.5%的含钙镁10×HBSS,9.5%的1%明胶,5%的FBS)调整细菌浓度为2.5×103 CFU/ml。培养好的HL-60细胞(原伦生物科技有限公司赠送)用含0.8% DMF的培养基调整浓度为4×105个/ml,37℃,5% CO2诱导分化4 d;将细胞置于50 ml离心管中,25℃,350×g离心5 min,弃上清,依次用含和不含Ca2+、Mg2+的1×HBSS清洗细胞,用OBB悬浮并调整细胞浓度为1×107个/ml;将细胞与胎兔补体按4∶1的比例混合。96孔细胞培养板中,对照孔每孔20 μl OBB,实验孔每孔20 μl多克隆抗体,加入10 μl细菌,室温700 r/min孵育1 h,每孔加入细胞补体混合物50 μl,37℃,5% CO2 700 r/min孵育1 h;孵育完成后取出96孔板放置冰上20 min终止实验,每孔各取5 μl混合物接种于LB固体培养基上,37℃培养16~18 h,计数培养基上存活菌落数。
选取6~8周龄SPF级雌性BALB/c小鼠(北京维通利华实验动物技术有限公司),体重16~18 g,随机分为2组,每组10只。KPC-2免疫组是将KPC-2抗原(30 μg)与氢氧化铝佐剂(0.5 mg)混合,常温吸附2 h,每只小鼠肌肉注射200 μl;对照组肌肉注射同等剂量的PBS与佐剂混合物。分别于0、7、14 d免疫3次,并于6、13、20 d采集尾静脉血,4℃,1 480×g离心10 min分离血清用于ELISA检测血清IgG抗体滴度及亚型。本研究中的动物实验经中国人民解放军陆军军医大学实验动物福利伦理委员会审批通过[动物实验伦理编号:AMUWEC20230412,实验动物许可证号:SCXK(渝)2022-0018]。
用包被液将KPC-2抗原稀释至5 μg/ml, 100 μl/孔加入96孔酶标板,4℃包被过夜;PBST洗涤3次,每孔加入200 μl的2% BSA,37℃封闭2 h;洗涤酶标板,将血清用PBST稀释至一定倍数后再于96孔板内倍比稀释,100 μl/孔,37℃孵育1 h;洗涤3次,山羊抗小鼠IgG-HRP、IgG1-HRP、IgG2a-HRP、IgG2b-HRP,IgG3-HRP用PBST以1∶250稀释,100 μl/孔,37℃孵育1 h;洗涤3次,每孔加入100 μl TMB显色液,37℃孵育10 min,再加入100 μl TMB显色终止液,检测450 nm处的吸光度(A)值。以待测样本(S)与阴性对照(N)的比值即S/N≥2.1作为阳性结果判断标准。
取鉴定为KPC-2阳性的Kpn临床菌株SRT,无抗LB平板划板培养过夜,挑取单菌落37℃,150 r/min培养过夜;吸取100 μl菌液加入10 ml培养基,37℃,220 r/min培养4 h;用PBS调整细菌浓度为致死(9×106 CFU)或亚致死剂量(1.5×106 CFU)。小鼠腹腔给予异戊巴比妥钠,待小鼠完全麻醉后,用软管包裹针头的微量进样针通过气管插管将20 μl细菌滴注入小鼠肺部。
末次免疫完成后7 d,采用致死剂量的SRT菌株通过气管滴注的方式感染小鼠,连续7 d观察并记录小鼠生存情况;用亚致死剂量的SRT菌株感染小鼠,48 h后取肺置于玻璃研磨管中,提前加入1 ml PBS,将肺研磨成匀浆,并用PBS依次稀释5、25、125、625倍。各吸取5 μl稀释液,接种于方形无抗LB固体培养基,待液体完全吸收后,37℃倒置培养过夜;16~18 h后对培养基上的菌落数进行计数。另外,亚致死剂量感染小鼠48 h后,取肺泡灌洗液,用炎症因子检测试剂盒检测IL-1β、IL-6、TNF-α的浓度;同时取肺置于4%多聚甲醛内,4℃固定24 h,HE染色切片(重庆闻达生物科技有限公司),于光学显微镜下观察病理变化并采集图片。
SRT菌株亚致死剂量感染正常健康小鼠,感染1 h后尾静脉分别给予0.05、0.1和0.2 mg美罗培南与0.9% NaCl,48 h后取小鼠肺部做细菌定植,根据不同给药组细菌定植量的差异,选择与生理盐水组差异有统计学意义的0.1 mg作为后续抗生素治疗的给药剂量。
小鼠末次免疫完成后7 d,致死剂量SRT菌株感染小鼠,1 h后尾静脉给予0.1 mg美罗培南治疗,连续7 d观察并记录小鼠生存情况。同时采用致死剂量SRT菌株感染正常健康小鼠,1 h后尾静脉给予2 mg多克隆抗体与0.1 mg美罗培南治疗,对照组给予单纯美罗培南或生理盐水,连续7 d观察并记录小鼠生存情况。
从NCBI数据库下载21种不同KPC亚型的氨基酸序列,采用在线多序列比对软件CLUSTALW(https://www.genome.jp/ tools-bin/clustalw)进行序列比对,并通过ESPript 3(https://espript.ibcp.fr/ESPript/ ESPript/index.php)对结果作图。
采用GraphPad Prism 9.5软件进行统计学分析。实验数据以 ±s表示,两组间比较采用非配对t检验,多组间采用单因素方差分析,生存数据采用Kaplan-Meier分析。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用非配对t检验,多组间采用单因素方差分析,生存数据采用Kaplan-Meier分析。以P<0.05为差异有统计学意义。
质粒pGEX-6p-1-KPC-2转化入大肠埃希菌BL21(DE3)后,挑单菌落培养过夜,提取质粒用限制性内切酶XhoⅠ与BamHⅠ于37℃酶切30 min,琼脂糖凝胶电泳结果显示有2条DNA片段(图1A),其中一条位于5 000 bp以上,与质粒大小相符,另一条位于800 bp处,与KPC-2片段理论值(795 bp)相符,证明质粒pGEX-6P-1-KPC-2成功构建并转化入大肠埃希菌BL21(DE3)中。
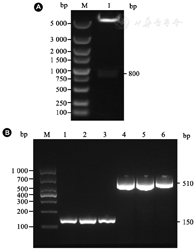

注:A:质粒pGEX-6P-1-KPC-2双酶切鉴定(M: DNA Marker DL5000; 1:双酶切片段);B: KPC-2阳性肺炎克雷伯菌鉴定[M: DNA Marker DL1000; 1~3(引物F1, R1):菌株SRT、64、12; 4~6(引物F2, R2):菌株SRT、64、12]
为了验证KPC-2疫苗的保护效果,拟采用KPC-2阳性的Kpn感染小鼠,因此对本中心保存的部分Kpn临床菌株进行鉴定。利用KPC-2特异性引物,采用PCR对提取的细菌DNA进行扩增,采用核酸电泳检测扩增结果,根据电泳条带中是否具有特异性目的片段来判断菌株是否为KPC-2阳性。引物F1、R1扩增的目的片段位于150 bp处,引物F2、R2扩增的目的片段位于510 bp处,因此判断菌株SRT、64和12为KPC-2阳性,图1B为上述3个菌株两对引物PCR扩增结果,后续实验中选择SRT菌株开展动物实验。
工程菌pGEX-6P-1-KPC-2/BL21(DE3)经0.1 mmol/L IPTG,16℃诱导16~18 h。收获菌体纯化目的蛋白,SDS-PAGE检测结果显示目的条带相对分子质量(Mr)为29×103(图2A),与目的蛋白KPC-2的理论Mr相符。KPC-2蛋白免疫新西兰兔后,分离的血清经Protein G纯化获得KPC-2多克隆抗体,SDS-PAGE检测结果显示出两个条带(图2B),其中重链Mr为53×103,轻链Mr为22×103,Mr大小与兔IgG轻、重链理论Mr相符。BCA法检测KPC-2多抗浓度为4.5 mg/ml,ELISA检测抗体效价为160 000。为了进一步检验提取的多克隆抗体是否具有功能活性,采用调理吞噬杀菌试验检测抗体活性。结果显示抗体组细菌存活数量与对照组相比差异有统计学意义(图2C, t=8.342, P<0.001),结果证明分离的KPC-2多抗具有体外杀菌活性。
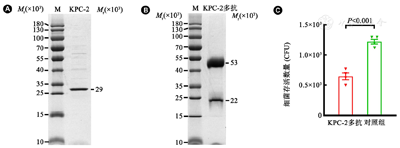

注:A:纯化后的KPC-2;B:纯化后的KPC-2多抗;C:调理吞噬杀菌试验检测细菌存活数量。M:蛋白质Marker
为了检验免疫程序是否引起小鼠有效的免疫应答,分别于每次免疫后6 d采集尾静脉血,ELISA检测血清KPC-2特异性IgG抗体滴度。首次免疫后KPC-2免疫组血清IgG抗体升高不明显,与佐剂组类似(t=0.389, P=0.709,图3A),表明1次免疫虽能引起免疫应答,但强度较弱。2次免疫后抗体显著升高(t=2.586, P=0.036,图3B),3次免疫后免疫组特异性IgG抗体滴度进一步上升(t=3.056, P=0.011,图3C)。抗体亚型检测表明KPC-2特异性抗体主要为IgG1(图3D),提示以Th2型应答为主。以上结果证明KPC-2具有很强的免疫原性,后续实验中均采用相同的免疫程序。
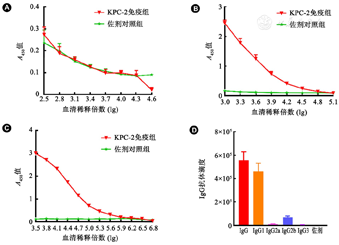

注:A~C:分别为1、2、3次免疫后血清IgG抗体滴度;D:血清IgG亚型
为了评价KPC-2疫苗的免疫保护效果,于末次免疫后7 d,通过气管滴注构建KPC-2阳性SRT菌株感染小鼠肺炎模型。感染48 h后,肺部细菌定植结果分析显示,KPC-2免疫组的细菌负荷量与佐剂组之间的差异有统计学意义(t=3.127, P<0.05,图4A,),提示KPC-2疫苗通过抑制Kpn在肺部的定植或增强机体对细菌的清除能力而发挥保护作用。采用致死剂量SRT菌株感染小鼠(n=10),生存率检测结果显示实验组小鼠的生存率为70%(7/10),佐剂组小鼠生存率为10%(1/10),两组差异有统计学意义(P<0.05,图4B)。以上结果表明采用KPC-2作为抗原的疫苗具有良好的保护效果。
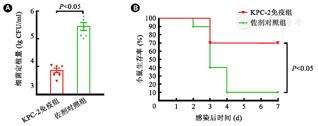

注:A: SRT菌株亚致死剂量感染48 h后,小鼠肺部细菌定植量;B: SRT菌株致死剂量感染后7 d,小鼠的生存率
为了检测疫苗是否能减轻细菌对小鼠肺组织造成的炎症及损伤,取感染48 h的肺泡灌洗液进行炎性因子检测,结果显示疫苗免疫组炎症因子IL-1β、IL-6、TNF-α水平均低于佐剂对照组(图5A)。另取感染48 h后的肺组织进行HE染色切片,结果显示抗原免疫组肺部结构相对完整,仅有少数肺泡破损;而对照组几乎无完整的肺泡结构,同时存在较严重的中性粒细胞浸润(图5B)。以上结果表明疫苗免疫后可显著降低肺组织的炎症水平。
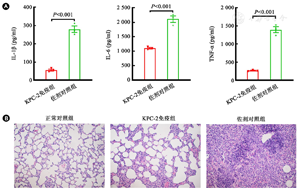

注:A: SRT菌株亚致死剂量感染48 h后,小鼠肺泡灌洗液中炎性因子IL-1β、IL-6、TNF-α的浓度;B:肺部病理切片HE染色(×200)
KPC-2对碳青霉烯类抗生素具有水解活性,从而导致碳青霉烯类抗生素对KPC-2阳性Kpn感染的治疗效果较差。为了评价KPC-2疫苗是否能增强碳青霉烯类抗生素的治疗效果,选择低剂量美罗培南(0.1 mg, 图6A)作为治疗药物,小鼠免疫后采取致死剂量细菌感染,1 h后静脉给予抗生素治疗。连续观察7 d,免疫组小鼠存活9只(n=10),存活率为90%,而佐剂组仅存活3只,存活率为30%,组间差异有统计学意义(P<0.05,图6B),表明KPC-2疫苗能有效增强美罗培南的治疗效果。
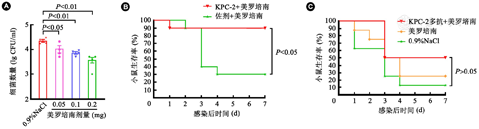

注:A:抗生素治疗剂量筛选;B:免疫后致死剂量SRT菌株感染并给予美罗培南治疗后,小鼠的生存率;C:致死剂量SRT菌株感染并给予KPC-2多抗及美罗培南治疗后,小鼠的生存率
为了评价KPC-2抗体在小鼠体内是否具有治疗活性以及能否增强美罗培南的治疗效果,采用细菌感染健康小鼠,1 h后尾静脉给予KPC-2多抗与美罗培南治疗。7 d后,生理盐水组小鼠的生存率为12.5%(1/8),单独给予美罗培南的小鼠生存率为25%(2/8),抗体与美罗培南联合给药组小鼠生存率为50%(4/8),虽然差异无统计学意义,但KPC-2多抗具有增强抗生素治疗效果的趋势(图6C)。被动免疫联合给药的治疗效果较主动免疫联合给药的效果差,证明KPC-2疫苗的免疫保护效果除了由体液免疫应答提供,还存在其他应答途径提供保护作用。
21种KPC亚型蛋白序列比对结果显示,不同序列之间氨基酸序列高度保守,氨基酸一致性在85%以上,多数亚型只有几个氨基酸缺失或突变(图7),这表明KPC不同亚型之间的免疫优势抗原表位可能高度保守,采用在中国为主的KPC-2亚型制备的疫苗可能具有良好的交叉保护效果,后续将进一步筛选其他亚型的菌株评价KPC-2疫苗保护效果。


1996年美国北卡罗来纳州首次报道了Kpn KPC[14],直到2005年也仅在美国东部零星报道,但到目前为止,KPC已遍布世界各国[14,15,16]。KPC-2能水解多数临床使用的β-内酰胺类抗生素,目前市面上仅有少数β-内酰胺酶抑制剂具有微弱抑制作用,因此对新抗生素或KPC-2抑制剂的研发刻不容缓。截至目前,研究者围绕KPC-2的结构功能和水解机制等开展了系列研究,筛选了大量的候选药物,文献报道的KPC-2抑制剂主要来源于天然合成(硼酸衍生物、氮杂环丁胺等)[17,18,19]、天然产物(科罗索酸,BLIP等)[20,21,22],以及计算机辅助药物设计[23]。这些候选药物几乎都是以靶向降低细菌的耐药性为出发点,作用靶点单一,通用性不强,有效性也有待进一步验证和提升。
疫苗等免疫学手段是防治细菌感染的重要途径[24]。KPC-2是锚定在革兰阴性菌外膜表面的蛋白质,这种细胞定位使得其容易被宿主免疫系统识别,可作为疫苗研究的候选抗原。本研究以KPC-2作为抗原,提出通过主动免疫的方法诱导宿主特异性免疫应答对抗细菌的耐药性,既可通过抗体阻断耐药酶的功能,也可能通过抗体调理吞噬作用发挥直接的杀菌活性,将为耐药菌的治疗提供一种全新的思路。在本研究中,KPC-2免疫能够引起小鼠较强的体液免疫应答,有效减少细菌在肺部的定植量,提高小鼠的存活率,并能有效提升美罗培南的治疗效果,表明采用耐药靶标作为候选抗原制备疫苗是合理可行的。与小分子抑制剂不同,疫苗诱导的抗原特异性抗体或效应淋巴细胞可以靶向抗原的多个表位,多管齐下同时发挥作用,既发挥了对KPC-2酶学活性的抑制作用,也可能从一定程度上抑制细菌耐药性的产生,具有明显的优势。
本研究探索了KPC-2疫苗对小鼠肺部感染KPC-2阳性Kpn的保护效果,并取得了良好的结果。另外,KPC虽已突变出多种亚型,但不同亚型之间的基因序列相对保守,仅有少数几个位点突变,据此推测KPC-2疫苗大概率会对其他亚型也产生保护效果。同时,KPC-2基因可通过质粒与转座子在不同细菌之间水平传播,其序列在不同菌种之间完全一致,使得KPC-2疫苗可能具有良好的通用性。我们将对KPC-2疫苗的通用性以及对不同亚型的交叉保护性展开进一步研究,以该耐药靶标制备疫苗的研究思路也可以进一步推广到其他耐药靶点。
王晓琼,明光阳,陈致富,等.肺炎克雷伯菌耐药靶标KPC-2的免疫原性和保护效果评价及保护机制初步研究[J].中华微生物学和免疫学杂志,2024, 44(1): 2-10. DOI: 10.3760/cma.j.cn112309-20231129-00154.
所有作者声明无利益冲突



























