
钇-90微球选择性内放射治疗(90Y-SIRT)肝脏恶性肿瘤已有50余年临床应用史,大规模临床应用亦超过20年,其安全性和疗效已被证实,但在我国仍处于起步阶段。90Y-SIRT操作复杂,涉及多学科团队协作,对操作者要求较高,一旦发生90Y微球异位分布可能会导致严重并发症。因此,规范90Y-SIRT操作技术,对促进90Y-SIRT在我国稳步推广至关重要。中国医师协会介入医师分会联合中国研究型医院学会肝胆胰外科专业委员会组织国内相关领域专家,基于现有文献证据并结合我国临床实践,围绕患者筛选、术前影像学评估、90Y-SIRT方案、处方剂量计算、90Y-SIRT的实施、术后管理、常见不良反应与并发症等,共同制订本专家共识,以规范90Y-SIRT操作,保证疗效,降低并发症发生率,促进90Y-SIRT在国内的推广和普及。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
钇-90微球选择性内放射治疗(Yttrium-90 selective internal radiation therapy,90Y-SIRT)是通过选择性插管方式将载有放射性核素90Y的微球注射到靶区域,90Y发射的纯β射线产生的电离辐射引起肿瘤组织不可逆损伤,导致肿瘤坏死,从而达到控制肿瘤的目的。虽然20世纪60年代就开展了90Y-SIRT的临床研究,并于20世纪70年代开始临床推广,但直至21世纪才真正在国外被广泛使用,现已成为治疗肝脏恶性肿瘤的重要手段之一[1]。而我国虽然20世纪90年代初就开展了90Y-SIRT治疗肝恶性肿瘤的试验和临床研究,但真正临床应用仍处于起步阶段[2, 3]。90Y-SIRT操作技术较经动脉化疗栓塞(transarterial chemoembolization,TACE)更具复杂性和挑战性,对操作者的要求较高,一旦发生90Y微球异位分布,严重并发症发生率更高[4, 5]。因此,规范90Y-SIRT操作对促进其在国内的稳步开展至关重要。中国医师协会介入医师分会和中国研究型医院学会肝胆胰外科专业委员会共同组织国内相关领域专家,基于目前已有的文献证据并结合我国的临床实践,共同制订《钇-90微球选择性内放射治疗肝脏恶性肿瘤规范化操作专家共识(2024版)》(以下简称本共识),以促进90Y-SIRT操作技术的规范化与标准化,保证其疗效的同时,最大限度减少并发症的发生。
本共识的使用者为从事90Y-SIRT相关的医师,目标应用人群为肝脏恶性肿瘤患者。本共识由中国医师协会介入医师分会和中国研究型医院学会肝胆胰外科专业委员会共同发起,并在国际实践指南注册与透明化平台注册(http://www.guidelines-registry.cn/user/guid/tail/2289)。专家组成员包括来自介入科、肝胆外科、核医学科、放射科等多学科团队的临床医学专家、循证医学专家、系统评价员和信息科学家等。项目组所有人员均申报了相关利益冲突,在无利益冲突前提下参与推荐意见的生成。
本共识使用PubMed、Embase、Cochrane Library、CNKI等数据库进行文献检索。采用《牛津循证医学中心分级2011版》具体执行证据质量评价和分级(附表1,扫描本文首页二维码可浏览附表1),并结合推荐与评价分析系统对证据质量评价指导原则进行调整[6],例如对间接证据进行降级。针对已被广泛认可的最佳临床操作、器械准备、装置准备、操作流程等则采用常规陈述方式呈现,不另予分级。
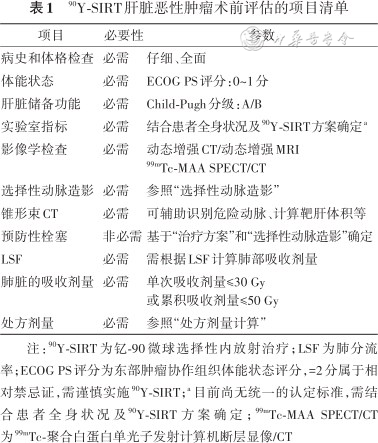
90Y-SIRT肝脏恶性肿瘤术前评估的项目清单
90Y-SIRT肝脏恶性肿瘤术前评估的项目清单
| 项目 | 必要性 | 参数 |
|---|---|---|
| 病史和体格检查 | 必需 | 仔细、全面 |
| 体能状态 | 必需 | ECOG PS评分:0~1分 |
| 肝脏储备功能 | 必需 | Child-Pugh分级:A/B |
| 实验室指标 | 必需 | 结合患者全身状况及90Y-SIRT方案确定a |
| 影像学检查 | 必需 | 动态增强CT/动态增强MRI99mTc-MAA SPECT/CT |
| 选择性动脉造影 | 必需 | 参照“选择性动脉造影” |
| 锥形束CT | 必需 | 可辅助识别危险动脉、计算靶肝体积等 |
| 预防性栓塞 | 非必需 | 基于“治疗方案”和“选择性动脉造影”确定 |
| LSF | 必需 | 需根据LSF计算肺部吸收剂量 |
| 肺脏的吸收剂量 | 必需 | 单次吸收剂量≤30 Gy 或累积吸收剂量≤50 Gy |
| 处方剂量 | 必需 | 参照“处方剂量计算” |
注:90Y-SIRT为钇-90微球选择性内放射治疗;LSF为肺分流率;ECOG PS评分为东部肿瘤协作组织体能状态评分,=2分属于相对禁忌证,需谨慎实施90Y-SIRT;a 目前尚无统一的认定标准,需结合患者全身状况及90Y-SIRT方案确定;99mTc-MAA SPECT/CT为99mTc-聚合白蛋白单光子发射计算机断层显像/CT
本共识采用电子投票方式计算共识率。投票意见分为以下5级:A级为完全同意;B级为同意,但有小修改意见;C级为同意,但有较大修改意见;D级为中立;E级为不同意。共识率=(A级+B级)专家位数/所有专家位数×100%。若某条意见共识率<85%,将征询专家意见,并形成新的条款,再次采用电子投票的方式进行投票计算共识率。以上共识率的权衡应兼顾患者的获益、方案的可及性和成本效果、患者的意愿、资源的合理利用以及证据等级等。
本共识将通过学术期刊、学术会议、宣讲、解读、新媒体推文等多种途径传播,促进共识在临床上实施。计划在3年内,评估最新研究证据情况和临床需求,必要时进行更新。
选择合适的患者一定程度上决定了90Y-SIRT的安全性和疗效。目前,市场上有2种主要的商用90Y微球产品(附表2,扫描本文首页二维码可浏览附表2):树脂微球和玻璃微球[7, 8, 9]。两者在不同地区获批的适应证不同,但在临床实践中均可用于治疗各种肝脏恶性肿瘤[2,10]。具体适应证和禁忌证如下。

钇-90微球选择性内放射治疗肝脏恶性肿瘤树脂微球的推荐吸收剂量
钇-90微球选择性内放射治疗肝脏恶性肿瘤树脂微球的推荐吸收剂量
| 病理学类型 | 治疗方案 | 单房室模型 | 多房室模型 | |||
|---|---|---|---|---|---|---|
| 灌注体积吸收剂量(Gy) | 证据等级 | 正常肝脏灌注区吸收剂量(Gy) | 肿瘤吸收剂量(Gy) | 证据等级 | ||
| HCC | RS | >150[32] | 5 | 不适用 | ||
| RL | 不推荐 | >70a[32] | ≥100~120[32,53] | 3 | ||
| 单叶 | 不推荐 | <40[32] | ≥100~120[32,53] | 3 | ||
| 双叶 | 不推荐 | <30b/40[32] | ≥100~120[32,53] | 3 | ||
| ICC | RS | >150[32] | 5 | 不适用 | ||
| RL | 不推荐 | >70[32] | ≥100~120[54] | 3 | ||
| 单叶 | 不推荐 | <40[32] | ≥100~120[54] | 3 | ||
| 双叶 | 不推荐 | <30b/40[32] | ≥100~120[54] | 3 | ||
| mCRC | RS | >150[32] | 5 | 不适用 | ||
| RL | 不推荐 | >70[32] | >100[32,55] | 3 | ||
| 单叶 | 不推荐 | <40[32] | >100[32,55] | 3 | ||
| 双叶 | 不推荐 | <30b/40[32] | >100[32,55] | 3 | ||
注:HCC为肝细胞癌;ICC 为肝内胆管细胞癌;mCRC 为结直肠癌肝转移;RS为放射性肝段切除;RL为放射性肝叶切除;a 适用于剩余正常肝脏体积>30%的患者;b 肝功能受损或之前接受过治疗的患者
接受90Y-SIRT应满足以下条件:(1)不可切除或患者拒绝接受手术切除/消融的肝脏恶性肿瘤(证据等级:2级,共识率:94.74%)。(2)预期生存时间>3个月(证据等级:2级,共识率:100%)[8,11, 12, 13, 14, 15, 16, 17, 18]。
绝对禁忌证包括:(1)东部肿瘤协作组织体能状态评分>2分或恶液质或多脏器功能衰竭。(2)肝功能 Child-Pugh C级,严重肝功能障碍(肝性脑病、难治性腹水、肝肾综合征等)。(3)无法纠正的凝血功能障碍。(4)肾功能不全(肌酐>176.8 μmol/L或肌酐清除率<30 ml/min)或肺功能不全[动脉氧分压<60 mmHg(1 mmHg=0.133 Kpa)或氧饱和度<90%]。(5)合并严重感染且不能有效控制。(6)肿瘤广泛转移,且预期生存时间<3个月。(7)门静脉主干闭塞,侧支血管形成少且不能纠正。(8)不可纠正的肝动-静脉分流或肝动脉-胃肠道动脉分流。(9)肺部单次吸收剂量>30 Gy或累积吸收剂量>50 Gy。(10)其他:如孕妇、哺乳期妇女、严重碘对比剂过敏[2,8,10, 11, 12,14,19, 20]。
相对禁忌证包括(证据等级:5级,共识率:100%):(1)东部肿瘤协作组织体能状态评分=2分。(2)既往接受过经颈静脉肝内门体分流术。(3)可纠正的体能状态不良。(4)可纠正的肝功能不良。(5)可纠正的血细胞减少(化疗性骨髓抑制或脾功能亢进等)。
术前影像学评估包括以诊断和分期为目的一般性影像学评估以及以过程模拟和预测为目的特殊影像学评估。前者主要包括 CT、MRI、正电子发射计算机断层显像(positron emission tomography computed tomography,PET/CT)。后者主要包括:99mTc-聚合白蛋白(99mTc-macroaggregated albumin,99mTc-MAA)单光子发射计算机断层显像/CT(single-photon emission computed tomography/CT,SPECT/CT)显像、选择性动脉造影[5]。99mTc-MAA SPECT/CT显像是模拟和预测的必须环节,选择性动脉造影是过程模拟的前驱步骤,不但可以筛选合适的靶血管注射核素显像剂,还可以预处理可能对90Y-SIRT造成干扰的血管。
患者必须在90Y-SIRT前1个月内行肝脏动态增强CT或动态增强MRI检查,对肝脏及肿瘤进行全面评估,并为准确勾画肿瘤提供参考(证据等级:5级,共识率:100%)。
18F-FDG PET/CT检查对FDG高代谢肿瘤病灶具有高检出率,能更全面和准确评估肿瘤分布,可以作为CT、MRI检查的重要补充。
99mTc-MAA显像可模拟、测算术后肿瘤和肝实质内90Y微球的分布,以及肺、消化道分流,用于处方剂量计算,预估肝损伤并降低胃肠道损伤及放射性肺炎的发生率[21]。99mTc-MAA评估应在90Y-SIRT前2周内进行(证据等级:5级,共识率:100%),在选择性动脉造影评估时,通过超选择至肿瘤供血动脉特定部位的微导管将2.5~5 mCi(4~8 ml)99mTc-MAA注射至拟实施90Y-SIRT的目标靶区,推荐分支血管注射。显像视野需包括胸部和上腹部,以保证全肺、全肝以及十二指肠等重要器官位于视野内。由于99mTc-MAA稳定性较差,推荐在标记后2 h内注射,注射后2 h内进行SPECT/CT显像,以降低99mTc-MAA脱标和清除造成的影响(证据等级:2级,共识率:100%)[22]。
选择性动脉造影必须在90Y-SIRT前2周内完成(证据等级:5级,共识率:100%),其包括但不局限于腹腔干、肝总、肝固有及肝内动脉分支,注意肠系膜上动脉、膈动脉等肝外侧支血管的供血情况[23]。选择性动脉造影不但可对肝动脉解剖、肿瘤供血动脉、危险动脉/吻合等进行全面评估以及采取必要的预防性栓塞,降低90Y微球异位分布的发生率,还可以辅助完成术前99mTc-MAA评估。其内容主要包括:(1)辨认可能导致90Y微球异位分布的危险动脉/吻合,并对其进行预防性栓塞。(2)确定90Y-SIRT时微导管超选择至合适位置,并进行99m Tc-MAA注射。(3)为相关参数计算提供参考(见“处方剂量计算”)[5]。造影时选择具体参数需结合微导管头端所在位置、与所在血管之间的角度、所在血管的血流动力学参数、肿瘤病变血供特点、数字减影血管造影(digital subtraction angiography,DSA)设备等不同而有所变化,其目的在于准确显示病变部位、边界、供血动脉,以及与周围组织的解剖关系。
推荐术中使用锥形束 CT(cone beam CT,CBCT)检查,结合术前影像学检查仔细分析造影表现,明确肿瘤部位、大小、数目及供血动脉情况(证据等级:2级,共识率:100%)[24, 25]。
1.危险动脉的评估及处理:术者应熟练掌握危险动脉的评估及预防性栓塞技术,避免90Y微球异位分布导致的并发症,勿将以往TACE的经验和方法直接移植到90Y-SIRT中。以下对可能导致90Y微球异位分布的危险动脉进行阐述。
(1)胆囊动脉:如果需要将导管头端置于胆囊动脉开口近端的位置实施90Y-SIRT,应对其进行评估,如分流量过大,且胆囊壁显影明显,推荐对其进行预防性栓塞或尝试使用球囊微导管避免反流;反之,则无需处理(证据等级:3级,共识率:97.37%)[26, 27]。
(2)胃右动脉:如果需要将导管头端置于胃右动脉开口近端的位置实施90Y-SIRT,推荐对其进行预防性栓塞或使用球囊微导管避免反流;反之,则无需预处理(证据等级:2级,共识率:97.37%)[28]。
(3)胃十二指肠动脉(gastroduodenal artery,GDA):在对全肝进行一次性90Y-SIRT时,导管头端可能需要置于肝固有动脉。如90Y微球反流入GDA的几率较小,可不必常规预防性栓塞,如术者认为有较高风险时,可对GDA进行预防性栓塞或使用球囊微导管避免反流(证据等级:2级,共识率:94.73%)[28]。
(4)十二指肠上动脉:常规造影检查通常不显影,当栓塞GDA后,再次行肝固有动脉造影检查时常可观察到有代偿性增粗现象。如果在肝固有动脉进行90Y-SIRT,则导管头端必须置于十二指肠上动脉开口远端,同时要采取抗反流措施预防微球反流,否则需要对其进行预防性栓塞(证据等级:2级,共识率:97.37%)[28]。
(5)镰状动脉:起自肝左或肝中动脉终末支、走行于镰状韧带内的一支小血管。如果发现这一动脉处于治疗靶区,则需要对其进行预防性栓塞或体表局部冰袋冷敷以减少微球异位分布(证据等级:2级,共识率:92.1%)[28]。
(6)其他常见的动脉异常:肝左动脉发出副胃左动脉、肝左动脉-胃左动脉吻合、肝左动脉-食管动脉吻合、肝动脉-膈下动脉吻合、动-静脉分流(肝动脉-肝静脉分流、肝动脉-门静脉分流、肝动脉-肺静脉分流)等,如果发现这些解剖关系,并且处于90Y-SIRT的靶区域,则必须结合这些血管的供血区域进行综合评估是否需要处理[29, 30]。
2.预防性栓塞的注意事项:对可能导致90Y微球异位分布的动脉、吻合及分流,均应进行超选择性动脉造影检查,并结合CBCT,同时需注意血管造影技术参数对结果的影响。如需进行预防性栓塞,则栓塞要彻底,避免再通,最常用的栓塞材料为弹簧圈。还可考虑使用抗反流导管(如球囊微导管)等[31]。无论造影是否发现危险动脉及吻合,或是否进行相应处理,行99mTc-MAA显像后均需结合术中和术前影像学资料,整体评估血管分布情况,并相应调整治疗计划。
再次进行90Y-SIRT包括分次治疗和重复治疗。(1)分次治疗:对肝内多发肿瘤在不同时间进行分次治疗,通常是第1次治疗1个肝叶,第2次治疗另1个肝叶,治疗间隔一般为3~8周[32]。(2)重复治疗:因肿瘤复发或残留而重复治疗同一区域的肿瘤病灶。无论是分次治疗还是重复治疗,再次进行90Y-SIRT前均需再次评估[33]。除常规评估外,还需注意:(1)控制双肺的累积吸收剂量≤50 Gy。(2)均需再次进行肺分流率(lung shunt fraction,LSF)评估。(3)当重复治疗同一个病灶区域时,间隔时间应>3个月,再次90Y-SIRT前应关注肿瘤对上一次90Y-SIRT的反应,如果肿瘤无明显缩小或坏死,则此类患者不适宜再次进行90Y-SIRT。
根据治疗目的不同,90Y-SIRT方案分为根治性治疗、降期转化治疗、姑息性治疗。以上治疗方案应基于患者的肿瘤特征、体能状态、肝脏储备功能、实验室检查等综合制订。
目的是肿瘤得到治愈,如放射性肝段切除和放射性肝叶切除[35]。近年来,90Y-SIRT逐渐向超选择性治疗发展,如肝亚段,甚至更小靶区域的治疗。
放射性肝段切除适用于肿瘤病灶局限于≤2个肝段的患者(证据等级:3级,共识率:97.37%)[36]。放射性肝叶切除适用于单叶病变的患者(证据等级:3级,共识率:97.37%)[37],允许靶肝叶接受较高的吸收剂量,并诱导对侧肝叶增生、肥大。
处方剂量是指医嘱剂量,即计划注射到靶组织的放射性活度,国际单位是贝克勒(Bq),常用单位是吉贝克勒(GBq,109 Bq)。吸收剂量是指单位质量受照射物质所吸收的平均辐射能量,国际单位是焦耳/千克(J/kg),通常用戈瑞(Gy)表示。推荐使用以医学内照射剂量(medical internal radiation dose,MIRD)方程为基础的房室模型个性化计算处方剂量(证据等级:2级,共识率:100%)[48, 49, 50, 51]。
单位放射性活度的90Y树脂微球(49.67 J/GBq)和玻璃微球(50 J/GBq)授予肝组织和肿瘤组织的吸收剂量是常数(又称转化因子),两者仅是保留的有效数字位数不同,对剂量计算影响较小。如果组织内90Y微球均匀分布,且90Y微球衰变产生的β射线被组织完全吸收,那么注射一定放射性活度的90Y微球后,组织的吸收剂量可通过MIRD方程计算:公式1。
D ①
D为吸收剂量;A为放射性活度;CF为转化因子;TM为靶区组织质量
MIRD方程变换后,指定靶区的吸收剂量,即可计算所需的放射性活度(公式2)。
AMIRD为所需的放射性活度;D为吸收剂量;CF为转化因子;TM为靶区组织质量
放射性微球剂量计算所用的房室模型建立在上述基础之上,根据房室设定分为单房室模型和多房室的分区模型。
1.单房室模型:将肝脏灌注区视为单一房室,指定所需的吸收剂量后,通过公式2计算所需的放射性活度[靶区组织质量=1.03 kg/L×靶区房室体积(L)]。同时考虑肺分流情况进行校正(公式3),得到最终的处方剂量Ap(GBq)。
Ap为单房室模型计算的处方剂量;AMIRD为所需的放射性活度;LSF为肺分流率
单房室模型仅考虑了靶区体积和剂量的关系,不区分肿瘤和正常肝组织微球分布的差异,勾画和测算均较简单。拟实施放射性肝段切除的患者,当病灶和灌注区域较局限或病灶与肝实质微球分布差异较小时,单房室模型即能满足计算需要,推荐使用单房室模型(证据等级:3级,共识率:89.47%)[52]。对于肿瘤和正常肝组织微球分布差异显著的情形,只有在无法获取分区模型所需的必要参数时才使用单房室模型。
2.分区模型:在单房室模型基础之上,考虑到肿瘤和正常肝组织微球分布的不同,将其区分为不同房室,即分区模型。处方剂量计算需要依据99mTc-MAA模拟显像勾画测量肿瘤体积、灌注区正常肝组织体积,以及其内放射性活度(A)或计数,并计算肿瘤/正常肝组织放射性微球分布比率(公式4)。
TNR(tumor to nontumoral liver ratios)为肿瘤/正常肝组织放射性微球分布比率;Atumor为肿瘤内放射性活度或计数;Vtumor为肿瘤体积;Anormalliver为灌注区正常肝组织内放射性活度或计数;Vnormal liver为灌注区正常肝组织体积
指定肿瘤平均吸收剂量后,可通过公式5计算处方剂量。公式5中的(1-LSF)同样用于校正肺分流的影响。
APM为分区模型计算的处方剂量;D为吸收剂量;Mtumor为肿瘤质量(为1.03 kg/L×Vtumor);TNR为肿瘤/正常肝组织放射性微球分布比率;Vtumor为肿瘤体积;Vnormal liver为灌注区正常肝组织体积;CF为转化因子;LSF为肺分流率
根据关注角度不同,公式5有多种变形:如指定灌注区正常肝组织拟耐受的吸收剂量(D),处方剂量可通过公式6计算。
APM为分区模型计算的处方剂量;D为吸收剂量;TNR为肿瘤/正常肝组织放射性微球分布比率;Mtumor为肿瘤质量;Mnormalliver为灌注区正常肝组织质量;CF为转化因子;LSF为肺分流率
分区模型适用于需要分别考虑肿瘤和灌注区肝实质吸收剂量的情形,如拟实施姑息性治疗、单叶分次治疗的患者。由于灌注范围大,需要平衡病灶吸收剂量与正常肝组织以及肺组织的辐射损伤,将肝、肺辐射损伤控制在安全范围以内[12]。
房室模型考虑了LSF,可以根据双肺分流微球的放射性活度,通过MIRD方程(公式1)计算肺组织的吸收剂量。肺组织转化因子数值与肝组织相同,含气肺组织密度常以0.3 kg/L计。
计算处方剂量前需明确若干参数,包括LSF、肿瘤/正常肝组织放射性微球分布比率(TNR)、灌注区域和目标靶区的体积、全肝和全肺体积。
LSF=肺内放射性计数总量/(肺+肝放射性计数总量),指分流至肺内放射性活度占注射放射性活度的百分比,通过99mTc-MAA模拟获取。可采用平面采集或断层采集图像,勾画计算。平面和前后位均采集,建议采集的光子计数为1 M。断层扫描建议每6°~10°采集1个体位,每个体位采集时间15~30 s。
平面采集和断层采集分别用公式7和公式8计算LSF,放射性活度可以用光子计数替代。平面采集图像,勾画和计算简便,但放射性浓聚范围常大于放射源分布区域,肝脏内高活度放射源,特别是膈顶处放射源,常映射到邻近肺实质内,夸大了LSF。断层图像能较好地克服肝脏膈顶部放射性浓聚对肺内计数的影响。
LSF为肺分流率;-F表示前位,-B表示后位;ALung-F为肺前位放射性活度;ALung-B为肺后位放射性活度;ALiver-F为肝前位放射性活度;ALiver-B为肝后位放射性活度;ALiver、ALung分别为肝脏和双肺放射性活度
TNR计算受肿瘤大小、浸润程度、肿瘤坏死灶及测量技术等影响。99mTc-MAA SPECT/CT影像中,平扫CT显示病灶的灵敏度和特异度较低。结合增强CT等影像,可提高病灶勾画的准确性。
拟单支血管治疗,可根据99mTc-MAA SPECT/CT勾画灌注区域,进而计算剂量。经多支动脉99mTc-MAA 灌注显像,需结合CBCT图像来确定不同动脉的灌注区域,并进行勾画和剂量计算。
剂量控制应考虑以下3方面因素:肿瘤反应、肝组织损伤、刺激肝脏代偿性肥大。肿瘤反应-无反应的吸收剂量范围有较大重叠,推荐在全肝吸收剂量安全范围内尽可能提高处方剂量(证据等级:5级,共识率:100%)。有文献报道,正常肝组织对电离辐射的耐受量为70~80 Gy,肝功能正常患者其剩余正常肝脏体积>30%是安全的,但对伴有慢性肝病及前期接受过化疗的患者,肝脏对电离辐射的耐受量为50~70 Gy[3]。当需要刺激非灌注区肝脏代偿性肥大时,灌注区正常肝组织的吸收剂量应根据患者的肝功能储备情况综合评估确定。
在实际治疗过程中,受微球数量和比活度等因素影响,不同微球在组织内的分布差异大,同一房室内组织的吸收剂量并不均匀。欧洲核医学协会针对不同病理学类型的肝脏肿瘤和不同90Y微球产品,基于房室模型计算处方剂量,推荐的吸收剂量如下(表2,3)[10]。

钇-90微球选择性内放射治疗肝脏恶性肿瘤玻璃微球推荐吸收剂量
钇-90微球选择性内放射治疗肝脏恶性肿瘤玻璃微球推荐吸收剂量
| 病理类型 | 治疗方案 | 单房室模型 | 多房室模型 | |||
|---|---|---|---|---|---|---|
| 灌注体积吸收剂量(Gy) | 证据等级 | 正常肝脏吸收剂量(Gy) | 肿瘤吸收剂量(Gy) | 证据等级 | ||
| HCC | RS | >400[52] | 3 | 不适用 | ||
| RL | >150,若全肝剂量a<150[56] | 2b | ≥88c[57] | ≥205[56] | 2 | |
| 140~150[37] | 3 | <75(50/90d)[57] | ≥250/300e | 3 | ||
| 单叶 | >150,若全肝剂量a<150[56] | 2b | <120c若 HR<30%[56] | ≥205[56] | 2b | |
| 80~150[56,58] | 2 | <75(50/90d)[59] | ≥250/300e | 3 | ||
| 双叶 | 80~150e[60, 61, 62] | 3 | <50/90d[59] | ≥205[63] | 3 | |
| ICC | RS | >400[64] | 3 | 不适用 | ||
| RL | 140~150[10] | 5 | <75(50/90d) | ≥260[65] | 3 | |
| 单/双叶 | 80~150[66] | 3 | <75(50/90d) | ≥260[65] | 3 | |
| mCRC | RS | >400[67] | 3 | 不适用 | ||
| RL | 140~150[10] | 5 | <75(50/90d) | ≥189[68] | 3 | |
| 单/双叶 | 80~150[69] | 3 | <75(50/90d) | ≥189[68] | 3 | |
注:HCC 为肝细胞癌;ICC 为肝内胆管细胞癌;mCRC为结直肠癌肝转移;RS为放射性肝段切除;RL为放射性肝叶切除;HR 为剩余正常肝脏体积;a全肝剂量:由于90Y微球灌注区体积(受照体积)越小,对吸收剂量的耐受越高,将灌注区吸收剂量乘以灌注区体积占全肝的百分比,折算为全肝吸收剂量,即全肝剂量,用于评估全肝的放射损伤[70, 71];b与DOSISPHERE-01研究人群类似的患者(Child-Pugh A、大病灶、HR>30%)[56];c首次治疗,正常肝脏灌注区的吸收剂量;d全肝正常肝组织平均剂量粗略的阈值上限为75 Gy,当总胆红素>18.8 μmol/L,<50 Gy,当总胆红素<18.8 μmol/L,<90 Gy;e对于大病灶[56]
90Y-SIRT必须在术前影像评估后2周内实施,包括房间准备、患者准备、给药装置准备、90Y微球输注、术中辐射防护等,确保手术的安全实施(证据等级:5级,共识率:100%)[7]。
按标准的介入手术室准备,在手术室出口处建立污染控制区。需在DSA手术台和放置90Y微球推车之间的地板上放置一次性铺巾,导管接头下方需放置双层铺巾,以防术中发生放射性污染。应放置2个辐射探测器:(1)手术室出口处配备一台可检测辐射水平˂0.1 mrem/h的盖革探测器,检测工作人员、废弃物及房间内固定设备上可能存在的放射性污染。(2)能够检测低至1 mrem/h辐射剂量的便携式电子计量器,测量从患者身上发出的韧致辐射以及药剂瓶中剩余的放射性活度。
患者术前准备与TACE类似,注射使用的导管和微导管应与前次动脉造影的导管相同,微导管头端的位置、角度、形态等应与注射99mTc-MAA时保持一致,并进行动脉造影,推荐重新进行CBCT扫描,确保导管位置准确,并确认预防性栓塞的靶血管处于闭塞状态,且未出现新的侧支循环或代偿性增粗的危险动脉,血供区覆盖计划治疗的靶病变区域,避免90Y微球异位分布或覆盖区域不足。
微导管应符合以下标准:(1)内径>90Y微球直径,避免微球滞留于给药装置和微导管。(2)头端不得堵塞准备灌注90Y微球的血管,以便血流将微球带至肿瘤组织。(3)长度足够,避免长度过短导致难以连接到给药装置或微导管头端移位。
术中需保持输送系统的密闭性和无菌操作。如组装过程中出现任何故障,应及时更换给药装置。严禁在给药装置和微导管之间使用任何装置。输注前介入医师与物理师共同核对90Y微球产品和剂量是否准确,所有装置是否连接正确。确认后方可将微导管连接到90Y微球容器的输出管。
输注前确保给药装置所处的水平高于患者身体中心水平约20 cm,注入液体预充管路系统,排出注射管路中的气泡,检查并确认注射管路的通畅性和各连接处是否密闭,微导管头端位置无移位,全部确认完毕后开始输注微球。输注全程需保持微导管的体内部分稳定,根据不同微球特点及其输注要求,需确保微球随血流进入肿瘤组织内。应连续监测容器内剩余的放射性活度。输注完毕,将导管、剂量瓶、输注管道和接触敷料回收至核废物专用塑料罐,并由核医学技师送至核废物储存室。
1.树脂微球:树脂微球比重(1.6 g/ml)接近血液比重(1.1 g/ml),宜缓慢输注,根据血流情况调整输注速度,微球随血流动力达到肿瘤末梢血管。输注过程中随时检查导管头端位置和形态,并间歇性血管造影,确保正向血流。注意剂量瓶中插入不同针尖的位置和深度,及时控制注射线路中液体的流向和每次注入微球的量。注射完所有微球后再调整针尖位置,改注入空气将剂量瓶中的液体全部压入管线并注射完,最后血管造影确认。术中如发现靶血管血流速度减缓,需要控制微球注入量和速度。推荐使用5%的葡萄糖溶液,减少90Y微球淤滞的风险(证据等级:3级,共识率:100%)[72, 73]。
2.玻璃微球:玻璃微球比重(3.6 g/ml)大于血液比重(1.1 g/ml),输注速度应>20 ml/min,由于输注装置有泄压装置,可维持输注压力恒定,一般输注3~5次完成,每次20 ml(具体根据说明书进行)。输注玻璃微球时需:(1)摇晃小瓶并用力敲击其底部,使滞留在隔膜和瓶内壁的微球回到溶液中,注射全程保持小瓶直立。(2)合理使用弹簧钳夹,避免气泡进入出口管,防止过早输液或管线中微球残留。
防护罩以外及连接到导管等部位均无防护装置,存在暴露风险,相关人员应站在屏蔽屏后方或保持一定距离。手术室内所有人员除穿铅衣防护外,还要对眼睛、皮肤和手等进行防护。避免无谓的人员、器械和区域的接触。任何有潜在污染可能的物品均需立即放入放射性污物回收罐内。在确保无手术人员、操作台、手术室地面放射性污染之后才能对患者进行下一步处理,如拔鞘、压迫止血等。所有在场人员在离开房间时均需检测体表部位可能接触的放射性污染。还要对推车、铅筒、设备、导管连接处下方及推车下方区域等进行放射性污染检测。
患者术后无需特殊防护。如有肝外分布且伴有临床症状,需根据情况采取干预措施。
出院后1周内应电话随访1次,侧重询问患者饮食、精神及体能状况,以及有无腹痛等情况;治疗后的2~4周第1次门诊随访,之后常规门诊随访,内容主要包括询问病史、体格检查、实验室及影像学检查,术后影像学疗效评估包括:动态增强CT/动态增强MRI、PET/CT,术后第1次影像学检查应在治疗后1~3个月进行,之后每2~3个月复查1次[74, 75]。
90Y-SIRT需多学科团队协作完成,并遵循以下流程(图1),推荐专科成员的分工如下:(1)患者筛选、评估:肝胆外科、介入科、影像科、核医学科、肿瘤内科、肝病内科、放疗科、放射科等。(2)选择性动脉造影、治疗方案确定及手术的实施:介入科。(3)处方剂量计算:介入科、核医学科。(4)术后管理:介入科、肝胆外科、肿瘤内科等。
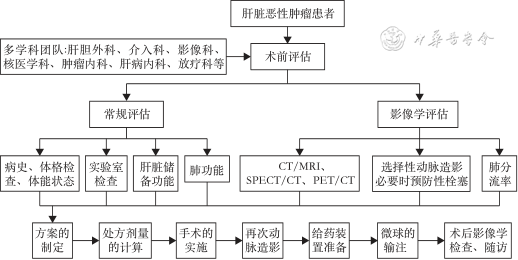

注:SPECT/CT为单光子发射计算机断层显像/计算机断层显像;PET/CT为正电子发射计算机断层显像
不良反应是指术后出现的非特异性临床症状或实验室指标异常。常见症状包括乏力、厌食、恶心、呕吐、腹痛、发热,发生率为10%~70%,大多轻微且在数日内自愈[10,76, 77]。实验室指标异常包括胆红素和转氨酶升高及外周血淋巴细胞和血小板计数降低。术后约1/3的患者出现实验室检查指标异常,通常无任何临床表现。由于不良反应缺乏特异性,治疗措施主要为对症处理,缓解患者不适[4,10]。
并发症主要是90Y微球异位分布引起的组织或器官的放射性损伤。包括放射性上消化道损伤、放射性肝炎、放射性胆囊炎/胆管损伤、放射性肺炎、放射性皮炎等[1,4]。一旦怀疑或确诊,推荐按表4的处理措施积极治疗,减轻并发症带来的不良后果(证据等级:5级,共识率:100%)[4]。

钇-90微球选择性内放射治疗(90Y-SIRT)并发症的发生率及处理措施[4]
钇-90微球选择性内放射治疗(90Y-SIRT)并发症的发生率及处理措施[4]
| 并发症 | 发生率 | 处理措施 |
|---|---|---|
| 放射性胆管损伤 | <10%[76,78] | 缓解梗阻性黄疸,酌情使用抗生素 |
| 放射性肝炎 | <5.4%a[76,79, 80, 81] | 利尿、改善肝功能和凝血功能:静脉内注射去纤苷钠,必要时需考虑TIPS |
| 放射性上消化道损伤 | <5%[82, 83] | 高剂量质子泵抑制剂、胃动力药、硫糖铝、止吐药、镇痛药;严重者可全胃肠外营养或空肠造口术;出现放射性消化道狭窄/梗阻者,可选择球囊扩张或外科手术 |
| 放射性胆囊炎 | <1%[26, 27,84] | 静脉补液和镇痛,胆囊坏死或穿孔行胆囊造瘘或切除 |
| 放射性肺炎 | <1.8%[21,85] | 经验性使用类固醇,吸氧 |
| 放射性胰腺炎 | 罕见[76] | 禁食、胃肠减压、使用抑酸和抑酶剂;补液及营养支持、解痉、止痛等 |
| 放射性血细胞减少 | 33.3%~96%b[86, 87] | 对症治疗 |
注:TIPS为经颈内静脉肝内门体分流术;a90Y-SIRT治疗前后接受化疗的患者,放射性肝炎的发生率显著增高(达20%)[88];b放射性淋巴细胞减少最常见,未见因此导致的机会性感染
90Y-SIRT在中国刚刚起步,因其操作技术具有一定的复杂性,且涉及多学科团队协作,希望本共识能够推动 90Y-SIRT操作技术的标准化、规范化,在保证疗效的同时,降低并发症的发生率,最终促进90Y-SIRT在国内的普及和推广应用。
执笔专家:朱海东(东南大学附属中大医院介入与血管外科);张琳(清华大学附属北京清华长庚医院肝胆胰中心介入科);贾中芝(南京医科大学附属常州第二人民医院介入血管科);刘加成(东南大学附属中大医院核医学科);陆建(东南大学附属中大医院介入与血管外科)
本共识制订专家组成员(按姓氏汉语拼音排序):曹明溶(暨南大学附属第一医院肝胆外科);董家鸿(清华大学附属北京清华长庚医院肝胆胰外科);段旭华(郑州大学第一附属医院介入科);韩国宏(西安国际医学中心医院消化内科);韩新巍(郑州大学第一附属医院介入科);韩星敏(郑州大学第一附属医院核医学科);胡红杰(浙江大学医学院附属邵逸夫医院放射科);胡红耀(武汉大学人民医院放射介入科);胡鸿涛(河南省肿瘤医院介入科);黄中柯(浙江大学医学院附属邵逸夫医院核医学科);孔铭新(潍坊市人民医院放射介入科);黎海亮(河南省肿瘤医院介入科);李林法(中国科学院大学附属肿瘤医院核医学科);林海澜(福建省肿瘤医院介入科);刘畅(四川大学华西医院肝脏外科);鲁东(中国科学技术大学第一附属医院介入科);陆骊工(珠海市人民医院介入医学科);吕维富(中国科学技术大学第一附属医院介入科);牛惠敏(广州中医药大学金沙洲医院钇90 治疗中心);邵国良(中国科学院大学附属肿瘤医院介入科);邵海波(中国医科大学附属第一医院介入治疗科);施万印(安徽医科大学第一附属医院介入科);石亮荣(中南大学湘雅医院放射科);司同国(天津医科大学肿瘤医院介入科);苏新辉(浙江大学医学院附属第一医院核医学科);滕皋军(东南大学附属中大医院介入与血管外科);田蓉(四川大学华西医院核医学科);王瑞华(郑州大学第一附属医院核医学科);王松(青岛大学附属医院介入科);王远成(东南大学附属中大医院放射科);王忠敏(上海交通大学医学院附属瑞金医院介入科);向华(湖南省人民医院介入血管外科);谢强(中国科学技术大学附属第一医院核医学科);谢印法(山东第一医科大学附属肿瘤医院介入科);颜志平(复旦大学附属中山医院介入科);杨辉(河南省肿瘤医院核医学科);杨业发(海军军医大学附属第三医院介入科);于海鹏(天津医科大学肿瘤医院介入科);于丽娟(海南省肿瘤医院核医学科);张辉(陆军军医大学第一附属医院肝胆外科);张齐(东南大学附属中大医院介入与血管外科);张艳(暨南大学附属第一医院介入血管外科);张子曙(中南大学湘雅二医院放射介入科);郑传胜(华中科技大学同济医学院附属协和医院放射科);郑家平(中国科学院大学附属肿瘤医院介入科);郑鑫(西安交通大学第一附属医院肝胆外科);朱康顺(广州医科大学附属第二医院微创介入科);朱旭(北京大学肿瘤医院介入科);邹英华(北京大学第一医院介入血管外科)
共识方法学专家:夏君(宁波诺丁汉大学GRADE中心)
证据评价:赵展(天津溯源循证科技有限公司);赵赛(上海道田循证科技有限公司)
中国医师协会介入医师分会临床诊疗指南专委会, 中国研究型医院学会肝胆胰外科专业委员会. 钇-90微球选择性内放射治疗肝脏恶性肿瘤规范化操作专家共识(2024版)[J]. 中华医学杂志, 2024, 104(7): 486-498. DOI: 10.3760/cma.j.cn112137-20231025-00894.
中国肝癌介入MDT联盟、中国临床实践指南联盟(GUIDANCE)在共识组织过程中联络沟通、统筹协调付出的辛勤工作
所有作者声明不存在利益冲突




























