
探讨多发性骨髓瘤(MM)患者自体造血干细胞移植(ASCT)后出现寡克隆条带(OB)对患者疗效及预后的影响。
回顾性分析2013年12月到2022年2月江苏省人民医院血液科接受ASCT治疗的156例初诊MM患者,其中男91例,女65例,年龄[M(Q1,Q3)]为56(26,71)岁。根据ASCT治疗后OB形成情况将患者分为两组:OB组(n=60)与非OB组(n=96)。末次随访日期为2023年8月31日,随访时间为42(18,117)个月。比较两组患者临床基线特点及疗效。采用Kaplan-Meier法绘制生存曲线,比较两组患者无进展生存时间(PFS)及总生存时间(OS)的差异;采用Cox风险回归模型分析与预后相关的危险因素。
OB组与非OB组患者在发病年龄、分型、分期、危险分层、是否合并髓外病变、初诊循环浆细胞比例、诱导治疗方案等方面差异均无统计学意义(均P>0.05)。OB组患者接受ASCT治疗后获得完全缓解(CR)及以上缓解程度比例为93.3%(56/60),高于非OB组患者的80.2%(77/96)(P=0.024)。OB组患者微小残留病(MRD)阴性率为66.7%(40/60),高于非OB组患者的34.4%(33/96)(P=0.001)。OB组PFS及OS均为未达到,非OB组PFS及OS时间分别为28(2,80)、86(2,100)个月,OB组较非OB组患者具有更长的PFS(P<0.001)和OS(P=0.017)。在Cox多因素分析中,OB形成是MM患者PFS的保护因素(HR=0.314,95%CI:0.153~0.644,P=0.002)。亚组分析发现,在Mayo骨髓瘤分层及风险调整治疗(mSMART)高危组患者中,OB组患者OS时间为未达到,优于非OB组患者的71(2,90)个月(P=0.046);但在mSMART标危组患者中,OB组与非OB组OS均为未达到,差异无统计学意义(P=0.103);在初诊合并髓外病变患者中,OB组OS为未达到,优于非OB组患者的47(6,74)个月(P=0.037);但在初诊无髓外病变患者中,OB组OS为未达到,非OB组OS为86(2,100)个月,差异无统计学意义(P=0.130)。
MM患者接受ASCT治疗后OB形成与疗效及预后相关,尤其对于初诊合并髓外病变或具有高危遗传学特征的患者,OB形成可提高患者MRD阴性率,延长患者OS时间,改善患者预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple myeloma,MM)是以骨髓中浆细胞克隆性增殖并产生单克隆免疫球蛋白(M蛋白)为特点的恶性血液病。随着疾病达到完全缓解(complete response,CR),血和尿免疫固定电泳中的M蛋白消失,部分患者在CR后复发时重新出现与原类型相同的M蛋白,然而有部分患者在CR后出现与初诊时类型不同的新型M蛋白,称之为寡克隆条带(oligoclonal bands,OB)[1, 2]。OB通常发生在化疗或自体造血干细胞移植(autologous stem cell transplant,ASCT)后,尤其多见于ASCT治疗后,其发生率为6.6%~73.0%,发生机制可能与更深层次的缓解以及免疫重建相关[3, 4, 5]。OB对MM患者预后的意义尚无统一定论,有研究报道OB与非移植患者的预后相关,而与移植患者的预后无明显相关性[6]。也有观点认为OB的出现是ASCT后预后良好的标志[7]。本研究回顾性分析了本中心诊治的156例初诊MM患者的临床资料,所有患者均接受早期ASCT治疗,旨在探究ASCT治疗后OB形成对疗效及生存的影响。
本研究为回顾性队列研究,研究方案通过江苏省人民医院伦理委员会审批(伦理号:2022-SR-448),研究过程中未对患者采取干预措施,不损害患者利益,已申请免除知情同意并通过。
1. 纳入标准:符合国际骨髓瘤工作组(International Myeloma Working Group,IMWG)MM诊断标准。
2. 排除标准:(1)未进行规律诱导治疗;(2)未在诱导治疗后行早期ASCT。
3. 分组:回顾性纳入2013年12月至2022年2月江苏省人民医院初诊接受ASCT的MM连续病例156例,其中男91例,女65例,年龄为56(26,71)岁。根据ASCT治疗后OB形成情况将患者分为两组:OB组(n=60)与非OB组(n=96)。
1. 临床资料收集:收集患者性别、年龄、病史、分型、分期、是否合并髓外病变(包括骨相关髓外病变和骨外髓外病变)、初诊循环浆细胞比例(流式细胞术)、初诊 Mayo骨髓瘤分层及风险调整治疗(Mayo stratification of myeloma and risk-adapted therapy,mSMART)、一线治疗方案等基本临床资料。
2. 治疗方案:所有患者均接受以蛋白酶体抑制剂和(或)免疫调节剂为基础的诱导治疗。诱导治疗后所有患者均按照自身意愿接受ASCT治疗,随后进行巩固及维持治疗。MM患者接受ASCT治疗后出现不同于最初诊断的重链和(或)轻链免疫球蛋白的新型M蛋白定义为OB。
3. 高危与标危判断标准:根据mSMART分层系统,存在高危细胞遗传学异常[包括t(4;14)、t(14;16)、t(14;20)、del(17p)、p53突变、1q扩增],修订的国际分期体系(R-ISS)分期为Ⅲ期、S期(增殖期)浆细胞高比例,GEP基因表达谱高危标志等任何1项均属于高危患者,其余所有类型为标危患者。
4. 疗效评估及随访:通过查阅门诊或住院病例及电话进行随访,截至2023年8月31日,随访时间为42(18,117)个月。疗效评估按照IMWG标准执行,包括严格意义上的完全缓解(stringent complete response,sCR)、CR、非常好的部分缓解(very good partial response,VGPR)、部分缓解(partial response,PR)。微小残留病(minimal residual disease,MRD)阴性定义为骨髓流式细胞术检测至少1×106个细胞,表型异常克隆浆细胞<10个。MRD阴性持续时间定义为ASCT治疗后疗效达MRD阴性的持续时长。对于ASCT治疗前达MRD阴性的患者,MRD阴性持续时间则为从ASCT治疗开始MRD阴性的持续时长,移植后平均每3~6个月检测骨髓MRD情况。无进展生存时间(progression-free survival,PFS)定义为自ASCT起至疾病进展或死亡的时间;总生存时间(overall survival,OS)定义为自ASCT起至死亡或末次随访的时间;移植后早期复发定义为移植后12个月内复发。
应用SPSS 25.0和Graphpad Prism 8.0软件进行统计学分析。偏态分布计量资料采用M(Q1,Q3)表示;计数资料采用频数及百分率表示,组间比较采用χ2检验或Fisher精确概率法。采用Kaplan-Meier法绘制生存曲线,组间PFS和OS比较采用log-rank检验。采用Cox比例风险回归模型评估与PFS和OS相关的危险因素,将单因素分析中P<0.05的因素纳入多因素回归分析。双侧检验,检验水准α=0.05。
共有60例患者接受ASCT治疗后出现OB,出现时间为ASCT治疗后94(34,354)d。OB类型分别为IgG-κ(19例)、IgG-λ(24例)、IgM(4例)、κ轻链(10例)、双克隆IgG-κ+λ(3例)。OB组和非OB组患者性别、年龄、疾病分型、分期、危险分层、髓外病变、初诊循环浆细胞比例、诱导治疗方案差异均无统计学意义(均P>0.05),结果见表1。
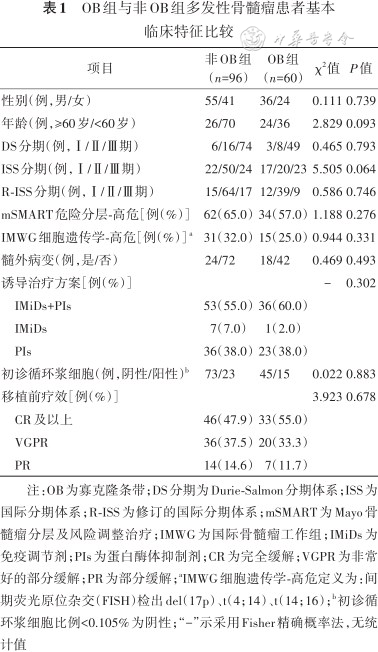
OB组与非OB组多发性骨髓瘤患者基本临床特征比较
OB组与非OB组多发性骨髓瘤患者基本临床特征比较
| 项目 | 非OB组(n=96) | OB组(n=60) | χ2值 | P值 |
|---|---|---|---|---|
| 性别(例,男/女) | 55/41 | 36/24 | 0.111 | 0.739 |
| 年龄(例,≥60岁/<60岁) | 26/70 | 24/36 | 2.829 | 0.093 |
| DS分期(例,Ⅰ/Ⅱ/Ⅲ期) | 6/16/74 | 3/8/49 | 0.465 | 0.793 |
| ISS分期(例,Ⅰ/Ⅱ/Ⅲ期) | 22/50/24 | 17/20/23 | 5.505 | 0.064 |
| R-ISS分期(例,Ⅰ/Ⅱ/Ⅲ期) | 15/64/17 | 12/39/9 | 0.586 | 0.746 |
| mSMART危险分层-高危[例(%)] | 62(65.0) | 34(57.0) | 1.188 | 0.276 |
| IMWG细胞遗传学-高危[例(%)] a | 31(32.0) | 15(25.0) | 0.944 | 0.331 |
| 髓外病变(例,是/否) | 24/72 | 18/42 | 0.469 | 0.493 |
| 诱导治疗方案[例(%)] | - | 0.302 | ||
| IMiDs+PIs | 53(55.0) | 36(60.0) | ||
| IMiDs | 7(7.0) | 1(2.0) | ||
| PIs | 36(38.0) | 23(38.0) | ||
| 初诊循环浆细胞(例,阴性/阳性)b | 73/23 | 45/15 | 0.022 | 0.883 |
| 移植前疗效[例(%)] | 3.923 | 0.678 | ||
| CR及以上 | 46(47.9) | 33(55.0) | ||
| VGPR | 36(37.5) | 20(33.3) | ||
| PR | 14(14.6) | 7(11.7) |
注:OB为寡克隆条带;DS分期为Durie-Salmon分期体系;ISS为国际分期体系;R-ISS为修订的国际分期体系;mSMART为Mayo骨髓瘤分层及风险调整治疗;IMWG为国际骨髓瘤工作组;IMiDs为免疫调节剂;PIs为蛋白酶体抑制剂;CR为完全缓解;VGPR为非常好的部分缓解;PR为部分缓解;aIMWG细胞遗传学-高危定义为:间期荧光原位杂交(FISH)检出del(17p)、t(4;14)、t(14;16);b初诊循环浆细胞比例<0.105%为阴性;“-”示采用Fisher精确概率法,无统计值
OB组患者接受ASCT治疗后获得CR及以上缓解程度比例为93.3%(56/60),高于非OB组患者的80.2%(77/96)(χ2=5.060,P=0.024)。OB组患者MRD阴性率为66.7%(40/60),高于非OB组患者的34.4%(33/96)(χ2=10.526,P=0.001,图1A)。在mSMART高危组患者中,OB组患者MRD阴性持续时间为未达到,较非OB组患者[25(95%CI:28~47)个月]延长(χ2=7.225,P=0.007,图1B);而在mSMART标危组患者中,OB组与非OB组患者MRD阴性持续时间均为未达到,差异无统计学意义(χ2=2.857,P=0.091,图1C)。在初诊合并髓外病变的患者中,OB组患者MRD阴性持续时间为未达到,较非OB组患者[18(95%CI:14~35)个月]延长(χ2=11.707,P=0.001,图1D);而在初诊无髓外病变患者中,OB组患者与非OB组患者MRD阴性持续时间分别为未达到、41(95%CI:32~51)个月,差异无统计学意义(χ2=3.477,P=0.062,图1E)。
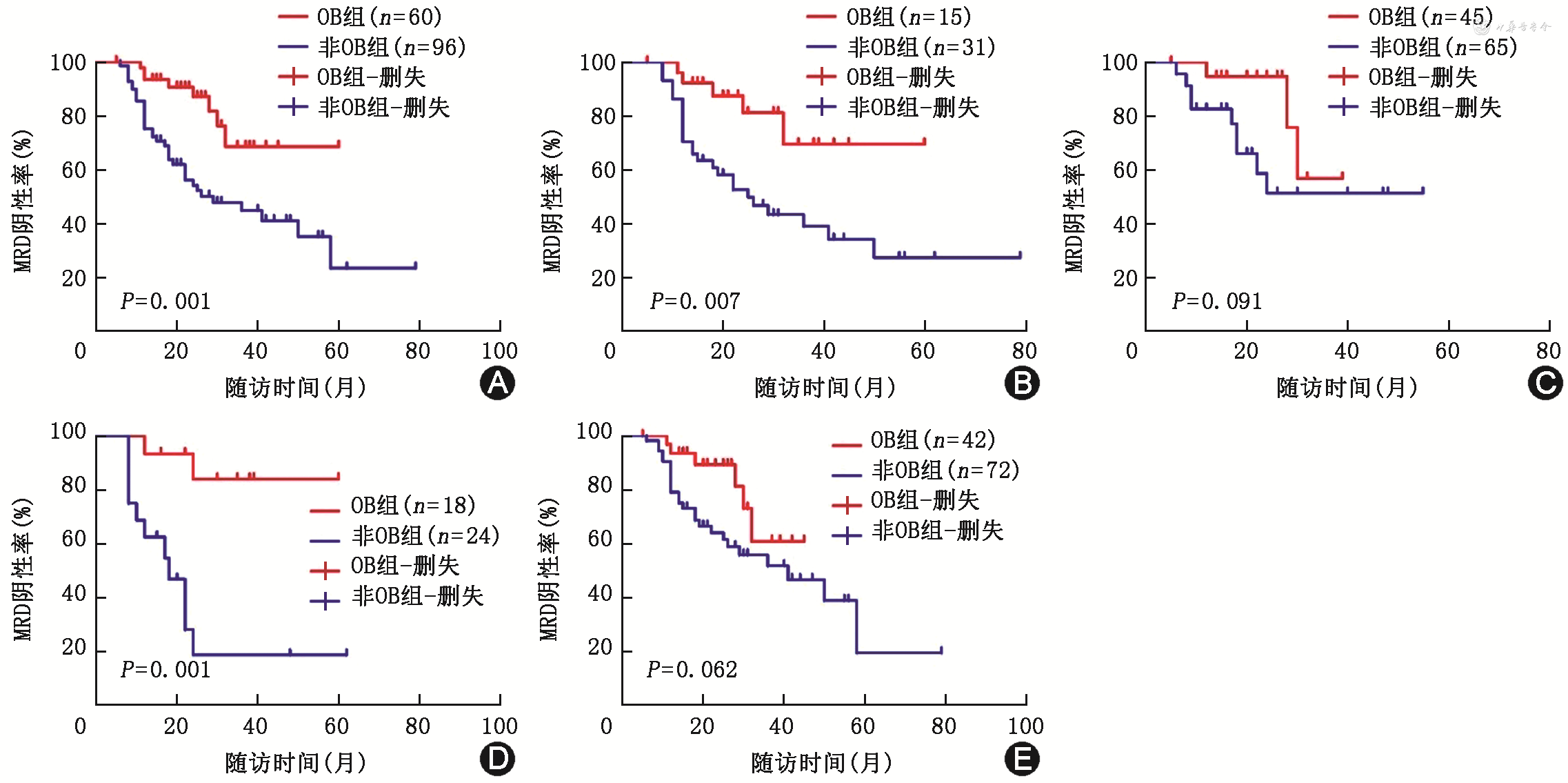

注:OB为寡克隆条带;MRD为微小残留病
OB组患者PFS为未达到,较非OB组患者[28(95%CI:31~44)个月]延长(χ2=14.720,P<0.001);OB组患者OS为未达到,较非OB组患者[86(95%CI:61~80)个月]延长(χ2=5.661,P=0.017)(图2)。在mSMART高危组患者中,OB组患者OS为未达到,较非OB组患者[71(95%CI:63~74)个月]延长(χ2=3.966,P=0.046,图3A),而在mSMART标危组患者中,OB组与非OB组患者OS均为未达到,差异无统计学意义(χ2=2.662,P=0.103,图3B)。在初诊合并髓外病变患者中,OB组OS为未达到,较非OB组患者[47(95%CI:35~61)个月]延长(χ2=4.348,P=0.037,图3C),而在初诊无髓外病变患者中,OB组与非OB组患者OS分别为未达到、86(95%CI:64~85)个月,差异无统计学意义(χ2=2.289,P=0.130,图3D)。在移植后MRD阴性患者中,OB组患者OS为未达到,较非OB组患者延长(86个月,χ2=4.535,P=0.033,图3E),而在移植后MRD阳性患者中,OB组与非OB组患者OS分别为34(95%CI:31~65)个月以及30(95%CI:33~60)个月,差异无统计学意义(χ2=1.029,P=0.310,图3F)。
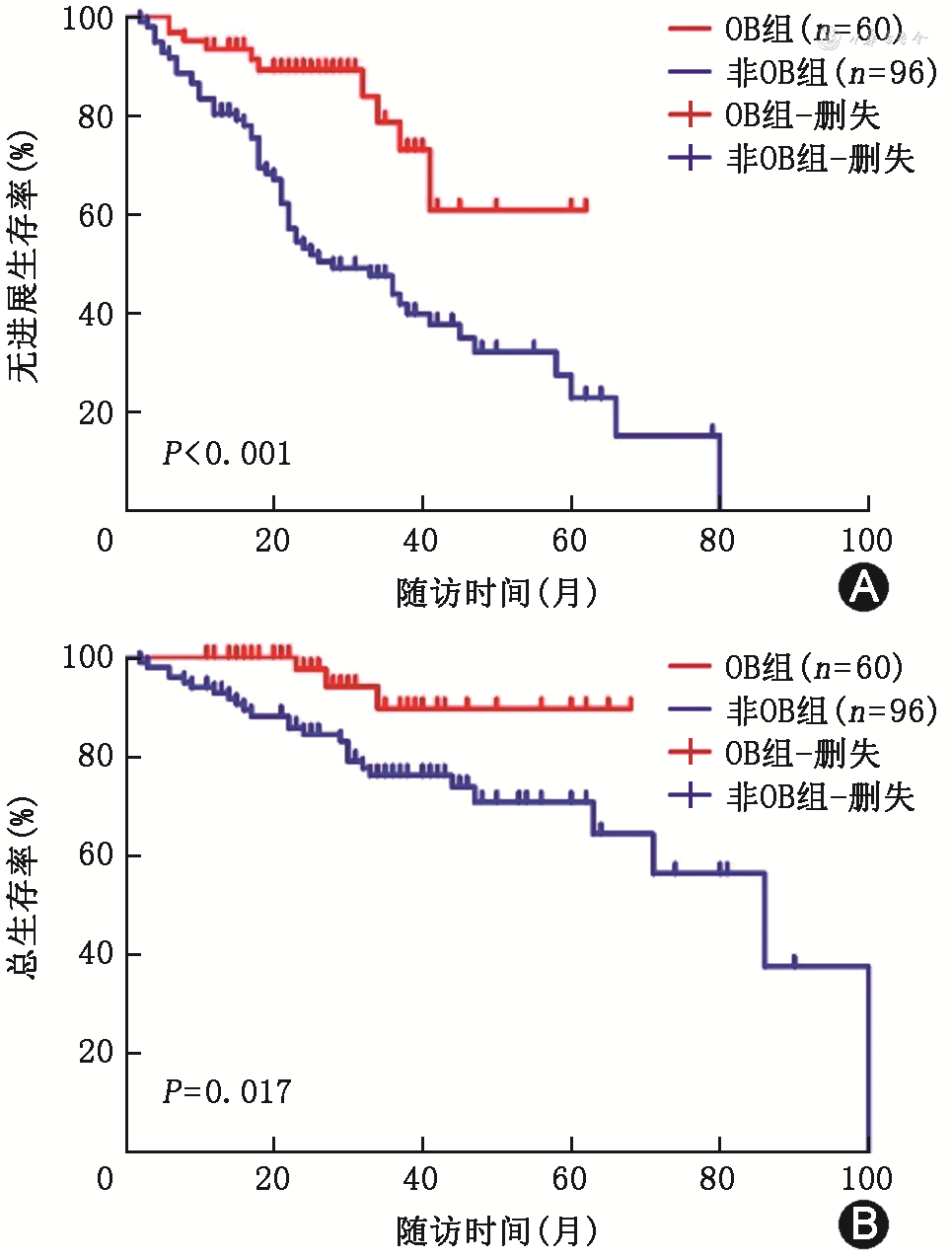

注:OB为寡克隆条带
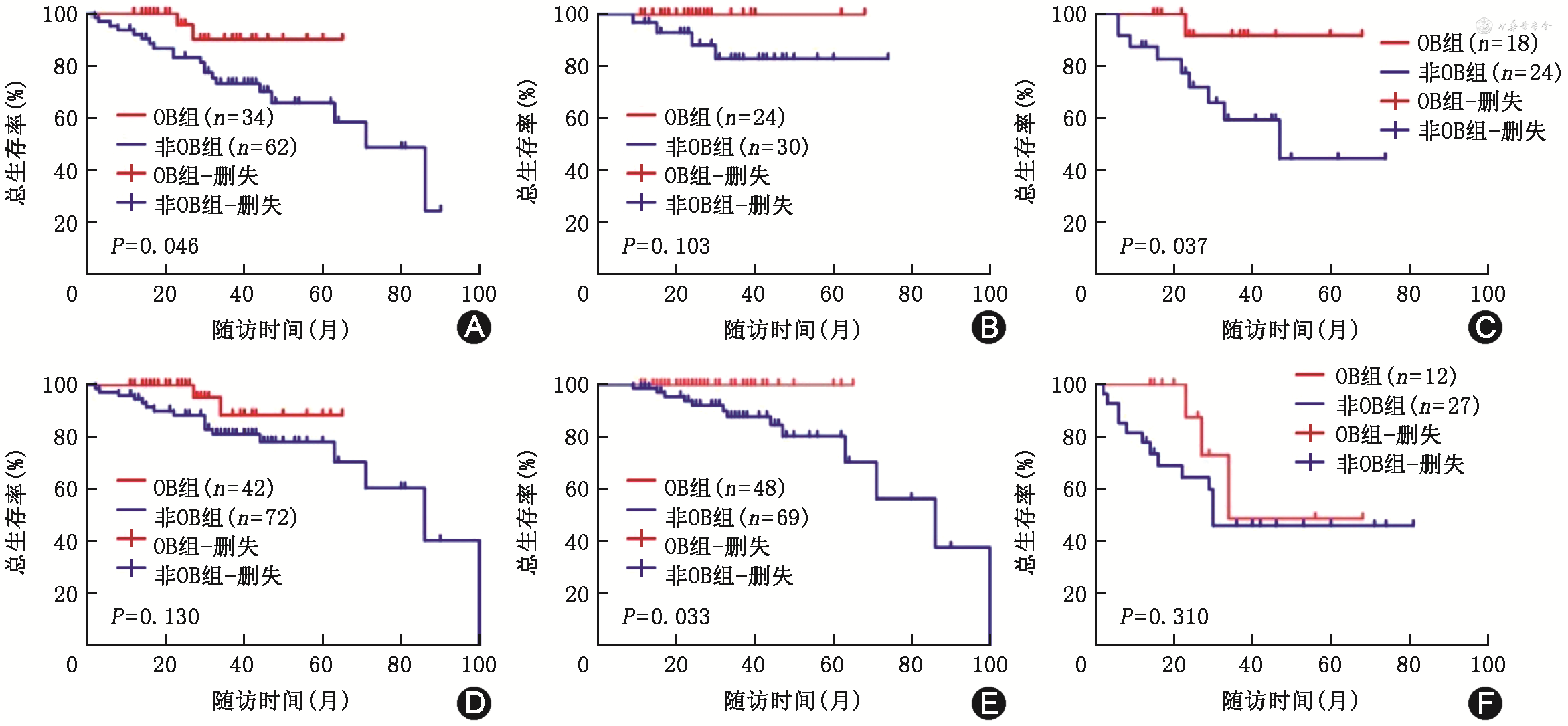

注:OB为寡克隆条带;MRD为微小残留病
将危险分层、移植后是否达sCR、移植后是否达MRD阴性以及是否有OB形成、移植后是否早期复发纳入多因素Cox回归模型分析,结果显示OB形成是患者PFS的保护因素(HR=0.314,95%CI:0.153~0.644,P=0.002),mSMART高危是患者PFS的危险因素(HR=2.402,95%CI:1.291~4.468,P=0.006),移植后达MRD阴性是患者PFS的保护因素(HR=0.300,95%CI:0.163~0.554,P<0.001)。移植后达MRD阴性是患者OS的保护因素(HR=0.230,95%CI:0.085~0.627,P=0.004),移植后早期复发是患者OS的危险因素(HR=49.810,95%CI:14.569~170.299,P<0.001)(表2、3)。
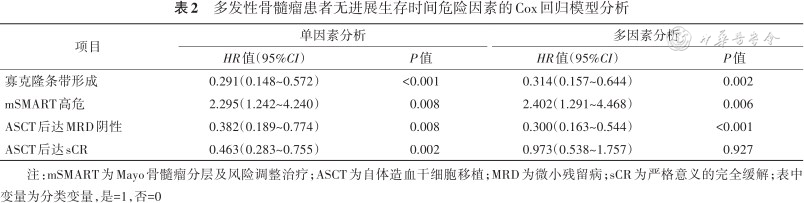
多发性骨髓瘤患者无进展生存时间危险因素的Cox回归模型分析
多发性骨髓瘤患者无进展生存时间危险因素的Cox回归模型分析
| 项目 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 寡克隆条带形成 | 0.291(0.148~0.572) | <0.001 | 0.314(0.157~0.644) | 0.002 |
| mSMART高危 | 2.295(1.242~4.240) | 0.008 | 2.402(1.291~4.468) | 0.006 |
| ASCT后达MRD阴性 | 0.382(0.189~0.774) | 0.008 | 0.300(0.163~0.544) | <0.001 |
| ASCT后达sCR | 0.463(0.283~0.755) | 0.002 | 0.973(0.538~1.757) | 0.927 |
注:mSMART为Mayo骨髓瘤分层及风险调整治疗;ASCT为自体造血干细胞移植;MRD为微小残留病;sCR为严格意义的完全缓解;表中变量为分类变量,是=1,否=0
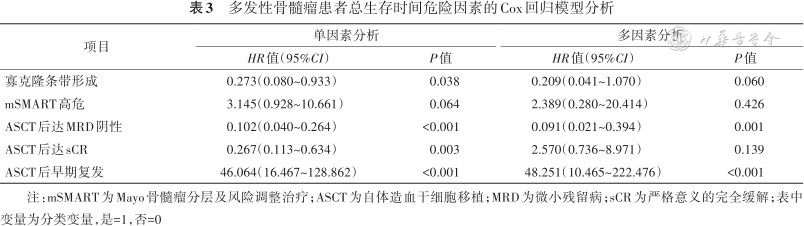
多发性骨髓瘤患者总生存时间危险因素的Cox回归模型分析
多发性骨髓瘤患者总生存时间危险因素的Cox回归模型分析
| 项目 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 寡克隆条带形成 | 0.273(0.080~0.933) | 0.038 | 0.209(0.041~1.070) | 0.060 |
| mSMART高危 | 3.145(0.928~10.661) | 0.064 | 2.389(0.280~20.414) | 0.426 |
| ASCT后达MRD阴性 | 0.102(0.040~0.264) | <0.001 | 0.091(0.021~0.394) | 0.001 |
| ASCT后达sCR | 0.267(0.113~0.634) | 0.003 | 2.570(0.736~8.971) | 0.139 |
| ASCT后早期复发 | 46.064(16.467~128.862) | <0.001 | 48.251(10.465~222.476) | <0.001 |
注:mSMART为Mayo骨髓瘤分层及风险调整治疗;ASCT为自体造血干细胞移植;MRD为微小残留病;sCR为严格意义的完全缓解;表中变量为分类变量,是=1,否=0
早在1989年,Paul等[8]首次报道了MM患者在接受大剂量化疗联合ASCT后出现OB的现象。后续研究认为OB的出现与患者自身免疫重建有关,是预后良好的标志[9, 10]。然而,迄今为止OB在MM患者中的发生机制尚未明确。有研究表明,ASCT后OB患者的重链可变区基因测序与原始克隆之间并无同型关系,这一结果表明OB为非恶性起源[3,11]。也有研究显示,ASCT后骨髓多克隆B细胞含量的增加与患者的良好预后相关,因此有学者猜想OB可能来源于多克隆B细胞,而OB的出现可能代表着一种更好的免疫重建的评估指标,或者代表由正常B细胞或T细胞所促进的独特免疫重建[11, 12, 13]。此外,ASCT后机体B细胞功能的恢复,以及OB具有一定靶向骨髓瘤抗原的特点,也是目前认为OB的免疫球蛋白具有一定抗骨髓瘤活性的可能机制[14]。
OB对于MM患者的预后预测价值目前尚存争议。有文献报道,OB患者的良好预后主要源自患者在出现OB时已有的较深的缓解程度,而OB本身对患者的OS和PFS并无影响[15]。另有研究表明,与OB相比,疗效达CR对患者的长期生存及预后影响更大[16]。国内也有数据表明,虽然在未进行ASCT的MM患者中OB可明显改善患者的长期生存,但对于ASCT后的患者而言,OB对预后并无影响[6]。与上述结论相反,也有数据表明OB对于骨髓瘤患者的预后具有预测价值[7,13,17]。本研究结果显示,在接受ASCT的MM患者中,OB患者的预后优于非OB患者。两组患者在包括年龄、分期、分型、危险分层、髓外病变等方面差异均无统计学意义。进一步分析显示OB患者具有更长的MRD阴性持续时间、移植后PFS及OS。虽然多个文献报道了ASCT后出现OB与预后的相关性,本研究结果也证实了在ASCT患者中OB对预后的影响,但目前尚无文献报道OB与高危因素和髓外病变的关系。本研究在进一步亚组分析时发现,与标危及无髓外病变的患者相比,在高危患者和初诊合并髓外病变的患者中,OB形成可延长其MRD阴性持续时间以及移植后的OS时间。
虽然当前诱导治疗序贯ASCT的规范治疗策略已经极大地改善了MM患者的预后,但仍有一些合并高危因素及髓外病变的患者在接受规范治疗后依然出现早期复发及进展。在MM治疗的长期管理策略中,疗效达MRD阴性及MRD阴性持续时间均是MM患者疗效评估及预后判断的重要指标,也是目前推进MM患者个体化治疗的重要参考因素[18, 19, 20, 21]。OB形成对于MRD的清除作用尚不明确,目前认为宿主免疫状态在MM患者的肿瘤控制和肿瘤免疫监视中发挥重要作用[4]。有数据显示OB的形成与低肿瘤残留及免疫丰富度增加密切相关,因此有学者认为ASCT后强大的免疫重建导致了OB形成,而免疫重建又增加了宿主对于肿瘤残留的监视和清除作用,有助于MM患者体内微小残留病灶的清除[11,22]。本研究结果显示OB组患者MRD阴性率及MRD阴性持续时间均较非OB组延长,尤其是对于初诊合并髓外病变的患者,OB形成改善了此类患者的预后,此现象的原因可能是机体免疫重建后增加了宿主对于肿瘤的监视作用,进而减少肿瘤细胞的免疫逃逸现象,可以更好地清除髓外病变以及MRD。
综上所述,本研究发现OB形成与MM患者的疗效及预后密切相关,尤其是对于初诊合并髓外病变或具有高危遗传学特征的患者,OB形成可延长患者的MRD阴性持续时间,改善患者预后。
史青林, 徐影, 王静, 等. 多发性骨髓瘤患者自体造血干细胞移植后寡克隆条带形成对疗效及预后的影响[J]. 中华医学杂志, 2024, 104(7): 514-520. DOI: 10.3760/cma.j.cn112137-20230927-00580.
所有作者声明不存在利益冲突



























