
探讨先天性食管闭锁(esophageal atresia,EA)的治疗及患儿术后生活质量。
收集2008年6月至2018年12月复旦大学附属儿科医院新生儿外科首次治疗的259例EA患儿的临床资料,其中男143例,女116例,统计合并畸形、放弃治疗、治愈率、EA分型、术后并发症等情况,并对术后中远期临床症状和生长发育情况进行随访。
共计259例食管闭锁患儿在复旦大学附属儿科医院首次治疗,213例接受了手术,术后放弃治疗死亡或自动出院失随访19例。194例食管闭锁治愈并出院,术后治愈率为91.1%(194/213)。其中A型11例,C型179例,D型1例,E型3例。179例C型食管闭锁,其中99例开放手术,80例胸腔镜手术,胸腔镜手术吻合口狭窄率显著高于开放手术(55.0%比39.4%,P<0.05),但胸腔镜手术并非吻合口狭窄的独立危险因素。现有数据分析未发现吻合口漏的危险因素;但吻合口漏是食管气管瘘复发的独立危险因素。中远期临床症状主要以慢食为主,占65.0%;其次为进食后反流或烧心症状,占33.6%,1.6%需手术干预;术后脊柱侧弯有5.6%,以特发性、保守治疗为主,合并脊柱发育异常需要手术。EA患儿整体生长发育情况较好,仅8.8%年龄别身高<-2,生长发育迟缓,而食管复杂手术史是生长发育迟缓的影响因素。
EA患儿整体预后良好,但术后中远期随访存在相关临床症状,仍需要长期随访观察。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性食管闭锁(esophageal atresia, EA)是严重的食管发育畸形,在先天性消化道畸形中较为常见,发病率约2.99∶10 000 [1]。目前文献报道EA患儿术后生存率已经超过90%,但EA术后近期并发症有吻合口漏、吻合口狭窄、食管气管瘘复发等,中远期并发症有胃食管反流、反复呼吸道症状、胸廓畸形等,这些可影响患儿术后生长发育和生活质量[2]。本研究收集2008年6月至2018年12月就诊于复旦大学附属儿科医院首次治疗食管闭锁患儿的临床资料,比较不同类型食管闭锁、开胸手术与胸腔镜手术的术后并发症情况,并随访术后中远期并发症的临床表现及生长发育情况,以提高临床认识及诊疗水平,改善患儿术后生活质量。
收集2008年6月至2018年12月期间复旦大学附属儿科医院收治的所有食管闭锁患儿的住院资料及门诊资料,其中男143例,女116例,收录统计相关信息如:出生体重、胎龄、性别、住院天数、疾病分型、手术方式、手术日龄、手术时长、合并畸形、肠内营养时间、呼吸机使用时间、食管扩张次数、术后并发症。
本研究经复旦大学附属儿科医院伦理委员会审核通过(2021277),所有参与本研究的患儿法定监护人均知情同意。
纳入标准:①食管造影明确食管闭锁诊断;②本院行首次手术且术中证实食管闭锁;③相关检查及记录资料完整。排除标准:①首次手术非本院完成;②住院检查及记录资料不完整。
2011年7月之前,本院EA患儿均行开放手术。技术要点:右胸后外侧切口经第4肋间进胸,奇静脉常规结扎缝扎后离断,用4-0 vicryl或5-0 PDS结扎和缝扎食管气管瘘的气管侧,并离断瘘管;行食管两端端端吻合,用5-0 vicryl可吸收线间断全层吻合,常规留置胃管,置入一根胸腔引流管。
2011年7月之后,本院逐步开展胸腔镜手术。技术要点:早期奇静脉缝扎后离断,后期术者根据吻合视野暴露情况有离断和不离断,食管气管瘘均为结扎缝扎后离断,行食管两端端端吻合,早期为可吸收线间断吻合或连续吻合,后改为后壁连续吻合前壁间断吻合,常规留置胃管,置入一根胸腔引流管。
术后24~48 h开始管饲喂奶,逐渐加量;术后6~8 d安排造影检查,如术后临床症状及胸腔引流液明确提示吻合口漏,则延期至临床症状消失或改善后造影评估;完成食管造影无吻合口漏开始经口喂养。术后1个月再次造影检查,一旦发现吻合口狭窄,强调早期扩张,最早在术后3~4周。出院后1年内每3个月复诊,之后根据恢复情况调整至每6~12个月复诊。
对2008年6月至2018年12月期间在本院首次手术并治愈出院的食管闭锁患儿进行门诊、电话及网络随访,询问与记录患儿术后情况。主要内容如下:①食管复杂手术史,包括食管延期吻合、结肠代食管、因难治性狭窄重新行食管端端吻合、胃底折叠术、食管气管瘘复发;②消化系统症状,包括反酸、烧心、慢食、大块固体食物进食困难;③呼吸系统症状,包括呼吸道感染、气管软化;④其他症状,胸廓畸形、胸廓不对称、脊柱侧弯等;⑤生长发育情况,按标准化方法测量身高及体征,体格指标Z值以中国九市2005年0~18岁儿童身高、体重标准作为参考值。根据世界卫生组织标准,计算年龄别体重Z值(weight for age Z-score,WAZ),WAZ<-2定义为低体重,WAZ<-3定义为重度低体重,WAZ>2定义为超重;计算年龄别身高Z值(height for age Z-score,HAZ),HAZ<-2定义为生长发育迟缓,HAZ<-3定义为重度生长发育迟缓。
临床数据统计分析使用Microsoft office 2016及SPSS 28.0软件。计数资料以例数和百分比表示,组间比较采用卡方检验。当1<T<5时采用连续性校正卡方检验,当T<1或n<40采用Fishers精确概率法;计量资料中服从正态分布者采用 ±s描述,采用独立样本t检验进行组间对比;非正态分布者采用M(Q1,Q3)描述,采用秩和检验进行组间对比。将单因素分析中P<0.1的变量纳入多因素logistic回归,计算优势比及其95%CI。以P<0.05为差异有统计学意义。
±s描述,采用独立样本t检验进行组间对比;非正态分布者采用M(Q1,Q3)描述,采用秩和检验进行组间对比。将单因素分析中P<0.1的变量纳入多因素logistic回归,计算优势比及其95%CI。以P<0.05为差异有统计学意义。
10年间共有259例食管闭锁患儿于本院首次治疗,46例术前放弃治疗(17.8%,46/259),其中3例在医院内死亡,43例自动出院;多发畸形30例(心脏畸形17例,直肠肛门畸形8例,肢体畸形6例,脊柱畸形4例,腭裂5例,耳廓畸形3例,尿道下裂1例),其他原因术前放弃治疗16例(染色体异常2例,早产儿7例,足月小样儿1例,合并先天性梅毒1例,社会性因素放弃治疗7例)。213例接受手术治疗(82.2%,213/259)。术后放弃治疗死亡11例(呼吸衰竭8例,肾功能衰竭2例,凝血功能障碍1例),自动出院8例,共计19例(8.9%,19/213)。
194例EA患儿治愈,手术治愈率91.1%(194/213)。男女比例104:90,早产儿占26.2%(51/194),低体重出生儿11.3%(22/194),合并畸形45.9%(89/194)。其中合并脊柱畸形5例,肛门畸形15例,心脏畸形50例,喉裂及喉软骨发育不良6例,肾发育异常8例,肢体畸形10例,环状胰腺2例,腭裂1例,耳廓畸形3例,尿道下裂3例。中位入院年龄1(0,2)d,中位手术年龄2(2,4)d,胸腔引流时间7(6,9)d,呼吸机使用时间剖胸组2(1,3)d,胸腔镜组3(2,4.75)d。
EA分型中C型为主(92.3%, 179/194),均行一期食管端端吻合术;11例A型EA行内牵引术及二期食管端端吻合术,其中9例剖胸完成,1例胸腔镜下完成,1例为胸腹联合手术、行胃代食管;1例D型EA行一期食管端端吻合术;3例E型EA,其中1例经颈行食管气管瘘结扎,2例经胸行食管气管瘘缝合术;无B型EA的记录。
194例EA患儿术后发生吻合口狭窄为45.9%(89/194),其中Gross A型占5例,Gross C型83例,Gross D型1例;吻合口漏发生率14.4%(28/194),均为Gross C型;最为严重的并发症食管气管瘘复发为3.1%(6/194),均为Gross C型。术后气胸的发生率4.1%(8/194),其中Gross A型2例,Gross C型6例;严重胸腔感染需要重新置管引流的发生率1.0%(2/194),均为Gross C型。。
179例C型EA患儿的术后吻合口狭窄、吻合口漏、食管气管瘘复发(recurrent tracheoesophageal fistula, rTEF)等危险因素分析结果显示,胸腔镜手术吻合口狭窄率显著高于开放手术(55.0%比39.4%,P<0.05),详见表1。将单因素分析中P<0.1的变量(早产、腔镜吻合、连续吻合)纳入多因素logistic回归模型,未发现EA术后吻合口狭窄的独立危险因素,详见表2。术后出现吻合口漏组和未出现吻合口漏组在手术方式、吻合方式、盲端距离、近远端食管比例、远端食管直径等因素上均无明显统计学差异(P>0.05),详见表3。术后出现食管气管瘘复发组和未复发组在手术方式、吻合方式、盲端距离、近远端食管比例、远端食管直径等因素上差异亦均无统计学意义(P>0.05),但食管气管瘘复发组合并吻合口漏发生率与未出现食管气管瘘组差异具有统计学意义(P<0.05),见表4;将单因素分析中P<0.1的变量(合并术后吻合口狭窄、吻合口漏)纳入多因素logistic回归模型,结果提示术后吻合口漏是食管气管瘘复发的独立危险因素,详见表5。
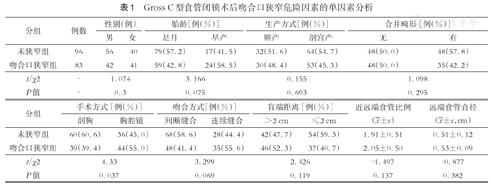
Gross C型食管闭锁术后吻合口狭窄危险因素的单因素分析
Gross C型食管闭锁术后吻合口狭窄危险因素的单因素分析
| 分组 | 例数 | 性别(例) | 胎龄[例(%)] | 生产方式[例(%)] | 合并畸形[例(%)] | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 足月 | 早产 | 顺产 | 剖宫产 | 无 | 有 | ||
| 未狭窄组 | 96 | 56 | 40 | 79(57.2) | 17(41.5) | 32(51.6) | 64(54.7) | 48(50.0) | 48(57.8) |
| 吻合口狭窄组 | 83 | 42 | 41 | 59(42.8) | 24(58.5) | 30(48.4) | 53(45.3) | 48(50.0) | 35(42.2) |
| t/χ2 | - | 1.074 | 3.166 | 0.155 | 1.098 | ||||
| P值 | - | 0.3 | 0.075 | 0.693 | 0.295 | ||||
| 分组 | 手术方式[例(%)] | 吻合方式[例(%)] | 盲端距离[例(%)] | 近远端食管比例( ±s) ±s) | 远端食管直径( ±s,cm) ±s,cm) | |||
|---|---|---|---|---|---|---|---|---|
| 剖胸 | 胸腔镜 | 间断缝合 | 连续缝合 | >2 cm | ≤2 cm | |||
| 未狭窄组 | 60(60.6) | 36(45.0) | 68(58.6) | 28(44.4) | 42(47.7) | 54(59.3) | 1.91±0.51 | 0.51±0.12 |
| 吻合口狭窄组 | 39(39.4) | 44(55.0) | 48(41.4) | 35(55.6) | 46(52.3) | 37(40.7) | 2.05±0.50 | 0.53±0.09 |
| t/χ2 | 4.33 | 3.299 | 2.426 | -1.497 | -0.877 | |||
| P值 | 0.037 | 0.069 | 0.119 | 0.137 | 0.382 | |||
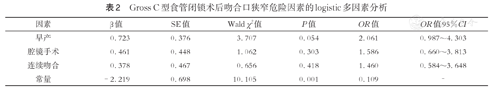
Gross C型食管闭锁术后吻合口狭窄危险因素的logistic多因素分析
Gross C型食管闭锁术后吻合口狭窄危险因素的logistic多因素分析
| 因素 | β值 | SE值 | Wald χ2值 | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|
| 早产 | 0.723 | 0.376 | 3.707 | 0.054 | 2.061 | 0.987~4.303 |
| 腔镜手术 | 0.461 | 0.448 | 1.062 | 0.303 | 1.586 | 0.660~3.813 |
| 连续吻合 | 0.378 | 0.467 | 0.656 | 0.418 | 1.460 | 0.584~3.648 |
| 常量 | -2.219 | 0.698 | 10.105 | 0.001 | 0.109 | - |
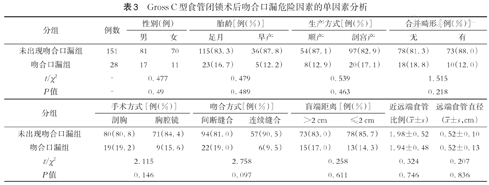
Gross C型食管闭锁术后吻合口漏危险因素的单因素分析
Gross C型食管闭锁术后吻合口漏危险因素的单因素分析
| 分组 | 例数 | 性别(例) | 胎龄[例(%)] | 生产方式[例(%)] | 合并畸形[例(%)] | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 足月 | 早产 | 顺产 | 剖宫产 | 无 | 有 | ||
| 未出现吻合口漏组 | 151 | 81 | 70 | 115(83.3) | 36(87.8) | 54(87.1) | 97(82.9) | 78(81.3) | 73(88.0) |
| 吻合口漏组 | 28 | 17 | 11 | 23(16.7) | 5(12.2) | 8(12.9) | 20(17.1) | 18(18.8) | 10(12.0) |
| t/χ2 | - | 0.477 | 0.479 | 0.539 | 1.515 | ||||
| P值 | - | 0.49 | 0.489 | 0.463 | 0.218 | ||||
| 分组 | 手术方式[例(%)] | 吻合方式[例(%)] | 盲端距离[例(%)] | 近远端食管比例( ±s) ±s) | 远端食管直径( ±s,cm) ±s,cm) | |||
|---|---|---|---|---|---|---|---|---|
| 剖胸 | 胸腔镜 | 间断缝合 | 连续缝合 | >2 cm | ≤2 cm | |||
| 未出现吻合口漏组 | 80(80.8) | 71(84.4) | 94(81.0) | 57(90.5) | 73(83.0) | 78(85.7) | 1.98±0.52 | 0.52±0.10 |
| 吻合口漏组 | 19(19.2) | 9(15.6) | 22(19.0) | 6(9.5) | 15(17.0) | 13(14.3) | 1.94±0.48 | 0.52±0.13 |
| t/χ2 | 2.115 | 2.758 | 0.258 | 0.324 | 0.207 | |||
| P值 | 0.146 | 0.097 | 0.611 | 0.746 | 0.836 | |||
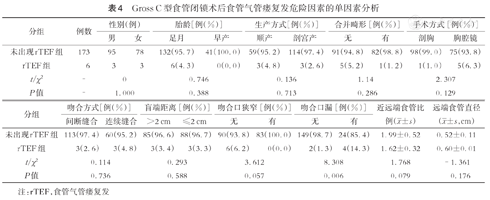
Gross C型食管闭锁术后食管气管瘘复发危险因素的单因素分析
Gross C型食管闭锁术后食管气管瘘复发危险因素的单因素分析
| 分组 | 例数 | 性别(例) | 胎龄[例(%)] | 生产方式[例(%)] | 合并畸形[例(%)] | 手术方式[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 足月 | 早产 | 顺产 | 剖宫产 | 无 | 有 | 剖胸 | 胸腔镜 | ||
| 未出现rTEF组 | 173 | 95 | 78 | 132(95.7) | 41(100.0) | 59(95.2) | 114(97.4) | 91(94.8) | 82(98.8) | 98(99.0) | 75(93.8) |
| rTEF组 | 6 | 3 | 3 | 6(4.3) | 0(0.0) | 3(4.8) | 3(2.6) | 5(5.2) | 1(1.2) | 1(1.0) | 5(6.3) |
| t/χ2 | - | 0 | 0.746 | 0.136 | 1.14 | 2.307 | |||||
| P值 | - | 1.000 | 0.388 | 0.713 | 0.286 | 0.129 | |||||
| 分组 | 吻合方式[例(%)] | 盲端距离[例(%)] | 吻合口狭窄[例(%)] | 吻合口漏[例(%)] | 近远端食管比例( ±s) ±s) | 远端食管直径( ±s,cm) ±s,cm) | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 间断缝合 | 连续缝合 | >2 cm | ≤2 cm | 无 | 有 | 无 | 有 | |||
| 未出现rTEF组 | 113(97.4) | 60(95.2) | 85(96.6) | 88(96.7) | 90(93.8) | 83(100.0) | 149(98.7) | 24(85.4) | 1.99±0.52 | 0.52±0.11 |
| rTEF组 | 3(2.6) | 3(4.8) | 3(3.4) | 3(3.3) | 6(6.2) | 0(0.0) | 2(1.3) | 4(14.3) | 1.62±0.32 | 0.60±0.01 |
| t/χ2 | 0.114 | 0.293 | 3.612 | 8.308 | 1.768 | -1.361 | ||||
| P值 | 0.736 | 0.588 | 0.057 | 0.006 | 0.079 | 0.176 | ||||
注:rTEF,食管气管瘘复发
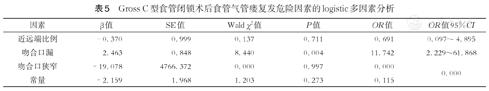
Gross C型食管闭锁术后食管气管瘘复发危险因素的logistic多因素分析
Gross C型食管闭锁术后食管气管瘘复发危险因素的logistic多因素分析
| 因素 | β值 | SE值 | Wald χ2值 | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|
| 近远端比例 | -0.370 | 0.999 | 0.137 | 0.711 | 0.691 | 0.097~4.895 |
| 吻合口漏 | 2.463 | 0.848 | 8.440 | 0.004 | 11.742 | 2.229~61.868 |
| 吻合口狭窄 | -19.078 | 4766.372 | 0.000 | 0.997 | 0.000 | 0.000 |
| 常量 | -2.159 | 1.968 | 1.203 | 0.273 | 0.115 |
194例EA患儿治愈出院,手术后存活,但在随访中死亡3例(术后半年因先天性心脏病手术感染死亡1例,术后13个月因呼吸衰竭合并染色体异常死亡1例,术后5年因罹患腹膜后肿瘤死亡1例),66例因随访中更换电话或福利院资料不全等因素失访,125人术后随访至今(65.4%,125/191),中位随访年龄为6(3,8)岁。
消化道症状:81例(65%,81/125)患儿平素有轻度吞咽困难症状,表现为慢食(吃饭速度落后于同龄儿,需细嚼慢咽,每餐进食时间需超过30 min)。2例患儿因术后难治性食管狭窄(食管扩张≥20次),重新行食管端端吻合术。其中1例患儿4岁时食管再吻合,目前12岁,仍有轻度吞咽困难症状;另1例患儿5岁时行食管再吻合,目前术后半年,仍有吻合口狭窄,定期食管扩张中。42例(33.6%,42/125)患儿平素有进食后反流或烧心症状,但大多症状较轻,可通过垫高枕控制症状,2例患儿反流症状较重,食管造影提示胃食管反流,于本院行经腹胃底折叠术,目前反流症状明显改善。
呼吸道症状:48例(38.4%,48/125)患儿平素有咳嗽、休息或活动时气喘、胸闷等呼吸道症状。8例(6.4%,8/125)患儿出现术后1~3年内反复感染肺炎(定义为每年感染3次及以上,有胸片肺部渗出依据,医疗机构诊断为肺炎;其中1例患儿已完善气管镜检查排除气管软化等疾病。
其他症状:7例(5.6%,7/125)患儿出现脊柱侧弯畸形,其中1例为先天性半椎体患儿,6例为特发性脊柱畸形。4例(4/125,3.2%)患儿出现胸廓不对称畸形。6例特发性脊柱畸形和4例胸廓不对称畸形均为开胸手术后患儿,可能与食管或合并心脏畸形开胸手术有关。
102例EA患儿完成身高体重测量,22例(21.56%)患儿体重偏低(WAZ位于-2~-1),6例(5.94%)患儿为低体重(WAZ<-2),其中2例(1.96%)为重度低体重(WAZ<-3);这6例低体重患儿均有慢食、轻度吞咽困难等消化道症状,其中2例为Gross A型EA,3例为Gross C型,1例为Gross E型。
15例(14.71%)患儿身高偏低(HAZ位于-2~-1),9例(8.82%)患儿生长发育迟缓(HAZ<-2),其中4例(3.92%)患儿重度生长发育迟缓(HAZ<-3),见表6。其中1例为Gross C型EA合并重症反流行胃底折叠术术后;1例为上述提到因难治性食管狭窄4岁时行食管再吻合的患儿、术后多次食管扩张至6岁;1例合并先天性半椎体畸形;1例于1岁时发现脑积水、颅内感染,行脑室外引流术,该患儿目前7岁,合并语言发育迟缓、轻中度自闭症,儿保科定期随访中。

2~12岁先天性食管闭锁患儿生长发育情况
2~12岁先天性食管闭锁患儿生长发育情况
| 参数 | <-3SD | -3~-2SD | -2~-1SD | -1~1SD | 1~2SD | 2~3SD | >3SD |
|---|---|---|---|---|---|---|---|
| WAZ[例(%)] | 2(1.96%) | 4(3.92%) | 22(21.56%) | 59(57.84%) | 8(7.84%) | 5(4.90%) | 2(1.96%) |
| HAZ[例(%)] | 4(3.92%) | 5(4.90%) | 15(14.71%) | 58(56.86%) | 8(7.84%) | 6(5.88%) | 6(5.88%) |
注:SD,标准差;WAZ,年龄别体重Z值;HAZ,年龄别身高Z值
对9例生长发育迟缓(HAZ<-2)患儿进行影响因素分析,结果显示,复杂食管手术史是生长发育迟缓的影响因素,见表7。
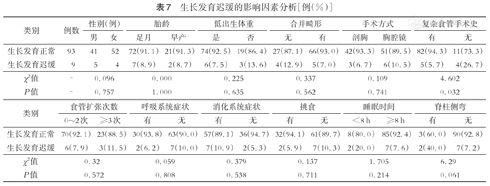
生长发育迟缓的影响因素分析[例(%)]
生长发育迟缓的影响因素分析[例(%)]
| 类别 | 例数 | 性别(例) | 胎龄 | 低出生体重 | 合并畸形 | 手术方式 | 复杂食管手术史 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 足月 | 早产 | 是 | 否 | 无 | 有 | 剖胸 | 胸腔镜 | 有 | 无 | ||
| 生长发育正常 | 93 | 41 | 52 | 72(91.1) | 21(91.3) | 74(92.5) | 19(86.4) | 27(87.1) | 66(93.0) | 42(93.3) | 51(89.5) | 82(94.3) | 11(73.3) |
| 生长发育迟缓 | 9 | 5 | 4 | 7(8.9) | 2(8.7) | 6(7.5) | 3(13.6) | 4(12.9) | 5(7.0) | 3(6.7) | 6(10.5) | 5(5.7) | 4(26.7) |
| χ2值 | - | 0.096 | 0.000 | 0.225 | 0.337 | 0.109 | 4.602 | ||||||
| P值 | - | 0.757 | 1.000 | 0.635 | 0.562 | 0.741 | 0.032 | ||||||
| 类别 | 食管扩张次数 | 呼吸系统症状 | 消化系统症状 | 挑食 | 睡眠时间 | 脊柱侧弯 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0~2次 | ≥3次 | 有 | 无 | 有 | 无 | 有 | 无 | <8 h | ≥8 h | 有 | 无 | |
| 生长发育正常 | 70(92.1) | 23(88.5) | 30(93.8) | 63(90.0) | 57(89.1) | 36(94.7) | 32(94.1) | 61(89.7) | 8(80.0) | 85(92.4) | 3(60.0) | 90(92.8) |
| 生长发育迟缓 | 6(7.9) | 3(11.5) | 2(6.2) | 7(10.0) | 7(10.9) | 2(5.3) | 2(5.9) | 7(10.3) | 2(20.0) | 7(7.6) | 2(40.0) | 7(7.2) |
| χ2值 | 0.32 | 0.059 | 0.379 | 0.137 | 1.705 | 6.29 | ||||||
| P值 | 0.572 | 0.808 | 0.538 | 0.711 | 0.214 | 0.061 | ||||||
先天性食管闭锁和(或)食管气管瘘是新生儿期重症消化道发育畸形之一,可危及患儿生命,手术治疗是唯一的根治方式。食管闭锁根治手术分为食管一期吻合、食管延期吻合,长段型食管闭锁可行食管外牵引、延期吻合或结肠代食管术,手术方法分为传统的开胸手术和胸腔镜手术[3]。我院总体食管闭锁术后治愈率达90%(194/213),与多数文献报道基本相同,但Gross A型及E型EA的治愈率较高,达到100%,可能与病例数不多有关。
EA术后存在吻合口漏、吻合口狭窄、食管气管瘘复发等食管并发症。食管闭锁术后吻合口漏发生率为5%~20%,早期可通过禁食和抗生素治疗自行恢复,严重的可能需要较长时间的胸腔闭式引流和手术修补,伴有严重感染的吻合口漏则需要行颈部食管造瘘和胃造瘘术[4]。我院吻合口漏的比例为14.4%,经保持引流通畅、积极抗感染治疗均保守成功。吻合口狭窄是指经食管吞钡检查或内镜检查发现的食管吻合口水平的狭窄,并伴有明显功能损害和症状,在EA并发症中发生率最高,可达30%~60%[5]。EA术后吻合口狭窄发病率45.9%,与文献报道基本相符,主要采用内镜下食管扩张术(包括球囊和探条扩张)作为治疗吻合口狭窄的首选方法。早期诊断狭窄、早期行扩张手术至关重要,如果EA术后较长时间已形成致密的纤维瘢痕,则会造成难治性狭窄,降低食管扩张的成功率[6]。目前我们对EA患儿常规术后4周即复查食管造影,一经发现吻合口狭窄即尽早扩张,首次扩张多采用球囊扩张,之后需要再扩张的病例多选择探条扩张。
文献报道食管气管瘘复发的概率为5%~10%[7,8],高于本院的3.1%,可能与本团队强调可吸收线结扎(5-0 vicryl或5-0 PDS线)、缝扎瘘管,并做离断有关。采用吸收线结扎缝扎瘘管,可以减少局部反应;离断瘘管可能减少瘘管复发。食管气管瘘复发诊断明确即有再手术指征,再手术的最短间隔时间为3个月,对于手术3个月以内复发的瘘管,可先采用胃镜下夹闭瘘管,观察疗效。
本研究对Gross C型EA的术后并发症进行回归分析。虽然胸腔镜手术吻合口狭窄率显著高于开放手术(P<0.05),但纳入多因素logistic回归分析校正混杂因素后证实胸腔镜手术不是吻合口狭窄的独立危险因素。腔镜下吻合口狭窄高于开放,可能与腔镜下手术早期多行连续吻合有关,后续已改进为后壁连续缝合、前壁间断缝合。现有数据分析未发现吻合口漏的影响因素;但术后吻合口漏是食管气管瘘复发的独立危险因素。
EA术后存在食管动力障碍、胃食管反流、呼吸道感染、气管软化等中远期并发症。食管动力障碍存在于所有EA患儿中,导致食团运输和清除减慢,加重胃食管反流;也可导致较高的吸入风险和肺部并发症[9]。21%~84%的EA患儿在手术修复后长期出现不同程度的吞咽困难,在除外食管狭窄等机械性因素后应考虑食管动力异常[10]。随访数据显示,虽有65%家属表述患儿平素有轻度吞咽困难症状,表现为吃饭速度落后于同龄儿,需细嚼慢咽,每餐进食时间超过30 min,但大多数患儿进食的食物种类和数量不受影响。
胃食管反流病(gastroesophageal reflux disease, GERD)亦是EA术后常见的并发症之一,文献报道发生率22%~63%[11]。本团队随访资料显示33.6%(42/125)EA患儿诉有轻度临床反流症状,但临床检查多以上消化道造影评估为主,仅部分行24 h的pH监测,提示对EA患儿术后评估胃食管反流的检查尚不全面。一方面pH监测需要预约,且相比于造影检查更复杂,家属配合度下降,医生也可能强调不够,导致目前临床应用较少。加强EA患儿术后GERD评估与干预,是提高EA患儿术后生存质量的重要举措之一。GERD可导致食管壁损伤、运动障碍进一步恶化,引起反流性食管炎、胃肠化生和Barrett食管,甚至食管腺癌的发生[12,13]。一项前瞻性研究显示,23%的EA术后患儿有组织学证实的食管炎,17%的患儿有胃化生,7%的患儿有Barrett食管,是普通人群患病率的4倍[14]。这提示存在GERD的EA患儿早期行pH监测及内镜检查随访非常必要,对提高远期预后具有重要意义。
食管闭锁术后呼吸系统并发症较为常见,其病因可能与肺芽异常发育导致的气管软化有关[15]。气管软化可导致黏液纤毛清除功能受损,增加呼吸系统感染风险。此外,手术中的神经损伤、食管气管瘘复发、GERD和食管动力障碍也被认为破坏了气管屏障、增加误吸风险[16]。文献显示,EA术后支气管炎的发病率高达74%,气管高反应性达65%,呼吸系统感染发生率达53%[17,18]。本院随访资料显示38.4%(48/125)患儿平素有咳嗽、休息或活动时气喘、胸闷等呼吸道症状,6.4%(8/125)患儿出现术后1~3年内每年感染肺炎3次及以上,有胸片肺部渗出依据。本研究肺部感染发生率低,其原因可能与食管气管瘘复发率低有关。另一方面,早期EA患儿术后喉镜检查、后期改进术前支气管镜检查,若提示喉软化或气管软化,予以鼻饲喂养一段时间可减少肺部感染。此外,吻合口狭窄早期即行食管扩张,故吸入性肺炎发生率低。因此,EA术后反复肺炎患儿应完善气管镜检查排除气管软化等疾病。
本研究中亦关注到了EA术后的胸廓脊柱畸形情况。6例(9~12岁)EA患儿出现特发性脊柱畸形,4例患儿(10~12岁)出现胸廓不对称畸形,均为开胸手术后患儿。分析原因,一方面EA或EA合并心脏畸形的开胸手术与脊柱畸形有关;另一方面,本院自2013年后开展胸腔镜手术数量逐渐增多,大多数胸腔镜术后EA患儿随访年龄未达8岁,可能暂未关注到胸廓脊柱畸形这一情况。
EA术后的生长发育情况亦是随访的重点。EA患儿普遍存在喂养困难及营养不良,在婴儿期多见,与大多数手术和长期住院治疗发生在出生后的第一年有关,并可随着年龄的增长而发生追赶[19,20]。然而一项最新研究显示,71%的EA术后青少年每日能量摄入量低于该年龄推荐标准,超过2/3的患儿报告了吞咽困难的症状,且避免食用特定食物,15%的患儿存在发育迟缓(HAZ评分<-2)[21]。Menzies等[22]对75名0~16岁EA患儿进行了回顾性分析,认为年龄<1岁的婴儿、有胃底折叠病史的患儿和生后第一年接受多次手术的儿童与营养不良有关。胃底折叠病史意味着更严重的GERD,误吸和反复肺炎的风险增加,并可能加重食管动力障碍[23]。尽管食管动力障碍、呼吸系统和消化系统并发症可能是生长发育落后的原因,但暂无统计学数据。消化道及呼吸道症状对生长发育有负面影响。本团队随访了EA患儿的远期生长发育情况,结果显示,整体生长发育情况良好,食管复杂手术史是生长发育迟缓的影响因素。
总之,虽然绝大多数EA患儿术后中远期相关临床症状不需要再手术干预,但仍需要长期随访观察。成立一个EA多学科诊疗小组,对EA儿童制定长期随访和干预策略,有利于提高远期预后。
所有作者均声明不存在利益冲突



























