
《血液透析滤过质量控制临床实践指南》由血液净化专家组成的编写委员会共同编写,基于目前循证医学证据,同时借鉴和参考了目前国内外相关临床实践指南与专家建议以及《血液净化标准操作规程(2021版)》,重点针对血液透析滤过的适应证、治疗模式选择、置换液的选择与成分调整、血管通路、抗凝治疗、处方设置以及相关并发症防治等临床及其医疗质量控制问题,提出推荐意见和相关医疗质控指标。目的在于指导我国血液透析滤过的临床实践和临床研究,提高血液透析滤过医疗质量的标准化、规范化和同质化。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血液透析滤过(hemodiafiltration,HDF)是终末期肾病的主要治疗模式,中国血液净化病例信息登记系统数据显示,截至2021年底我国正在接受血液透析治疗的患者为75.1万;其中34.9万具有HDF登记数据的患者中,62.5%的患者接受HDF治疗。
一篇针对35项随机对照试验4 039例维持性血液透析患者的荟萃分析结果显示,与血液透析比较,HDF可显著降低心血管病死亡率、透析期间低血压发生率和透析前β2-微球蛋白水平,提高透析充分性[1]。此外,在线HDF(on-line HDF)方式被认为是最先进和最适合的临床肾脏替代治疗模式[2]。
我国HDF的标准化和规范化亟待提高。4项随机对照研究结果显示,每周3次的后稀释on-line HDF治疗时,每次置换液剂量17~23 L才能降低全因死亡和心血管病死亡风险[3, 4, 5, 6]。2 293例接受后稀释的on-line HDF治疗,随访至少2年的维持性透析患者队列研究中,每周置换液剂量>56.8 L(32.7 L/m2)才能显著增加患者生存率[7]。国内单中心139例维持性透析患者的回顾性队列研究结果显示,与高通量血液透析比较,高通量血液透析联合每周1次HDF可显著提高尿毒症患者短期生活质量,改善营养状况,降低住院时间及住院人次,减少促红细胞生成素及静脉铁剂用量,降低病死率[8]。但是,2021年底中国血液净化病例信息登记系统中的HDF登记数据显示,HDF治疗频率每周1次仅为19.4%,每2周1次为35.2%,每4周1次为37.2%。因此,为更好地指导我国HDF临床实践和临床研究,提高HDF医疗质量的标准化、规范化和同质化,中国医师协会肾脏内科医师分会组织我国血液净化领域专家共同制订《血液透析滤过治疗质量控制临床实践指南》(以下简称“本指南”)。
本指南制订方法遵循《世界卫生组织指南制订手册》(第二版)[9]及《制订/修订临床诊疗指南的基本方法及程序》[10],并依据国际实践指南报告标准[11]和指南研究与评价工具[12]撰写。中国医师协会肾脏内科医师分会组织血液净化、肾脏病和医疗质量控制专家建立指南撰写专家工作组,重点针对HDF的适应证、治疗模式选择、置换液的选择与成分调整、血管通路、抗凝治疗、处方设置以及相关并发症防治等HDF的临床及其医疗质量控制问题,检索Medline、Embase、Web of Science、Cochrane Library、Epistemonikos、中国生物医学文献、万方和中国知网等数据库,形成指南循证医学证据。采用2009版牛津大学循证医学中心的证据水平和推荐级别(表1)[13]。

2009版牛津大学循证医学中心的证据水平与推荐级别
2009版牛津大学循证医学中心的证据水平与推荐级别
| 推荐级别 | 证据水平 | 证据说明 |
|---|---|---|
| A | 1a | 同质性良好的RCT的系统综述 |
| 1b | 单个RCT(可信区间窄) | |
| 1c | “全或无”的系列病例报告 | |
| B | 2a | 同质性良好的队列研究的系统综述 |
| 2b | 单个队列研究或低质量RCT(如随访率<80%) | |
| 2c | 结局研究 | |
| 3a | 同质性良好的病例-对照研究的系统评价 | |
| 3b | 单个病例-对照研究 | |
| C | 4 | 系列病例研究(包括低质量队列或病例-对照研究) |
| D | 5 | 基于经验的专家意见或病理生理基础上的意见 |
注:RCT为随机对照临床试验;A级为证据极有效,推荐;B级为证据有效,可推荐,也可能因将来更高质量的新证据出现而改变;C级为证据在一定条件下有效,应谨慎应用研究结果;D级为证据的有效性局限,只在较窄的范围内有效
本指南的推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过2/3的专家意见。经过6次专家讨论会进行修改,共同编制了《血液透析滤过治疗质量控制临床实践指南》,并广泛征求了血液净化、肾脏病等专业医护人员的意见,完成定稿。本指南推荐意见的目标人群是我国接受血液透析的尿毒症患者,供血液净化专业人员使用。本指南不具备强制性,不作为医疗事故鉴定和医学责任认定依据;指南发布后将根据实际临床应用情况,计划3~5年更新。
HDF是一种将血液透析和血液滤过(hemofiltration,HF)相结合,采用高通量透析膜,通过弥散和对流2种机制清除溶质的血液净化技术。因而HDF具有2种治疗模式的优点,能更高效地清除血液中蓄积的小分子和中大分子物质/毒素。HDF治疗过程中超滤清除的液体量大大超过设定的体重减少量(净超滤量),因而需要输注无菌、无致热原的置换液来维持患者的容量平衡。
鉴于临床上绝大多数维持性血液透析患者接受on-line HDF治疗,本指南重点针对on-line HDF的医疗质量控制进行规范。
推荐意见1:推荐HDF用于终末期肾病患者的维持性透析治疗。(A1a)
越来越多的证据显示与血液透析比较,高容量HDF能有效改善患者长期生存,减少心血管事件发生,并且具有良好的安全性。透析结果和实践模式研究(Dialysis Outcomes and Practice Patterns Study,DOPPS)结果显示,与低通量血液透析比较,高容量HDF(置换液15~25 L/次)减少患者全因死亡率35%[14]。最具代表性的欧洲4项前瞻性、随机对照研究中,虽然714例维持性血液透析患者的比较on-line HDF与低通量血液透析的全因死亡和心血管预后(CONTRAST)研究和782例维持性血液透析患者的比较on-line HDF与高通量血液透析的全因死亡和心血管事件(TURKISH)研究的初始分析均未发现HDF治疗较血液透析减少患者的死亡风险,但亚组分析显示,当置换液量≥22 L/次时,2项研究均显示显著的患者生存获益[3, 4]。906例维持性血液透析患者的比较on-line HDF与高通量血液透析的全因死亡(ESHOL)研究中,HDF治疗患者的平均对流量达到22.9~23.9 L/次,其全因死亡率和心血管病死亡率均较高通量血液透析患者下降30%;并且HDF组的低血压事件、脑卒中及感染的发生率分别下降了28%、61%和55%[5]。FRENCHIE研究是在65岁以上终末期肾病患者中进行的,重点关注了HDF的安全性,结果发现HDF较高通量血液透析患者发生透析低血压、肌肉痉挛的比例明显减少[6]。基于以上4项随机对照研究2 793例患者个体数据的汇总分析中,在平均2.5年的随访中出现769例死亡(其中292例死于心血管事件);结果分析发现置换液量>23 L/1.73 m2体表面积时,HDF组较血液透析组的全因死亡和心血管病死亡风险分别下降22%和31%[15]。
推荐意见2:推荐合并以下并发症的维持性血液透析患者优先选择HDF治疗,包括:(1)反复透析低血压(A1b);(2)合并心脏疾病(A1a);(3)高β2-微球蛋白血症及透析相关淀粉样变性(A1a);(4)炎症/微炎症状态(B2b);(5)促红细胞生成素治疗反应不佳的肾性贫血(B2b);(6)营养不良/蛋白能量消耗(B2b);(7)不宁腿综合征(C4)。
一篇针对35项随机对照试验4 039例维持性血液透析患者的荟萃分析结果显示,与血液透析比较,HDF或HF显著降低透析期间低血压的发生率(RR=0.72,95%CI:0.66~0.80)和心血管病死亡率(RR=0.75,95%CI:0.58~0.97,I2=0)以及透析前β2-微球蛋白水平[平均差值(MD)=-5.77 mg/dl,95%CI:-10.97~-0.56,I2=94%],并提高透析充分性[尿素清除指数(Kt/V)的MD=0.10,95%CI:0.02~0.19,I2=85%];但全因死亡率、非致命性心血管事件和住院治疗率无明显差别[1]。另一篇基于65项随机对照试验(29项交叉试验和36项平行臂试验)12 182例维持性血液透析患者的荟萃分析结果显示,与低通量血液透析比较,HDF/HF显著降低透析相关低血压(RR=0.55,95%CI:0.35~0.87,I2=99%)和心血管病死亡率(RR=0.84,95%CI:0.71~0.98,I2=0),全因死亡率和全因住院率无明显差别;显著增加β2-微球蛋白清除率(MD=64.8 ml/min,95%CI:46.8~82.8)和降低血清β2-微球蛋白水平(MD=-9.94 mg/dl,95%Cl:-12.42~-7.46)[16]。
基于4项比较血液透析和后稀释on-line HDF随机对照试验患者个体数据的具体死亡病因分析结果显示,平均随访2.5年期间on-line HDF(平均置换液量22 L/次)较血液透析显著减少全因死亡(HR=0.86,95%CI:0.75~0.99)、心脏疾病死亡(HR=0.64,95%CI:0.45~0.90)和包括猝死的心血管疾病死亡(HR=0.81,95%CI:0.65~1.00);其中减少的全因死亡71%的病例来源于减少心血管疾病死亡病例,减少的心血管疾病死亡73%的病例来源于减少心脏疾病死亡病例;on-line HDF较血液透析显著减少全部心脏事件(HR=0.64,95%CI:0.45~0.90)以及心肌梗死或心律失常(HR=0.58,95%CI:0.36~0.91)的发生[17]。10例失代偿性充血性心力衰竭[纽约心脏病协会(NYHA)Ⅲ~Ⅳ级]患者前瞻性对照研究结果显示,HDF与呋塞米治疗均可显著减少体重和血清脑钠肽水平;但HDF治疗后血清白细胞介素(IL)-8[(30.7±25.1)比(45.6±48.3)pg/ml,P<0.05]和单核细胞趋化蛋白-1[(2.3±0.3)比(10.9±4.5)pg/ml,P<0.05]水平显著降低,呋塞米剂量显著减少[(75±38)比(180±80)mg/d,P<0.05],而静脉注射呋塞米后均无明显变化;提示HDF可有效降低晚期充血性心力衰竭患者的循环脑钠肽水平和细胞因子水平,恢复呋塞米治疗反应性[18]。
45例每周3次血液透析≥2个月患者的前瞻性随机对照试验显示,后稀释on-line HDF[超滤量(21±1)L/次]较高通量血液透析能更有效清除β2-微球蛋白(治疗前后变化率73%比58%),透析前β2-微球蛋白浓度在随访1年中逐渐下降,且在HDF治疗组中下降更为明显[19]。69项临床研究1 879例患者的6 771个测量数据的随机效应荟萃分析和荟萃回归分析结果显示,HDF/HF的平均β2-微球蛋白清除率显著高于高通量血液透析(87.06比48.75 ml/min),透析膜成分与特性、净化方式(弥散或对流)、血流量和置换液量等是影响β2-微球蛋白清除的关键因素[20]。6 444例维持性血液透析患者的前瞻性观察研究结果显示,与血液透析患者比较,校正年龄和糖尿病后HDF/HF患者需要腕管综合征手术风险降低42%,调整年龄、性别和合并症后HDF/HF患者的死亡风险降低10%[21]。1 196例日本透析治疗协会登记患者分析结果显示,透析相关淀粉样变性治疗效果较差的风险以低通量血液透析为1.0时,高通量血液透析的风险为0.489,非联机HDF风险为0.117,on-line HDF的风险为0.013,推拉式HDF风险为0.017,联合应用β2-微球蛋白吸附柱的血液透析风险为0.054[22]。
血液透析患者常由于尿毒症毒素、透析膜生物不相容性等多种因素处于炎症/微炎症状态,直接影响患者预后。多项临床研究证实on-line HDF较血液透析显著降低C反应蛋白、IL-6等炎症标志物水平[23]。16例接受高通量血液透析治疗患者的前瞻性交叉对照研究证实,HDF较高通量血液透析可显著降低炎症指数,改善患者的微炎症状态和内皮损伤[24]。CONTRAST研究405例患者随访3年的高敏C反应蛋白和IL-6测定结果显示,与血液透析比较,长期使用超纯透析液的HDF可减少炎症活动[25]。103例儿童维持性血液透析患者12个月的前瞻性队列研究也证实,HDF较血液透析可减轻炎症反应,增加骨形成[26]。
促红细胞生成素低反应在维持性透析患者中并不少见,确切机制不明。22个国家560个透析中心的回顾性研究中,倾向评分匹配后平均随访1.3年的on-line HDF与高通量血液透析患者各3 373例分析结果显示,与高通量血液透析比较,on-line HDF组的促红细胞生成素抵抗指数下降更快,促红细胞生成素使用剂量减少更多,血红蛋白水平更高[27]。观察性研究也证明on-line HDF能更有效地改善肾性贫血,减少促红细胞生成素使用剂量,可能与其改善患者微炎症状态、促进铁利用等相关[28, 29]。
营养不良/蛋白能量消耗(protein-energy wasting,PEW)与透析患者的死亡风险密切相关。一项33例维持性高通量血液透析患者的前瞻性、开放标签对照研究显示,随访12个月后on-line HDF组患者较高通量血液透析患者能有效保持肌肉量,增加蛋白摄入,减少炎症状态,从而维持更好的营养状况,改善PEW[30]。on-line HDF与血液透析患者各10例的观察性研究中,当达到相同Kt/V时,前稀释on-line HDF较血液透析患者损失的谷氨酰胺和精氨酸以及非必需氨基酸显著减少,可使患者维持更好的营养状态[31]。
不宁腿综合征是维持性血液透析患者的常见并发症,严重影响患者生活质量;不宁腿综合征的发病机制主要涉及中枢神经系统多巴胺能神经元功能障碍,并可继发于铁缺乏;目前主要的治疗方法是给铁缺乏患者补充铁剂治疗,或者给予加巴喷丁、普瑞巴林及多巴胺激动剂等。病例报告结果显示,2例复发性不宁腿综合征患者经过高容量HDF治疗后症状缓解,笔者提出HDF治疗不宁腿综合征的靶目标是α1-微球蛋白下降率>40%[32]。单中心87例维持性血液透析患者435例次on-line HDF治疗结果显示,on-line HDF治疗后α1-微球蛋白下降率为33.8%±9.4%[33]。因此对于合并不宁腿综合征患者可尝试on-line HDF治疗。
此外,HDF对减少透析期间肌肉痉挛发生、纠正顽固性高血压、改善血磷、瘙痒等方面的获益均有报道,但存在一定争议,临床医师可根据患者具体情况选择。
推荐意见3:治疗无绝对禁忌证,但存在以下情况患者应当谨慎使用:(1)首次透析或诱导期透析的患者;(2)各种原因所致的严重低血压、休克、血流动力学不稳定患者;(3)严重心律失常等难以耐受治疗者;(4)精神障碍不能配合治疗者。(D5)
对上述患者应在治疗前做好充分病情评估,权衡利弊,并告知患方治疗相关风险。在有其他替代治疗方法时,可选择风险更小的治疗模式,如连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)、腹膜透析等。
终末期肾病患者接受HDF治疗前应经过仔细、充分评估,以确保患者治疗安全和有效,包含导入前评估和治疗期间的定期评估。
推荐意见4:准备接受HDF治疗的患者,应进行导入前病情评估。(D5)
导入前患者评估主要目的是全面了解患者的病情,以便制定合理的治疗方案,主要内容包括:(1)一般情况:原发病、教育程度、营养和精神状态及合作程度等;(2)血管通路:通路类型、血流量、有无通路相关并发症等;(3)出凝血情况:有无活动性出血、凝血功能障碍或高凝状态等;(4)心血管并发症:如高血压、心律失常、心力衰竭、缺血性心脏病等,可结合动态血压、血管超声、心脏超声、心电图、血清N末端脑钠肽前体(NT-proBNP)和肌钙蛋白等检查进行评估;(5)其他常见并发症:如贫血和铁代谢异常、慢性肾脏病-矿物质和骨代谢异常(CKD-MBD)、营养不良等;(6)重要的合并症:如糖尿病、肿瘤、肝硬化、脑血管意外等;(7)服药情况:如抗凝药物、抗血小板药物、抗生素等,以及是否存在药物过敏;(8)心理评估:是否存在焦虑、抑郁等精神心理异常情况。
推荐意见5:接受HDF治疗的患者应每次治疗前后进行相关评估。(D5)
主要内容应包括:(1)治疗前询问有无腹泻、水肿、呼吸困难、外伤、出血、手术操作等情况,测量生命体征与体重,心肺及下肢等体格检查情况;(2)治疗前评估血管通路状况:有无血管通路闭塞、出血及感染等;(3)治疗期间监测血压、跨膜压、透析器及管路与透析器凝血情况等;(4)治疗结束后测量生命体征与体重,记录治疗过程中急性并发症的发生与处理、净超量、抗凝剂总剂量、动静脉内瘘压迫止血时间等。
推荐意见6:接受HDF治疗患者应定期评估疗效及并发症,除常规血液透析监测指标外,有条件的单位重点监测β2-微球蛋白、C反应蛋白等相关指标。(D5)
目的是评估治疗效果,及时调整治疗方案,建议定期监测评估以下指标。
1. 血常规、血肌酐、血尿素氮及血清电解质:每1~3个月检查1次透析前血常规、血肌酐、血尿素氮及血清电解质[钾、钠、氯、钙、磷、HCO3-或二氧化碳结合力(CO2CP)等]。在贫血治疗的开始阶段、方案调整阶段以及病情不稳定时,应增加监测频率,及时调整治疗方案。
2. 铁代谢指标:每3~6个月检测1次铁代谢指标,包括血清铁蛋白、转铁蛋白饱和度等;铁剂治疗期间需增加检测频率,以便评估疗效,调整方案。
3. 血清甲状旁腺激素:每3~6个月检测1次血清甲状旁腺激素,根据患者接受药物的情况相应增加检测频率。
4. 营养评估和炎症状态评估:每3~6个月1次进行营养评估和炎症状态评估,包括血清营养学指标、高敏C反应蛋白、标准蛋白分解率(normalized protein catabolic rate,nPCR)及营养相关的体格检查指标等。
5. 透析充分性评估:每3~6个月评估1次透析充分性,包括Kt/V和尿素下降率(urea reduction rate,URR)。
6. 传染病学指标:包括乙型和丙型肝炎病毒标志物、艾滋病病毒和梅毒血清学指标。建议开始透析不满6个月患者,每1~3个月检测1次;维持性透析6个月以上患者,每6个月检测1次。
7. 心血管结构和功能检查:每6~12个月进行1次心血管结构和功能检查,包括心电图、心脏超声、外周血管多普勒超声等。
8. 血管钙化评估:每12个月进行1次腰椎侧位X线检查,评估血管钙化。
9. 中分子毒素和炎症指标:有条件的单位建议对患者中分子毒素和炎症指标等(如IL-6、IL-18、β2-微球蛋白、α1-微球蛋白、成纤维细胞生长因子23等)进行检测评估,每3~6个月1次,以便更好地评价HDF的疗效。
推荐意见7:建议HDF适应证与评估按以下指标进行医疗质量控制。(D5)
单位时间内,接受HDF治疗的患者占同期维持性血液透析患者比例。
1. 血常规定期检验完成率:每3个月完成血常规检验患者占接受HDF治疗患者的比例。
2. 血液生化定期检验完成率:每3个月完成血液生化(包括肝肾功能、电解质、血脂等)检验患者占接受HDF治疗患者的比例。
3. 甲状旁腺激素定期检验完成率:每6个月完成全段甲状旁腺激素(iPTH)检验患者占接受HDF治疗患者的比例。
4. 血清铁蛋白和转铁蛋白饱和度定期检验完成率:每6个月完成血清铁蛋白和转铁蛋白饱和度检验患者占接受HDF治疗患者的比例。
5. 血清前白蛋白定期检验完成率:每6个月完成前白蛋白检验患者占接受HDF治疗患者的比例。
6. C反应蛋白定期检验完成率:每6个月完成C反应蛋白检验患者占接受HDF治疗患者的比例。
7. Kt/V和URR定期记录完成率:每6个月完成Kt/V和URR记录患者占接受HDF治疗患者比例。
8. β2-微球蛋白定期检验完成率:每6个月完成β2-微球蛋白检验患者占接受HDF治疗患者比例。
9. 血源性传染病标志物定期检验完成率:每6个月完成乙型肝炎、丙型肝炎、梅毒及艾滋病标志物检验患者占接受HDF治疗患者比例。
on-line HDF治疗模式根据置换液接入位置分为前稀释HDF、后稀释HDF和混合稀释HDF。由于能够进行混合稀释HDF治疗的透析机目前我国使用率很低,且混合稀释HDF治疗的有效剂量的临床研究证据不足;因此本指南主要介绍前稀释HDF和后稀释HDF。
1. 前稀释HDF:置换液由透析器上游(动脉端)接入。与后稀释HDF相比,前稀释HDF可实现更高的超滤率(可高达血流速度的100%),避免后稀释HDF相关的血液浓缩,具有血流阻力小,残余血量少,不易形成滤过膜上的蛋白覆盖层,不易发生体外循环凝血等优点。然而,前稀释HDF治疗时血室内溶质浓度的降低导致通过扩散和对流清除溶质的效率下降。因此为了达到相同的清除效率,前稀释HDF的置换液剂量至少要达到后稀释HDF的2倍以上。
2. 后稀释HDF:置换液由透析器下游接入,通常注入静脉壶中。HDF治疗中的超滤率很高,故能有效防止高通量HD治疗中容易发生的反向超滤现象。后稀释HDF是最有效的溶质清除方法,但其潜在的缺点是较高的超滤率会引起血液浓缩,从而导致血浆蛋白沉积于半透膜的表面,堵塞透析器的膜孔和血液通道。这些效应会升高跨膜压(transmembrane pressure,TMP)引发报警,降低溶质清除能力并可能导致体外循环凝血的发生。
前稀释和后稀释HDF治疗模式的优缺点和适用人群见表2。

前稀释与后稀释HDF的优缺点及适用人群
前稀释与后稀释HDF的优缺点及适用人群
| 模式 | 优势 | 局限性 | 可能的适用人群 | 对透析器的要求 |
|---|---|---|---|---|
| 前稀释HDF | •低血流速度也能达到充分对流量 •白蛋白丢失少,生物相容性好 •稳定血流动力学 | •溶质清除率不及后稀释HDF •临床获益的证据有限 | •血管通路欠佳 •高出血风险 •低白蛋白血症 •存在高凝状态 | •无需特殊设计 |
| 后稀释HDF | •溶质清除率高 •更易实现有效对流量 •患者生存获益循证证据充分 | •白蛋白丢失量大 •体外循环凝血风险增加 | •血管通路良好,血流量充分 •血流动力学稳定 •无抗凝剂使用禁忌 •无营养不良 | •需要缩短长度以减少反向滤过 |
注:HDF为血液透析滤过
推荐意见8:需结合患者病情、技术设备的可及性及医疗保险政策等多种因素进行综合考虑选择HDF模式。(D5)
目前欧洲国家90%的患者采用后稀释治疗模式,对流量>21 L/次,每周3次,每次4 h,平均血流量350 ml/min;日本90%的患者采用前稀释模式,平均对流量40 L/次,每周3次,每次5 h,平均血流量180 ml/min[34]。
建议基于上述2种治疗模式的优缺点和适用人群,以及医疗机构的技术设备的可及性及医疗保险政策等多种因素进行综合考虑选择HDF模式。
推荐意见9:推荐血流速250~300 ml/min或>300 ml/min的患者,结合红细胞比容水平,选择后稀释HDF治疗模式(A1a);也可根据病情需求选择应用(D5)。
后稀释HDF的置换液用量较前稀释置换法少,而清除效率较前稀释置换法高,但容易导致高凝状态的患者滤器凝血[35]。多中心、前瞻性、随机对照的ESHOL研究证实高容量后稀释HDF显著降低患者的全因死亡和心血管病死亡风险[5]。基于4项随机对照研究的患者个体数据汇总分析也证实,高容量后稀释on-line HDF治疗能降低全因死亡和心血管病死亡风险[15]。Basile等[36]系统综述了高容量后稀释HDF相关研究,认为大多数可用数据支持选择高容量后稀释HDF。
值得注意的是,成功的高容量后稀释HDF治疗离不开有效的对流量,因而要求患者具有良好的血管通路满足较高的血流量,充分抗凝,无血黏度增高的情况(肾病综合征、冷球蛋白、单克隆丙种球蛋白血症)等[33]。此外,后稀释HDF治疗过程中,置换液输注前,透析器中血液浓缩会导致血浆蛋白在透析膜表面沉积,阻塞膜孔增高TMP。并且,血小板激活在HDF期间比血液透析期间更明显和更持久[37]。血液浓缩总体限制治疗过程中滤过分数为血流量的20%~25%。因此建议使用具有自动TMP控制功能的设备[38],其可以根据透析器中血黏度调节置换液速度,使滤过分数达到血流量的30%。
推荐意见10:建议血流速≤250 ml/min或红细胞比容>35%的患者选择前稀释HDF治疗模式。(B2b)
日本HDF中90%以上采用前稀释治疗模式。基于日本透析治疗学会肾脏数据注册数据库创建的5 000对患者的血液透析或前稀释on-line HDF倾向匹配队列研究证实,置换量>40 L/次的前稀释HDF患者的1年全因死亡率和心血管病死亡率均显著低于血液透析患者[39]。90例维持性血液透析患者的前瞻性随机平行交叉研究中期分析结果显示,前稀释和后稀释治疗模式患者的血压、透析中低血压频率或任何低血压测量频率无显著差异,β2-微球蛋白清除率和患者生活质量也无显著差异,但单次透析过程中后稀释治疗模式的白蛋白丢失显著大于前稀释治疗模式(4.87 g比3.78 g)[40]。日本采用前稀释HDF治疗模式的主要原因包括:(1)有效清除分子量大于β2-微球蛋白的中大分子量蛋白(包括炎性细胞因子、其他生物活性蛋白和蛋白结合的尿毒症毒素):尽管后稀释HDF较前稀释HDF更有效地清除分子量≤β2-微球蛋白的低分子量蛋白,当采用大孔滤过器清除低分子量蛋白时,后稀释HDF治疗模式存在显著的白蛋白丢失风险;但是,可以通过选择合适的孔径和控制对流速度调节低分子量蛋白清除,但通常需要更多的置换液剂量,因此需要更高的血流量。(2)日本透析患者的血流速较低,平均为200 ml/min;但前稀释on-line HDF可无限制地增加置换液剂量[40]。
因此,前稀释HDF适用于血管通路不佳导致血流量较低,伴有高凝状态或红细胞比容较高难以接受后稀释HDF治疗的患者。
推荐意见11:建议HDF治疗模式按以下指标进行医疗质量控制。(D5)
1. 后稀释HDF治疗适应证符合率:血流量250~300 ml/min或>300 ml/min结合红细胞比容水平采用后稀释HDF治疗模式患者占接受HDF治疗患者的比例。
2. 前稀释HDF治疗适应证符合率:血流量≤250 ml/min或红细胞比容>35%患者采用前稀释HDF治疗模式占接受HDF治疗患者的比例。
HDF治疗用置换液包括:联机法(on-line)获得的置换液和商品化置换液。On-line获得的置换液用于on-line HDF治疗;商品化置换液用于非联机HDF治疗,适用于需要调整置换液中电解质浓度治疗的合并严重电解质紊乱、严重血糖异常以及合并出血或高危出血风险采用局部枸橼酸钠抗凝治疗的患者。
推荐意见12:推荐on-line HDF置换液用于终末期肾病患者维持性治疗。(A1b)
全球范围内大量随机对照和观察性临床研究已证实联机生产HDF置换液的有效性和安全性[34,41]。on-line HDF置换液制备过程包括:从透析用水和浓缩液中制备透析液,然后经过内毒素过滤器等对该透析液进行处理,获得可直接注入血液中的HDF治疗置换液。每一步均应严格按照相关标准执行并做好检测。
推荐意见13:置换液的基本成分应与人体内生理浓度相符。(D5)
HDF置换液作为直接输入血液的成分,其溶质成分主要包括钠、钾、氯、碱基、钙、镁、磷及葡萄糖等,配方原则上要与生理浓度相符,并能改善终末期肾病患者的内环境。常用置换液配方:钠135~145 mmol/L、钾2.0~3.0 mmol/L、钙1.25~1.75 mmol/L、镁0.50~0.75 mmol/L、氯103~110 mmol/L、碳酸氢盐30~34 mmol/L。
推荐意见14:根据患者病情对置换液成分进行适当调整,达到个体化治疗。(D5)
on-line HDF置换液成分相对固定,而商品化置换液可根据患者电解质水平对钾、钠、钙等电解质浓度做出调整。如对严重高钠血症患者,一般调整置换液钠浓度至低于患者血钠浓度10 mmol/L,以防血钠浓度下降过快造成中枢神经系统等损害。对低钾血症的患者,可在置换液中加入适量氯化钾。高钙患者可选用生理钙置换液(1.25 mmol/L)。常规置换液中不含磷,但对低磷血症或需要长时间治疗的患者推荐配制置换液的磷浓度为0.7~1.0 mmol/L。血糖代谢异常患者推荐调整商品化置换液葡萄糖的浓度于5~12 mmol/L。此外,对肝功能严重异常的患者建议使用Port配方或改良Port配方治疗,高出血风险患者可适用枸橼酸置换液并在滤器后补充钙[42]。
推荐意见15:置换液应严格符合国际标准。(D5)
HDF治疗中置换液直接进入血液,因此对其品质和成分有严格的要求。国际标准化组织(International Organization for Standardization,ISO)发布的血液透析及相关治疗用水标准(ISO 11663:2014)提出用于HDF治疗的置换液必须无菌且无致热原[43]。商品化置换液一般参考静脉输液标准:内毒素<0.03活性单位(EU)/ml且细菌数<1×106菌落形成单位(CFU)/ml。此外,置换液中的溶质浓度应与上述生理浓度相符。
推荐意见16:透析用水应达到国家医药行业标准YY 0572-2015《血液透析及相关治疗用水》质量标准,浓缩透析液应达到国家医药行业标准YY 0598-2015《血液透析及相关治疗用浓缩物》质量标准,透析液应达到超纯透析液质量标准。(D5)
国家医药行业标准YY 0572-2015《血液透析及相关治疗用水》规定:透析用水中毒性污染物最大允许值:总氯(氯和氯胺)0.1 mg/L、铝0.01 mg/L、铜0.1 mg/L、氟化物0.2 mg/L、铅0.005 mg/L、硝酸盐(氮)2 mg/L、硫酸盐100 mg/L、锌0.1 mg/L,微量元素最大允许值:锑0.006 mg/L、砷0.006 mg/L、钡0.1 mg/L、铍0.000 4 mg/L、镉0.001 mg/L、铬0.014 mg/L、汞0.000 2 mg/L、硒0.09 mg/L、银0.005 mg/L和铊0.002 mg/L;细菌和内毒素的最大允许量分别为100 CFU/ml和0.25 EU/ml,并且明确提出对细菌和内毒素含量必须建立干预水平,通常干预水平是最大允许水平的50%。
国家医药行业标准YY 0598-2015《血液透析及相关治疗用浓缩物》规定:钠离子浓度应为标示量的97.5%~102.5%。其他溶质浓度应为标示量的95.0%~105.0%;细菌总数≤100 CFU/ml,真菌总数≤10 CFU/ml。大肠杆菌应不得检出;配制成的透析液内毒素≤0.5 EU/ml;不溶性微粒:≥10 μm的微粒≤25个/ml,≥25 μm的微粒≤3个/ml。
《血液净化标准操作规程(2021版)》中超纯透析液的质量标准:细菌数<0.1 CFU/ml,内毒素<0.03 EU/ml。
1. 透析用水硬度:每天监测1次透析用水的硬度,推荐<1格令(GPG)或17.1 mg/L。
2. 总氯量:每天监测1次活性炭罐出水总氯,要求总氯量<0.1 mg/L。
3. 生物污染监测:细菌培养应至少每个月1次,要求细菌数≤100 CFU/ml;内毒素检测至少每3个月1次,要求内毒素≤0.25 EU/ml。
4. 化学污染物:至少每年检测1次,需达到上述国家行业标准《血液透析及相关治疗用水》(YY0572-2015)的要求。
1. 细菌监测:每个月1次,每次至少检测2台血液透析机,每台机器每年至少检测1次;要求细菌数<0.1 CFU/ml。
2. 内毒素检测:每3个月1次,每次至少检测2台血液透析机,每台机器每年至少检测1次;要求内毒素<0.03 EU/ml。
3. 内毒素过滤器:按照产品使用说明中限定的次数要求进行更换。
推荐意见17:建议HDF置换液和透析液按照以下指标进行医疗质量控制。(D5)
1. on-line HDF治疗率:on-line HDF治疗患者占接受HDF治疗患者的比例。
2. 透析用水微生物污染检验合格率:血液透析室(中心)透析用水微生物污染检验合格的月份/季度在当年所占的比例。
3. 超纯透析液检验合格率:单位时间内,血液透析室(中心)符合超纯透析液标准的HDF治疗透析机数量占全部HDF治疗透析机数量的比例。
HDF治疗使用的血管通路基本上与血液透析一致,但后稀释HDF需要更高的血流量。因此,选择动静脉内瘘(arteriovenous fistula,AVFs)和移植物内瘘(arteriovenous grafts,AVGs)作为血管通路时,应使用16 G以上内径更大的穿刺针;选择带隧道带涤纶套中心静脉导管(tunneled cuffed central venous catheters,TCCs)作为血管通路时,应选择可满足较大血流量(≥300 ml/min)的TCCs。
推荐意见18:选择HDF治疗的血管通路,应评估患者血管条件、心脏功能及全身整体状态与预期生存时间等临床情况进行综合决策(D5);同等条件下优先选择AVFs,其次选择AVGs、TCCs(A1a)。
针对2 088例AVFs和1 728例AVGs具有不同特征患者的临床情况,11名国际血管通路专家采用兰德/加州大学洛杉矶分校(RAND/UCLA)适宜性方法,对每种情况的适宜性进行了两轮评级,结果显示,年龄较小(<60岁)、流出静脉直径>2 mm、正常或肥胖体质指数、流入动脉直径>2 mm和患者功能状态较高与AVFs的适宜性相关;年龄较大(>75岁)、透析依赖性和静脉直径<2 mm与AVGs的适宜性相关;性别、糖尿病和冠状动脉疾病与AVFs或AVGs的适宜性无关;透析状态(透析前或透析依赖)与AVFs的适宜性无关;体质指数(正常、肥胖或病态肥胖)和功能状态(独立、不独立居家或居住养老设施)与AVGs的适宜性无关[44]。
23项对照试验930例糖尿病和3 137例非糖尿病终末期肾病患者的荟萃分析结果显示,合并糖尿病患者的AVFs失败风险增加(OR=1.682,95%CI:1.429~1.981,I2=9.7%)[45]。10项队列研究1 171例成年和670例老年终末期肾病患者的荟萃分析结果显示,与老年患者比较,成人患者12个月(OR=1.525,95%CI:1.189~1.957)和24个月(OR=1.357,95%CI:1.062~1.751)的AVFs通畅率均显著增加;老年患者行桡动脉-头静脉吻合AVFs的手术失败率显著增加(OR=1.790,95%CI,1.136~2.821);老年患者中AVGs与桡动脉-头静脉吻合AVFs的手术失败率无明显差别[46]。
200项对照/非对照试验875 269条血管通路的荟萃分析结果显示,2年初级通畅率,AVFs为55%,AVGs为40%,TCCs为50%;2年间AVGs感染率显著高于AVFs(13%比2%),59周TCCs感染率为16%;患者病死率,TCCs为26%,AVGs为17%,AVFs为15%,且AVGs高于AVFs(HR=1.278,95%CI:1.139~1.435)[47]。62项队列研究586 337例的随机效应荟萃分析结果显示,与AVFs比较,TCCs增加患者全因死亡率(RR=1.53,95%CI:1.41~1.67,I2=83.1%)、致命感染(RR=2.12,95%CI:1.79~2.52,I2=0)和心血管事件(RR=1.38,95%CI:1.24~1.54,I2=85.2%)的风险;与AVGs比较,TCCs增加患者致命感染(RR=1.49,95%CI:1.15~1.93,I2=25.6%)和心血管事件(RR=1.26,95%CI:1.11~1.43,I2=0)的风险;与AVFs比较,AVGs增加患者全因死亡(RR=1.18,95%CI:1.09~1.27,I2=80.9%)和致命感染(RR=1.36,95%CI:1.17~1.58,I2=0)的风险[48]。
推荐意见19:未建立AVFs急诊行HDF治疗,或HDF治疗期间血管通路失功,或腹膜透析临时转为HDF治疗时,可选择无隧道无涤纶套中心静脉导管。(D5)
HDF治疗前未建立AVFs患者,由于心力衰竭、肺水肿、严重电解质紊乱、尿毒症脑病或消化道出血等需要急诊透析;或AVFs、AVGs或TCCs不能提供满足透析处方需求的血流量或因感染等原因无法继续使用;或腹膜透析患者由于任何原因必须暂停腹膜透析,需要转为HDF治疗时,可留置无隧道无涤纶套中心静脉导管[49]。
HDF血管通路的建立技术以及治疗时血管通路的上下机具体操作,同血液透析;应依据《血液净化标准操作规程(2021版)》进行具体操作[42]。
推荐意见20:AVFs术前和术后应评估AVFs不成熟的临床表现和基于超声检查的血流动力学风险,对于术后AVFs不成熟应及时进行挽救手术或球囊血管成形术;不建议使用球囊血管成形术联合副静脉闭塞术挽救未成熟AVFs。(B2b)
术前AVFs不成熟风险评估及术后早期评估血流动力学可以有效地识别出有AVFs不成熟风险的患者,并通过早期干预得到有效治疗。基于33项研究(21项为AVFs不成熟风险分析,12项为AVFs不成熟干预)的系统综述结果显示,对于早期AVFs不成熟风险,术前具有临床危险因素患者的绝对风险21%(95%CI:11%~30%)和相对风险1.7(95%CI:1.3~2.1),具有血流动力学危险因素患者的绝对风险50%(95%CI:42%~58%)和相对风险1.7(95%CI:1.4~2.0);术后不久出现血流动力学危险因素患者的绝对风险50%(95%CI:42%~58%)和相对风险4.3(95%CI:3.4~5.5);对于AVFs不成熟患者,早期手术治疗的平均成功率86%,1年初级通畅率51%,并发症发生率9.3%;86%(95%CI:74%~98%)的AVFs不成熟患者,可通过挽救手术至少使用1次AVFs进行血液透析,1年平均初级通畅率51%(95%CI:28%~68%),1年平均次级通畅率76%(95%CI:72%~95%)[50]。
球囊血管成形术或球囊血管成形联合副静脉闭塞术(经血管内套圈或外科手术结扎)均具有很好的技术成功率(治疗后AVFs血流量>300 ml/min)和临床成功率(治疗后AVFs可完成1次透析)以及显著的3、6个月初级通畅率和3、6、12个月的次级通畅率,2种技术间无明显差别。一篇针对14项研究1 030例应用球囊血管成形术或球囊血管成形联合副静脉闭塞术抢救未成熟AVFs患者的荟萃分析结果显示,球囊血管成形术或球囊血管成形联合副静脉闭塞术的技术成功率(93.6%比93.4%)和临床成功率(92.4%比88.1%)无明显差别,3个月(75.2%比75.7%)、6个月(67.6%比58.4%)和12个月(61.4%比52.7%)的初级通畅率无明显差别,3个月(91.2%比92.9%)、6个月(86.3%比90.0%)和12个月(80.1%比83.1%)的次级通畅率无明显差别[51]。
推荐意见21:推荐AVFs使用绳梯式或扣眼式穿刺方法。(B2a)
使用AVFs进行维持性血液透析患者的11项随机对照试验和4项连续对照试验的荟萃分析结果显示,与绳梯式穿刺比较,扣眼式穿刺显著减少了动脉瘤形成(RR=0.18,95%CI:0.1~0.32,I2=12%)、狭窄(RR=0.44,95%CI:0.25~0.77,I2=21%)、血栓形成(RR=0.4,95%CI:0.2~0.8,I2=0)和血肿(RR=0.63,95%CI:0.40~0.99,I2=51%);但≤6个月和>6个月的血管通路感染以及AVFs存活率均无明显差别[52]。
推荐意见22:基于血流测量或多普勒超声筛查的预防性干预,可显著减少血管通路的血栓形成。(A1a)
基于14项随机/准随机对照试验1 390例接受/计划开始血液透析患者的荟萃分析结果显示,在接受血液透析治疗的患者中,与无监测和延迟(发生血管通路功能失调后)矫正比较,基于监测的预防性狭窄矫正显著降低血栓形成风险(RR=0.79,95%CI:0.65~0.97,I²=30%),但血管通路失功无明显差别;亚组分析中,预防性狭窄矫正显著降低AVFs的血栓形成(RR=0.50,95%CI:0.35~0.71,I²=0)和失功(RR=0.50,95%CI:0.29~0.86;I²=0)风险,但未降低AVGs的血栓形成或失功的风险;预防性狭窄矫正显著降低住院率(RR=0.54,95%CI:0.31~0.93,I²=67%)和中心静脉导管使用率(RR=0.58,95%CI:0.35~0.98;I²=53%),但显著增加诊断程序(RR=1.78,95%CI:1.18~2.67,I²=62%);感染和病死率二者无明显差别[53]。
推荐意见23:远红外线治疗可改善AVFs的通畅率,并降低患者针刺疼痛的程度。(B2a)
一篇针对21项随机/准随机对照试验的960例接受红外线治疗和939例接受安慰剂治疗患者的荟萃分析结果显示,红外线治疗可显著增加血管通路的血流量(MD=81.69 ml/min,95%CI:46.17~117.21,I2=86%)、AVFs直径(MD=0.36 mm,95%CI:0.22~0.51,I2=68%)及其初级通畅率(RR=1.24,95%CI:1.12~1.37,I2=0),显著降低AVFs闭塞率(RR=0.20,95%CI:0.08~0.46,I2=0)和针刺疼痛程度(RR=0.08,95%CI:0.06~0.10,I2=99%)[54]。
推荐意见24:推荐使用低浓度(1 000 U/ml)肝素和低浓度(<5%)枸橼酸钠封管液。(A1a)
基于5项随机对照试验和3项对照研究916例患者的荟萃分析结果显示,与高剂量(≥5 000 U/ml)肝素比较,低剂量(<5 000 U/ml)肝素封管可以显著降低出血相关并发症的发生率(RR=3.29,95%CI:2.19~4.94)和导管相关感染发生率(RR=1.66,95%CI:1.01~2.73);导管存活时间以及导管血栓形成/闭塞或导管功能障碍发生率均无明显差别[55]。184例随机对照研究结果证实,与1 000 U/ml肝素比较,5 000 U/ml肝素封管的功能存活时间、导管闭塞率和感染率无明显差别;但显著延长封管后10 min的活化部分凝血活酶时间(APTT)[(30.1±34.4)s比(32.2±5.0)s,P<0.05],显著增加伴有血流动力学变化的大出血发生率(9.5%比1.1%,P<0.05)和红细胞比容下降速率[(-2.30±1.73)%/d比(-1.37±1.82)%/d,P<0.05][56]。
基于13项随机对照试验1 770例患者221 064个导管日的荟萃分析结果显示,与肝素封管比较,1.04%~4%枸橼酸钠封管(RR=0.38,95%CI:0.25~0.58,I2=10%)和4.6%~7%枸橼酸钠封管(RR=0.27,95%CI:0.12~0.64,I2=0)的导管相关血流感染发生率显著降低,但30%~46.7%枸橼酸钠无明显差别(RR=0.50,95%CI:0.14~1.83,I2=83%);与肝素封管比较,枸橼酸钠封管显著降低出血事件发生率(RR=0.48,95%CI:0.30~0.76),但出口部位感染、移除导管、溶栓治疗、全因死亡、导管血栓形成、平均导管生存时间及无导管相关血流感染的导管存活率及导管相关再入院率均无明显差别[57]。
推荐意见25:对于高危/合并导管功能障碍患者,推荐重组组织型纤溶酶原激活剂(rt-PA)封管;对于高危/合并导管相关感染患者,推荐抗凝剂联合抗生素/抗菌剂封管,可考虑优先选择枸橼酸钠+庆大霉素。(A1a)
一篇针对28项随机对照试验3 081例使用中心静脉导管的血液透析患者的荟萃分析结果显示,5 000 U/ml肝素是对照组最常使用的封管液(18/28项试验);与对照组比较,rt-PA封管液显著降低导管功能障碍(RR=0.58,95%CI:0.37~0.91);而枸橼酸钠、口服华法林、联合抗生素/抗菌剂封管液和低剂量/无肝素封管液均不影响导管功能障碍发生率;枸橼酸钠(RR=0.49,95%CI:0.34~0.72,I2=32.7%)、抗生素/抗菌剂(RR=0.27,95%CI:0.11~0.70)和rt-PA(RR=0.35,95%CI:0.13~0.93)封管液均可显著减少导管相关菌血症,而口服华法林全身抗凝和低剂量/无肝素封管液无明显效果;rt-PA封管液显著减少抢救性溶栓药物的使用(RR=0.21,95%CI:0.07~0.59),而枸橼酸钠无明显作用;使用rt-PA封管液和华法林的出血事件无明显差别[58]。
基于18项随机对照试验2 395例中心静脉导管的血液透析患者的贝叶斯网络荟萃分析结果显示,与肝素相比,庆大霉素联合枸橼酸钠(OR=0.07,95%CI:0~0.48)和庆大霉素联合肝素(OR=0.04,95%CI:0~0.23)封管显著降低导管相关血流感染,而米诺环素+乙二胺四乙酸(EDTA)、乙醇、枸橼酸钠、头孢噻肟+肝素、牛磺罗定+枸橼酸钠、万古霉素+肝素及头孢唑林+枸橼酸钠封管液无明显差别;米诺环素+EDTA、庆大霉素+枸橼酸钠、枸橼酸钠、庆大霉素+肝素、牛磺罗定+枸橼酸钠及万古霉素+肝素的出口部位感染无明显差别;米诺环素+EDTA、庆大霉素+枸橼酸钠、枸橼酸钠及庆大霉素+肝素的全因死亡率无明显差别[59]。
推荐意见26:建议HDF血管通路按以下指标进行医疗质量控制。(D5)
1. HDF患者血管通路建立前血管条件和全身状态评估完成率:血管通路建立前完成血管条件和全身状态评估的患者占接受HDF治疗患者的比例。
2. HDF患者AVFs使用率:HDF治疗患者中使用AVFs的患者比例。
3. AVFs长期生存率:HDF治疗患者中同一动静脉内瘘持续使用时间>2年的患者比例。
HDF的抗凝治疗方法与血液透析基本相同,应遵循《血液净化标准操作规程(2021版)》[42]。
推荐意见27:HDF治疗前应评估患者的凝血状态以及出血或血栓栓塞疾病的风险,指导抗凝剂的选择;首次HDF治疗时通过评估治疗过程中体外循环和患者体内凝血状态,以及治疗结束时患者体内凝血状态,调整抗凝剂剂量;并通过定期凝血状态评估,调整抗凝剂使用。(D5)
1. 评估内容:(1)依据患者的既往病史、临床特征和抗凝药物的使用情况,评估患者是否存在出血或血栓栓塞的风险;(2)通过实验室检测评估患者的内源性、外源性和凝血共同途径状态,以及血小板功能和纤溶活性状态,明确患者的出血或血栓栓塞风险。
2. 评估指标:建议常规检测APTT或活化凝血时间(ACT)、凝血酶原时间(PT)或国际标准化比值(INR)、纤维蛋白原、全血血小板计数及D-二聚体,有条件的单位建议常规检测抗凝血酶活性。
1. 监测内容:治疗过程中从HDF管路的静脉端采血,评估体外循环的凝血状态,明确抗凝治疗有效性;治疗过程中从HDF管路动脉端或患者静脉采血,以及治疗结束时从患者静脉采血,评估患者体内凝血状态,明确抗凝治疗安全性。
2. 监测指标:依据选择使用抗凝剂:(1)普通肝素:ACT;(2)低分子肝素:抗凝血因子Ⅹa活性;(3)阿加曲班或甲磺酸萘莫司他:APTT;(4)枸橼酸局部抗凝:APTT或PT、游离钙以及患者血液总钙/游离钙比值、钠离子、碳酸氢盐和二氧化碳水平。
每次HDF治疗结束后视觉凝血指标评估:根据每次HDF治疗结束后透析管路、透析器/血滤器的目测凝血情况以及穿刺点的止血时间等,经验性调整抗凝剂剂量,具有实时、简单、易行的特点。89个透析中心涉及6 093例透析患者的横断面观察性研究结果显示,调整普通肝素或低分子肝素的剂量调整方法为体外循环回路凝血(88.2%的中心)、回血后穿刺部位出血(75.3%的中心)以及患者体重(57.6%的中心)[61]。37家血液透析中心2 829例后稀释on-line HDF治疗患者的多中心回顾性研究结果显示,目测为洁净透析器的患者透析充分性显著高于其他类别透析器;目测评估透析结束后的透析器状态是帮助医师确定理想肝素剂量的绝佳机会,并建立了透析器和管路凝血状态的分级方法(图1、2)[62]。
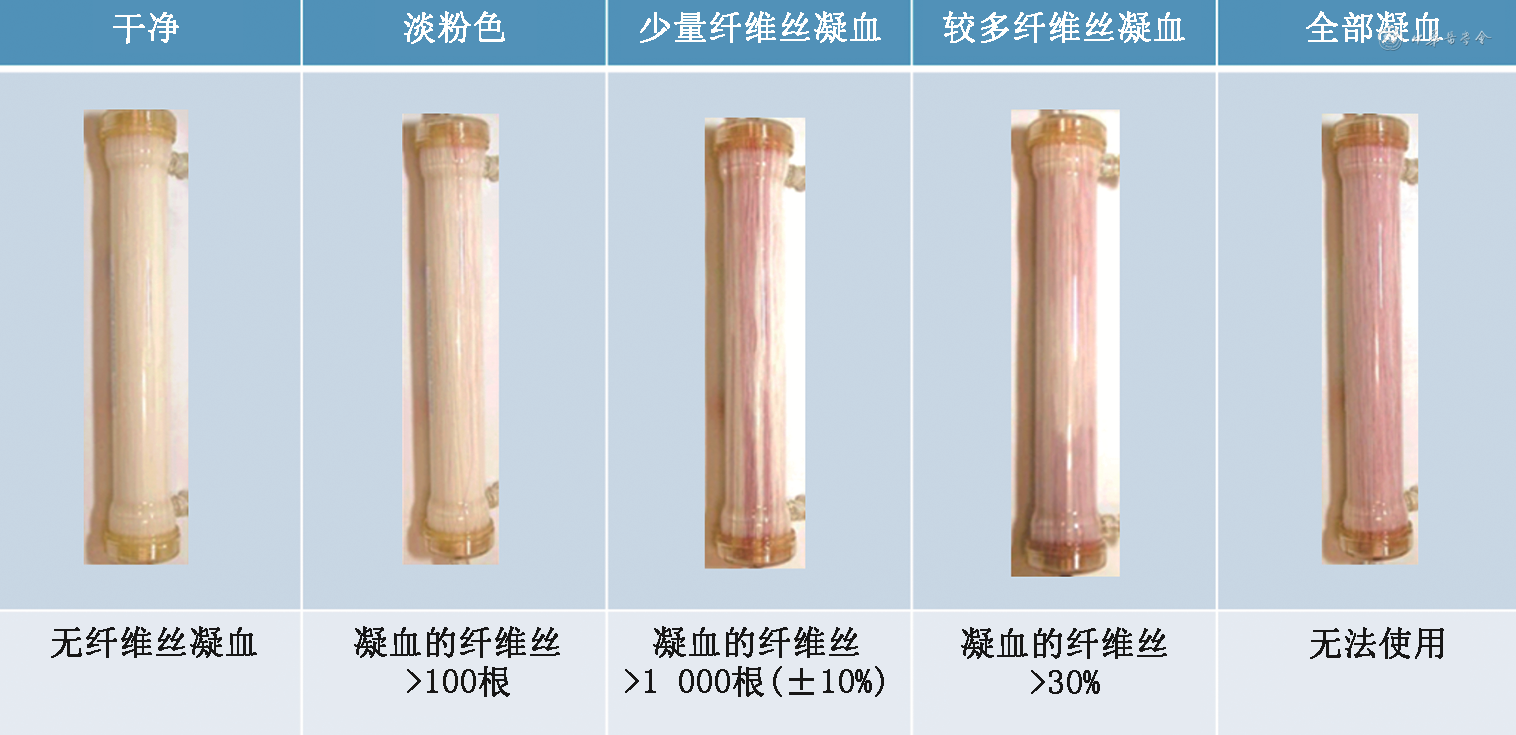



HDF治疗结束后出现显著的透析器/血滤器凝血,以及血栓栓塞或出血性疾病,应重新评估患者HDF治疗前、治疗过程中、治疗结束后的凝血状态(评估指标同上),调整抗凝剂的种类和剂量。
维持性HDF治疗患者,建议至少每3个月评估1次患者HDF治疗前、治疗过程中、治疗结束后的凝血状态(评估指标同上),调整抗凝剂的种类和剂量。
推荐意见28:抗凝剂的选择应首先除外抗凝剂使用禁忌证;活动性出血或高危出血风险、既往普通肝素或低分子肝素过敏史或肝素诱导的血小板减少症病史的患者禁用普通肝素或低分子肝素(A1a);合并严重肝功能障碍或新生儿酶系统发育不全的患者禁用枸橼酸钠,合并严重肝功能障碍患者禁用阿加曲班,既往甲磺酸萘莫司他过敏患者禁用甲磺酸萘莫司他(D5)。
一项基于23项维持性血液透析患者随机对照试验的系统综述与荟萃分析中,普通肝素与低分子肝素体外循环血栓危险比为1.00(95%CI:0.62~1.62),出血并发症危险比为1.16(95%CI:0.62~2.15),无明显差别[63]。15项随机/非随机对照试验7 287例患者的荟萃分析结果显示,肝素诱导的血小板减少症(HIT)发生率,普通肝素治疗时为1.5%~3.8%,低分子肝素治疗时为0.1%~0.4%;低分子肝素显著低于普通肝素[64]。此外,普通肝素和低分子肝素均具有发生过敏的风险;抗凝血酶活性<50%时,普通肝素或低分子肝素的抗凝作用显著降低,不建议选择应用。
实施局部枸橼酸钠抗凝治疗时,透析器/滤器前给予的枸橼酸钠和透析器/滤器后补充的钙盐,均将进入体内经肝脏、肾脏和肌肉代谢为碳酸氢盐和钙盐,进而碳酸氢盐分解为二氧化碳和水,经肺脏和肾脏/血液净化治疗排除。合并严重肝功能障碍或新生儿酶系统发育不全的患者不能代谢枸橼酸钠,合并肺功能障碍的患者则可导致二氧化碳潴留。合并低氧血症(动脉氧分压<60 mmHg,1 mmHg=0.133 kPa)和(或)组织灌注不足、代谢性碱中毒、高钙血症及高钠血症的患者应慎用枸橼酸钠。
阿加曲班在肝脏代谢,代谢产物由胆管系统排泄,肝功能不全患者阿加曲班的清除可减少75%,半衰期延长2~3倍[65]。文献报道血液透析患者应用甲磺酸萘莫司他可发生过敏反应[66, 67],因此既往甲磺酸萘莫司他过敏患者禁用。
推荐意见29:对无出血风险的患者,建议选择普通肝素或低分子肝素作为HDF的抗凝剂。(A1a)
基于11项维持性血液透析患者的随机对照试验的荟萃分析结果显示,与普通肝素比较,低分子肝素的体外循环血栓形成(RR=1.15,95%CI:0.70~1.91,I2=57.3%)、出血事件(RR=0.96,95%CI:0.27~3.43,I2=62.8%)以及血管通路压迫时间[加权平均差(WMD)=-0.87,95%CI:-2.75~1.02]均无明显差别[68]。
推荐意见30:对合并出血性疾病或高危出血风险的患者,除外药物禁忌,on-line HDF治疗时推荐选择阿加曲班或甲磺酸萘莫司他作为HDF的抗凝剂;非联机HDF治疗时也可选择局部枸橼酸钠抗凝。(A1b)
接受间歇性静脉-静脉血液滤过(IVVH)的伴有高危出血风险的急性肾损伤患者的前瞻性随机对照试验中,与无抗凝剂比较,阿加曲班可有效提供体外循环抗凝作用,且不影响患者体内凝血状态,未发现严重出血和严重不良反应[69]。
一篇针对17项观察性研究和3项随机对照试验的荟萃分析结果显示,与无抗凝实施CRRT组比较,使用甲磺酸萘莫司他实施CRRT组的滤器寿命显著延长(WMD=-8.4,95%CI:-9.9~-6.9,I2=33.7%)[70]。73例合并出血倾向、实施CRRT的急性肾损伤患者的前瞻性随机对照研究中,与无抗凝药物比较,甲磺酸萘莫司他显著延长滤器寿命、减少使用滤器数量,而输血及患者病死率或生存率无明显差异[71]。
另一篇基于14项随机对照试验1 134例接受CRRT患者的荟萃分析结果显示,与肝素治疗组比较,枸橼酸钠治疗组的患者病死率无明显差异(RR=0.97,95%CI:0.84~1.13);但显著延长连续静脉-静脉血液滤过(CVVH)亚组(MD=8.18,95%CI:3.86~12.51)和稀释前亚组(MD=17.51,95%CI:9.85~25.17)的管路使用时间,显著降低出血风险(RR=0.31,95%CI:0.19~0.51),显著减少HIT发生风险(RR=0.41,95%CI:0.19~0.87)[72]。17项观察性研究和3项随机对照试验的荟萃分析结果显示,与无抗凝实施CRRT组比较,使用局部枸橼酸抗凝实施CRRT组的滤器寿命显著延长(WMD=-23.01,95%CI:-28.62~-17.39,I2=0)[70]。
需要注意的是,on-line HDF治疗时置换液和透析液中均含有钙离子,由于含钙透析液(前稀释HDF治疗还包括含钙置换液)不断进入透析器/滤器,导致透析器/滤器静脉端大部分无法实现控制游离钙离子浓度0.25~0.35 mmol/L,不能实现透析器/滤器和静脉壶的有效抗凝,增加透析器/滤器和静脉壶凝血事件发生风险;若达到体外循环的充分抗凝,必须增加枸橼酸盐的输注量,可导致代谢性碱中毒、低钙血症和高钠血症发生风险增加,且同时置换液的钙浓度不能有效拮抗输注的枸橼酸,增加出血和低钙血症风险;后稀释HDF治疗时静脉壶追加补充枸橼酸盐可减少静脉壶凝血,但增加枸橼酸盐的输注量,导致低钙血症、代谢性碱中毒和高钠血症发生风险进一步增加。因此,on-line HDF治疗时不建议使用局部枸橼酸钠抗凝治疗;局部枸橼酸钠抗凝治疗仅适用于合并出血或高危出血风险、同时合并严重电解质紊乱,需要调整置换液电解质浓度而进行非联机HDF治疗的患者,此时应采用无钙的商品化置换液。
推荐意见31:对既往发生HIT的患者,进行HDF治疗时禁用肝素类药物,推荐选择阿加曲班作为抗凝剂,或选择其他抗凝药。(A1a)
一项47例前瞻性多中心研究中接受了阿加曲班治疗且合并肾功能衰竭需要肾脏替代治疗的HIT患者回顾性分析结果显示,阿加曲班可提供有效抗凝作用,且出血风险较低[73]。5项随机对照试验213例肾脏替代治疗患者的荟萃分析结果显示,阿加曲班显著降低HIT患者肾脏替代治疗中新发血栓的发生率(RR=0.40,95%CI:0.21~0.75,I2=0)[74]。
推荐意见32:以普通肝素作为抗凝剂时,采用初始剂量后持续透析器/血滤器前追加给药方式,HDF结束前30 min停止追加。(D5)
普通肝素的相对分子质量5 000~20 000 D,与分子量62 000 D的抗凝血酶结合后不能被透析器/血滤器清除,因此推荐给予初始剂量充分阻断血液流经透析管路和血滤器诱发的凝血活化基础上,通过透析器/血滤器的追加剂量,增强体外循环抗凝作用;尿毒症患者普通肝素半衰期为30~60 min,为在透析结束后恢复患者体内凝血状态,建议在透析结束前30~60 min停止追加剂量[60]。
推荐意见33:以低分子肝素作为抗凝剂时,建议HDF治疗前从静脉端一次性给药。(A1b)
一项16例维持性血液透析患者(含8例HDF治疗患者)双中心、前瞻性、开放标记的随机交叉试验结果显示,依诺肝素作为抗凝剂的HDF治疗患者,4 h的抗凝血因子Ⅹa活性,静脉给药显著高于管路动脉端给药[(0.82±0.29)U/ml比(0.39±0.14)U/ml,P<0.001][75]。13例维持性后稀释HDF治疗患者的前瞻性随机交叉试验结果证实,HDF前动脉端注射可导致亭扎肝素抗凝活性的丧失[76]。49例on-line HDF治疗患者的前瞻性对照试验结果显示,与管路动脉端注射那屈肝素比较,静脉端给药显著增加洁净透析器比例,显著减少透析器凝结比例;那屈肝素平均使用剂量,管路动脉端注射为0.43 ml,管路静脉端注射为0.3 ml,管路静脉端注射且减少剂量33%~50%后Kt/V从1.64提高至1.75,置换液剂量从20.18 L增加至21.96 L[77]。
推荐意见34:对于伴有出血风险采用阿加曲班、甲磺酸萘莫司他或局部枸橼酸钠进行抗凝治疗的患者,依据HDF治疗过程中患者体内和体外循环凝血状态以及治疗结束后体内凝血状态的监测结果个体化调整抗凝剂的剂量。(D5)
采用阿加曲班抗凝治疗时,初始剂量75 μg/kg,追加剂量0.4~0.6 μg·kg-1·min-1持续透析器/血滤器输注;或者1~2 μg·kg-1·min-1持续滤器前输注;控制滤器后的APTT>基础值的3.0倍,患者体内APTT<基础值的1.5倍;直至HDF治疗结束。
采用甲磺酸萘莫司他抗凝治疗时,给予20~50 mg/h持续滤器前输注。甲磺酸萘莫司他的有效剂量和监测方法尚未形成共识,一般而言应控制患者体内APTT<基础值的1.5倍,以避免发生出血事件。甲磺酸萘莫司他半衰期很短,应在HDF治疗结束时再停用。
对于同时合并严重电解质紊乱,需要调整置换液电解质浓度而进行非联机HDF治疗的患者采用局部枸橼酸钠抗凝治疗时,推荐使用无钙的商品化置换液,透析器/血滤器前持续输注枸橼酸钠,控制滤器后的游离钙离子浓度0.25~0.35 mmol/L,PT>基础值的2.5倍、INR>2.5或APTT>基础值的3.0倍;在静脉端持续输注钙制剂,控制患者体内游离钙离子浓度1.00~1.35 mmol/L,PT、INR或APTT<基础值的1.5倍;直到HDF治疗结束。不建议on-line HDF治疗时采用局部枸橼酸钠抗凝治疗。
推荐意见35:发生抗凝治疗不良事件时,及时评估患者出凝血状态,重新选择抗凝药物及其剂量;并针对不良反应给予处理。(D5)
对于合并出血或出血高危风险的患者,应尽可能选择枸橼酸钠(非联机HDF)、阿加曲班或甲磺酸萘莫司他作为抗凝药物,而非进行无抗凝药物治疗;应注重HDF治疗前凝血状态的评估,加强血液净化治疗过程中体内凝血状态的监测,个体化抗凝治疗。普通肝素或低分子肝素过量可给予适量的鱼精蛋白,枸橼酸钠过量可补充钙制剂,阿加曲班或甲磺酸萘莫司他过量可短暂观察,严重者可给予凝血酶原制剂或血浆;发生血栓栓塞性疾病时应给予抗凝、促纤溶药物治疗[78]。
1. 普通肝素或低分子肝素:发生过敏或HIT应禁用肝素类药物;发生HIT后应给予阿加曲班抗凝和(或)促纤溶药物治疗。
2. 枸橼酸钠:代谢性碱中毒、高钙血症、低钙血症及高钠血症等,发生后应适当减少其后HDF治疗时的枸橼酸钠剂量,严重时应停用枸橼酸钠,改用阿加曲班或甲磺酸萘莫司他,不具备条件时可采用无抗凝剂进行HDF治疗。
3. 阿加曲班:过敏、低血压、发热、恶心、腹泻、房室传导阻滞、室性心动过速等;发生过敏和(或)严重低血压的患者其后HDF治疗时应禁用阿加曲班;发生其他不良事件的患者给予对症治疗,严重时应停用阿加曲班,改用枸橼酸钠或甲磺酸萘莫司他,不具备条件时可采用无抗凝剂进行HDF治疗。
4. 甲磺酸萘莫司他:高血钾、低血钠、过敏、粒细胞减少、血小板异常、肝功能异常、腹泻、恶心、呕吐等;发生过敏的患者其后HDF治疗时应禁用甲磺酸萘莫司他;发生高血钾或低血钠的患者其后HDF治疗时应调整透析液和(或)置换液的钾离子与钠离子浓度;发生其他不良事件的患者给予对症治疗,严重时应停用甲磺酸萘莫司他,改用枸橼酸钠或阿加曲班,不具备条件时可采用无抗凝剂进行HDF治疗。
推荐意见36:HDF抗凝治疗按以下指标进行质量控制。建议按照质控指标管理与控制HDF抗凝治疗的医疗质量。(D5)
1. HDF治疗前凝血指标检测完成率:HDF治疗前完成系统凝血指标检测的患者占接受HDF治疗患者的比例。系统凝血指标:至少包括全血血小板计数、APTT或ACT、PT或INR、纤维蛋白原定量以及D-二聚体,有条件的单位应检测抗凝血酶活性。
2. HDF治疗期间定期凝血状态评估完成率:HDF治疗期间至少3个月完成1次系统凝血指标检测的患者占接受HDF治疗患者的比例。系统凝血指标:至少包括全血血小板计数、APTT或ACT、PT或INR、纤维蛋白原定量以及D-二聚体,有条件的单位应检测抗凝血酶活性。
3. HDF治疗结束后严重透析器/血滤器凝血发生率:HDF治疗结束后透析器/血滤器的凝血纤维丝>30%的例次占全部HDF治疗例次的比例。
4. 出血或血栓栓塞疾病发生率:单位时间内,发生出血或血栓栓塞疾病的患者占全部HDF治疗患者的比例。
HDF的处方设置包括透析器/血滤器、治疗模式、超滤量、透析频率、透析液等内容。HDF在透析器、血流量和透析液流速、抗凝剂使用等方面不同于血液透析[1]。临床上应综合考虑患者具体情况施行个性化的治疗。
推荐意见37:首选血滤器,也可使用具有高水分通透性和高溶质渗透性的高通量透析器进行HDF治疗,应满足超滤系数>20 ml·h-1·mmHg-1·m-2,β2-微球蛋白筛选系数>0.6。(A1b)
30例成年维持性血液透析患者单中心、前瞻性、开放、随机交叉对照试验结果显示,在其他透析参数保持不变的条件下,血滤器较高通量透析器清除β2-微球蛋白、肌红蛋白、催乳素和白蛋白的效果显著增加,提示血滤器较高通量透析器能够增加中分子物质的清除[79]。欧洲透析工作组(EUDIAL group)定义HDF透析器/滤器标准为超滤系数>20 ml·h-1·mmHg-1·m-2,β2-微球蛋白筛选系数>0.6[80]。但因为高通透性膜透析器在有效清除中分子毒素的同时也可能会导致白蛋白等生理必需物质的丢失,高通量透析器的选择还需根据患者情况个体化选择,并根据体表面积选择血滤器的膜面积,通常为1.6~2.2 m2。
此外,原则上后稀释HDF治疗时,由于产生血滤器/透析器内的血液浓缩,容易升高TMP,具有发生破膜风险;应选择能承受更大TMP,相对较短且膜面积较大的血滤器/透析器。前稀释HDF治疗时,应选择长度较长的血滤器/透析器,以达到更好的溶质清除效果。
临床医师要充分了解血滤器/透析器的特性,包括膜成分、消毒方式、膜面积、通量、溶质总转运系数(KoA)、超滤系数(Kuf)及生物不相容性等[81],并根据治疗目的、治疗模式及患者体表面积、血流速度等进行合理选择。
推荐意见38:建议每次透析净超滤总量不超过干体重的5%(D5)。推荐每次HDF治疗前稀释置换液量为30~50 L(B2b),后稀释置换液量为18~25 L(A1a)。
每次透析前根据患者既往透析过程中血压和透析前血压情况、机体容量状况以及透前实际体重,计算需要的净超滤量。建议每次透析净超滤总量不超过干体重的5%。存在严重水肿、急性肺水肿等情况时,超滤速度和总量可适当提高。根据总超滤量及预计治疗时间,设定超滤速度。同时在治疗中应密切监测血压变化,避免透析中低血压等并发症发生。
4项多中心、前瞻性随机对照研究(CONTRAST、TURKISH、ESHOL和French研究)2 793例维持性血液透析患者的个体汇总数据分析结果显示,每周3次、每次置换量>17.4~23 L后稀释HDF,才能较血液透析显著降低全因死亡和心血管病死亡风险[15]。2 293例接受后稀释的on-line HDF治疗、随访至少2年的维持性透析患者队列研究中,每周置换液剂量>56.8 L(32.7 L/m2)才能显著增加患者生存率[7]。基于1998—2001年欧洲DOPPS研究数据的2 165例维持性血液透析患者回顾性队列分析结果显示,每周3次、每次置换量15~25 L后稀释HDF较低通量血液透析显著降低全因死亡风险[14]。基于日本透析治疗学会肾脏数据注册数据库创建的5 000对患者的血液透析或前稀释on-line HDF倾向匹配队列,证实置换量>40 L/次的前稀释HDF患者的1年全因死亡率和心血管病死亡率均显著低于血液透析患者[39]。
《血液净化标准操作规程(2021版)》[42]中提出,根据滤器的超滤系数及血流速度,前稀释置换液量为血流量的50%~60%,建议前稀释HDF置换量30~50 L;后稀释置换液量为血流量的25%~30%,建议后稀释HDF置换量18~25 L。
推荐意见39:推荐至少每周1次HDF治疗(B2b),有条件建议每周3次(A1a)。
多项关于HDF治疗的随机对照研究是基于每周3次的治疗模式。381例65岁以上老年维持性血液透析患者前瞻性、开放标签随机对照试验(French研究)结果显示,每周3次HDF较高通量血液透析可以减少低血压及肌肉痉挛风险[6];906例维持性血液透析患者的ESHOL研究结果显示,每周3次HDF较高通量血液透析的全因死亡率减少30%,心血管事件死亡率减少33%,感染相关死亡率减少55%[5]。上述4项多中心、前瞻性随机对照研究患者的个体汇总数据分析也证实,每周3次每次充足置换量后稀释HDF可较血液透析显著降低全因死亡和心血管病死亡风险[15]。目前欧洲及日本已广泛开展每周3次on-line HDF治疗。目前我国由于医疗保险政策、透析机及经济因素等限制,较难开展每周3次HDF治疗。我国一项多中心回顾性队列研究中,根据HDF治疗频率分为每个月1次HDF、每周1次HDF以及单纯高通量血液透析,结果显示每周1次HDF较其他2组在病死率、营养状况、住院事件及住院人次等方面均有改善[8]。我国另一项纵向队列研究结果显示,多数患者每周接受1次HDF,与血液透析的校正死亡风险比为0.85(95%CI:0.71~1.03),提示HDF在中国具有临床益处[82]。因此,建议根据实际情况至少每周2次血液透析治疗结合1次HDF治疗。
推荐意见40:单次HDF治疗时间≥4 h。(A1b)
HDF治疗时间通常为4 h[4]。French研究平均HDF治疗时间为3.91~3.98 h[6];ESHOL研究的HDF时间为234.3~236.6 min[5];CONTRAST研究的HDF治疗时间为3.77~3.81 h[3]。因此推荐将HDF单次治疗时间设定为4 h。
推荐意见41:推荐需结合患者的病情、技术设备的可及性及医疗保险政策等多种因素进行综合考虑选择前稀释或后稀释模式(D5);推荐满足血流量≥300 ml/min结合红细胞比容≤35%的接受HDF治疗患者选择后稀释HDF治疗模式(A1a);建议血流量≤250 ml/min或红细胞比容>35%的接受HDF治疗患者选择前稀释HDF治疗模式(B2b);血流量250~300 ml/min患者结合红细胞比容,选择后稀释或依据病情需求选择治疗模式(D5)。
如前所述,后稀释置换液量为血流量的25%~30%,建议后稀释HDF置换量18~25 L。后稀释HDF治疗时不同血流量对应的超滤量见表3。因此,为达到有效的置换剂量,采用滤过分数25%需要血流量≥300 ml/min,采用滤过分数30%需要血流量≥250 ml/min。
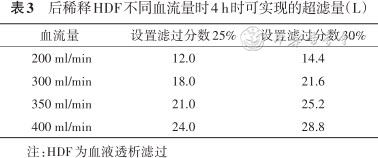
后稀释HDF不同血流量时4 h时可实现的超滤量(L)
后稀释HDF不同血流量时4 h时可实现的超滤量(L)
| 血流量 | 设置滤过分数25% | 设置滤过分数30% |
|---|---|---|
| 200 ml/min | 12.0 | 14.4 |
| 300 ml/min | 18.0 | 21.6 |
| 350 ml/min | 21.0 | 25.2 |
| 400 ml/min | 24.0 | 28.8 |
注:HDF为血液透析滤过
前瞻性、开放、随机交叉对照试验结果显示,小分子溶质清除率受血流量的影响更明显,当血流量增加至500~600 ml/min时,小分子溶质清除率仍逐步增加,但中大分子溶质的清除率在血流量超过250 ml/min后不再增加[79]。欧盟药品监督管理局on-line HDF共识会议报告认为,HDF最适合的血流速度为350~450 ml/min[80]。ESHOL研究中HDF血流量为379~398 ml/min[5],而CONTRAST研究中HDF使用的血流量为312~352 ml/min[3]。
推荐意见42:HDF常采用透析液流速为500~800 ml/min(A1a);透析液温度常设定为36.5 ℃,对于反复发生透析中低血压患者可尝试进行低温透析(A1a),合并发热的患者可进行低温透析(A1b)。
前瞻性、开放、随机交叉对照试验结果显示,透析液流量从500 ml/min增加至800 ml/min,小分子溶质的清除率逐步增加,但中大分子溶质清除率无明显变化[79]。ESHOL研究中HDF透析液流速为541~590 ml/min[5]。2 293例至少随访2年的on-line HDF患者的回顾性队列研究中,HDF透析液流速为(506.1±53.6)ml/min[7]。
26项随机对照试验484例维持性血液透析患者的荟萃分析结果显示,与标准温度透析(透析液温度36~37.5 ℃)相比,低温透析(透析液温度34.0~35.5 ℃)的透析内低血压发生率降低了70%(95%CI:49%~89%),透析治疗时的平均动脉压提高了12 mmHg(95%CI:8~16 mmHg);对透析充分性的影响没有明显差异[83]。但是,97个中心15 413例维持性血液透析患者的实用、双臂、平行组、基于注册、开放标签、集群随机、优越性试验结果显示,与标准温度(36.4 ℃)组比较,低温透析液(平均透析液温度35.8 ℃)组的心血管相关死亡或因心肌梗死、缺血性卒中或充血性心力衰竭入院的发生率无明显差别[22.4%比21.4%,校正相对危险度(aRR)=1.00,96%CI:0.89~1.10],透析治疗期间平均收缩压下降值无明显差别(27.1比26.6 mmHg,MD=-0.5 mmHg,99%CI:-1.4~0.4)[84]。因此,对于反复发生透析中低血压的患者可尝试进行低温透析(透析液温度<35.5 ℃)。
10例血液透析患者随机交叉研究结果显示,常规透析液温度(37 ℃)可增加人体储热量导致核心体温升高0.4 ℃,而低温透析液(35 ℃)可阻止人体储热量和核心温度的升高[85]。因此,对于合并发热的患者可进行低温透析。
推荐意见43:建议HDF处方设置按以下指标进行质量控制。(D5)
1. HDF有效剂量达标率:HDF每次治疗前稀释置换液量为30~50 L或后稀释置换液量为18~25 L患者占接受HDF治疗患者的比例。
2. 每周3次HDF治疗率:每周3次HDF治疗患者占接受HDF治疗患者的比例。
3. 透析间期体重增长控制率:透析间期体重增长<5%的患者占接受HDF治疗患者的比例。
推荐意见44:与血液透析比较,HDF不增加感染风险(A1a);但推荐在HDF治疗时必须使用超纯透析液,治疗过程中严格无菌操作,以减少感染风险(D5)。
714例维持性血液透析患者的多中心、前瞻性、随机对照试验(CONTRAST研究)中,平均3.03年随访期间,低通量血液透析与on-line HDF组间感染事件发生率无明显差异[3]。782例维持性血液透析患者的多中心、前瞻性、随机对照试验(TURKISH研究)中,平均随访22.7个月期间,on-line HDF组和高通量血液透析组间患者感染相关死亡率无明显差别[4]。405例维持性血液透析患者的随机对照试验中,3年随访结果显示,血液透析患者的C反应蛋白和IL-6浓度升高,而HDF患者保持稳定;调整基线变量后2组间的变化率存在显著差异(C反应蛋白差异20%/年,IL-6差异16%/年),提示与血液透析相比,使用超纯透析液的长期HDF可随时间推移降低炎症水平[27]。906例维持性血液透析患者多中心、开放标签、随机对照试验结果显示,与继续进行血液透析患者比较,接受on-line HDF患者的感染相关死亡率降低55%(HR=0.45,95%CI:0.21~0.96)[5]。
HDF患者的感染主要原因包括:血管通路感染、上下机无菌操作以及置换液和透析液的生物污染等。因此,应建议定期监测透析液、置换液的细菌和内毒素,定期更换内毒素过滤器;监测血管通路状态,HDF治疗过程中严格无菌操作,以减少感染风险。
推荐意见45:对于HDF治疗中或治疗后出现发热的患者,建议同时做血液、血管通路、置换液和透析液的细菌培养,检测置换液和透析液内毒素;如确诊感染应给予抗感染治疗。(D5)
对于在HDF治疗中和治疗后出现发热且其他原因不能解释的患者,应同时做血液、血管通路、置换液和透析液的细菌培养,并检测置换液和透析液内毒素;明确感染病因,并立即给予抗感染治疗。
寻找体外循环发生凝血的原因是预防再次发生及调整抗凝剂用量的重要依据。HDF治疗时发生体外循环凝血的常见原因包括以下几方面。
1. 后稀释HDF超滤率过高:大部分HDF治疗采用后稀释HDF。后稀释HDF时如果超滤率过高会导致血滤器/透析器的血液室中血细胞比容和血清蛋白浓度显著增加,引起血液黏度和跨膜压升高,导致蛋白质沉积在膜表面,降低膜对液体和溶质的通透性;这些因素将超滤速率限制在血液流速的30%左右[86]。
2. 血流速度过慢:血流速度过慢或血流中断时凝血的可能性增加。因此,使用HDF时需建立可靠的血管通路,保证足够的血流量。
3. 抗凝剂用量不足:HDF需要的抗凝剂用量往往高于HD,后稀释on-line HDF患者的抗凝药剂量(普通肝素或低分子量肝素)比血液透析患者高10%~20%[87]。13例维持性HDF患者随机交叉试验证实,最有效的低分子肝素使用方式是在透析管路出口注射低分子量肝素[76]。
4. 其他:①血液黏滞度增加:存在血红蛋白过高、冷球蛋白血症、单克隆丙种球蛋白血症等高黏滞状态;②透析中输注血液、血制品或脂肪乳剂;③透析血管通路再循环过大;④各种原因引起动静脉壶气泡增多、液面过高。
推荐意见46:HDF治疗时应避免后稀释输注超滤率过高、血流速度过慢,合理选择和应用抗凝剂。(D5)
避免后稀释输注超滤率过高、避免血液速度过慢、及时调整抗凝剂剂量是预防HDF治疗时凝血的关键。其他预防方法包括:治疗前全面评估患者凝血状态,选择合适的抗凝剂及其剂量;加强透析中凝血状况的监测,及时调整抗凝剂剂量;尽可能避免透析中输注血液、血制品和脂肪乳等引起体外循环凝血的危险因素。
推荐意见47:发生轻度凝血可以追加抗凝剂用量,调高血流速度;发生重度凝血需立即回血,更换透析器/滤器和管路。(D5)
发生轻度凝血常可通过追加抗凝剂用量,调高血流速度来解决。在治疗中应严密监测患者体外循环凝血情况,一旦凝血程度加重,应立即回血,更换透析器/滤器和透析管路。
发生重度凝血常需立即回血。如因凝血程度重而不能回血,则建议直接丢弃透析管路和透析器/滤器,不主张强行回血,以免凝血块进入体内发生栓塞事件。
推荐意见48:接受HDF治疗患者应纠正低钙血症等电解质紊乱,避免HDF治疗过程中超滤率过快,预防低血压,防治肌肉痉挛;对于反复发生肌肉痉挛的患者,建议使用1.5 mmol/L钙浓度或短期使用高钙(1.75 mmol/L)透析液。(D5)
HDF治疗过程中血清离子钙下降幅度较大,是发生肌肉痉挛最常见的原因。HDF治疗过程中,第1个小时离子钙下降幅度较大,因此对潜在的低钙血症的耐受性较差[88],故肌肉痉挛多见于每次治疗的中后期。其他常见原因包括低钾血症、低镁血症、透析中低血压、低血容量、超滤速度过快及应用低钠透析液治疗等。
因此,对于低钙血症患者HDF治疗过程中应避免起始超滤率过快,建议采用1.5 mmol/L钙浓度或短期使用高钙(1.75 mmol/L)透析液;并注意防治低钾血症、低钠血症、低镁血症,有效控制贫血和低蛋白血症;调整降压药物使用,预防透析相关低血压或肌肉痉挛的发生。
HDF治疗时使用血滤器或高通量透析器,其透析器反应临床分为两类:A型反应(过敏反应型)和 B型反应。我国透析器反应发生率约2.11%[89]。
推荐意见49:发生A型透析器反应,应立即紧急处理,并寻找原因,采取预防措施避免再次发生。(D5)
A型透析器反应主要发病机制为快速的变态反应;常于透析开始后5 min内发生,少数迟至透析开始后30 min,发生率<5次/10 000透析例次。依据反应轻重可表现为皮肤瘙痒、荨麻疹、咳嗽、喷嚏、流清涕、腹痛、腹泻,甚至呼吸困难、休克、死亡等。
(1)紧急处理:①立即停止透析,夹闭血路管,丢弃管路和透析器中血液;②给予抗组胺药、糖皮质激素或肾上腺素治疗;③如出现呼吸循环障碍,立即给予心脏呼吸支持治疗。
(2)明确病因:主要是患者对与血液接触的体外循环管路、透析膜等发生变态反应所致,可能的致病因素包括透析膜材料、管路和透析器的消毒剂(如环氧乙烷)、透析器复用的消毒液、透析液受污染、肝素过敏等。另外,有过敏病史及高嗜酸细胞血症、血管紧张素转化酶抑制剂(ACEI)应用者,也易出现A型反应。
(3)预防措施:①透析前充分冲洗透析器和血路管;②选用蒸汽或γ射线消毒透析器和血路管;③复用透析器;④对于高危人群可于透析前应用抗组胺药物,并停用ACEI类药物。
推荐意见50:发生B型透析器反应,应首先排除心血管疾病,并寻找诱因,对症治疗,采取预防措施避免再次发生。(D5)
B型反应发病机制多认为是补体激活所致,与使用新的血滤器/透析器和(或)生物相容性差的血滤器/透析器相关。常于透析开始后20~60 min出现,其发作程度常较轻,多表现为胸痛和背痛。
(1)明确病因:HDF治疗过程中出现胸痛和背痛,首先应排除心血管疾病(如心绞痛、心包炎等),然后再考虑B型透析器反应,并寻找可能的诱因。
(2)处理:B型透析器反应多较轻,给予鼻导管吸氧及对症处理即可,常无需终止HDF治疗。
(3)预防:复用透析器或选择生物相容性好的血滤器/透析器可预防部分B型透析器反应。
推荐意见51:建议对接受HDF治疗的患者每3~6个月进行营养状态评估,并加强营养治疗。(D5)
HDF时使用血滤器或高通量透析器,可引起白蛋白丢失,并增加可溶性维生素、微量元素和小分子多肽等物质的丢失。但是,HDF营养状况方面的数据有限且结论不一致[90]。虽然随机试验显示HDF不会影响白蛋白水平和体重[4, 5,27],但可引起标准化蛋白分解代谢率增加[5]。
1. 营养状态评估:(1)临床调查:病史、体格检查、社会心理调查等;(2)饮食评估:传统采用三日饮食记录法,记录每日摄入食物种类和量;(3)人体测量:包括无水肿体重、体质指数、肱三头肌皮褶厚度和上臂肌围、人体成分测定等;(4)生化指标:包括血清白蛋白、透析前后的尿素氮、前白蛋白、转铁蛋白、血脂,有条件时可测定胰岛素样生长因子-1;(5)主观综合性评估:应用主观综合营养评估(SGA)及营养不良炎症评分法(MIS)进行评价。
2. 营养状态监测:建议每3~6个月1次评估患者的营养状态。
3. 营养治疗:目前关于HDF耗损综合征治疗的证据有限,参考2020年美国国家肾脏基金会肾病预后质量倡议(KDOQI)指南[91]、改善全球肾脏病预后组织(KDIGO)指南[92]、中国慢性肾脏病营养治疗临床实践指南[93],建议HDF患者蛋白质摄入量为1.0~1.2 g·kg-1·d-1。国内5个随机对照试验273例终末期肾病患者的系统综述和荟萃分析结果显示,低蛋白质饮食并补充复方α酮酸制剂0.12 g·kg-1·d-1可以改善患者营养状态[94]。
推荐意见52:建议HDF相关并发症防治按以下指标进行质量控制。(D5)
1. HDF治疗过程中急性并发症发生率:单位时间内,发生急性并发症(感染、体外循环凝血、肌肉痉挛及血滤器/透析器反应等)的HDF治疗患者占接受HDF治疗患者的比例。
2. HDF患者营养状态评估完成率:每3~6个月完成营养状态评估HDF患者占接受HDF治疗患者比例。
众多循证医学证据证实,与血液透析比较,HDF具有血流动力学稳定、降低透析期间低血压发生率和心血管病死亡率、提高β2-微球蛋白等中大分子尿毒症毒素清除率和透析充分性等特点。2023年6月发表在《新英格兰医学杂志》的1 360例接受高通量血液透析治疗3个月以上患者的国际多中心、前瞻性、随机对照试验结果也进一步证实,中位随访30个月期间,与继续进行高通量血液透析患者比较,更改为HDF(每周3次,每次≥4 h,每次置换液剂量25.3 L)患者的全因死亡率(HR=0.77,95%CI:0.65~0.93)、非心血管疾病死亡率(HR=0.76,95%CI:0.59~0.98)和包括新型冠状病毒感染的相关死亡率(HR=0.69,95%CI:0.49~0.96)显著降低[95]。on-line HDF被认为是最先进和最适合的临床肾脏替代治疗模式,临床应用日益增多。但是,on-line HDF治疗还存在许多亟待解决的科学问题,包括on-line HDF能够清除哪些尿毒症毒素?清除的尿毒症毒素对患者的贫血、CKD-MBD以及心血管并发症等具有什么病理生理效应?on-line HDF治疗的适合人群与启动时机?适合on-line HDF治疗患者的营养治疗方案等,迫切需要开展相关临床基础研究和循证医学研究。
此外,基于中国患者的on-line HDF的循证医学证据明显不足,特别是每周1次的on-line HDF治疗可否使中国患者获得生存获益也亟待阐明。另外,我国各地区on-line HDF应用差距明显,医疗质量控制刚刚起步,也迫切需要加强on-line HDF治疗的医疗质量控制研究。
希望本指南不仅对规范on-line HDF治疗和提高医疗质量提供指导,也为我国开展on-line HDF的临床循证医学研究提供借鉴和帮助。同时,希望我国血液净化医务工作者积累真实世界的on-line HDF治疗经验以及循证医学证据,为指南更新提供证据支持,也为众多尿毒症患者提供更好的医疗服务。
指南制订组组长:陈香美(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
执笔专家组
组长:陈香美(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
主要成员:孙雪峰(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心);陈晓农(上海交通大学医学院附属瑞金医院肾脏内科);林洪丽(大连医科大学附属第一医院肾内科);倪兆慧(上海交通大学医学院附属仁济医院肾内科);李冀军(解放军总医院第四医学中心肾内科);叶朝阳(上海中医药大学附属曙光医院肾病科);蔡广研(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
讨论专家组(按姓氏笔画排序):丁小强(复旦大学附属中山医院肾内科);马志芳(解放军总医院肾脏病医学部血液净化科);王荣(山东省立医院肾病内科);付平(四川大学华西医院肾内科);朱晗玉(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心);伦立德(空军特色医学中心风湿肾病科);刘文虎(首都医科大学附属北京友谊医院肾病内科);刘书馨(大连市中心医院肾内科);刘维萍(秦皇岛市第一医院肾脏内科);孙世仁(空军军医大学第一附属医院肾内科);李文歌(中日友好医院肾内科);李芳(解放军第二一一医院肾内科);李明旭(解放军总医院第六医学中心肾脏病科);邵凤民(河南省人民医院肾内科);杨琼琼(中山大学孙逸仙纪念医院肾内科);何娅妮(陆军军医大学第一附属医院肾内科);汪年松(上海市第六人民医院肾内科);张建荣(解放军总医院第三医学中心肾脏科);陈意志(解放军总医院海南医院肾脏病科);郭志勇(海军军医大学第一附属医院肾内科);涂晓文(火箭军特色医学中心肾病内科);曹宁(北部战区总医院血液净化科);蒋红利(西安交通大学第一附属医院血液净化科);蒋更如(上海交通大学医学院附属新华医院肾脏风湿免疫科);蔡广研(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
工作组
组长:孙雪峰(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
主要成员(按姓氏笔画排序):王远大、王涌、王宏、王聪慧、冯哲、李平、汤力(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心);陈晓农(上海交通大学医学院附属瑞金医院肾脏内科);周建辉、赵德龙、曹雪莹、董哲毅(解放军总医院肾脏病医学部 国家肾病学专业医疗质量管理与控制中心 肾脏疾病全国重点实验室 国家慢性肾病临床医学研究中心)
中国医师协会肾脏内科医师分会血液透析滤过质控指南工作组. 血液透析滤过质量控制临床实践指南[J]. 中华医学杂志, 2024, 104(8): 571-593. DOI: 10.3760/cma.j.cn112137-20231212-01361.
所有作者声明不存在利益冲突




























《中华医学杂志》2024年第104卷第8期《血液透析滤过质量控制临床实践指南》一文,第578页第1段“商品化置换液一般参考静脉输液标准:内毒素<0.03活性单位(EU)/ml且细菌数<1×106菌落形成单位(CFU)/ml”应为“商品化置换液一般参考静脉输液标准:内毒素<0.03活性单位(EU)/ml且细菌数<1×10-6菌落形成单位(CFU)/ml”。特此更正。更正的同时表示歉意!