
慢性肾脏病是一个全球性公共卫生问题,疾病负担重。肾移植作为一种肾脏替代疗法,与透析相比,具有更高的远期生存率及生活质量。抗体介导的排斥反应(antibody-mediated rejection,AMR)是肾移植后的重要并发症,目前其核心治疗为类固醇激素、血浆置换及免疫球蛋白,而抗CD20抗体、硼替佐米等新型治疗药物的有效性仍存在争议。但在这些联合治疗下,AMR仍是移植物丢失的主要原因,寻找新的有效治疗手段迫在眉睫。白细胞介素-6(interleukin-6,IL-6)是一种重要的细胞因子,参与调节炎症以及T细胞和B细胞的发育、成熟和活化。托珠单抗和克拉扎珠单抗是靶向IL-6的药物,是目前AMR预防和治疗中研究最多的药物之一,也是高致敏肾移植受体脱敏治疗的可选择药物之一。本文现就IL-6在AMR中的应用做一综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中国慢性病及其危险因素监测(China Chronic Disease and Risk Factor Surveillance,CCDRFS)发布的第六次调查报告显示,我国慢性肾脏病(chronic kidney disease,CKD)的加权患病率为8.2%,疾病所致经济负担重。即使采取各种防治措施,仍会有一定比例CKD患者进入终末期肾病(end-stage renal disease,ESRD),而ESRD的有效治疗方法是肾脏替代治疗[1]。具体包括血液透析、腹膜透析以及同种异体肾移植术。相较于透析治疗,肾移植受者在生存率、生活质量以及治疗费用上更占优势。
目前临床上普遍应用的免疫抑制方案的主要机制是抑制T细胞介导的排斥反应(T cell-mediated rejection,TCMR),使移植物获得了良好的短期存活率。尽管如此,在发现抗体介导的排斥反应(antibody-mediated rejection,AMR)之前,移植物的长期生存率并没有提高[2]。慢性AMR是移植物丢失的最常见原因,但其治疗方案仍存在局限[3]。因此,寻找有效治疗AMR的治疗手段迫在眉睫。
白细胞介素-6(interleukin-6,IL-6)作为一种参与炎症调节和免疫细胞分化的关键性细胞因子,是一个非常有前景的治疗靶点。目前,靶向IL-6/IL-6受体在类风湿性关节炎中的应用价值已被证实[4,5]。近期的一项研究显示,抗IL-6受体抗体可用于治疗移植物抗宿主病和同种异体移植物排斥反应[6]。本文现就靶向IL-6治疗在AMR中的应用做一综述。
AMR是由抗体、补体等多种体液免疫效应因子参与所致的排斥反应免疫损伤[6];其特征是急性或慢性移植物微循环炎症,主要表现为肾小球炎和管周毛细血管炎,管周毛细血管内C4d沉积及存在的循环供体特异性抗HLA抗体(donor-specific antibody,DSA),最终导致移植物功能障碍甚至失功[7]。
AMR的抗体来源分为移植前预存和移植后新生。其中,移植前的预存抗体主要因输血、妊娠或移植等原因形成,而移植后新生抗体主要是移植术后移植物内的移植抗原刺激受者免疫系统B细胞产生的抗供者移植抗原抗体。预存抗体可在移植术后与移植物内的移植抗原结合后激活补体,释放缓激肽等多种血管活性物质,损伤移植物的血管内皮细胞,形成动脉内膜炎、血栓,最终导致移植物缺血坏死。而新生抗体不仅可通过激活补体,释放C3a、C5a等过敏毒素,破坏周围组织,形成血栓、血管炎导致器官出现缺血性损伤,还能通过抗体依赖细胞介导的细胞毒作用,直接与抗原表位结合,激活效应细胞发生一系列反应,损伤移植物[7,8,9]。
目前,临床上针对AMR尚无有效的标准化多模式治疗,其核心治疗主要围绕去除抗体及预防抗体生成。去除抗体治疗主要包括免疫球蛋白(immunoglobulin,IVIG)、血浆置换和免疫吸附等;而类固醇激素、抗CD20抗体、硼替佐米(Bortezomib)等则可预防抗体生成。但抗CD20抗体、硼替佐米虽已被用于治疗AMR,但其治疗有效性仍存在争议[10]。
理论上,抗CD20抗体可通过减少B细胞减少抗体生成,但在Bailly等[11]进行的一项多中心、双盲随机对照试验中,纳入了38例肾移植术后第1年出现AMR的受者,所有受者均接受血浆置换、静脉注射免疫球蛋白和皮质类固醇治疗,其中11例接受安慰剂治疗(安慰剂组),另27例至少输注1次利妥昔单抗(抗CD20制剂,利妥昔单抗组);治疗后5年,两组受者供体特异性抗HLA抗体的平均荧光强度(mean fluorescence intensity,MFI)比较,差异没有统计学意义;治疗后7年,安慰剂组和利妥昔单抗组经死亡删失后的移植肾存活率(55%比44%)和肾功能比较,差异亦没有统计学意义。硼替佐米是一种蛋白酶体抑制剂,可消除体内成熟浆细胞,降低致敏受者血清DSA水平,目前在AMR中仅有小样本的病例报道。Cheng等[12]在预致敏肾移植大鼠的动物模型中使用硼替佐米,结果发现大鼠外周血和移植肾中B细胞和浆细胞数量减少、DSA水平降低,移植后管周毛细血管和肾小球炎症均减轻。但在Eskandary等[13]一项关于硼替佐米的随机对照试验中,接受硼替佐米与安慰剂治疗的移植物存活率比较,差异无统计学意义。因此,尽管有小样本研究显示利妥昔单抗和硼替佐米对于AMR具有一定疗效[10,14,15,16],研究者对于利妥昔单抗、硼替佐米等治疗AMR的有效性仍有疑虑,仍需探索新的治疗药物。
IL-6是一种由184个氨基酸组成的多效性细胞因子,是免疫和病理生理过程中的主要调节因子,涉及多个器官和细胞系统,包括先天免疫、适应性免疫、造血、细胞凋亡和细胞代谢,能够调节粒细胞数量、促进T细胞群体扩张和活化、B细胞分化以及急性期反应调节,影响抗体产生和自身免疫。
IL-6是炎症起始阶段的重要致炎因子,可以通过直接和间接作用诱导炎症部位的中性粒细胞、单核细胞、淋巴细胞等的生成、募集、趋化和凋亡,以及调节多种急性期蛋白的生成、聚集,如抑制中性粒细胞活化趋化因子(如CXCL-1等)的表达和调节凋亡调节因子(如BCL-2等)、C反应蛋白、补体C3以及黏附分子等的表达,发挥其炎症促进作用[17,18,19]。
幼稚T细胞在分化为各种不同表型的过程中,会受到组织微环境、共刺激分子及抗原刺激与抗原呈递细胞的相互作用影响。其中,抗原特异性启动过程中的细胞因子环境,是影响幼稚T细胞向不同辅助性T细胞(helper T cells,Th)谱系转化的关键因素。而IL-6在T淋巴细胞的谱系转化中起到了重要调节作用,其控制T淋巴细胞的增殖、存活和承诺,并调节其效应细胞因子产生,在维持T淋巴细胞反应中起支持作用(如控制Th1或Th2的增殖和存活),并对促进某些亚群发育[如Th17和滤泡辅助性T细胞(follicular helper T cell,TfH)亚群]或抑制某些亚群发育[如调节性T细胞(regulatory T cell,Treg)]至关重要。
IL-6是幼稚T细胞增殖的关键刺激物,其与IL-4、IL-11等细胞因子共同诱导Th2,激活幼稚CD4+T细胞中IL-4的转录,并通过上调细胞因子信号转导抑制因子1表达干扰干扰素-γ信号传导,诱导幼稚T淋巴细胞向Th2分化[20]。
转化生长因子-β(transforming growth factor β,TGF-β)是平衡Th17和外周调节性T细胞(pTreg)分化所必需的细胞因子之一,其在稳定状态下主要诱导Treg细胞分化,抑制Th17细胞分化。然而,IL-6可抑制TGF-β诱导的Treg细胞分化并阻止Th17细胞转化为Treg细胞,在pTreg和Th17细胞生成中发挥关键性作用[21,22]。此外,IL-6还可以通过增强IL-2和受体CD122、CD25表达,扩增效应、记忆性CD8+T细胞群[23]。
IL-6最初被称为B淋巴细胞生长因子,可诱导浆细胞分化,控制B淋巴细胞和浆母细胞的存活、增殖和成熟。抗体在IL-6与其他细胞因子联合作用下才能正常产生(图1),IL-6还可增强抗体的产生[24]。同时,IL-6也是生发中心形成所必需的细胞因子之一[25]。
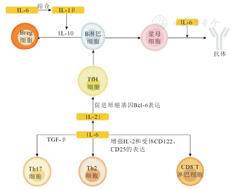

注:Breg细胞为调节性B细胞;TfH细胞为滤胞辅助性T细胞;Th17细胞为辅助性T细胞17;Th2细胞为辅助性T细胞2;IL-6为白细胞介素-6;IL-1B为白细胞介素-1B;IL-10为白细胞介素-10;TGF-β为转化生长因子-β;IL-2为白细胞介素-2
TfH是CD4+T细胞的一个特殊亚群,可促进B淋巴细胞增殖和免疫球蛋白类转换,为B淋巴细胞的同种型转换提供帮助,而诱导型T细胞共刺激因子(inducible co-stimulator,ICOS)是树突状细胞介导的启动TfH细胞分化所必需的刺激因子[26]。T细胞在IL-6的作用下可增强ICOS的表达,通过诱导转录抑制因子Bcl-6和促进IL-21活性促进幼稚T细胞产生Tfh细胞,促进B淋巴细胞分化为浆母细胞[27]。
IL-6在促进急性和慢性同种异体肾移植排斥反应中的作用是公认。IL-6可以诱导活化的B细胞分化为浆细胞,促进抗体生成;还可以诱导初始CD4+T细胞特异性分化为Th2细胞亚群,而Th2可分泌IL-10,促进B细胞活化、产生抗体;通过与TGF-β结合,IL-6还可诱导幼稚CD4+T细胞优先分化为Th17,而Th17产生的IL-17可以动员、募集及活化中性粒细胞,从而导致炎症的产生;此外,IL-6还可刺激单核/巨噬细胞以及上皮细胞、内皮细胞、成纤维细胞等,产生包括IL-6、IL-8、粒细胞-巨噬细胞集落刺激因子和细胞黏附分子1等促炎细胞因子,从而产生正反馈回路[28]。IL-6/IL-6受体信号通过以上适应性细胞和体液免疫直接或间接参与AMR、移植物炎症激活和缺血再灌注损伤,最终造成同种异体移植物损伤。
鉴于IL-6在炎症介导和免疫调节途径中的重要性,越来越多的研究将IL-6与同种异体移植物损伤联系起来。Wang等[29]对移植小鼠组织进行活检,发现IL-6在排斥反应期间表达升高,最常见于肾小管细胞,且其完全抑制了TGF-β诱导表达的Treg细胞。而Treg细胞在过去的实验模型中已被证明可以预防移植排斥反应并保持免疫耐受性[30]。提示IL-6在介导慢性移植物排斥反应中具有潜在作用。
过往的临床研究显示,在肾移植受者早期肾缺血再灌注过程中,IL-6会从肾脏局部大量释放[31];发生排斥反应时,受者血清、尿液和活检组织的IL-6升高,其水平与炎症细胞浸润程度相关[32]。另有研究显示,血清IL-6水平较高受者存在肾排斥反应,IL-6水平不高受者移植物长期存活且没有排斥反应,也佐证了IL-6在AMR中的作用[33]。
鉴于IL-6的重要作用,研究者对研制干扰功能失调的IL-6/IL-6受体信号传导的新药展开了很多的研究,包括阻断IL-6及其受体或细胞内转录因子等的药物。目前已被批准用于临床或正在开发的药物包括靶向IL-6的药物(克拉扎珠单抗、奥洛珠单抗等)和靶向IL-6受体的药物(托珠单抗、沙利鲁单抗)等。在肾移植受者AMR的脱敏、预防或治疗中,研究最多的药物为托珠单抗和克拉扎珠单抗。
托珠单抗是一款免疫球蛋白IgG1亚型的重组人源化抗IL-6受体单克隆抗体,可以阻断IL-6与IL-6受体(sIL-6R)的相互作用,通过减少炎症、降低抗体滴度以及靶向免疫反应来减少AMR的产生。托珠单抗最初被批准用于治疗类风湿性关节炎和全身型幼年特发性关节炎,后被用于其他适应证,包括系统性红斑狼疮[34]、巨细胞动脉炎[35]和高度复发的视神经脊髓炎谱系障碍[36]。还有研究将托珠单抗应用于新型冠状病毒危重患者的预防和治疗[37]。
托珠单抗在AMR中最早的研究之一是Vo等[38]在2015年进行的一项单中心Ⅰ/Ⅱ期探索性研究,该研究纳入了10例HLA致敏后用IVIG+利妥昔单抗+/-血浆置换脱敏失败的等待肾移植受者,对其进行IVIG+托珠单抗联合治疗。其中5例在治疗后顺利接受了移植,此5例在接受治疗后不仅DSA数量和强度均有所减少,脾脏和骨髓中产生抗体的浆细胞亦显著减少;术后6个月时对移植物进行病理活检,均未发现AMR,证明托珠单抗用于预防AMR具有可行性。此项研究中,受者最常见的不良反应是感染及胃肠道反应,甚至有受者因出现憩室炎而退出实验[38]。
Cabezas等[39]对包括117例受试者的6项关于使用托珠单抗治疗AMR的研究进行了回顾,其中5项研究结果均显示托珠单抗可显著降低DSA水平;研究者在后续的移植肾活检中,还观察到移植肾炎症和微血管病变减少。其中5项的受试者肾功能稳定,仅1项研究观察到受者肾功能显著下降,但这项研究与历史标准治疗组(即IVIG+利妥昔单抗)比较,差异无统计学意义;不良事件为轻至中度,最常见的不良反应是感染及低丙种球蛋白血症,而此类副作用在接受标准治疗受者中也很常见。因此认为,托珠单抗可以作为AMR一线治疗或标准治疗失败后的备用疗法。
克拉扎珠单抗是一种抗IL-6单克隆抗体,对IL-6具有高亲和力,可与人IL-6高效结合,目前已广泛应用于类风湿性关节炎[40]、银屑病关节炎[41]和新型冠状病毒感染重症[42]患者的治疗。
一项单中心临床试验中纳入了20例高度HLA致敏的肾移植等待者,他们每月接受6剂克拉扎珠单抗脱敏治疗;在此后的随访中,等待者的HLA Ⅰ类和Ⅱ类抗体的MFI显著降低,且DSA水平未出现反弹[43]。最终20例肾移植等待者中有18例接受了肾移植,没有新生DSA生成,受者和移植物在术后12个月时的存活率分别为100%和94%[43]。移植后6~12个月,受者Treg、调节性B细胞显著增加,表明克拉扎珠单抗可促进CD4+T细胞向Treg细胞分化,改变T、B淋巴细胞表型,从而通过减少炎症反应、增强免疫耐受来减少移植物损伤。另一项单中心随机对照试验中纳入了20例DSA阳性的儿童移植受者,行克拉扎珠单抗治疗后,受者DSA显著降低,肾小球滤过率下降斜率改善,其中18例在术后1年时接受了移植肾活检,7例(38.9%)的分子AMR评分为阴性,5例(27.8%)C4d内凹消失,4例(22.2%)的形态学AMR活性消失,提示克拉扎珠单抗可能对减缓AMR进展有潜在帮助[44]。在上述克拉扎珠单抗研究中,有受者出现严重感染事件、少数发展为强直性脊柱炎,说明其安全性仍需进行监测。
综上所述,CKD是一项全球性的公共卫生问题,只有肾移植可明显改善受者生活质量及远期生存率。AMR是肾移植后移植物丢失的主要原因,但目前总体治疗效果不甚理想。细胞因子被认为是炎症和免疫疾病的重要介质,IL-6在体液免疫和细胞免疫中起到了重要的调节作用,与T、B淋巴细胞的分化密切相关,参与实体器官移植后细胞和AMR相关的免疫反应。研究显示,阻断IL-6/IL-6受体信号传导可有效减轻T、B淋巴细胞对移植物的反应,抑制炎症级联反应[45]。在一些研究中,IL-6抗体似乎可以降低DSA水平,减少肾炎症和微血管病变,对肾功能有保护作用,可作为急性和慢性AMR核心治疗的潜在替代方案[38,39,43,44]。然而,目前针对靶向IL-6/IL-6受体在AMR中的应用还局限于个别病例及小样本的随机对照试验,其在肾移植受者中的不良反应、安全性仍需长期、大样本、规范的随机对照试验来探索。
所有作者声明无利益冲突




























本文第762页左栏第一自然段中“另一项单中心随机对照试验中纳入了20例DSA阳性的儿童移植受者,行克拉扎珠单抗治疗后,受者DSA显著降低,肾小球滤过率下降斜率改善,其中18例在术后1年时接受了移植肾活检,7例(38.9%)的分子AMR评分为阴性,5例(27.8%) C4d内凹消失,4例(22.2%)的形态学AMR活性消失,提示克拉扎珠单抗可能对减缓AMR进展有潜在帮助[44]。” 一句应为“另一项单中心随机对照试验中纳入了20 例DSA阳性的AMR成人肾移植受者,经克拉扎珠单抗治疗后,受者DSA显著降低,肾小球滤过率下降斜率显著改善;其中18例在术后1年时接受了移植肾活检,7例(38.9%)分子形态学AMR评分为阴性,5例(27.8%)毛细血管C4d沉积物消失,4例(22.2%)形态学上由活动性AMR向非活动性转变,提示克拉扎珠单抗可能对减缓AMR进展有潜在帮助[44]。”更正的同时表示歉意!