
在类中性粒细胞模型中,探讨尿激酶型纤溶酶原激活物受体(PLAUR)基因对中性粒细胞活化及凋亡的影响。
采用体外培养的人急性髓系粒细胞白血病细胞株HL60作为研究对象,全反式维甲酸(ATRA)诱导HL60细胞分化为类中性粒细胞。构建干扰人PLAUR基因的慢病毒载体,转染入类中性粒细胞(siRNA组),并设置磷酸盐缓冲液(PBS)组(未转染)和空白对照(NC组,转染空白质粒)作为对照(n=3)。饥饿培养、加入白细胞介素-17干预后,流式细胞术检测细胞膜CD11b表达,以及酶联免疫吸附法检测细胞培养液上清中髓过氧化物(MPO)、中性粒细胞胞外诱捕网(NETs)水平,了解类中性粒细胞活化情况。Annexin V/PI染色流式细胞术检测细胞凋亡,并用Western蛋白印迹法检测凋亡相关蛋白caspase-3、bax、bcl-2表达。
流式细胞术检测siRNA组HL60细胞细胞膜CD11b表达(32.37±8.17)较另两组下降(PBS组46.27±1.54,NC组53.07±8.14)(P<0.05)。siRNA组细胞培养液上清中MPO和NETs水平(33.37±1.11、57.69±3.03)也均较PBS组(41.64±2.20、77.60±4.33)和NC组(40.84±5.11、76.15±2.10)下降,差异均有统计学意义(均P<0.05)。流式细胞术检测siRNA组凋亡率(20.42%±2.45%)较PBS组(11.91%±2.23%)和NC组(11.13%±2.56%)升高(P<0.05)。siRNA组caspase-3和bax蛋白表达(0.84±0.05、0.83±0.04)较PBS组(0.68±0.02、0.63±0.08)和NC组(0.71±0.01、0.66±0.10)高,差异有统计学意义(P<0.05);抗凋亡蛋白bcl-2表达量减少(siRNA组:0.38±0.02,PBS组:0.73±0.05,NC组:0.69±0.06)(P<0.05)。
PLAUR可促进类中性粒细胞活化,抑制其凋亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人尿激酶型纤溶酶原激活物受体(plasminogen activator urokinase receptor,PLAUR)基因编码尿激酶纤溶酶原激活物受体(urokinase plasminogen activator receptor,uPAR)蛋白。生理条件下,PLAUR主要表达于中性粒细胞、单核细胞和巨噬细胞,在细胞活化、黏附、迁移和外渗等过程中发挥重要作用[1]。本研究前期收集皮肌炎相关间质性肺病(dermatomyositis associated interstitial lung disease,DM-ILD)患者和健康志愿者血液样本进行转录组测序及生物信息学分析,发现唯一差异基因PLAUR,该基因与中性粒细胞及中性粒细胞相关生物学过程有关[2]。基于此,本研究将体外培养的人急性髓系粒细胞白血病细胞株HL60作为研究对象,全反式维甲酸(all-trans retinoic acid,ATRA)诱导HL60细胞分化为类中性粒细胞。构建干扰人PLAUR基因的慢病毒载体,转染入类中性粒细胞,从而构建敲减PLAUR的类中性粒细胞模型,在体外确定PLAUR基因对中性粒细胞活化及凋亡的影响。
1.细胞:人急性髓系粒细胞白血病M3型细胞株HL60细胞(武汉Procell公司,货号:CL-0110)。
2.试剂:PLAUR抗体(美国Bioss公司,货号bs-1927R),β肌动蛋白(β-actin)抗体(美国Zenbio公司,货号200068-8F10),天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinyl aspartate-specific proteinase-3,caspase-3)抗体(货号:bsm-33284M)、bcl2关联X蛋白(bcl-associated X protein,bax)抗体(货号:bsm-33283M)、B细胞淋巴瘤基因2(B cell lymphoma 2,bcl-2)抗体(货号:bs-34012R)(美国Bioss公司);天根快速反转录试剂盒[FastQuant RT Kit(With gDNase)](北京天根公司,货号Cat#KR106-02);实时荧光定量聚合酶链反应(real time quantitative PCR,RT-qPCR)试剂盒2xSYBR(货号Lot#LT202301)、cDNA第一链合成试剂盒(货号Lot#YL203301)(武汉Servicebio公司);人髓过氧化物酶(myeloperoxidase,MPO)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒(中国睿信生物公司,货号RX103691H);中性粒细胞胞外诱捕网络(neutrophil extracellular traps,NETs)ELISA试剂盒(上海酶联公司,货号ml060524);CD11b抗体(美国Bioss公司,货号bs-1014R);山羊抗兔IgG(Alexa Fluor 488)(英国Abcam公司,货号ab150077);膜联蛋白-V(Annexin V)/碘化丙啶(propidium iodide,PI)双染细胞凋亡检测试剂盒(凯基生物公司,货号KGAV114)。
1.ATRA诱导HL60细胞:选用含10%胎牛血清的RPMI 1640培养基,在含5% CO2、37 ℃恒温孵箱中培养HL60细胞。HL60细胞计数密度为1×106个/ml时,加入1×10-6 mol/L ATRA溶液,连续诱导培养4 d后,离心速度1 200 r/min,离心3 min沉淀细胞(离心半径19 cm),进一步检测。
2.HL60细胞迈格吉(May-Grunwald Giemsa,MGG)染色:HL60细胞悬液离心沉淀,加入10%甲醛溶液固定,MGG染色后重悬细胞,取细胞悬液滴加于载玻片上,盖玻片封片,置于正置显微镜下观察HL60细胞分化情况。分组:HL60组(未加ATRA)、HL60+ATRA组(加ATRA)。
3.流式细胞术(flowcytometry,FCM)测定HL60细胞膜CD11b表达:细胞悬液经1 000 r/min,离心洗涤8 min(离心半径19 cm),CD11b抗体稀释液(100 μl含2.5 μl CD11b抗体)重悬细胞,冰上孵育;再次1 000 r/min,8 min离心洗涤后,山羊抗兔IgG抗体稀释液(100 μl含2.5 μl山羊抗兔IgG)重悬细胞,冰上孵育。重悬后流式细胞仪检测HL60细胞膜CD11b表达。分组:HL60组,HL60+ATRA组。
4.PLAUR-小干扰RNA(small interference RNA,siRNA)-慢病毒(lentivirus,LV)转染ATRA诱导后的HL60细胞:PLAUR重组慢病毒载体的构建、包装及滴度测定由上海和元生物科技有限公司包装并经过滴度测定。根据人PLAUR基因转录本设计siRNA靶点,共设计3条PLAUR基因siRNA序列,选择干扰效果最佳的1条用于构建细胞模型,空载为含一段无关序列的空白质粒(表1)。安排引物合成。将单链引物退火成双链oligo序列,连接入双酶切线性化的RNA干扰载体,替换掉原来的ccdB毒性基因。菌落PCR筛选转化子,筛选的阳性克隆进行测序验证。测序验证正确的克隆,进行高纯度质粒抽提。包装慢病毒,测定慢病毒滴度。将诱导分化后的HL60细胞按1×105/孔接种于6孔板,加入病毒液转染,加入病毒液体积(μl)=细胞数×感染复数(multiplicity of infection,MOI)/滴度(TU/ml)×1 000(本次实验MOI值5),混匀继续培养。感染后12 h观察到细胞形态良好,病毒未造成不良反应,感染后24 h更换为新鲜培养基,继续培养。在已转染的细胞中加入2 μg/ml嘌呤霉素清除未转染的细胞及已转染但不能正常表达的细胞,从而得到纯度较高的转染细胞。

PLAUR基因小干扰RNA(siRNA)序列
PLAUR基因小干扰RNA(siRNA)序列
| 基因 | 序列(5′-3′) |
|---|---|
| PLAUR siRNA | CCTGAAGAACAGTGCCTGGAT |
| NC空载 | CCTAAGGTTAAGTCGCCCTCG |
注:PLAUR为人尿激酶型纤溶酶原激活物受体;NC空载为空白质粒
5.RT-qPCR、Western蛋白印迹法验证敲减效率:HL60细胞经ATRA诱导分化为类中性粒细胞后,根据不同干预分为3组:磷酸盐缓冲液组(PBS组),未转染;NC组,转染空载质粒;siRNA组,转染PLAUR-siRNA-LV。
RT-qPCR检测不同分组的类中性粒细胞PLAUR mRNA表达:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为PLAUR内参基因,引物序列见表2。按照TriQuick Reagent总RNA提取试剂盒说明书提取总RNA。配制逆转录反应体系:5×反应缓冲液4 μl,寡聚胸腺嘧啶引物[Oligo(dt)Primer]1 μl,Servicebio 反转录酶混合液1 μl,总RNA 0.1 ng~5 μg,加无RNA酶水至20 μl。逆转录得到cDNA。RT-qPCR反应体系:2×SYBR预混液10 μl,正反向引物各0.4 μl,模板2 μl,加无核酸酶纯水补足至20 μl,每组3复孔。扩增程序:预变性95 ℃ 30 s,1个循环;PCR反应:变性95 ℃ 15 s,退火60 ℃ 30 s,40个循环。计算:采用2-ΔΔCt法计算PLAUR mRNA相对表达水平。

PLAUR mRNA实时荧光定量聚合酶链反应(RT-qPCR)引物序列
PLAUR mRNA实时荧光定量聚合酶链反应(RT-qPCR)引物序列
| 基因 | 引物 | 序列(5′➝3′) | 长度(bp) |
|---|---|---|---|
| PLAUR | 上游 | TGTAAGACCAACGGGGATTGC | 21 |
| 下游 | AGCCAGTCCGATAGCTCAGG | 20 | |
| GAPDH | 上游 | CTGGGCTACACTGAGCACC | 19 |
| 下游 | AAGTGGTCGTTGAGGGCAATG | 21 |
注:PLAUR为尿激酶型纤维酶原激活物受体;GAPDH为甘油醛-3-磷酸脱氢酶
Western蛋白印迹法检测不同分组的类中性粒细胞PLAUR蛋白表达:RIPA裂解液裂解细胞,取上清BCA法测定蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,印迹转移至硝酸纤维素膜,加入一抗抗PLAUR抗体(1∶2 000),抗β-actin抗体(1∶10 000),4 ℃过夜。加入二抗孵育,室温下1.5 h。以β-actin作内参,化学发光成像系统AI 600成像。分别检测PBS组、NC组、siRNA组类中性粒细胞PLAUR蛋白表达(n=3)。
6.FCM及ELISA法检测类中性粒细胞活化:无血清的1640培养基(细胞饥饿处理)分别培养PBS组、NC组、siRNA组细胞,48 h后加入50 ng/ml白细胞介素17(interleukin 17,IL-17)干预24 h后分组检测,FCM法测3组细胞胞膜上CD11b表达。ELISA法检测3组细胞培养液上清NETs、MPO水平:按试剂盒操作,测各孔450 nm处吸光度A值,标准品浓度为纵坐标,对应A值为横坐标,建立标准曲线方程,算出NETs、MPO相对表达量(n=3)。
7. FCM Annexin V/PI法检测类中性粒细胞凋亡:收集经饥饿处理,并经IL-17干预24 h后的培养细胞于流式管中,1 000 r/min,离心5 min后重悬细胞(离心半径19 cm),细胞浓度为1×106/ml,加入5 μl Annexin-V FITC及5 μl PI轻轻震荡,室温25 ℃,避光反应15 min,1 h内上流式细胞仪Annexin V/PI法分别检测PBS组、NC组、siRNA组类中性粒细胞凋亡。Western蛋白印迹法分别检测3组类中性粒细胞凋亡相关蛋白caspase-3、bax、bcl-2(n=3)。
所有实验均重复至少3次。使用SPSS 26.0和GraphPad Prism 6.0软件对数据进行统计学分析。计量资料符合正态分布以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,方差分析有意义的结果采用最小显著性差异法(least significant difference,LSD)进行组间两两比较;不符合正态分布以M(Q1,Q3)表示,两组间比较用非参数独立样本Mann-Whitney U检验,多组间比较用独立样本Kruskal-Wallis检验,对Kruskal-Wallis检验有意义的结果采用Bonferroni法进行两两比较。双侧检验,取α=0.05。
MGG染色显示,与HL60组相比,HL60+ATRA组细胞胞核缩小,胞质变多,核有凹陷及分叶(图1);FCM测得HL60组和HL60+ATRA组细胞胞膜上CD11b的表达分别为0.36±0.20、92.23±6.53,差异有统计学意义(t=-24.35,P<0.05)。
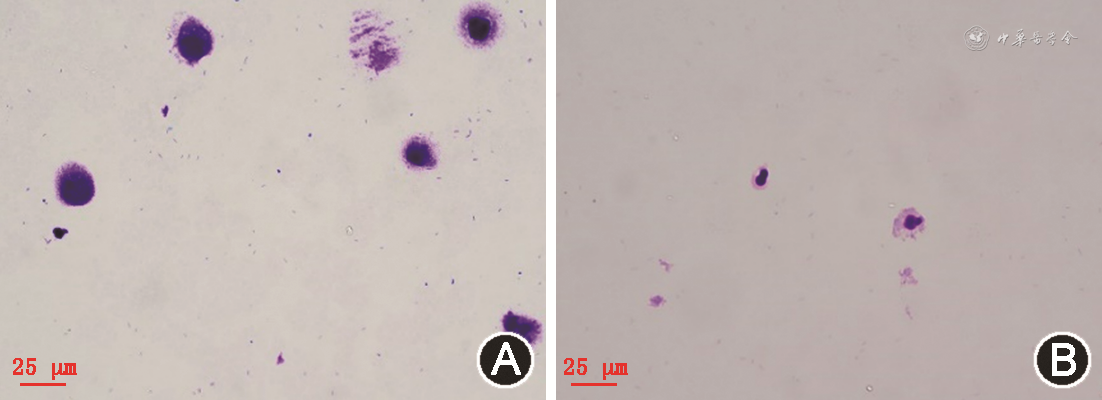

RT-qPCR检测PBS组、NC组、siRNA组PLAUR mRNA表达分别为0.29±0.01、1.00±0.02、0.24±0.01,差异有统计学意义(F=2 591.10,P<0.001);siRNA组与PBS组、NC组相比,PLAUR mRNA表达下降(均P<0.01);3组PLAUR蛋白相对表达量则分别为0.44±0.05、0.44±0.03、0.26±0.02,差异有统计学意义(F=24.26,P=0.001);siRNA组PLAUR蛋白相对表达量与PBS组、NC组相比均下降,差异均有统计学意义(均P<0.001)。
FCM法检测PBS组、NC组、siRNA组细胞胞膜上CD11b表达分别为46.27±1.54、53.07±8.14和32.37±8.17,差异有统计学意义(F=7.40,P=0.024);siRNA组与PBS组、NC组相比,细胞胞膜上CD11b表达均下降,差异均有统计学意义(均P<0.05);3组细胞培养液上清中MPO水平分别为41.64±2.20、40.84±5.11和33.37±1.11,差异有统计学意义(F=5.82,P=0.039);siRNA组MPO水平与PBS组、NC组相比下降,差异均有统计学意义(均P<0.05);3组NETs水平则分别为77.60±4.33、76.15±2.10和57.69±3.03,差异有统计学意义(F=34.26,P=0.001);siRNA组与PBS组、NC组相比均下降,差异均有统计学意义(均P<0.001)。
流式Annexin V/PI检测PBS组、NC组、siRNA组细胞凋亡,3组间凋亡表达差异有统计学意义(P<0.05);siRNA组与PBS组、NC组相比凋亡表达增加,差异有统计学意义(均P<0.01);3组间caspase-3、bax、bcl-2蛋白相对表达量差异均有统计学意义(均P<0.05)。其中,siRNA组caspase-3蛋白与PBS组、NC组相比增加(均P<0.01);与PBS组、NC组相比,siRNA组bax蛋白表达增加,差异均有统计学意义(均P<0.05);与PBS组、NC组相比,siRNA组bcl-2蛋白表达下降(均P<0.001)(表3)。
Annexin V/PI法流式细胞及Western蛋白印迹法检测3组类中性粒细胞凋亡率及蛋白表达(n=3,)
Annexin V/PI法流式细胞及Western蛋白印迹法检测3组类中性粒细胞凋亡率及蛋白表达(n=3,)
| 项目 | PBS组 | NC组 | siRNA组 | F值 | P值 |
|---|---|---|---|---|---|
| Annexin V/PI(%) | 11.91±2.23 | 11.13±2.56 | 20.42±2.45 | 13.63 | 0.006 |
| caspase-3蛋白 | 0.68±0.02 | 0.71±0.01 | 0.84±0.05 | 20.83 | 0.002 |
| bax蛋白 | 0.63±0.08 | 0.66±0.10 | 0.83±0.04 | 6.13 | 0.035 |
| bcl-2蛋白 | 0.73±0.05 | 0.69±0.06 | 0.38±0.02 | 47.02 | <0.001 |
注:Annexin V/PI为膜联蛋白-V/碘化丙啶;bax为bcl2关联X蛋白;bcl-2为B细胞淋巴瘤基因2;PBS为磷酸盐缓冲液;NC组为转染空载质粒组;siRNA组为转染人尿激酶型纤溶酶原激活物受体小干扰RNA-慢病毒组
DM是遗传和环境因素相互作用导致机体发生慢性炎症的结果[3],DM-ILD发生率高,是DM患者常见预后不良因素[4],但其发病机制尚不明确。本研究前期通过转录组测序,在DM-ILD患者和健康个体间筛选出差异基因PLAUR,其与中性粒细胞及中性粒细胞相关生物学过程有关[2]。在此基础上,以体外培养的人急性髓系粒细胞白血病细胞株HL60作为研究对象,构建敲减PLAUR的类中性粒细胞模型,探讨PLAUR与中性粒细胞活化在DM-ILD发病中的可能机制。实验证实,PLAUR促进类中性粒细胞活化,抑制其凋亡。
中性粒细胞作为先天免疫反应和感染清除的重要参与者,在许多自身免疫性疾病中发挥着重要作用[5, 6],也参与ILD发生[7]。动物实验中,中性粒细胞凋亡和清除障碍,引发ILD[8],而清除中性粒细胞可使慢性超敏性肺炎模型小鼠的炎症和纤维化程度显著减轻[9]。DM中,NETs过度形成,引发肺血管内皮细胞损伤和炎症细胞浸润,亦与ILD的发生有关[10]。可见,中性粒细胞过度活化及凋亡不足在引发ILD相关炎症中发挥了一定作用。
本研究中,敲减了PLAUR基因的类中性粒细胞模型上,胞膜CD11b的表达降低,同时ELISA检测细胞培养液上清中NETs、MPO水平下降。CD11b、NETs、MPO均可反映中性粒细胞免疫活性,敲减PLAUR后,上述指标降低,提示类中性粒细胞的活性被抑制,PLAUR能促进类中性粒细胞活化。推测在DM-ILD中,PLAUR促进中性粒细胞活化,使其活化产物生成增加,可能在ILD炎症发生中发挥作用。
在敲减PLAUR后,流式Annexin V/PI检测细胞凋亡增加,执行细胞凋亡的caspase-3蛋白、bax蛋白表达增加,抗凋亡的bcl-2蛋白表达降低,类中性粒细胞凋亡增加。提示PLAUR减少类中性粒细胞凋亡。推测在DM-ILD中,PLAUR使中性粒细胞凋亡不足,受损或过多的中性粒细胞积累,引发肺部损害。
有关PLAUR的研究表明,PLAUR与肺损伤有关[11],是哮喘潜在的易感基因[12]。临床上,DM-ILD表现隐匿,在皮损和肌肉病变出现前数月甚至数年,约4%的患者已存在肺部损害[13],在高分辨率CT出现异常前开始治疗,可改善预后[14]。在DM-ILD中开展PLAUR的研究,可能为疾病的早期诊治提供新的生物标记物,使患者受益。
此外,中性粒细胞水平在DM-ILD患者支气管肺泡灌洗液中升高[15],无肌病皮肌炎患者外周血CD11b mRNA水平与肺损伤呈正相关[16],中性粒细胞增殖与活化影响DM-ILD病情严重度。PLAUR促进中性粒细胞活化,可能为解释DM-ILD的疾病机制提供更多信息,从而为评估疾病预后及寻找新的治疗药物提供线索。
综上,尽管DM的肺损伤目前认为与自身抗体关系密切,但对于异质性较强的DM而言,PLAUR促进中性粒细胞活化的研究,将有助于了解DM-ILD不同的发病机制,可能对今后的诊疗有所帮助。有关PLAUR促进中性粒细胞活化在DM-ILD发病中的具体分子机制仍有待进一步探索。PLAUR促进类中性粒细胞活化,抑制其凋亡。这些发现丰富了人们对中性粒细胞活化的认识,有助于了解中性粒细胞参与的疾病的发病机制。
陈娟, 张瑞仙, 谢敏, 等. 尿激酶型纤溶酶原激活物受体基因对中性粒细胞活化及凋亡的影响[J]. 中华医学杂志, 2024, 104(11): 877-882. DOI: 10.3760/cma.j.cn112137-20230917-00481.
所有作者声明不存在利益冲突



























