
2019年9月至2020年10月广州血液中心对临床诊断为人类白细胞抗体引起输血相关急性肺损伤(TRALI)的3例患者进行发病原因分析,包括男2例,女1例,年龄分别为56、50及20岁。通过固相凝集法、抗人球蛋白试验及流式细胞术检测供者体内是否存在针对患者的抗体;采用基于测序的人类白细胞抗原(HLA-SBT)分型技术检测患者的人类白细胞抗原(HLA)基因型;采用Lifecodes HLA-Ⅰ/Ⅱ类单抗原特异性抗体检测试剂(LSA-Ⅰ/Ⅱ),通过Luminex 200液相悬浮芯片系统检测供者血液中的HLA-Ⅰ、Ⅱ类抗体特异性;并分析供者体内针对患者HLA的特异性抗体及相应抗原决定簇。结果显示,供者体内检出针对TRALI患者的HLA-Ⅰ或Ⅱ类特异性抗体,其中患者1接受的供者3血浆中含有针对患者HLA-DRB1*09∶01抗原的抗体,介导供受者抗原抗体反应的抗原决定簇为70R、31I、70QA;供者4血浆中存在针对患者2的HLA-A*11∶02、HLA-A*11∶01、DRB1*12∶02及DRB1*09∶01抗原的抗体,相关抗原决定簇为151AHA、57V和16Y;供者6和供者7血浆中存在针对患者3的HLA-DRB1*14∶04、DRB1*11∶01及DPB1*05∶01抗原的抗体,相关抗原决定簇为96HK、140TV、13SE及111K。通过实验室检测分析明确了3例TRALI病例是由HLA抗体引起的,对临床疑似TRALI病例应重视HLA抗体检测,并给予针对性的诊断及治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
输血相关急性肺损伤(transfusion-related acute lung injury,TRALI)是指在输血期间或输血后6 h内,以急性非心源性肺水肿、低氧血症为主要临床表现的综合征[1]。TRALI起病急,病情重,死亡率为6%~12%[2]。美国食品药品监督管理局(Food and Drug Administration,FDA)报告显示,2012至2016年,TRALI死亡病例数占输血相关死亡总数的34%,是输血不良反应死亡的首要原因;每输注1单位的血液成分,TRALI的发生率约为0.02%[3, 4]。目前认为,TRALI主要由血液贮存期间累积和产生的生物活性物质或所输注血液中含有针对人类白细胞抗原(human leucocyte antigen,HLA)、人类中性粒细胞抗原(human neutrophil antigen,HNA)和CD36抗原的抗体所致,其中以抗体引起的TRALI较常见和严重[5, 6, 7]。为了减少TRALI的发生,国外采取主要采集男性献血者血浆的措施,显著降低了TRALI的发生率[8]。在我国,由于对TRALI认识不足、确诊或鉴别诊断困难等原因,致使其确切发病率尚不清楚。本研究旨在对疑似TRALI病例开展实验室检测,并进行病因分析。
1.对象:2019年9月至2020年10月广州血液中心对送检的多个疑似TRALI病例开展实验室检测分析,其中3例由人类白细胞抗体介导。(1)患者1:女,56岁,肝硬化失代偿期,治疗过程中曾多次输注血液成分及白蛋白制品,无输血不良反应。2019年9月17日,在输注新鲜冰冻血浆后30 min内突发呼吸困难、寒战、心率加快、全身花斑,血氧饱和度低于90%,双肺湿啰音;床旁胸片显示双肺下叶渗出性病灶,双肺纹理增粗、增多、模糊。诊断为TRALI。立即停止输血,同时给予吸氧、药物治疗(具体不详)、深静脉插管等,患者1 h后症状缓解。(2)患者2:男,50岁,因呕血伴黑便1 d于2020年1月22日入当地医院治疗。结合患者病史及辅助检查初步诊断为肝恶性肿瘤伴食管胃底静脉曲张破裂。血常规提示血红蛋白70 g/L;CT图像显示双肺感染、双侧胸腔积液;肝脏多发结节,腹腔大量积液。给予扩容、升压、纠正电解质紊乱、抑酸护胃、降低门脉压、输血对症支持治疗及胃镜下食管静脉曲张硬化剂治疗,患者腹胀、精神、纳差有好转,生命体征稳定。于2020年2月13日输注同型新鲜冰冻血浆以改善凝血功能时,患者迅速出现寒战、呼吸困难、烦躁不安,血氧饱和度降至80%~85%;双肺可闻及湿啰音;胸部CT显示双肺渗出较前明显增多,双肺大部分实变,双侧胸腔积液较前增多;疑似发生输血反应。立即停止输血转入重症监护病房,行气管插管、呼吸机辅助通气,给予异丙嗪、甲强龙、去甲肾上腺素升压及补液治疗,患者病情缓解,生命体征趋于稳定。心电监护提示:体温36.5 ℃,血压92/60 mmHg(1 mmHg=0.133 kPa),呼吸24次/min,心率70次/min,血氧饱和度<98%。(3)患者3:男,20岁,因急性上消化道大出血于2020年10月6日入住当地医院治疗。既往无心肺疾病史,双肺呼吸音清,未闻及干湿啰音,心律齐,各瓣膜未闻及杂音。患者因重度贫血,给予4 U红细胞悬液及200 ml血浆输注治疗。于2020年10月7日03∶30开始输入白细胞过滤新鲜冰冻血浆,至03∶55患者突发气促,端坐呼吸;查体:双肺弥漫性湿啰音,心电监护提示心率160次/min,血氧饱和度80%,B-型利钠肽(B-type natriuretic peptide,BNP)<70 ng/L;血气分析提示:二氧化碳分压(PCO2)31.8 mmHg,氧分压(PO2)40.7 mmHg。胸部CT显示双肺弥漫浸润性病变,有散在斑片状、小片状密度增高影,以双肺下叶为著,边缘模糊,部分略成磨玻璃密度。诊断为TRALI。立即停止输血,给予甲强龙减轻肺水肿、西地兰强心、呋塞米利尿及无创呼吸机辅助通气等处理,患者于04∶49症状趋于平稳。08∶33复查血气分析,PCO2为30.1 mmHg,PO2为93.7 mmHg,血氧饱和度98.9%。
2. TRALI诊断标准[9]:(1)急性发病;(2)出现低氧血症,室内环境血氧饱和度<90%;(3)有双肺水肿的影像学证据;(4)不存在左心房高压情况;(5)输血过程中或输血后6 h内出现呼吸困难;(6)有或无急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)危险因素。
3.仪器与试剂:PCR扩增仪采用美国ABI公司9700型;HLA基因分型及HLA抗体特异性检测通过美国Millipore公司的Luminex 200液相悬浮芯片系统进行;酶标仪采用美国Thermo Fisher Scientific公司的Multiskan FC型;真空泵采用美国Millipore公司的WP6122050;孵育箱采用上海一恒科学仪器有限公司的BPH-9042型;离心机采用日本久保田的5220型;微孔板振荡器采用杭州奥盛仪器有限公司的MX100-4A;微柱凝胶卡离心机采用中国Baso公司的C12型。
4.实验室检测方法:对疑似TRALI患者及血液成分供者进行相关实验室检查。本研究通过广州血液中心伦理委员会批准[医伦(2019)第001号],所有患者和供者均签署知情同意书。交叉配合实验采用荷兰Sanquin公司的固相凝集法(MASPAT)试剂盒;HLA抗体筛选检测采用美国Immucor公司的HLA抗体筛查试剂盒(LMX);HLA-Ⅰ、Ⅱ类特异性抗体检测采用美国Immucor公司HLA-Ⅰ类/Ⅱ类单抗原特异性抗体检测试剂盒(lifecodes single antigen class Ⅰ/Ⅱ Kit,LSA-Ⅰ/Ⅱ);HLA基因分型送检广州博富瑞医学检验有限公司,通过基于测序分型(sequencing-based typing,SBT)法检测;红细胞不规则抗体筛查采用中国BaSo公司的抗人球蛋白检测卡;HLA基因分型结果通过LABTools软件分析;HLA-Ⅰ、Ⅱ类特异性抗体及相应抗原决定簇(epitopes)结果采用MATCH IT(1.3.0)和HLA Matchmaker(1.1)软件分析。
1.交叉配合、HLA抗体及红细胞不规则抗体筛查:患者1的血小板与当日3名血液成分输注供者的血清均呈阳性反应,其中供者3与患者1的反应较强。患者2与供者4血清呈强阳性反应。患者3与3名供者的血清均不反应。通过抗人球蛋白凝胶卡检测,3例患者及7名供者的红细胞不规则抗体筛查均为阴性。在供受者的HLA抗体筛查中,发现患者1、供者3、供者4、供者6及供者7的群体反应性抗体(panel reactive antibody,PRA)均为阳性,提示供者体内可能存在针对患者HLA的抗体(表1)。
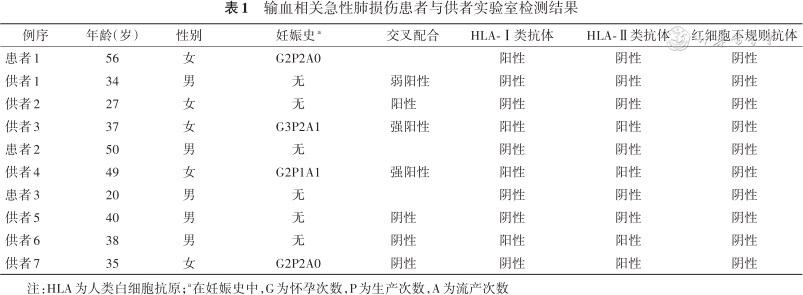
输血相关急性肺损伤患者与供者实验室检测结果
输血相关急性肺损伤患者与供者实验室检测结果
| 例序 | 年龄(岁) | 性别 | 妊娠史a | 交叉配合 | HLA-Ⅰ类抗体 | HLA-Ⅱ类抗体 | 红细胞不规则抗体 |
|---|---|---|---|---|---|---|---|
| 患者1 | 56 | 女 | G2P2A0 | 阳性 | 阴性 | 阴性 | |
| 供者1 | 34 | 男 | 无 | 弱阳性 | 阴性 | 阴性 | 阴性 |
| 供者2 | 27 | 女 | 无 | 阳性 | 阴性 | 阴性 | 阴性 |
| 供者3 | 37 | 女 | G3P2A1 | 强阳性 | 阳性 | 阳性 | 阴性 |
| 患者2 | 50 | 男 | 无 | 阴性 | 阴性 | 阴性 | |
| 供者4 | 49 | 女 | G2P1A1 | 强阳性 | 阳性 | 阳性 | 阴性 |
| 患者3 | 20 | 男 | 无 | 阴性 | 阴性 | 阴性 | |
| 供者5 | 40 | 男 | 无 | 阴性 | 阴性 | 阴性 | 阴性 |
| 供者6 | 38 | 男 | 无 | 阴性 | 阳性 | 阳性 | 阴性 |
| 供者7 | 35 | 女 | G2P2A0 | 阴性 | 阴性 | 阳性 | 阴性 |
注:HLA为人类白细胞抗原;a在妊娠史中,G为怀孕次数,P为生产次数,A为流产次数
2.HLA基因分型和抗体特异性分析:3例患者HLA-A、B、C、DRB1、DQB1、DPB1位点的基因分型检测结果见表2。供者HLA特异性抗体检测结果显示,供者3有针对患者1的HLA-DRB1*09∶01抗原的抗体,其中70R、31I、70QA是引起抗原抗体反应的位点;供者4存在针对患者2的HLA-A*11∶02、A*11∶01、DRB1*12∶02、DRB1*09∶01抗原的抗体,涉及位点包括151AHA、57V和16Y;供者6和供者7存在针对患者3的HLA-DRB1*14∶04、DRB1*11∶01及DPB1*05∶01抗原的抗体,抗原表位包括96HK、140TV、13SE及111K(表3)。
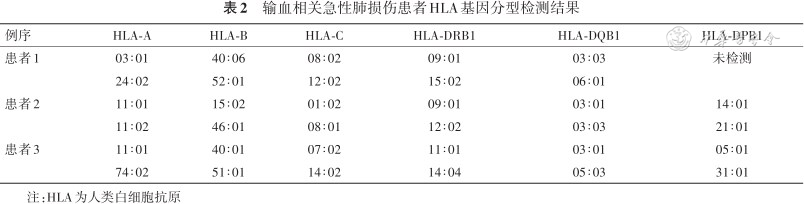
输血相关急性肺损伤患者HLA基因分型检测结果
输血相关急性肺损伤患者HLA基因分型检测结果
| 例序 | HLA-A | HLA-B | HLA-C | HLA-DRB1 | HLA-DQB1 | HLA-DPB1 |
|---|---|---|---|---|---|---|
| 患者1 | 03∶01 | 40∶06 | 08∶02 | 09∶01 | 03∶03 | 未检测 |
| 24∶02 | 52∶01 | 12∶02 | 15∶02 | 06∶01 | ||
| 患者2 | 11∶01 | 15∶02 | 01∶02 | 09∶01 | 03∶01 | 14∶01 |
| 11∶02 | 46∶01 | 08∶01 | 12∶02 | 03∶03 | 21∶01 | |
| 患者3 | 11∶01 | 40∶01 | 07∶02 | 11∶01 | 03∶01 | 05∶01 |
| 74∶02 | 51∶01 | 14∶02 | 14∶04 | 05∶03 | 31∶01 |
注:HLA为人类白细胞抗原
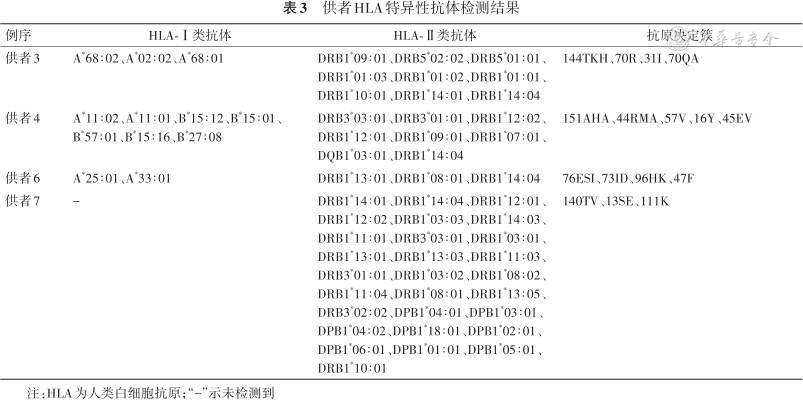
供者HLA特异性抗体检测结果
供者HLA特异性抗体检测结果
| 例序 | HLA-Ⅰ类抗体 | HLA-Ⅱ类抗体 | 抗原决定簇 |
|---|---|---|---|
| 供者3 | A*68∶02、A*02∶02、A*68∶01 | DRB1*09∶01、DRB5*02∶02、DRB5*01∶01、DRB1*01∶03、DRB1*01∶02、DRB1*01∶01、DRB1*10∶01、DRB1*14∶01、DRB1*14∶04 | 144TKH、70R、31I、70QA |
| 供者4 | A*11∶02、A*11∶01、B*15∶12、B*15∶01、B*57∶01、B*15∶16、B*27∶08 | DRB3*03∶01、DRB3*01∶01、DRB1*12∶02、DRB1*12∶01、DRB1*09∶01、DRB1*07∶01、DQB1*03∶01、DRB1*14∶04 | 151AHA、44RMA、57V、16Y、45EV |
| 供者6 | A*25∶01、A*33∶01 | DRB1*13∶01、DRB1*08∶01、DRB1*14∶04 | 76ESI、73ID、96HK、47F |
| 供者7 | - | DRB1*14∶01、DRB1*14∶04、DRB1*12∶01、DRB1*12∶02、DRB1*03∶03、DRB1*14∶03、DRB1*11∶01、DRB3*03∶01、DRB1*03∶01、DRB1*13∶01、DRB1*13∶03、DRB1*11∶03、DRB3*01∶01、DRB1*03∶02、DRB1*08∶02、DRB1*11∶04、DRB1*08∶01、DRB1*13∶05、DRB3*02∶02、DPB1*04∶01、DPB1*03∶01、DPB1*04∶02、DPB1*18∶01、DPB1*02∶01、DPB1*06∶01、DPB1*01∶01、DPB1*05∶01、DRB1*10∶01 | 140TV、13SE、111K |
注:HLA为人类白细胞抗原;“-”示未检测到
TRALI的发病机制目前存在多个假说,但普遍认可的是“二次打击模型”,认为第一次打击与患者的临床状态有关,可能存在感染、脓毒症、手术和创伤等因素;第二次打击为患者输入含白细胞抗体和(或)生物活性物质的血液制品,这些抗体或生物活性物质使已经处于易感状态的细胞活化,导致肺血管内皮损伤和毛细血管通透性增加,导致TRALI发生[8,10, 11]。根据发病原因,可将TRALI分为抗体介导的TRALI和非抗体介导的TRALI,其中HLA抗体介导的TRALI较常见,占65%~89%,以HNA-3a和HLA-Ⅱ类抗体为主[12, 13, 14]。研究发现,尽管HLA-Ⅰ类抗体在供者抗体筛选中检出率比较高,但与TRALI的发生相关性不强,而HLA-Ⅱ类抗体是导致TRALI发生的主要抗体[14]。研究认为HLA-Ⅱ类抗体结合并激活单核细胞,释放细胞因子,趋化中性粒细胞于肺微血管内皮聚集,并使之活化,介导内皮细胞损伤[15]。本研究中,供者3和供者4的血清分别与患者1和患者2的血小板反应较强或强阳性;通过供者HLA抗体筛查,发现供者3和供者4均存在HLA-Ⅰ类和Ⅱ类抗体。分析供者3和供者4的HLA抗体特异性类型,发现都具有针对患者的DRB1*09∶01抗体,且供者4同时具有针对患者2的A*11∶01和A*11∶02特异性抗体,这与其表现出血清呈强阳性反应具有相关性。另外,供者3、供者4及供者7均为多次妊娠的经产妇,其血浆中含有针对患者的HLA的特异性抗体,以HLA-Ⅱ类抗体为主,包括针对HLA-DRB1*09∶01、DRB1*12∶02、DRB1*14∶04、DRB1*11∶01和DPB1*05∶01的抗体。可见,采集多次生育女性献血者的血浆存在导致TRALI发生的高风险。本研究中,引起3例患者发生TRALI的HLA-Ⅱ类抗体与文献报道的有所不同,推测导致TRALI发生的HLA-Ⅱ类抗体类型可能存在地区和种族差异[16]。文献报道及本研究结果均提示应重视HLA-Ⅱ类抗体检测及由其引起的TRALI作用机制的研究。
此外,本研究还分析了这3例由HLA抗体介导TRALI发生的抗原表位,发现70R、31I、70QA、151AHA、57V、16Y、140TV、13SE及111K可参与供受者的抗原抗体反应,介导TRALI的发生。目前,HLA抗原表位分析已广泛应用于器官移植研究[17]。本研究将其应用于TRALI病例分析,有助于指导临床输血治疗。3例患者今后若需要输注血液成分,应避开引起TRALI发生的抗原表位。
目前我国对TRALI的认识和研究还处于初级阶段,考虑到TRALI的发病率和致死率,以及我国用血量巨大的状况,应得到输血工作者的广泛关注[18, 19, 20]。本研究对HLA抗体介导的TRALI病例开展了一系列检测分析,可协助临床查找发病原因。鉴于HLA抗体是介导TRALI发生的重要原因,应足够重视相关抗体的实验室检测。
邓晶, 徐秀章, 叶欣, 等. 人类白细胞抗原抗体引起输血相关急性肺损伤发病原因分析[J]. 中华医学杂志, 2024, 104(11): 883-887. DOI: 10.3760/cma.j.cn112137-20231201-01263.
所有作者声明不存在利益冲突



























