
探讨替雷利珠单抗注射液联合化疗方案治疗中晚期非小细胞肺癌(NSCLC)的疗效及其对患者免疫功能、生存质量的影响。
采用病例对照研究,回顾性分析舟山医院2021年5月至2022年6月收治的中晚期NSCLC患者104例的临床资料,按照治疗方法不同分为A组(52例)和B组(52例)。A组采用吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组采用替雷利珠单抗注射液联合吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,21 d为1个周期,两组患者治疗3个周期。比较两组患者近期疗效,治疗前后Ⅲ期、Ⅳ期患者血清肿瘤标志物水平,免疫功能指标,生存质量评分以及不良反应发生情况。
B组近期总有效率[51.92%(27/52)]高于A组[32.69%(17/52)])(Z=4.11,P < 0.001)。治疗后,两组Ⅲ期、Ⅳ期患者血清肿瘤标志物水平、CD8+百分比均比治疗前低,且B组均低于A组(均P < 0.05);两组CD4+百分比、CD4+/CD8+比值、功能子量表、症状子量表、总评分均高于治疗前(均P < 0.05),且B组均高于A组高(均P < 0.05)。B组不良反应发生率为44.23%(23/52),高于A组的21.15%(11/52)(χ2=6.29,P=0.012)。
替雷利珠单抗联合化疗方案用于NSCLC患者的治疗中,可降低血清肿瘤标志物水平,调节免疫功能,提升患者生活质量,临床疗效确切。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌多发于老年人[1],非小细胞肺癌(non-small cell lung cancer,NSCLC)在肺癌中占80%以上[2]。肺癌早期症状不明显,发病较为隐匿,但病情进展较快,且恶性程度较高,严重威胁患者的生命安全。既往报道显示,约有1/2以上的NSCLC患者在就诊时已处于中晚期,从而错过最佳的手术治疗时机,而只能采用非手术治疗[3]。作为临床常用的化疗方案,吉西他滨+顺铂或培美曲塞+顺铂化疗取得了较好的治疗效果,但也可能使患者正常细胞受损,从而导致临床应用受限[4]。替雷利珠单抗与其他程序性死亡受体1的区别在于该药有着特有的结合表位,可避免抗体依赖的细胞吞噬作用,可使T细胞的损耗减少,从而发挥有效的抗肿瘤活性。目前替雷利珠单抗已被用于局部晚期或转移性鳞状NSCLC患者的治疗中[5, 6]。本研究旨在探讨替雷利珠单抗联合化疗方案对中晚期NSCLC患者近期疗效及免疫功能、生存质量的影响。现报告如下。
采用病例对照研究,回顾性分析舟山医院2021年5月至2022年6月收治的中晚期NSCLC患者104例的临床资料。纳入标准:符合《中国非小细胞癌免疫检查点抑制剂专家共识(2019年版)》[7]中的诊断标准,且经组织病理学检测确诊者;肿瘤分期(TNM分期)[8]为Ⅲ~Ⅳ期;卡氏功能状态(Karnofsky,KPS)[9]评分在60分以上;存在表皮生长因子受体基因突变(19或21外显子突变),均为肺组织活检标本;合并基因突变予以免疫治疗者;无放疗禁忌证;患者或近亲属知情同意。排除标准:继发性肺癌患者;早期肺癌患者或可行手术治疗者;合并严重感染者;预计生存期在3个月以内者;资料不全患者。按照治疗方法不同将患者分为A组(52例)和B组(52例)。A组:男41例,女11例;年龄范围33~72岁,年龄为(54.50±7.55)岁;肺癌类型:鳞癌9例,腺癌31例,其他12例;TNM分期:Ⅲ期30例,Ⅳ期22例;KPS评分为(77.95±7.21)分。B组:男42例,女10例;年龄范围34~71岁,年龄为(54.33±7.41)岁;肺癌类型:鳞癌10例,腺癌32例,其他10例;TNM分期:Ⅲ期31例,Ⅳ期21例;KPS评分为(77.84±6.18)分。两组患者性别、年龄、肺癌类型、临床分期等基线资料比较,差异均无统计学意义(均P > 0.05),有可比性。本研究经舟山医院医学伦理委员会批准(批号:2023伦审第019号)。
A组:吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗。采用注射用盐酸吉西他滨溶入0.9%氯化钠注射液100 mL中,静脉滴注,1.2 g/m2,分别于第1、8天给药;注射用培美曲塞二钠溶入0.9%氯化钠注射液100 mL中,静脉滴注,0.5 g/m2,于第1天给药;顺铂注射液溶入0.9%氯化钠注射液500 mL中,静脉滴注,50 mg/m2,分别于第1、2、3天给药。化疗周期为21 d。B组:在A组基础上联合替雷利珠单抗注射液治疗。替雷利珠单抗注射液[勃林格殷格翰生物药业(中国)有限公司生产,国药准字S20190045,规格:100 mg(10 mL)/瓶,批号:202109047]200 mg溶入0.9%的氯化钠注射液100 mL中,静脉滴注,200 mg/次,每3周1次。两组患者均进行为期3个周期的治疗。
(1)近期疗效:参照《实体瘤疗效评价标准》[10]评定两组患者治疗3个疗程后近期疗效,疗程结束后患者肿瘤病灶消失,且维持1个月以上为完全缓解(CR);病灶长径之和缩小在30%以上者为部分缓解(PR);病灶长径之和增加至20%以上为进展(PD);治疗后不符合部分缓解、进展者为稳定(SD)。近期有效率=CR率+PR率。(2)观察两组血清肿瘤标志物变化:采集两组患者空腹静脉血3 mL,离心,采用放射免疫分析法检测血清人癌胚抗原(carcinoembryonic antigen,CEA)、神经原特异烯醇化酶(neuron-specific enolase,NSE)、鳞癌抗原(squamous cell carcinoma,SCC)水平。(3)观察两组免疫功能:采集两组患者外周静脉血3 mL,采用流式细胞仪测定CD4+、CD8+百分比,并计算CD4+/CD8+比值。(4)比较两组患者治疗过程中恶心呕吐、皮疹、骨髓抑制、肝功能受损等并发症发生情况。(5)采用欧洲生命质量协作组编制的癌症质量(quality of life questionnaire,QLQ-C30)量表[11]评定生存质量,该量表包括社会功能、躯体、角色等功能子量表,疲劳、恶心呕吐等症状子量表等,本研究主要选取了功能子量表和症状子量表,分值越高,则表明患者生活质量水平越高。
采用SPSS 20.0统计学软件处理数据。计量资料均经过正态性检验,符合正态分布的计量资料以表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验。计数资料以例(%)表示,组间比较采用χ2检验或Wilcoxon秩和检验。P < 0.05为差异有统计学意义。
B组近期总有效率高于A组(Z=4.11,P < 0.001)。见表1。
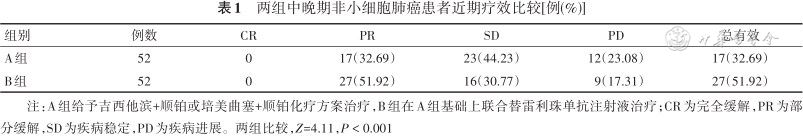
两组中晚期非小细胞肺癌患者近期疗效比较[例(%)]
两组中晚期非小细胞肺癌患者近期疗效比较[例(%)]
| 组别 | 例数 | CR | PR | SD | PD | 总有效 |
|---|---|---|---|---|---|---|
| A组 | 52 | 0 | 17(32.69) | 23(44.23) | 12(23.08) | 17(32.69) |
| B组 | 52 | 0 | 27(51.92) | 16(30.77) | 9(17.31) | 27(51.92) |
注:A组给予吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组在A组基础上联合替雷利珠单抗注射液治疗;CR为完全缓解,PR为部分缓解,SD为疾病稳定,PD为疾病进展。两组比较,Z=4.11,P < 0.001
治疗后,两组Ⅲ期、Ⅳ期患者血清CEA、NSE、SCC水平均比治疗前低(均P < 0.05),且B组均低于A组(均P < 0.05)。见表2。
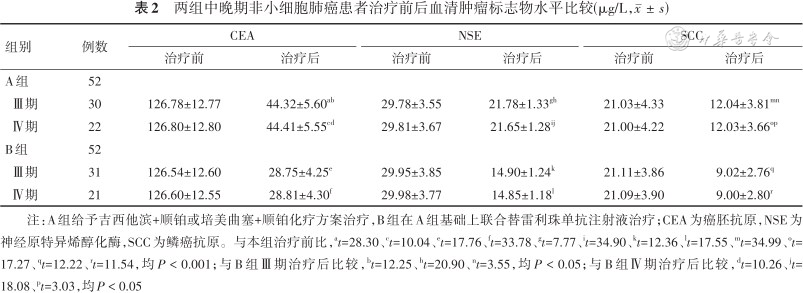
两组中晚期非小细胞肺癌患者治疗前后血清肿瘤标志物水平比较(μg/L,)
两组中晚期非小细胞肺癌患者治疗前后血清肿瘤标志物水平比较(μg/L,)
| 组别 | 例数 | CEA | NSE | SCC | |||
|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| A组 | 52 | ||||||
| Ⅲ期 | 30 | 126.78±12.77 | 44.32±5.60ab | 29.78±3.55 | 21.78±1.33gh | 21.03±4.33 | 12.04±3.81mn |
| Ⅳ期 | 22 | 126.80±12.80 | 44.41±5.55cd | 29.81±3.67 | 21.65±1.28ij | 21.00±4.22 | 12.03±3.66op |
| B组 | 52 | ||||||
| Ⅲ期 | 31 | 126.54±12.60 | 28.75±4.25e | 29.95±3.85 | 14.90±1.24k | 21.11±3.86 | 9.02±2.76q |
| Ⅳ期 | 21 | 126.60±12.55 | 28.81±4.30f | 29.98±3.77 | 14.85±1.18l | 21.09±3.90 | 9.00±2.80r |
注:A组给予吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组在A组基础上联合替雷利珠单抗注射液治疗;CEA为癌胚抗原,NSE为神经原特异烯醇化酶,SCC为鳞癌抗原。与本组治疗前比,at=28.30、ct=10.04、et=17.76、ft=33.78、gt=7.77、it=34.90、kt=12.36、lt=17.55、mt=34.99、ot=17.27、qt=12.22、rt=11.54,均P < 0.001;与B组Ⅲ期治疗后比较,bt=12.25、ht=20.90、nt=3.55,均P < 0.05;与B组Ⅳ期治疗后比较,dt=10.26、jt=18.08、pt=3.03,均P < 0.05
治疗后两组Ⅲ期、Ⅳ期患者CD4+百分比、CD4+/CD8+比值水平均比治疗前高,且B组均高于A组;CD8+百分比则比治疗前低(均P < 0.05),且B组低于A组低(均P < 0.05)。见表3。
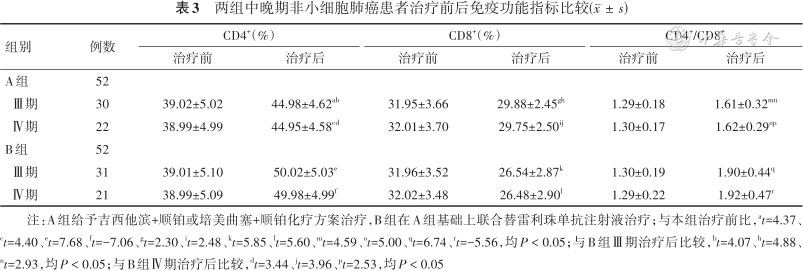
两组中晚期非小细胞肺癌患者治疗前后免疫功能指标比较()
两组中晚期非小细胞肺癌患者治疗前后免疫功能指标比较()
| 组别 | 例数 | CD4+(%) | CD8+(%) | CD4+/CD8+ | |||
|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| A组 | 52 | ||||||
| Ⅲ期 | 30 | 39.02±5.02 | 44.98±4.62ab | 31.95±3.66 | 29.88±2.45gh | 1.29±0.18 | 1.61±0.32mn |
| Ⅳ期 | 22 | 38.99±4.99 | 44.95±4.58cd | 32.01±3.70 | 29.75±2.50ij | 1.30±0.17 | 1.62±0.29op |
| B组 | 52 | ||||||
| Ⅲ期 | 31 | 39.01±5.10 | 50.02±5.03e | 31.96±3.52 | 26.54±2.87k | 1.30±0.19 | 1.90±0.44q |
| Ⅳ期 | 21 | 38.99±5.09 | 49.98±4.99f | 32.02±3.48 | 26.48±2.90l | 1.29±0.22 | 1.92±0.47r |
注:A组给予吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组在A组基础上联合替雷利珠单抗注射液治疗;与本组治疗前比,at=4.37、ct=4.40、et=7.68、ft=-7.06、gt=2.30、it=2.48、kt=5.85、lt=5.60、mt=4.59、ot=5.00、qt=6.74、rt=-5.56,均P < 0.05;与B组Ⅲ期治疗后比较,bt=4.07、ht=4.88、nt=2.93,均P < 0.05;与B组Ⅳ期治疗后比较,dt=3.44、jt=3.96、pt=2.53,均P < 0.05
B组不良反应发生率高于A组(P=0.012)。见表4。
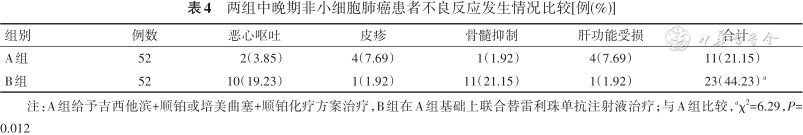
两组中晚期非小细胞肺癌患者不良反应发生情况比较[例(%)]
两组中晚期非小细胞肺癌患者不良反应发生情况比较[例(%)]
| 组别 | 例数 | 恶心呕吐 | 皮疹 | 骨髓抑制 | 肝功能受损 | 合计 |
|---|---|---|---|---|---|---|
| A组 | 52 | 2(3.85) | 4(7.69) | 1(1.92) | 4(7.69) | 11(21.15) |
| B组 | 52 | 10(19.23) | 1(1.92) | 11(21.15) | 1(1.92) | 23(44.23) a |
注:A组给予吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组在A组基础上联合替雷利珠单抗注射液治疗;与A组比较,aχ2=6.29,P=0.012
治疗后两组Ⅲ期、Ⅳ期患者功能子量表、症状子量表、总评分均比治疗前高(均P < 0.05),且B组均高于A组(均P < 0.05)。见表5。
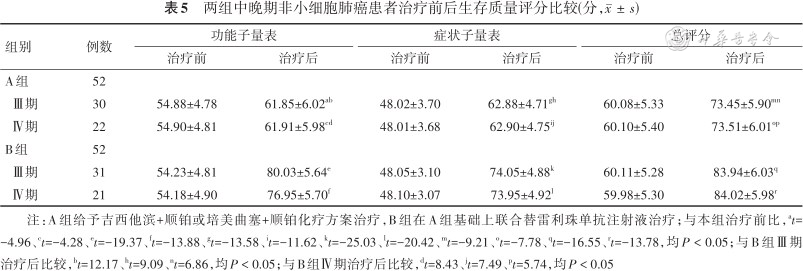
两组中晚期非小细胞肺癌患者治疗前后生存质量评分比较(分,)
两组中晚期非小细胞肺癌患者治疗前后生存质量评分比较(分,)
| 组别 | 例数 | 功能子量表 | 症状子量表 | 总评分 | |||
|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| A组 | 52 | ||||||
| Ⅲ期 | 30 | 54.88±4.78 | 61.85±6.02ab | 48.02±3.70 | 62.88±4.71gh | 60.08±5.33 | 73.45±5.90mn |
| Ⅳ期 | 22 | 54.90±4.81 | 61.91±5.98cd | 48.01±3.68 | 62.90±4.75ij | 60.10±5.40 | 73.51±6.01op |
| B组 | 52 | ||||||
| Ⅲ期 | 31 | 54.23±4.81 | 80.03±5.64e | 48.05±3.10 | 74.05±4.88k | 60.11±5.28 | 83.94±6.03q |
| Ⅳ期 | 21 | 54.18±4.90 | 76.95±5.70f | 48.10±3.07 | 73.95±4.92l | 59.98±5.30 | 84.02±5.98r |
注:A组给予吉西他滨+顺铂或培美曲塞+顺铂化疗方案治疗,B组在A组基础上联合替雷利珠单抗注射液治疗;与本组治疗前比,at=-4.96、ct=-4.28、et=-19.37、ft=-13.88、gt=-13.58、it=-11.62、kt=-25.03、lt=-20.42、mt=-9.21、ot=-7.78、qt=-16.55、rt=-13.78,均P < 0.05;与B组Ⅲ期治疗后比较,bt=12.17、ht=9.09、nt=6.86,均P < 0.05;与B组Ⅳ期治疗后比较,dt=8.43、jt=7.49、pt=5.74,均P < 0.05
针对中晚期NSCLC患者,临床治疗的关键在于如何使患者的存活时间延长[12]。吉西他滨+顺铂或培美曲塞+顺铂化疗方案是目前常用的一线化疗方案,采用该化疗方案可有效治疗肺癌,其中作为一种胞嘧啶核苷衍生物,吉西他滨主要作用于G1/S期,可抑制核苷酸还原酶,使脱氧核苷三磷酸酯量下降,从而对肿瘤细胞的生长产生抑制[13];培美曲塞的药理作用在于作用于叶酸代谢途径中的多种酶类物质,对叶酸代谢起到抑制作用,起到抑制肿瘤细胞合成的作用,疗效显著[14]。顺铂主要通过结合DNA,从而破坏其功能,并有效抑制细胞的有丝分裂,具有广谱抗癌作用[15]。吉西他滨+顺铂或培美曲塞+顺铂化疗方案应用于NSCLC患者的治疗中,可起到协同增效的作用,从而起到有效的抗癌作用。但该方案在对癌细胞进行杀灭的同时可使机体正常组织受损,因而患者耐受性较差,且治疗过程中易出现不良反应,治疗效果有待提升。
目前已有多个免疫检查点抑制剂被用于肿瘤免疫治疗。作为一种新型的程序性死亡受体1抑制剂,替雷利珠单抗被证实适用于难治性经典型霍奇金淋巴瘤的治疗,目前已被应用于其他癌症的治疗中,且取得了较好的治疗效果[16, 17]。本研究结果显示,B组近期总有效率比A组高,表明替雷利珠单抗联合化疗方案治疗NSCLC患者,疗效确切。这是由于替雷利珠单抗进入患者体内后,PD-1受体结合配体PD-L1和PD-L2,上调部分肿瘤细胞PD-1配体,从而对激活的T细胞对肿瘤细胞的免疫监视进行抑制,对该通路进行阻断可以逆转肿瘤免疫微环境,使肿瘤细胞的生长受到抑制。
肿瘤发生后,机体一般会产生适应性的免疫应答来与肿瘤抗原进行对抗,其中有细胞免疫和体液免疫[18]。CD4+百分比的主要作用在于对免疫反应进行调控;CD8+百分比是直接杀伤性细胞;CD4+/CD8+比值水平反映的是细胞免疫功能是否处于平衡状态[19, 20]。本研究结果显示,治疗后B组Ⅲ期、Ⅳ期患者CD4+百分比、CD4+/CD8+比值均相较A组高,而CD8+百分比则相较A组低,提示替雷利珠单抗联合化疗方案应用于NSCLC患者的治疗中,可有效对机体免疫功能进行调节,从而有助于抑制和杀灭肿瘤细胞。其原因可能在于替雷利珠单抗进入机体后,可激活程序性死亡受体1/程序性死亡受体配体1信号通路,从而形成免疫抑制性肿瘤微环境,从而使T细胞的增殖受到抑制,部分肿瘤细胞的程序性死亡受体1上升,通过对该通路进行阻断可以恢复T细胞的增殖、分泌功能,从而抑制肿瘤细胞的生长[21]。同时,本研究显示,治疗后B组Ⅲ期、Ⅳ期患者血清CEA、NSE、SCC水平均比A组低,证实了替雷利珠单抗联合化疗方案用于NSCLC患者的治疗中,可降低血清肿瘤标志物水平,与江红等[22]的研究结果相符。本研究结果显示,B组不良反应总发生率高于A组,其可能原因在于化疗不可避免地会刺激患者的消化系统与骨髓细胞,从而使患者呕吐、骨髓抑制的发生风险增加。本研究中采用QLQ-C30量表对两组患者生存质量进行评价并比较发现,治疗后B组功能子量表、症状子量表、总评分均比A组高,表明替雷利珠单抗联合化疗方案用于NSCLC患者的治疗中,可有助于患者生存质量的改善。
综上所述,替雷利珠单抗联合化疗方案用于NSCLC患者的治疗中,可使血清肿瘤标志物水平下降,并调节免疫功能,提升患者生活质量,临床疗效确切,值得临床推广。
刘孝凤, 潘鑫福, 卢洁. 替雷利珠单抗联合化疗方案治疗中晚期NSCLC疗效观察[J]. 中国基层医药,2024,31(3):347-352. DOI:10.3760/cma.j.cn341190-20230725-00028.
所有作者声明无利益冲突



























