
分析我国消除丙型肝炎(丙肝)的普通人群HCV检测策略的成本效果,明确最佳成本效果的HCV检测年龄。
运用TreeAge pro 2019软件构建决策树马尔科夫模型,以1年为周期,模拟10万名20~59岁各年龄组人群HCV检测和治疗结果,以全社会角度分析策略间比较的成本效果和效益。效果指标为增量成本效果比(ICER),效益指标为净货币效益(NMB),以我国2022年人均国内生产总值(85 698元)为意愿支付阈值。通过单因素敏感性分析和概率敏感性分析评估结果可靠性。
在20~59岁人群HCV检测有成本效果,在40~49岁年龄组进行HCV检测成本效果最佳。20~59岁年龄组人群HCV检测策略与未HCV检测策略比较,增量成本为161.24元/人,增量效用为0.003 6质量调整寿命年(QALYs)/人,ICER为45 197.26元/QALY,ICER小于意愿支付阈值,具有成本效果。各年龄组人群HCV检测策略与未HCV检测策略比较,ICER为42 055.06~53 249.43元/QALY,NMB为96.52~169.86元/人,其中40~49岁年龄组的ICER最低,NMB最高。单因素敏感性分析结果显示,贴现率、丙肝抗体(抗-HCV)检测成本、人群抗-HCV阳性率和直接抗病毒药物治疗成本对经济学评价影响较大,但改变参数取值,结论不变。概率敏感性分析结果表明模型分析结果稳定。
医疗机构探索动员20~59岁普通人群进行HCV检测具有较好的成本效果,以40~49岁年龄组人群的HCV检测成本效果最佳。在我国普通人群中实施HCV检测的“愿检尽检”策略,能降低人群丙肝疾病负担。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2016年,世界卫生大会通过《2016-2021全球卫生部门病毒性肝炎战略》,提出要消除丙型肝炎(丙肝)公共卫生威胁的目标[1],需要检测发现90%的慢性丙肝患者,其中80%患者要接受治疗。我国《消除丙型肝炎公共卫生危害行动工作方案(2021-2030年)》中提出实施普通人群 “愿检尽检”策略,即由医疗卫生机构探索动员≥40岁人群进行丙肝抗体(抗-HCV)检测。本研究构建马尔科夫模型,从全社会角度,对20~59岁人群进行HCV检测和治疗进行卫生经济学评价,为人群HCV检测策略制定和调整提供科学依据。
1. 构建模型:构建我国10万名20~59岁人群HCV检测和治疗的决策树马尔科夫模型,人群转移状态包括[2]:易感者、急性HCV感染、慢性HCV感染[肝纤维化Metavir评分:慢性丙肝纤维化F0期(F0);慢性丙肝纤维化F1期(F1);慢性丙肝纤维化F2期(F2);慢性丙肝纤维化F3期(F3);代偿期肝硬化(CC);失代偿期肝硬化(DC);肝细胞癌(HCC)]、肝移植、自然死亡和HCV相关死亡。见图1。人群在模型初始循环周期中的分布,按照不同年龄的抗-HCV流行率和慢性HCV感染者在各转移状态中的分布情况设置。易感者感染HCV后进入急性HCV感染阶段,85%的急性HCV感染者表现为无症状感染,有临床症状与无症状急性HCV感染者的自发清除率分别为37.50%(25.00%~50.00%)和12.54%(10.00%~15.00%)[3],其他状态按照一定概率实现疾病状态转移。
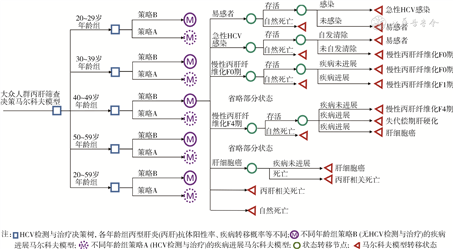

2. 检测和治疗策略:本研究共A、B两种研究策略。A为研究策略,即对20~59岁人群进行HCV检测;同时分别对20~29、30~39、40~49、50~59和20~59岁5个年龄组人群HCV检测策略(分别为A1、A2、A3、A4和A5策略)进行成本效果分析,并进行了优化。B为对照策略,即不对20~59岁各年龄组进行HCV检测。实现WHO的丙肝消除目标要达到90%的检出率和80%的治疗率,由于检出率在实际工作中难以计算,本研究以90%的检测率代替90%的检出率进行模拟。
A研究策略对人群进行HCV检测,检测及管理流程按照中华人民共和国卫生行业标准《丙型病毒性肝炎筛查及管理》流程[4],检测方法包括抗-HCV检测、HCV RNA检测和HCV基因分型检测。人群抗-HCV检测阳性后接受HCV RNA检测,HCV RNA检测阳性为现症感染者,HCV RNA检测阴性为既往感染或急性丙肝低病毒血症期。HCV RNA阳性者接受直接抗病毒药物(DAAs)治疗,由于泛基因型和基因特异性DAAs在各基因型的中国丙肝患者中,持续治疗12周后,90%以上的患者可获得持续病毒学应答(SVR)[5],因此研究不区分HCV基因型。
3. 模型参数:包括流行病学数据(抗-HCV阳性率和抗-HCV阳性者HCV RNA阳性比)、临床观察数据、人群自然死亡率、成本和效用数据等。
(1)流行病学数据:抗-HCV阳性率来自2006年的中国丙肝血清流行病学研究[6];抗- HCV阳性者HCV RNA阳性比例来自一项中国的调查研究[7](表1)。
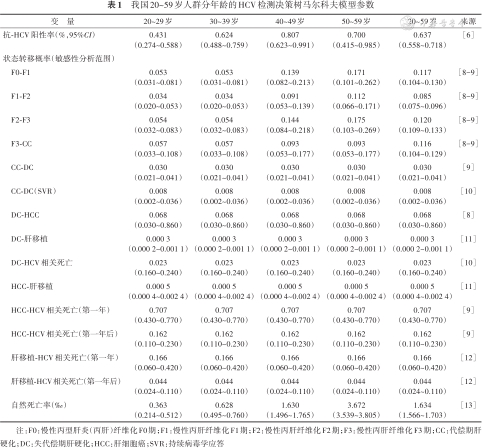
我国20~59岁人群分年龄的HCV检测决策树马尔科夫模型参数
我国20~59岁人群分年龄的HCV检测决策树马尔科夫模型参数
| 变 量 | 20~29岁 | 30~39岁 | 40~49岁 | 50~59岁 | 20~59岁 | 来源 |
|---|---|---|---|---|---|---|
| 抗-HCV阳性率(%,95%CI) | 0.431 (0.274~0.588) | 0.624 (0.488~0.759) | 0.807 (0.623~0.991) | 0.700 (0.415~0.985) | 0.637 (0.558~0.718) | [6] |
| 状态转移概率(敏感性分析范围) | ||||||
| F0-F1 | 0.053 (0.031~0.081) | 0.053 (0.031~0.081) | 0.139 (0.082~0.213) | 0.171 (0.101~0.262) | 0.117 (0.104~0.130) | [8, 9] |
| F1-F2 | 0.034 (0.020~0.053) | 0.034 (0.020~0.053) | 0.091 (0.053~0.139) | 0.112 (0.066~0.171) | 0.085 (0.075~0.096) | [8, 9] |
| F2-F3 | 0.054 (0.032~0.083) | 0.054 (0.032~0.083) | 0.144 (0.084~0.218) | 0.175 (0.103~0.269) | 0.120 (0.109~0.133) | [8, 9] |
| F3-CC | 0.057 (0.033~0.108) | 0.057 (0.033~0.108) | 0.093 (0.053~0.177) | 0.093 (0.053~0.177) | 0.116 (0.104~0.129) | [8, 9] |
| CC-DC | 0.030 (0.021~0.041) | 0.030 (0.021~0.041) | 0.030 (0.021~0.041) | 0.030 (0.021~0.041) | 0.030 (0.021~0.041) | [9] |
| CC-DC(SVR) | 0.008 (0.002~0.036) | 0.008 (0.002~0.036) | 0.008 (0.002~0.036) | 0.008 (0.002~0.036) | 0.008 (0.002~0.036) | [10] |
| DC-HCC | 0.068 (0.030~0.860) | 0.068 (0.030~0.860) | 0.068 (0.030~0.860) | 0.068 (0.030~0.860) | 0.068 (0.030~0.860) | [8] |
| DC-肝移植 | 0.000 3 (0.000 2~0.001 1) | 0.000 3 (0.000 2~0.001 1) | 0.000 3 (0.000 2~0.001 1) | 0.000 3 (0.000 2~0.001 1) | 0.000 3 (0.000 2~0.001 1) | [11] |
| DC-HCV相关死亡 | 0.023 (0.160~0.240) | 0.023 (0.160~0.240) | 0.023 (0.160~0.240) | 0.023 (0.160~0.240) | 0.023 (0.160~0.240) | [10] |
| HCC-肝移植 | 0.000 5 (0.000 4~0.002 4) | 0.000 5 (0.000 4~0.002 4) | 0.000 5 (0.000 4~0.002 4) | 0.000 5 (0.000 4~0.002 4) | 0.000 5 (0.000 4~0.002 4) | [11] |
| HCC-HCV相关死亡(第一年) | 0.707 (0.430~0.770) | 0.707 (0.430~0.770) | 0.707 (0.430~0.770) | 0.707 (0.430~0.770) | 0.707 (0.430~0.770) | [9] |
| HCC-HCV相关死亡(第一年后) | 0.162 (0.110~0.230) | 0.162 (0.110~0.230) | 0.162 (0.110~0.230) | 0.162 (0.110~0.230) | 0.162 (0.110~0.230) | [9] |
| 肝移植-HCV相关死亡(第一年) | 0.166 (0.060~0.420) | 0.166 (0.060~0.420) | 0.166 (0.060~0.420) | 0.166 (0.060~0.420) | 0.166 (0.060~0.420) | [12] |
| 肝移植-HCV相关死亡(第一年后) | 0.044 (0.024~0.110) | 0.044 (0.024~0.110) | 0.044 (0.024~0.110) | 0.044 (0.024~0.110) | 0.044 (0.024~0.110) | [12] |
| 自然死亡率(‰) | 0.363 (0.214~0.512) | 0.628 (0.495~0.760) | 1.630 (1.496~1.765) | 3.672 (3.539~3.805) | 1.634 (1.566~1.703) | [13] |
注:F0:慢性丙型肝炎(丙肝)纤维化F0期;F1:慢性丙肝纤维化F1期;F2:慢性丙肝纤维化F2期;F3:慢性丙肝纤维化F3期;CC:代偿期肝硬化;DC:失代偿期肝硬化;HCC:肝细胞癌;SVR:持续病毒学应答
(2)临床观察数据:分年龄的丙肝疾病状态转移概率来自北极星实验室的研究[14],中国男性和女性的抗-HCV阳性率差异无统计学意义(0.46%和0.40%)[6],因此研究未区分性别;全国法定传染病报告中丙肝新报告病例中男女性别比为1.39∶1[15],同时防止低估疾病进展速度,选择进展速度更快的男性的丙肝疾病状态转移概率进行模型计算(表1)。
(3)人群自然死亡率来自2020年中国人口普查年鉴[13],通过计算获得(表1)。
(4)成本和效用数据:成本包括抗-HCV检测和HCV RNA检测费用、HCV基因型分型费用、DAAs治疗费用、各疾病阶段健康管理费用和肝移植费用,成本敏感性分析范围为±20%(表2)。其中各疾病阶段健康管理费用来源于2019年的研究[16],按照贴现率折算成2022年的价格,贴现率为5%(0%~8%)[17]。
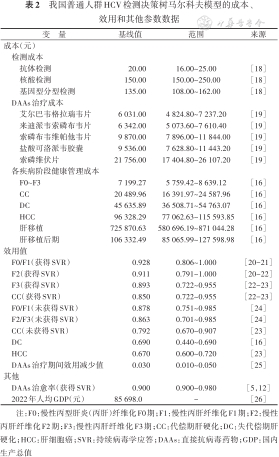
我国普通人群HCV检测决策树马尔科夫模型的成本、效用和其他参数数据
我国普通人群HCV检测决策树马尔科夫模型的成本、效用和其他参数数据
| 变 量 | 基线值 | 范围 | 来源 |
|---|---|---|---|
| 成本(元) | |||
| 检测成本 | |||
| 抗体检测 | 20.00 | 16.00~25.00 | [18] |
| 核酸检测 | 150.00 | 150.00~250.00 | [18] |
| 基因型分型检测 | 135.00 | 108.00~162.00 | [18] |
| DAAs治疗成本 | |||
| 艾尔巴韦格拉瑞韦片 | 6 031.00 | 4 824.80~7 237.20 | [19] |
| 来迪派韦索磷布韦片 | 6 342.00 | 5 073.60~7 610.40 | [19] |
| 索磷布韦维帕他韦片 | 9 870.00 | 7 896.00~11 844.00 | [19] |
| 盐酸可洛派韦胶囊 | 9 536.00 | 7 628.80~11 443.20 | [19] |
| 索磷维伏片 | 21 756.00 | 17 404.80~26 107.20 | [19] |
| 各疾病阶段健康管理成本 | |||
| F0~F3 | 7 199.27 | 5 759.42~8 639.12 | [16] |
| CC | 20 489.96 | 16 391.97~24 587.96 | [16] |
| DC | 45 635.89 | 36 508.71~54 763.07 | [16] |
| HCC | 96 328.29 | 77 062.63~115 593.85 | [16] |
| 肝移植 | 725 870.63 | 580 696.19~871 044.28 | [16] |
| 肝移植后期 | 106 332.49 | 85 065.99~127 598.98 | [16] |
| 效用值 | |||
| F0/F1(获得SVR) | 0.928 | 0.806~1.000 | [20, 21] |
| F2(获得SVR) | 0.911 | 0.791~1.000 | [20, 21, 22] |
| F3(获得SVR) | 0.893 | 0.722~0.955 | [22, 23] |
| CC(获得SVR) | 0.850 | 0.722~0.955 | [22, 23] |
| F0/F1(未获得SVR) | 0.878 | 0.751~0.985 | [24] |
| F2/F3(未获得SVR) | 0.863 | 0.701~0.985 | [24] |
| CC(未获得SVR) | 0.792 | 0.670~0.907 | [23] |
| DC | 0.690 | 0.440~0.690 | [16] |
| HCC | 0.670 | 0.600~0.720 | [23] |
| DAAs治疗期间效用减少值 | 0.030 | 0.010~0.050 | [25] |
| 其他 | |||
| DAAs治愈率(获得SVR) | 0.900 | 0.900~0.980 | [5,12] |
| 2022年人均GDP(元) | 85 698.0 | - | [26] |
注:F0:慢性丙型肝炎(丙肝)纤维化F0期;F1:慢性丙肝纤维化F1期;F2:慢性丙肝纤维化F2期;F3:慢性丙肝纤维化F3期;CC:代偿期肝硬化;DC:失代偿期肝硬化;HCC:肝细胞癌;SVR:持续病毒学应答;DAAs:直接抗病毒药物;GDP:国内生产总值
4. 分析指标:
(1)主要健康产出:模拟10 000次蒙特卡罗模拟获得不同策略的新发慢性丙肝患者数、新发DC患者数、新发HCC患者数和丙肝相关死亡患者数,计算比较策略与对照策略比较下主要健康产出减少的比例。
(2)成本、效果和效益:采用全社会视角,HCV检测和治疗的总成本包括抗-HCV和HCV RNA检测成本、DAAs治疗成本、肝硬化和HCC治疗成本及肝移植治疗成本(直接医疗成本),住院费、交通费和食宿费等(直接非医疗成本),以及未能阻断丙肝疾病进展出现不良疾病结局导致损失的劳动力成本(间接成本)。效果为不同策略的质量调整寿命年(QALYs)。效益指标为净货币效益(NMB),NMB是干预策略在贴现后的总收益与总成本的差值,在全社会角度,只有NMB>0的方案才是可行的,才可能增加资源的使用效率[27]。净效益计算公式:NMB=λ×ΔE-ΔC,其中ΔE为策略间效益的差值,ΔC为策略间成本的差值,λ是意愿支付(WTP)阈值,本研究采用1倍的人均国内生产总值(GDP)为WTP阈值。
(3)成本效果分析:以增量成本效果比(ICER)和成本效果比(CER)为检测策略比较的评价指标。计算公式:;其中和分别表示研究策略和对照策略的成本,和分别表示研究策略和对照策略的效果。按照WHO推荐的成本效果评价标准,当ICER<0,表示多获得1个QALY节约成本,最具有成本效果;当0<ICER<1倍人均GDP时策略具有较高成本效果。计算CER,即获得1个QALY时所需的成本,公式:;其中和分别表示策略在第t年的成本和效果值,t为年份或循环周期,n为期望寿命,i为贴现率[28]。
5. 敏感性分析:单因素敏感性分析(DSA)通过在给定的取值范围内逐个改变模型参数的取值,获得相应的ICER,以ICER为坐标轴绘制旋风图观察各参数对HCV检测策略成本效果评价指标ICER的影响大小。概率敏感性分析(PSA)采用蒙特卡罗模拟在给定参数分布情况下模拟运行1 000次,疾病转移概率服从Beta分布,成本数据服从Gamma分布。以增量成本和增量效果为纵轴与横轴绘制反映ICER分布的成本效果散点图,根据散点图中95%的散点分布位置和趋势,判断所比较的检测策略的经济学意义和结果的可靠性[28]。
1. 经济学评价结果:
(1)主要健康产出:分析结果显示,人群实施HCV检测可以减少新发慢性丙肝患者、新发DC患者数和新发HCC患者数。人群在无HCV检测策略(策略B)下,10年内各年龄组新发慢性丙肝患者数平均为441.08~533.42人,新发DC患者数平均为8.70~12.33人,新发HCC患者数平均为4.44~5.49人,丙肝相关死亡数平均为1.70~2.16人。各年龄组人群HCV检测策略(策略A)的新发慢性丙肝患者数、新发DC患者数和新发HCC患者数较策略B明显减少,减少比例分别为94.18%~ 96.02%、29.20%~49.55%、68.24%~73.04%和10.59%~ 29.63%(表3)。
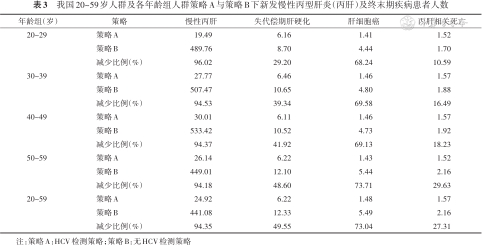
我国20~59岁人群及各年龄组人群策略A与策略B下新发慢性丙型肝炎(丙肝)及终末期疾病患者人数
我国20~59岁人群及各年龄组人群策略A与策略B下新发慢性丙型肝炎(丙肝)及终末期疾病患者人数
| 年龄组(岁) | 策略 | 慢性丙肝 | 失代偿期肝硬化 | 肝细胞癌 | 丙肝相关死亡 |
|---|---|---|---|---|---|
| 20~29 | 策略A | 19.49 | 6.16 | 1.41 | 1.52 |
| 策略B | 489.76 | 8.70 | 4.44 | 1.70 | |
| 减少比例(%) | 96.02 | 29.20 | 68.24 | 10.59 | |
| 30~39 | 策略A | 27.77 | 6.46 | 1.46 | 1.57 |
| 策略B | 507.47 | 10.65 | 4.80 | 1.88 | |
| 减少比例(%) | 94.53 | 39.34 | 69.58 | 16.49 | |
| 40~49 | 策略A | 30.01 | 6.11 | 1.46 | 1.57 |
| 策略B | 533.42 | 10.52 | 4.73 | 1.92 | |
| 减少比例(%) | 94.37 | 41.92 | 69.13 | 18.23 | |
| 50~59 | 策略A | 26.14 | 6.22 | 1.43 | 1.52 |
| 策略B | 449.01 | 12.10 | 5.44 | 2.16 | |
| 减少比例(%) | 94.18 | 48.60 | 73.71 | 29.63 | |
| 20~59 | 策略A | 24.92 | 6.22 | 1.48 | 1.57 |
| 策略B | 441.08 | 12.33 | 5.49 | 2.16 | |
| 减少比例(%) | 94.35 | 49.55 | 73.04 | 27.31 |
注:策略A:HCV检测策略;策略B:无HCV检测策略
(2)成本效果分析:以策略B为对照,策略A为比较策略,分析结果显示,20~59岁人群进行HCV检测具有成本效果。20~59岁人群策略A与策略B相比,增量效果为0.003 6 QALYs/人,增量成本为161.24元/人,ICER为45 197.26元/QALY,ICER<1倍的我国人均GDP(2022年),表明在我国20~59岁人群进行HCV检测策略符合成本效果(表4)。
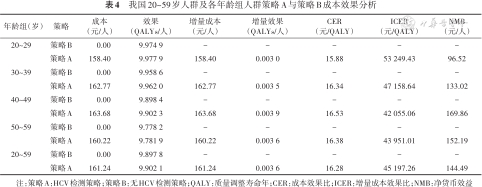
我国20~59岁人群及各年龄组人群策略A与策略B成本效果分析
我国20~59岁人群及各年龄组人群策略A与策略B成本效果分析
| 年龄组(岁) | 策略 | 成本 (元/人) | 效果 (QALYs/人) | 增量成本 (元/人) | 增量效果 (QALYs/人) | CER (元/QALY) | ICER (元/QALY) | NMB (元/人) |
|---|---|---|---|---|---|---|---|---|
| 20~29 | 策略B | 0.00 | 9.974 9 | - | - | - | - | - |
| 策略A | 158.40 | 9.977 9 | 158.40 | 0.003 0 | 15.88 | 53 249.43 | 96.52 | |
| 30~39 | 策略B | 0.00 | 9.958 6 | - | - | - | - | - |
| 策略A | 162.77 | 9.962 0 | 162.77 | 0.003 5 | 16.34 | 47 158.64 | 133.02 | |
| 40~49 | 策略B | 0.00 | 9.898 4 | - | - | - | - | - |
| 策略A | 163.68 | 9.902 3 | 163.68 | 0.003 9 | 16.53 | 42 055.06 | 169.86 | |
| 50~59 | 策略B | 0.00 | 9.778 2 | - | - | - | - | - |
| 策略A | 160.22 | 9.781 9 | 160.22 | 0.003 6 | 16.38 | 43 951.01 | 152.19 | |
| 20~59 | 策略B | 0.00 | 9.897 8 | - | - | - | - | - |
| 策略A | 161.24 | 9.902 1 | 161.24 | 0.003 6 | 16.28 | 45 197.26 | 144.49 |
注:策略A:HCV检测策略;策略B:无HCV检测策略;QALY:质量调整寿命年;CER:成本效果比;ICER:增量成本效果比;NMB:净货币效益
以20~29、30~39、40~49、50~59和20~59岁年龄组的策略B为对照,策略A为比较策略,分析结果显示(表4),在40~49岁年龄组进行HCV检测最具成本效果。各年龄组的增量效果为0.003 0~0.003 6 QALYs/人,增量成本为158.40~163.68元/人,ICER为42 055.06~53 249.43元/QALY。其中,40~49岁年龄组的ICER最低,为42 055.06元/QALY,其次为50~59岁年龄组的43 951.01元/QALY,在获得相同效果时40~49岁年龄组的成本最低;40~49岁和50~59岁年龄组ICER低于20~59岁人群,20~29岁和30~39岁人群ICER高于20~59岁人群,在高年龄组进行HCV检测获得相同效果时成本更低。
(3)成本效益分析:以策略B为对照,策略A为比较策略,结果表明在各年龄组进行HCV检测具有成本效益。各年龄组NMB在96.52~169.86元/人,说明对人群进行HCV检测是可行的,可能增进资源利用效率。其中,40~49岁年龄组人均NMB最高,在40~49岁年龄组进行HCV检测最具成本效益(表4)。
2. 敏感性分析:
(1)DSA:各年龄组DSA结果表明,模型主要参数对分析结果影响方向相同,主要参数在取值范围内变化得到的ICER均在1倍的人均GDP内,以40~49岁年龄组,策略A与策略B进行DSA为例(图2),其中贴现率、抗-HCV检测成本、抗-HCV阳性率和DAAs治疗成本对ICER影响较大。抗-HCV检测成本和DAAs检测成本增加使ICER增高,即获得相同QALYs付出的成本更多;抗-HCV阳性率和抗-HCV阳性中核酸阳性率增加时ICER降低,即获得相同QALYs付出的成本减少。
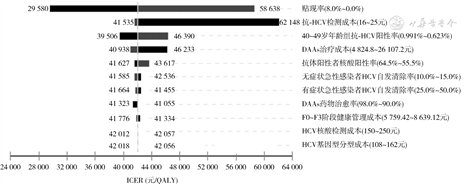

注:ICER:增量成本效果比;DAAs:直接抗病毒药物;QALY:质量调整寿命年;F0~F3:慢性丙型肝炎纤维化F0~F3期
(2)PSA:增量成本效果散点图显示,所有散点均在第一象限内,表明成本效果分析结果可靠,增加成本可以获得更多效果。所有散点均在WTP阈值(1倍的人均GDP)以下,说明人群进行HCV检测和治疗具有较高成本效果。
我国普通人群抗-HCV阳性率和自然死亡率存在年龄差异,感染HCV后疾病进展速度随年龄增长加快[29],对不同年龄人群进行丙肝筛查的收益不同。本研究对20~59岁人群HCV检测进行经济学评价,结果显示在20~59岁人群进行HCV检测与未进行HCV检测相比,ICER为45 197.26元/QALY,低于我国1倍的人均GDP(2022年),具有成本效果。各年龄组经济学评价显示,人群进行HCV检测与未进行HCV检测相比,ICER在40~49岁年龄组最低,为42 055.06元/QALY,即在40~49岁年龄组进行HCV检测的成本效果最佳。20~59岁人群进行HCV检测也具有成本效果,开展HCV检测有利于提高资源利用效率。
本研究显示,20~59岁人群进行HCV检测和治疗符合经济学原则,可以在我国医疗机构动员20~59岁人群进行HCV检测。WHO和美国CDC推荐人群HCV RNA阳性率不低于0.1%的地区,≥18岁人群一生中至少应接受一次HCV检测[5,30],我国1~59岁人群抗-HCV阳性率为0.43%,抗-HCV阳性人群中HCV RNA阳性率为60.0%(95%CI:55.5%~64.5%)[7],应推荐进行HCV检测。根据丙肝血清流行病学调查结合高风险人群检测结果,估计我国有760万HCV感染者,但截至2021年底我国累计报告病例约290万,我国HCV感染者检测发现率低[15],通过实施大众人群“愿检尽检”策略和“抗-HCV阳性者HCV RNA检测全覆盖”等策略,早期发现HCV感染者,减少肝硬化和HCC等丙肝终末期疾病阶段患者,可以减轻我国丙肝疾病负担。
各年龄组人群中进行HCV检测经济学评价,在40~49年龄组人群进行HCV检测获得相同效果需要的成本最低,与该年龄组人群丙肝流行率较高和疾病进展速度较快有关。我国40~59岁人群抗- HCV阳性率高于其他年龄组[6],本研究结果显示,在40~49岁和50~59岁年龄组HCV检测策略与未HCV检测策略比较的ICER分别为42 055.06和43 951.01元/QALY,低于20~59岁人群,在抗-HCV流行率高的年龄组进行HCV检测收益更高。Girardin等[31]评估对瑞士精神疾病入院患者扩大HCV检测进行成本效果分析,与瑞士当前的检测策略相比,目标人群HCV流行率越高时进行丙肝常规检测的ICER越小,以10万美元为WTP阈值,当目标人群丙肝流行率低于0.07%时NMB<0,即扩大检测不具有成本效果。在40~49岁年龄组进行HCV检测成本效果好也可能与不同年龄HCV疾病进展快慢有关,患者感染HCV的年龄越大,丙肝疾病进展越快,进入肝硬化、HCC和丙肝相关死亡的风险越高[32],有研究显示40~70岁年龄组患者感染HCV后因丙肝死亡概率是其他年龄组的2倍[33]。
我国针对40岁以上人群实施的“愿检尽检”策略,扩大HCV检测年龄和提高HCV检测、治疗依从性有助于消除丙肝公共卫生威胁目标。在40~49岁年龄组进行HCV检测最具成本效果,在20~29、30~39岁年龄组依然有成本效果,因此在抗- HCV阳性率低的20~29、30~39岁年龄组早检测、早治疗可行。国外研究同样支持该结论,Deuffic-Burban等[34]对法国不同HCV检测和治疗策略进行模型分析,结果表明早治疗更具成本效果,当患者治疗起点分别为晚于F1期和任意治疗起点时,在18~80岁人群中HCV检测ICER为147 200和31 100欧元/QALY。提高人群HCV检测率和治疗依从性,同样具有成本效果,Coffin等[35]对美国人群扩大HCV检测进行成本效果分析,当检测率提高到60%,与检测率15%和基于危险行为的机会性检测相比,ICER分别为12 400和10 900美元/QALY,具有成本效果。
DSA结果显示,主要参数取值变化时,人群HCV检测与未检测策略比较,对抗-HCV阳性率较高人群进行HCV检测更具成本效果,因此,使用一般人群抗-HCV阳性率代替医疗机构就诊者抗-HCV阳性率,进行经济学评价的结论不变。人群HCV检测与未检测策略比较的经济学评价中,贴现率对ICER影响较大,本研究对成本和健康产出均进行贴现,结果显示,贴现率在敏感性分析范围变化时,HCV检测策略均有成本效果。疾病转移概率对经济学评价结果影响较小,使用来源于国外临床研究的疾病转移概率结果可靠。抗-HCV检测成本和DAAs治疗成本升高时ICER增加,我国正不断推动DAAs国家医保谈判,纳入医保的DAAs已有8种(截至2023年3月),同时加强医疗保障、卫生健康、民政等部门协作,减轻患者诊疗经济负担。人群抗-HCV升高时ICER降低,提示在丙肝防治工作中,将资源合理分配至抗- HCV阳性率高的年龄组,有利于资源利用效率。
本研究存在局限性。一是研究中抗-HCV阳性率数据来源于2006年全国丙肝血清流行病学调查,目前仍被广泛应用于中国丙肝疫情估计和相关研究[9,12,14],研究结果被广泛引用[5],目前尚无最新调查数据;二是医疗机构就诊者抗-HCV阳性率高于一般人群抗-HCV阳性率[36],利用一般人群抗-HCV阳性率分析可能低估在医疗机构探索动员人群的成本效果;三是疾病转移概率来源于国外临床研究和Meta分析,样本量大,且国内外丙肝患者疾病进展主要受感染的HCV基因型影响,地区间差异较小[2]。
综上所述,在20~59岁人群进行HCV检测均有较好的成本效果,在40~49岁人群进行HCV检测成本效果最好。我国人口基数大,在医疗机构检测发现HCV感染者,省时省力的同时有利于提高患者治疗的依从性,要大力实施医疗机构探索动员≥40岁人群进行HCV检测的“愿检尽检”策略。提高人群HCV检测率,扩大人群HCV筛查年龄,能降低人群丙肝疾病负担,有助于实现消除丙肝公共卫生威胁目标。
刘鹏程, 徐迪, 丁国伟, 等. 我国消除丙型肝炎的普通人群HCV检测策略的成本效果分析[J]. 中华流行病学杂志, 2024, 45(3): 464-472. DOI: 10.3760/cma.j.cn112338-20230908-00140.
Liu PC, Xu D, Ding GW, et al. Cost-effectiveness of HCV testing strategies for hepatitis C elimination in general population in China[J]. Chin J Epidemiol, 2024, 45(3):464-472. DOI: 10.3760/cma.j.cn112338-20230908-00140.
所有作者声明无利益冲突



























