
探讨孕晚期B族链球菌(group B streptococcus,GBS)定植对孕妇阴道微生态及新生儿结局的影响。
选择2020年9月至2021年9月于北京市顺义区妇幼保健院接受产前检查并分娩的孕妇进行前瞻性研究,根据孕妇阴道分泌物GBS培养和(或)聚合酶链式反应检测结果将孕妇分为GBS阳性组和GBS阴性组,根据新生儿是否存在早发感染将孕妇分为早发感染组和非早发感染组,比较不同组间孕妇阴道微生态情况及新生儿结局。
共纳入125例孕妇,其中GBS阳性组65例(52.0%)、GBS阴性组60例(48.0%);早发感染组24例(19.2%)、非早发感染组101例(80.8%)。GBS阳性组孕妇胎膜早破、羊水污染、绒毛膜羊膜炎、新生儿早发感染比例明显高于阴性组,差异有统计学意义(P<0.05)。孕妇GBS阳性组阴道菌群中链球菌属和脲原体属丰度高于GBS阴性组(P<0.01),而红球菌属、叶杆菌属、双歧杆菌属丰度低于GBS阴性组(P<0.05)。早发感染组孕妇肠球菌属丰度高于非早发感染组,差异有统计学意义(P<0.05)。GBS阳性且存在新生儿早发感染组的孕妇阴道菌群中大肠埃希-志贺菌属丰度较其余3组高,GBS阳性但未发生新生儿早发感染组的孕妇阴道菌群中加德纳氏菌属丰度较其余3组高,差异均有统计学意义(P<0.05)。
孕妇GBS定植增加胎膜早破、羊水污染、绒毛膜羊膜炎、新生儿早发感染的发生风险。GBS定植导致孕妇阴道菌群结构紊乱,阴道菌群中脲原体属、链球菌属、大肠埃希-志贺菌属、肠球菌属的增加可能与新生儿早发感染的发生相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
B族链球菌(group B streptococcus,GBS)是定植于人类下消化道和泌尿生殖道的革兰氏阳性球菌,是导致围生期母婴不良结局的主要病原菌之一。全球约18%的女性存在GBS生殖道定植[1],孕晚期GBS定植可明显增加胎膜早破、绒毛膜羊膜炎、新生儿肺炎、新生儿早发败血症等发生率[2]。产前预防性应用抗菌药物使新生儿早发感染发病率显著下降,但仍有发生[3, 4]。不合理使用抗菌药物会增加新生儿早发GBS感染和耐药风险。国内外研究发现健康女性阴道菌群以乳酸杆菌为主,有多种微生物共存。阴道菌群紊乱与胎膜早破、绒毛膜羊膜炎、新生儿早发败血症、早产相关[5, 6, 7]。目前我国对GBS定植孕妇阴道微生态情况研究较少,GBS定植对阴道菌群的影响、与新生儿早发感染的相关性还需进一步探讨。本研究分析孕晚期GBS定植孕妇的阴道微生态情况,探讨孕晚期GBS定植对孕妇阴道微生态及新生儿结局的影响,以期加深对GBS感染发病机制的研究,为母婴GBS相关疾病的治疗和预防提供依据。
前瞻性选择2020年9月至2021年9月于北京市顺义区妇幼保健院接受产前检查并分娩的孕妇为研究对象。纳入标准:(1)孕周≥32周且<42周,经阴道分娩;(2)宫内单胎妊娠;(3)采样前1个月内未使用抗菌药物和益生菌。排除标准:(1)免疫抑制剂用药史;(2)有人乳头状瘤病毒、梅毒、艾滋病病毒感染、宫颈癌等;(3)取样前进行阴道冲洗、放药等操作;(4)产前筛查存在胎儿畸形需要引产;(5)习惯性流产。本研究通过我院医学伦理委员会审批(2019-11),孕妇及家属均签署知情同意书。
1.资料收集:收集孕妇年龄、检测孕周、分娩孕周、分娩次数、采样后至产前抗菌药物使用情况、受教育程度、生活环境等;收集新生儿胎龄、出生体重、有无生后窒息、感染、黄疸情况等。
2.分组情况:(1)根据是否存在GBS定植,将孕妇分为GBS阳性组和GBS阴性组;(2)根据是否存在新生儿早发感染,将孕妇分为早发感染组和非早发感染组;(3)将存在GBS定植且发生新生儿感染的孕妇记为GG组,存在GBS定植但无新生儿感染的孕妇记为GN组,无GBS定植但发生新生儿感染的孕妇记为NG组,无GBS定植且无新生儿感染的孕妇记为NN组。
3.样本采集及检测:所有入组孕妇于分娩前最后一次产检时采样,半小时内送检进行细菌培养及聚合酶链式反应(polymerase chain reaction,PCR)检测。同时留取另一拭子于-80℃冰箱保存,后续采用荧光定量PCR方法检测GBS特定基因。
4.孕妇阴道微生态检测:根据DNA抽提试剂盒说明书进行微生物群落总DNA抽提,对样本DNA进行纯度和浓度测定,检测DNA的完整性。使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对16S rRNA基因V3-V4可变区进行PCR扩增,使用2%琼脂糖凝胶回收PCR产物,使用AxyPrep DNA凝胶提取试剂盒纯化回收产物,使用Quantus™荧光计检测并定量回收的产物。使用Illumina Miseq PE300平台进行测序。使用fastp软件(版本0.20.0)对原始测序序列进行质控[8],使用FLASH软件(版本1.2.7)进行拼接[9]。使用UPARSE软件(版本7.1),基于97%的相似性对序列进行操作分类单元聚类并消除嵌合体[10]。使用RDP分类器(版本2.2)注释每个序列的物种分类[11]。
5.相关定义:(1)GBS定植:孕妇阴道GBS细菌培养和(或)PCR检测阳性。(2)新生儿早发感染:即生后72 h内发生的感染,包括新生儿感染性肺炎、败血症、化脓性脑膜炎等。(3)新生儿病理性黄疸诊断参照第5版《实用新生儿学》[12]。(4)胎儿宫内窘迫和绒毛膜羊膜炎诊断参照第9版《妇产科学》[13]。
应用SPSS 26.0统计软件进行数据分析。正态分布的连续变量以表示,两组间比较采用t检验;计数资料以例(%)表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
共1 320例孕妇符合纳入标准,排除采样前阴道冲洗及放药462例、失访720例、梅毒11例、使用免疫抑制剂2例,最终纳入125例,其中GBS阳性组65例(52.0%)、GBS阴性组60例(48.0%);早发感染组24例(19.2%),非早发感染组101例(80.8%);GG组19例(15.2%),GN组46例(36.8%),NG组5例(4.0%),NN组55例(44.0%)。GBS阳性组和GBS阴性组孕妇年龄、检测孕周、分娩孕周、分娩次数、采样后至产前抗菌药物使用、受教育程度等方面比较差异无统计学意义(P>0.05),见表1。
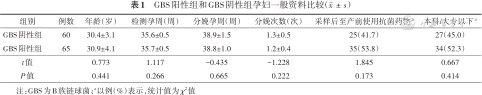
GBS阳性组和GBS阴性组孕妇一般资料比较()
GBS阳性组和GBS阴性组孕妇一般资料比较()
| 组别 | 例数 | 年龄(岁) | 检测孕周(周) | 分娩孕周(周) | 分娩次数(次) | 采样后至产前使用抗菌药物a | 本科/大专以下a |
|---|---|---|---|---|---|---|---|
| GBS阴性组 | 60 | 30.4±3.1 | 35.6±0.5 | 38.9±1.5 | 1.3±0.5 | 25(41.7) | 27(45.0) |
| GBS阳性组 | 65 | 30.9±4.1 | 35.7±0.5 | 38.8±1.0 | 1.2±0.4 | 35(53.8) | 34(52.3) |
| t值 | 0.773 | 1.117 | -0.435 | -1.228 | 1.845 | 0.667 | |
| P值 | 0.441 | 0.266 | 0.665 | 0.222 | 0.173 | 0.414 |
注:GBS为B族链球菌;a以例(%)表示,统计值为χ2值
两组孕妇均未发生早产。GBS阳性组胎膜早破、羊水污染、绒毛膜羊膜炎、新生儿感染发生率均高于GBS阴性组,差异有统计学意义(P<0.05);两组巨大儿、窒息、宫内窘迫、新生儿病理性黄疸比例比较差异无统计学意义(P>0.05),见表2。
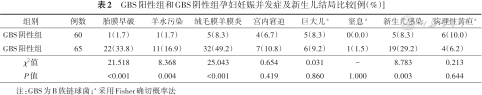
GBS阳性组和GBS阴性组孕妇妊娠并发症及新生儿结局比较[例(%)]
GBS阳性组和GBS阴性组孕妇妊娠并发症及新生儿结局比较[例(%)]
| 组别 | 例数 | 胎膜早破 | 羊水污染 | 绒毛膜羊膜炎 | 宫内窘迫 | 巨大儿a | 窒息a | 新生儿感染 | 病理性黄疸a |
|---|---|---|---|---|---|---|---|---|---|
| GBS阴性组 | 60 | 1(1.7) | 1(1.7) | 5(8.3) | 4(6.7) | 5(8.3) | 0(0.0) | 5(8.3) | 6(10.0) |
| GBS阳性组 | 65 | 22(33.8) | 11(16.9) | 32(49.2) | 7(10.8) | 6(9.2) | 1(1.5) | 19(29.2) | 4(6.2) |
| χ2值 | 21.518 | 8.368 | 25.043 | 0.654 | 0.031 | - | 8.783 | 0.213 | |
| P值 | <0.001 | 0.004 | <0.001 | 0.419 | 0.860 | 1.000 | 0.003 | 0.644 |
注:GBS为B族链球菌;a 采用Fisher确切概率法
共收集125个孕妇阴道分泌物样本,得到2 622个操作分类单元。随机抽取一定数量的序列,计算相应样本的Alpha多样性指数,绘制稀释曲线,曲线趋于平缓,表明本研究得到的测序数据量是合理的,可用于进一步分析。
在属水平,GBS阳性组加德纳氏菌属、链球菌属、脲原体属相对丰度高于GBS阴性组,红球菌属、叶杆菌属和双歧杆菌属相对丰度低于GBS阴性组,差异有统计学意义(P<0.05)。见图1。
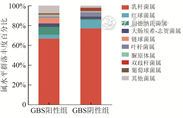

注:GBS为B族链球菌
新生儿早发感染组孕妇阴道菌群中叶杆菌属、双歧杆菌属相对丰度低于非早发感染组,差异有统计学意义(P<0.05)。早发感染组孕妇阴道菌群中大肠埃希-志贺菌属和链球菌属占比分别为6.0%和7.2%,非早发感染组分别为2.4%和2.1%,但两组比较差异无统计学意义(P>0.05),见图2。肠球菌属在早发感染组占比为0.17%,非早发感染组为0.07%,两组比较差异有统计学意义(P<0.05)。
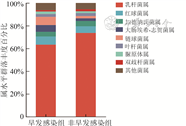

4组中,GN组菌群丰度最高,NN组最低。4组间两两比较发现,NG组红球菌属、叶杆菌属丰度最高,GN组加德纳氏菌属丰度最高,GG组大肠埃希-志贺菌属丰度最高,差异均有统计学意义(P<0.05)。见图3。
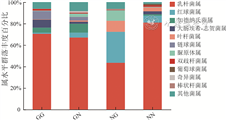

注:GG组为孕妇存在GBS定植且发生新生儿感染,GN组为孕妇存在GBS定植但无新生儿感染,NG组为孕妇无GBS定植但存在新生儿感染,NN组孕妇无GBS定植且无新生儿感染;GBS为B族链球菌
阴道微生态平衡对维持孕期阴道内环境健康有积极影响,微生态菌群紊乱可导致孕妇生殖道感染、新生儿围产期感染、早产和低出生体重儿等的发生[14, 15]。GBS、脲原体、加德纳氏菌是导致早产、围生期感染等不良妊娠结局最常见的病原体[16]。本研究通过分析孕妇妊娠晚期阴道微生态发现,GBS定植孕妇阴道菌群中乳杆菌属减少,脲原体属、加德纳氏菌属、链球菌属含量增加。脲原体通过分解尿素,使阴道的pH值升高,从而削弱乳杆菌属对阴道微环境的保护作用,可与GBS共同破坏阴道微生态的平衡。本研究还发现,GBS阴性孕妇阴道菌群中双歧杆菌含量高于GBS阳性孕妇。既往文献报道,双歧杆菌与加德纳氏菌存在相互竞争,GBS定植后阴道菌群发生紊乱,当加德纳氏菌数增长时,双歧杆菌生长受抑制[17]。本研究还发现红球菌属、叶杆菌属在GBS阴性组中丰度显著增加。红球菌属为人畜共患机会致病菌[18],叶杆菌属为人类消化系统的共生菌[19],此二类菌属在阴道微生态中的致病性尚未发现,需进一步研究。
大肠埃希菌是新生儿早发败血症中最常见的病原体[20]。本研究中早发感染组孕妇阴道菌群中链球菌属、大肠埃希-志贺菌属丰度高于非早发感染组孕妇,但本研究样本量偏少,两组比较无统计学意义,之后可进行大样本量研究。肠球菌属在孕妇阴道菌群中含量较低,但早发感染组孕妇阴道菌群中肠球菌属的丰度明显高于非早发感染组,推测孕妇阴道菌群中肠球菌属增多与新生儿早发感染之间存在相关性。有研究发现胎儿微生物群可以从母体阴道、羊水等部位垂直传播而来[21]。母体阴道内的链球菌属、大肠埃希-志贺菌属和肠球菌属可通过羊水、阴道转移到新生儿体表,引发新生儿早发感染。因此,加强孕妇阴道菌群监测对预测母婴不良妊娠结局及预防新生儿早发感染具有潜在的生物学意义。
乳酸杆菌是正常孕妇阴道菌群中的优势菌,有助于维持阴道菌群平衡[22]。孕妇阴道乳杆菌属丰度降低与新生儿早发感染的发生密切相关。本研究中NG组孕妇阴道菌群中乳杆菌属含量最低,GG组孕妇乳杆菌属含量虽不低,但大肠埃希-志贺菌属和链球菌属含量较高。因此,阴道菌群中乳杆菌属等优势菌属含量低者,新生儿感染风险增加。加德纳氏菌属是细菌性阴道病的主要病原,存在多种亚型,各亚型存在不同的耐药性、毒性、细菌负荷[23],在健康女性的阴道微生物群中也可检测到。本研究发现GN组孕妇阴道菌群中仅加德纳氏菌属丰度增高,而其他致病菌属丰度不高,可能存在非致病性加德纳氏菌属。
本项研究存在一定不足之处,由于研究对象胎龄跨度较大,研究样本量偏少,尚未进行胎龄分层比较,某些菌属之间的差异未能完全显示;本研究仅针对孕妇阴道菌群,并未涉及新生儿菌群,二者之间的关系有待进一步研究。
综上,GBS定植孕妇阴道微生态组成与GBS阴性孕妇存在差异,GBS定植孕妇链球菌属、脲原体属增加,红球菌属、叶杆菌属、双歧杆菌属降低;孕晚期GBS定植孕妇阴道菌群中脲原体属、链球菌属、大肠埃希-志贺菌属、肠球菌属的增加可能与新生儿早发感染的发生相关。
感谢本次科研及论文写作过程中美吉生物云平台大力支持
韩玥, 尉进茜, 王亚娟, 等. 孕晚期B族链球菌定植对孕妇阴道微生态及新生儿结局的影响[J]. 中华新生儿科杂志, 2024, 39(4): 199-203. DOI: 10.3760/cma.j.issn.2096-2932.2024.04.002.
所有作者声明无利益冲突



























