
吸烟是全球公认的呼吸系统疾病的重要危险因素之一。本文简单介绍了全球和我国的吸烟流行状况,阐述了卷烟烟雾中的多种有害成分及其致病机制,为理解吸烟与呼吸系统疾病的关系提供了生物学依据。通过列举大量流行病学和临床研究证据,分别论述了吸烟与慢性阻塞性肺疾病、支气管哮喘、肺炎等多种呼吸系统疾病的关系。本文还强调了戒烟对改善呼吸系统疾病的重要作用,以及科学有效的戒烟干预方法,以期为控烟和呼吸系统疾病防治工作提供参考依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
吸烟是当前全球公认的重要的公共卫生问题之一。已知吸烟是导致呼吸系统疾病发生发展的极重要因素,因此,系统评价吸烟与呼吸系统疾病,特别是与COPD、支气管哮喘(哮喘)和肺炎等疾病的关系,对于指导控烟工作、预防呼吸系统疾病具有重要意义。本文就吸烟流行状况、卷烟烟雾(cigarette smoke,CS)的致病机制、吸烟与呼吸系统疾病的关系、科学戒烟治疗方法等内容进行总结。
根据2023年WHO全球烟草流行报告,全球15岁及以上人群的吸烟率已从2007年的22.8%下降至2021年的17.0%,但每年仍有超过800万人因吸烟失去生命,其中约700万人死于吸烟导致的疾病,约130万人死于二手烟暴露所致疾病[1]。
中国已开展多次全国吸烟流行病学调查,2020年调查结果显示,我国15岁以上人群的吸烟率为25.8%[2]。尽管我国吸烟率呈下降趋势,但与《"健康中国2030"规划纲要》中设定的控烟目标"2030年15岁以上人群吸烟率下降至20%以下"[3]仍存在较大差距。
CS中含有7 000余种化学成分,其中包含多种有害物质,主要有尼古丁、二氧化碳、一氧化碳、氮氧化物、含硫气体和多种挥发性有机物等[4,5]。CS中的有害物质可通过破坏呼吸道物理防御(干扰黏液纤毛运载系统、破坏上皮细胞屏障),破坏呼吸道化学防御(氧化应激、蛋白酶-抗蛋白酶失衡),破坏呼吸道免疫防御(破坏先天免疫、破坏适应性免疫)等方式,引发或加剧呼吸系统疾病[6]。
CS中的挥发性有机物如芳香族烃、羰基化合物、脂肪族烃和腈类等,可通过抑制纤毛运动和强氧化作用对呼吸道造成损伤。CS还可导致中央气道纤毛数量减少、黏液腺肥大、杯状细胞数量增多,并通过降低人体咳嗽反射的敏感性,抑制病原体清除,有利于病原体繁殖。此外,CS引起的支气管上皮组织学改变,如鳞状上皮化生、原位癌等,也会破坏细胞间的连接,从而损伤气道上皮的完整性[6]。
CS能增加气道中的氧化应激反应,如氮氧化物通过强氧化作用对呼吸系统造成损害;活性氧化硝基可直接启动炎症过程,导致肺纤维化。组织蛋白酶S参与结缔组织和基底膜的重塑或降解,吸烟者组织蛋白酶S的表达和活性显著升高,影响肺稳态。另外,CS抑制α1-抗胰蛋白酶活性,减弱其对一氧化氮生成的抑制作用,使体内一氧化氮生成增加,提高肺纤维化的风险[6]。
短期CS暴露可通过刺激肺泡巨噬细胞分泌炎性介质,引起气道炎症。而长期CS暴露可损害免疫细胞,抑制免疫分子产生,导致病原体快速传播和长期定植。此外,烟草中的苯并芘可抑制细胞免疫功能,增加人体对结核杆菌的易感性。CS还可增强铜绿假单胞菌的毒力,并诱导其对中性粒细胞的抵抗力。CS也会破坏适应性免疫细胞,并减少效应分子的释放[6]。
《中国吸烟危害健康报告》[5]与《中国吸烟危害健康报告2020》[7]均明确指出,吸烟可以导致COPD、呼吸系统感染、肺结核、多种间质性肺疾病(interstitial lung disease,ILD),且吸烟量越大,吸烟年限越长,疾病的发生风险越高。此外,吸烟还可以增加哮喘、小气道功能障碍(small airway dysfunction,SAD)、肺血栓栓塞症、尘肺病等的发生风险。
COPD是一种常见的呼吸系统疾病,以持续存在的呼吸系统症状和气流受限为特点,严重影响患者的劳动能力和生活质量。2018年我国COPD流行病学调查结果显示,20岁以上人群COPD的患病率为8.6%(95%CI:7.5%~9.9%),40岁以上人群COPD的患病率为13.7%(95%CI:12.1%~15.5%),总患病人数为9 990万[8]。
吸烟是导致COPD非常重要的危险因素。Adeloye等[9]对65个国家、162项研究进行meta分析,结果显示现在吸烟者患COPD的风险是不吸烟者的3.2倍(OR=3.2,95%CI:2.5~4.0)。在我国,王辰院士团队对具有全国代表性的10个省、自治区、直辖市中的50 991名20岁以上居民进行COPD流行病学调查发现,现在吸烟者中有13.7%(95%CI:11.6%~16.2%)患COPD,而不吸烟者中仅有6.2%(95%CI:5.4%~7.0%)患COPD[8]。
我国20岁及以上人群哮喘患病率为4.2%,患者总人数为4 570万[10]。吸烟是哮喘的主要环境危险因素之一。Sio和Chew[11]对289项研究进行meta分析,结果显示吸烟者患哮喘的风险是不吸烟者的1.66倍(OR=1.66,95%CI:1.44~1.90)。我国一项大型流行病学研究发现,吸烟者较非吸烟者更易罹患哮喘,患病率分别为5.8%(95%CI:3.8%~8.7%)和3.5%(95% CI:2.8%~4.4%)[10]。此外,电子烟也可增加哮喘的发病风险。Xian和Chen[12]开展的meta分析显示,电子烟使用者患哮喘的风险是不吸烟者的1.27倍(OR=1.27,95%CI:1.17~1.37)。
小气道是指内径≤2 mm的气道,包括第8~23级支气管,有气流缓慢、管腔纤细、分泌物或渗出物易阻塞、数量多、总横截面积大、对气流的阻力仅占总阻力的20%以下等特点。SAD在临床上可无症状和体征,因此小气道也被称为肺部的"沉默区域"[13]。
吸烟可以增加SAD的发生风险,且吸烟量越大,吸烟时间越长,发生风险越高。在我国人群中,Xiao等[14]开展的研究发现,吸烟者罹患SAD的风险是不吸烟者的1.16倍(OR=1.16,95%CI:1.07~1.25),且吸烟量越大,吸烟时间越长,SAD的发生风险越高。
吸烟可以增加呼吸系统感染的发病风险。吸烟量越大,吸烟年限越长,吸烟起始年龄越小,呼吸系统感染的发病风险越高。
Blake等[15]对1 230名士兵开展的前瞻性队列研究表明,吸烟者发生上呼吸道感染的风险是不吸烟者的1.46倍(RR=1.46,95%CI:1.10~1.80),吸烟者急性感染临床症状的发生率高于非吸烟者(OR=2.23,95%CI:1.03~4.82)。
McGeoch等[16]对30余万研究对象进行了12年的随访,发现吸烟者患流行性感冒的风险是不吸烟者的1.82倍(HR=1.82,95%CI:1.47~2.24)。
吸烟可以增加社区获得性肺炎(community-acquired pneumonia,CAP)的发病风险。Baskaran等[17]对27项研究、460 592例研究对象进行meta分析,结果显示吸烟者患CAP的风险为从不吸烟者的2.17倍(OR=2.17,95%CI:1.70~2.76),且吸烟量越大,CAP的发病风险越高。
吸烟是肺炎球菌性肺炎的重要危险因素。Nuorti等[18]开展的病例对照研究显示,调整年龄、性别、慢性疾病、受教育程度等因素后,吸烟者发生肺炎球菌性肺炎的风险是不吸烟者的4.1倍(OR=4.1,95%CI:2.4~7.3),51%肺炎球菌性肺炎的发生可归因于吸烟。
吸烟者患军团菌肺炎的风险高于不吸烟者。Straus等[19]开展的一项基于医院人群的病例对照研究结果显示,现在吸烟者患军团菌肺炎的风险是不吸烟者的3.75倍(OR=3.75,95%CI:2.27~6.17),且每日吸烟量越大,患军团菌肺炎的风险越高。
此外,对于新型冠状病毒感染,吸烟者发展为重症和出现死亡的风险更高。基于320项研究,Gallus等[20]发现与从不吸烟者相比,吸烟者因新型冠状病毒感染住院(OR=1.16,95%CI:1.05~1.27)和死亡(OR=1.44,95%CI:1.31~1.58)的风险升高。
结核病是由结核杆菌感染引起的一种慢性传染性疾病,其中肺结核是结核病最主要的类型。吸烟可以增加患肺结核的风险。Molla等[21]对16项研究进行meta分析发现吸烟是罹患多重耐药性肺结核的主要危险因素。此外,吸烟者的抗结核治疗效果也不佳。Wang等[22]对21项研究进行meta分析发现吸烟者接受抗结核治疗效果不佳的风险更大(OR=1.23,95%CI:1.14~1.33)。
ILD是一组累及肺间质和肺泡腔的肺部疾病。近年来研究者越来越重视吸烟与ILD之间的关系。吸烟相关的ILD主要包括呼吸性细支气管炎伴间质性肺疾病(respiratory bronchiolitis with interstitial lung disease,RB-ILD)、脱屑性间质性肺炎(desquamative interstitial pneumonia,DIP)、肺纤维化合并肺气肿(combined pulmonary fibrosis and emphysema,CPFE)综合征和肺朗格汉斯细胞组织细胞增生症(pulmonary langerhans cell histiocytosis,PLCH)等。
ATS/ERS在关于特发性间质性肺炎国际多学科分类的官方声明中指出,RB-ILD属于特发性间质性肺炎中的主要类型,基本上仅发生于现在或曾经重度吸烟者中[23]。呼吸性细支气管炎是由吸烟刺激呼吸性细支气管引起的生理性炎症反应,组织病理学特征是在呼吸性细支气管、周围的肺泡管和肺泡中分布有含棕褐色素的巨噬细胞(又名"吸烟者的巨噬细胞"),并向邻近肺泡间隙延伸,伴有肺泡间隔非特异性增厚。呼吸性细支气管炎通常不伴随呼吸道症状,但在重度吸烟者中,病变范围可达肺泡和肺间质,并出现类似ILD的临床症状。RB-ILD患者在诊断时通常已有30包年以上的吸烟史[24]。
DIP与吸烟的关系比较明确,90%的DIP患者为吸烟者,平均吸烟指数为30包年。"吸烟者的巨噬细胞"均匀沉积于肺泡腔中是DIP的组织病理学特征,低倍镜下表现为明显的弥漫性、均匀性肺受累,患者的肺泡结构通常保存良好,间质中有轻度慢性炎症细胞浸润。DIP的病程相对稳定,10年生存率约为70%,少见对治疗无反应的病例,部分患者还会出现自发好转(可能与戒烟有关)[25]。
吸烟相关CPFE综合征是发生于吸烟者的一种上肺叶发生肺气肿、下肺叶发生纤维化病变的临床综合征,常见于60岁以上男性,吸烟指数超过40包年,伴严重呼吸困难、气体交换障碍和肺容积保留效应。目前吸烟相关CPFE综合征缺乏有效的治疗措施,病死率高,中位生存时间仅2.1~8.5年,5年生存率为38%~55%[26]。
PLCH的特征是肺内多克隆性沉积的CD1α树突状细胞,好发于20~40岁成年人,发病没有性别差异,超过90%的患者有吸烟史,二手烟暴露者也有可能患病,其发病机制可能是CS作为吸入的抗原,触发了朗格汉斯细胞增殖[27]。
吸烟增加肺血栓栓塞症的患病风险,且吸烟量越大,吸烟年限越长,发病风险越高。邵斌霞等[28]的研究对244例急性肺栓塞病例和相关危险因素进行了分析,发现吸烟是导致危重状况的独立危险因素。《肺血栓栓塞症诊治与预防指南》[29]也明确指出,在我国吸烟是肺血栓栓塞症的常见危险因素之一。
尘肺病是指在职业活动中长期吸入致病性的生产性粉尘并在肺内潴留,引起的以肺组织弥漫性纤维化为主的一组职业性肺部疾病,是我国职业性疾病中影响面最广、危害最严重的一类疾病。王海椒等[30]调查了景德镇3个瓷厂1960-1974年在册且工作>1年的2 992名接尘工人,发现在相同接尘水平下,吸烟者发生尘肺病的风险是不吸烟者的1.6倍(RR=1.6,95%CI:1.3~1.9)。
戒烟可以减慢肺功能下降的速率,延缓病变进展。COPD全球倡议2023报告指出,戒烟是预防COPD发生的关键措施和重要干预手段[31]。戒烟后肺功能下降速度减慢,部分人有可能恢复至不吸烟者的水平,伴肺功能下降的中年吸烟者如果能戒烟,就可能避免严重或致死性COPD的发生。Wei等[32]对23项研究开展meta分析,结果显示戒烟是减缓COPD患者肺功能下降关键的干预措施。还有研究发现,与现在吸烟者相比,戒烟者更少出现呼吸系统疾病症状,如咳嗽、咳黏痰、喘息和气短等[33]。
吸烟会导致成瘾,长期接触尼古丁会使吸烟者对烟草上瘾,称之为烟草依赖。烟草依赖是导致吸烟者无法戒烟的重要原因,是一种致命的慢性疾病[34]。目前全球范围内针对烟草依赖进行的流行病学研究还比较少。2018年中国居民健康素养监测调查显示,在吸烟者中,49.7%患有烟草依赖,据此估计中国约有1.835亿烟草依赖患者,其中男性1.775亿。此外,非烟草依赖吸烟者成功戒烟的可能性是烟草依赖者的2.88倍[35]。
烟草依赖的诊断可参照《中国临床戒烟指南(2015年版)》[36]提出的诊断标准。烟草依赖的严重程度可根据Fagerström烟草依赖评估量表[37]和吸烟强度指数进行评估。
简短戒烟干预是指医护人员在临床诊疗过程中,为吸烟者提供快捷有效的戒烟建议和帮助。简短戒烟干预一般耗时不超过3 min。具体流程见图1。
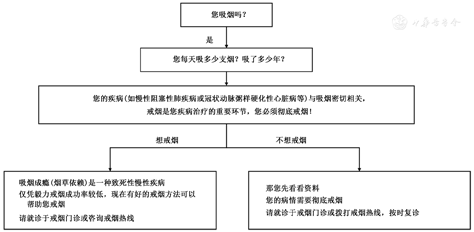

强化戒烟干预包括联合使用多种干预方法、进行多次随访、增加每次干预的时间、几位医生共同进行干预等,适用于烟草依赖较为严重并愿意接受强化干预的吸烟者。医生应询问就医者的吸烟状况,评估吸烟者的戒烟意愿,根据吸烟者的具体情况提供恰当的治疗方法。目前常以"5R"方案增强吸烟者的戒烟意愿,"5A"方案帮助吸烟者戒烟。"5R"方案包括如下内容。(1)相关(Relevance):使吸烟者认识到戒烟与他们密切相关,可从吸烟者的疾病状态、家中有小孩、对健康的忧虑等方面进行引导;(2)危害(Risk):使吸烟者认识到吸烟的潜在健康危害,同时医生应强调使用低焦油/低尼古丁卷烟或其他形式的烟草制品不会降低吸烟对健康的危害;(3)益处(Rewards):使吸烟者认识到戒烟的益处;(4)障碍(Roadblocks):使吸烟者认识到在戒烟过程中可能会遇到的障碍,并让他们了解现有的戒烟治疗方法;(5)反复(Repetition):反复对吸烟者进行动机干预。"5A"方案包括询问(Ask)吸烟情况,建议(Advise)戒烟,评估(Assess)戒烟意愿,提供戒烟帮助(Assist)和安排(Arrange)随访。
戒烟热线的有效性已被研究证实[38],具有易获得、服务对象广泛、更符合成本-效益的优势。经专业培训的戒烟热线咨询员会为吸烟者提供有效的戒烟帮助。
根据《中国临床戒烟指南(2015年版)》[36],目前用于临床戒烟的一线药物主要有三类,分别是尼古丁替代疗法(nicotine replacement therapy,NRT)药物、盐酸安非他酮缓释片和酒石酸伐尼克兰片。
NRT药物安全有效,可使长期戒烟成功率提高1倍。它们不能完全消除戒断症状,但可不同程度地减轻戒烟不适。NRT药物为非处方药,包括贴片、口香糖、含片等剂型。不同剂型间戒烟疗效无显著差异,可根据吸烟者意愿选择。建议使用NRT贴片或口香糖至少12周。如果单一NRT药物效果不佳,可联合2种使用。一旦开始戒烟,应规律使用NRT药物[36]。
盐酸安非他酮缓释片是一种有效的非尼古丁类戒烟药物,可通过抑制多巴胺和去甲肾上腺素的再摄取、干扰尼古丁乙酰胆碱受体功能等途径,显著提高长期戒烟成功率。盐酸安非他酮缓释片属于处方药,在使用前应当咨询专业戒烟医生,并遵循医生的指导进行用药[36]。
酒石酸伐尼克兰片也是一种非尼古丁类戒烟药物,为α4β2尼古丁乙酰胆碱受体的部分激动剂。当酒石酸伐尼克兰与尼古丁乙酰胆碱受体结合后,会产生双重效应,一方面,它表现为激动剂,促使大脑释放多巴胺,从而减轻戒烟后的戒断症状;另一方面,其拮抗特性可干扰尼古丁与尼古丁乙酰胆碱受体结合,降低吸烟所产生的愉悦感。酒石酸伐尼克兰片属于处方药,在使用前应当咨询专业戒烟医生,并遵循医生的指导进行用药[36]。
随着互联网技术不断发展,移动戒烟技术同样可为吸烟者提供戒烟帮助。与传统医疗模式相比,移动戒烟技术为戒烟治疗和管理提供了一种更为综合和便捷的途径。它拓宽了现有的治疗和管理模式,为吸烟者的戒烟过程提供了监测、指导、评估和反馈等多方面的支持,同时一定程度上可以弥补医疗资源短缺和交通不便等问题。
2019年受国家卫生健康委员会的委托,在WHO指导下,中日友好医院启动我国移动戒烟项目,开发"在线戒烟"同名网站、微信公众号和小程序,核心功能为基于消息推送的戒烟干预,辅助功能包括戒烟科普、戒烟门诊查询、戒烟打卡和记录等。"在线戒烟"于2021年5月正式发布。截至2023年12月,注册人数逾3万人,累计推送戒烟信息逾220万条,公众号共发布内容136篇,阅读量近13万次。2023年5月Su等[39]的研究表明,"在线戒烟"项目成功戒烟率达21.9%,即每5位吸烟者中,有1位可通过"在线戒烟"成功戒烟。
综上所述,本文通过梳理现有研究,揭示了吸烟与呼吸系统疾病之间的密切关系。吸烟可显著增加多种呼吸系统疾病的发病与死亡风险,不仅对个体健康产生不利的影响,也对社会经济产生了沉重的负担。另外,本文总结了科学戒烟治疗方法,以期为控烟和呼吸系统防治工作提供参考依据。
虽然已有大量的研究支持吸烟与呼吸系统疾病之间的联系,但研究工作还远未完成。未来的研究可以朝多个方向展开。首先,需要更多的大样本前瞻性队列研究,以深入了解吸烟对不同年龄、性别、种群和遗传背景人群的影响,这将有助于识别高风险群体,为个体化的干预提供更准确的方向;其次,深入的细胞和分子水平研究将有助于揭示吸烟致病的精确机制,以便更好地理解吸烟对呼吸系统组织的损害过程,开发更有效的治疗和预防策略,特别是寻找潜在的生物标志物;最后,必须持续努力推动控烟工作,帮助吸烟者戒烟,并预防新的吸烟者吸烟,降低我国高居不下的吸烟率,减轻呼吸系统疾病的负担,助力实现"健康中国2030"目标。
所有作者声明无利益冲突



























